Композиции и способы для доставки лекарственных средств
Иллюстрации
Показать всеНастоящее изобретение относится к поверхностно-модифицированным частицам и способам их изготовления и применения, фармацевтическим суспензиям, содержащим указанные поверхностно-модифицированные частицы, и способу усиления поглощения клетками активного агента. Поверхностно-модифицированные частицы содержат ядро частицы и покрытие, связанное с ядром частицы; указанное покрытие абсорбировано на поверхности ядра частицы, в котором содержится терапевтический агент; покрытие содержит опсонин; и поверхностно-модифицированная частица имеет средний размер приблизительно от 1 нм до 2000 нм; указанный опсонин выбран из белков и пептидов, которые связываются с частицами или клетками таким образом, что повышается подверженность указанных частиц или клеток фагоцитозу, где pH раствора, содержащего опсонин, находится ниже изоэлектрической точки опсонина. 5 н. и 30 з.п. ф-лы, 11 ил., 3 табл., 11 пр.
Реферат
Права правительства на изобретение
Настоящее изобретение осуществлено при правительственной поддержке в виде гранта № R01NS036126-12, присужденного Национальными институтами здравоохранения. Правительство имеет определенные права на настоящее изобретение.
Уровень техники
Область техники
Описание относится, главным образом, к композициям, содержащим частицы с покрытием, и к способам изготовления и применения указанных композиций для направленной доставки лекарственных средств.
Краткое описание уровня техники
Наночастицы (включая наносферы) и микрочастицы (включая микросферы), обобщенно называемые в настоящем документе «частицами», представляют собой твердые или полутвердые частицы, имеющие диаметр приблизительно от 1 нм до 10000 нм (10 микрон). Указанные частицы можно изготавливать из различных материалов, включая белки, синтетические полимеры, полисахариды, нуклеиновые кислоты, малые молекулы и их комбинации, и использовать для множества различных целей, главным образом, для сепарации, диагностики и доставки лекарственных средств.
Композиции, содержащие указанные частицы, как было установлено, являются пригодными для доставки лекарственных средств. Например, патентная публикация США № 2006/0073199 описывает, что частицы, содержащие активный агент, можно изготавливать в форме водных суспензий и стабилизировать против агрегации и увеличения размеров частиц путем нанесения покрытий из поверхностно-активных агентов на частицы или вблизи частиц.
В настоящее время продолжает существовать потребность в разработке композиций, содержащих частицы, и способов их изготовления и применения, особенно, в области доставки лекарственных средств, представляющих интерес.
Раскрытие изобретения
Один аспект изобретения относится к поверхностно-модифицированной частице, содержащей ядро частицы и покрытие, связанное с ядром частицы. Ядро частицы содержит активный агент, такой как терапевтический агент или диагностический агент (например, малую органическую молекулу или биомакромолекулу). Покрытие содержит опсонин, например, антитело, имеющее изотип IgG, или комплементный белок, такой как C3b или С5. Можно использовать также другие белки, о которых известно, что они действуют как опсонины. Поверхностно-модифицированные частицы по настоящему изобретению обычно имеют средний размер приблизительно от 1 нм до 10000 нм.
Другой аспект изобретения относится к способу усиления поглощения клетками активного агента. Способ предусматривает контактирование клеток с поверхностно-модифицированными частицами в условиях, достаточных для усиления поглощения клетками поверхностно-модифицированных частиц. Частицы содержат ядро частицы и покрытие, связанное с ядром частицы, в которых ядро частицы содержит активный агент, покрытие содержит опсонин (например, антитело, имеющее изотип IgG, или комплементный белок, такой как C3b или С5), и поверхностно-модифицированная частица имеет средний размер приблизительно от 1 нм до 2000 нм.
Другой аспект изобретения относится к способу лечения субъекта, имеющего воспалительное заболевание или расстройство, который предусматривает введение указанному субъекту множества поверхностно-модифицированных частиц; указанные поверхностно-модифицированные частицы содержат ядро частицы и покрытие, связанное с ядром частицы, в которых ядро частицы содержит активный агент (например, противовоспалительный агент), покрытие содержит опсонин (например, антитело, имеющее изотип IgG, или комплементный белок, такой как C3b или С5), поверхностно-модифицированная частица имеет средний размер приблизительно от 1 нм до 2000 нм, а указанное введение является эффективным для облегчения, лечения и/или профилактики симптомов или патологический состояний, связанных с указанным воспалительным заболеванием или расстройством.
Другой аспект изобретения относится к способу лечения субъекта, имеющего пролиферативное заболевание или расстройство, который предусматривает введение указанному субъекту множества поверхностно-модифицированных частиц; указанные поверхностно-модифицированные частицы содержат ядро частицы и покрытие, связанное с ядром частицы, в которых ядро частицы содержит активный агент (например, антипролиферативный агент, такой как антинеопластический агент), покрытие содержит опсонин (например, антитело, имеющее изотип IgG, или комплементный белок, такой как C3b или С5), поверхностно-модифицированная частица имеет средний размер приблизительно от 1 нм до 2000 нм, а указанное введение является эффективным для облегчения, лечения и/или профилактики симптомов или патологических состояний, связанных с указанным пролиферативным заболеванием или расстройством.
Другой аспект изобретения относится к способу лечения субъекта, имеющего инфекционное заболевание или расстройство, который предусматривает введение указанному субъекту множества поверхностно-модифицированных частиц; указанные поверхностно-модифицированные частицы содержат ядро частицы и покрытие, связанное с ядром частицы, в которых ядро частицы содержит активный агент (например, антиинфекционный агент), покрытие содержит опсонин (например, антитело, имеющее изотип IgG, или комплементный белок, такой как C3b или С5), поверхностно-модифицированная частица имеет средний размер приблизительно от 1 нм до 2000 нм, а указанное введение является эффективным для облегчения, лечения и/или профилактики симптомов или патологических состояний, связанных с указанным инфекционным заболеванием или расстройством.
Другой аспект изобретения относится к способу лечения субъекта, имеющего нейродегенеративное заболевание или расстройство, который предусматривает введение указанному субъекту множества поверхностно-модифицированных частиц; указанные поверхностно-модифицированные частицы содержат ядро частицы и покрытие, связанное с ядром частицы, в которых ядро частицы содержит активный агент (например, антинейродегенеративный агент), покрытие содержит опсонин (например, антитело, имеющее изотип IgG, или комплементный белок, такой как C3b или С5), поверхностно-модифицированная частица имеет средний размер приблизительно от 1 нм до 2000 нм, а указанное введение является эффективным для облегчения, лечения и/или профилактики симптомов или патологических состояний, связанных с указанным нейродегенеративным заболеванием или расстройством.
Краткое описание рисунков
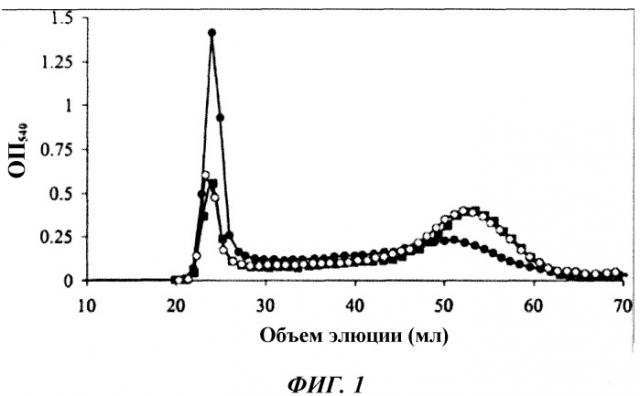
Фиг. 1 представляет собой график, показывающий профиль элюирования суперпарамагнитных наночастиц (NP) оксида железа (SPIO) из колонки с сефарозой 4B-CL. Показаны SPIO NP, конъюгированные с IgG, после инкубации IgG с окисленным SPIO (закрашенные кружки); IgG, инкубированными с неокисленным SPIO (закрашенные квадратики); и окисленные SPIO, блокированные добавлением избыточного количества аминогрупп (незакрашенные кружки).
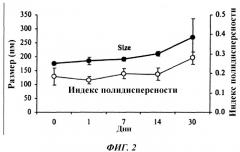
Фиг. 2 представляет собой график, показывающий измерения размеров (в нанометрах) и индекса полидисперсности IgG-SPIO в различные моменты времени после конъюгирования, при хранении при 4°С.
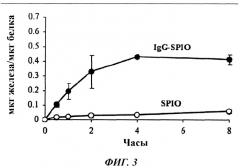
Фиг. 3 представляет собой график, показывающий поглощение SPIO и IgG-SPIO моноцитами по истечении различных периодов времени, по оценке с использованием колориметрического феррозинового анализа.
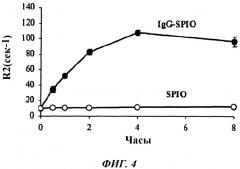
Фиг. 4 представляет собой график, показывающий поглощение SPIO и IgG-SPIO моноцитами по истечении различных периодов времени, по оценке с использованием измерения релаксации (R2) с помощью МРТ.
Фиг. 5 представляет собой график, показывающий поглощение SPIO и IgG-SPIO моноцитами и макрофагами при различных условиях. (А) показывает график поглощения частиц SPIO различных размеров (62 нм, 122 нм, 266 нм и 394 нм), присоединенных к декстрану 100 кДа, и частиц SPIO размеров 130-170 нм, присоединенных к декстрану 10 кДа. (В) показывает график поглощения моноцитами частиц IgG-SPIO, изготовленных с использованием растворов с различной концентрацией IgG. (С) показывает график поглощения моноцитами нативных SPIO, инкубированных со свободным IgG. (D) показывает график поглощения моноцитами частиц IgG-SPIO при 4°С и 37°С. (Е) показывает график поглощения моноцитами и полученными из моноцитов макрофагами (MDM) частиц IgG-SPIO. (F) показывает график поглощения моноцитами частиц IgG-SPIO, инкубированных совместно с избытком свободного IgG. (G) показывает график поглощения моноцитами частиц SPIO, конъюгированных с человеческим сывороточным альбумином (HAS). (Н) показывает график, изображающий поверхностный заряд частиц (дзета-потенциал) и размер частиц для нативных, конъюгированных с IgG и конъюгированных с HSA частиц SPIO.
Фиг. 6 представляет собой график, показывающий количественную оценку in vivo частиц SPIO и IgG-SPIO, с помощью МРТ картирования с использованием циклирования Т2 фазы CPMG. (А) представляет собой график, показывающий изменения релаксивности (R2=1/T2) в селезенке после инъекции 12,5 мкг SPIO или IgG-SPIO в хвостовую вену мышей (n=6). (В) представляет собой график, показывающий изменения релаксивности (R2=1/T2) в селезенке после инъекции 62,5 мкг SPIO или IgG-SPIO в хвостовую вену мышей (n=5). (С) представляет собой график, показывающий изменения релаксивности (R2=1/T2) в печени после инъекции 12,5 мкг SPIO или IgG-SPIO в хвостовую вену мышей (n=6). (D) представляет собой график, показывающий изменения релаксивности (R2=1/T2) в печени после инъекции 62,5 мкг SPIO или IgG-SPIO в хвостовую вену мышей (n=6). (Е) представляет собой график, показывающий изменения релаксивности (R2=1/T2) в почке после инъекции 12,5 мкг SPIO или IgG-SPIO в хвостовую вену мышей (n=6). (F) представляет собой график, показывающий изменения релаксивности (R2=1/T2) в почке после инъекции 62,5 мкг SPIO или IgG-SPIO в хвостовую вену мышей (n=5).
Фиг. 7 представляет собой график, показывающий дзета-потенциал покрытых IgG частиц паклитаксела при различных соотношениях IgG и паклитаксела.
Фиг. 8 представляет собой график, показывающий дзета-потенциал покрытых IgG частиц ритонавира при различных соотношениях IgG и ритонавира.
Фиг. 9 представляет собой график, показывающий поглощение частиц паклитаксела без покрытия, меченных с использованием Oregon Green (без покрытия), покрытых IgG частиц паклитаксела, меченных с использованием Oregon Green (IgG), и покрытых протамином частиц паклитаксела, меченных с использованием Oregon Green (протамин).
Фиг. 10 представляет собой график, показывающий поглощение частиц паклитаксела без покрытия (без покрытия), покрытых IgG частиц паклитаксела, меченных с использованием Oregon Green (IgG), и покрытых протамином частиц паклитаксела, меченных с использованием Oregon Green (протамин).
Фиг. 11 представляет собой график, показывающий поглощение частиц паклитаксела без покрытия, меченных с использованием Oregon Green (без покрытия) и покрытых IgG частиц паклитаксела, меченных с использованием Oregon Green (IgG).
Подробное описание
Заявленное изобретение допускает варианты осуществления во многих различных формах. Предпочтительные варианты осуществления настоящего изобретения, описанные в настоящем документе, следует рассматривать как примеры принципов заявленного изобретения, которые, таким образом, не предназначены для ограничения широких аспектов заявленного изобретения описанными вариантами осуществления.
Один аспект изобретения относится к поверхностно-модифицированной частице, содержащей ядро частицы и покрытие, связанное с ядром частицы. Ядро частицы содержит активный агент, покрытие содержит опсонин (например, антитело, имеющее изотип IgG, или комплементный белок, такой как C3b или С5), и поверхностно-модифицированная частица имеет средний размер приблизительно от 1 нм до 2000 нм. В некоторых вариантах осуществления настоящего изобретения частицы, имеющие покрытия, содержащие комплементные белки, можно использовать в комбинации с веществами, способными ослаблять эффекты высвобождения гистамина, которое может быть вызвано активированными комплементными белками.
Другой аспект изобретения относится к способу усиления поглощения активного агента фагоцитарными или нефагоцитарными клетками посредством воздействия на клетки поверхностно-модифицированной частицей, содержащей ядро частицы и покрытие, связанное с ядром частицы. Ядро частицы содержит активный агент, покрытие содержит опсонин (например, антитело, имеющее изотип IgG, или комплементный белок, такой как C3b или С5), и поверхностно-модифицированная частица имеет средний размер приблизительно от 1 нм до 2000 нм. Усиленное поглощение клетками активного агента наблюдается по сравнению с клетками, которые контактировали с частицами, не имеющими покрытия, содержащего опсонин.
Еще один аспект изобретения относится также к способам доставки поверхностно-модифицированной частицы с ткани-мишени млекопитающего субъекта посредством клеточного транспорта. Используемый в настоящем документе термин «ткань-мишень» или «тканевая мишень» относится к конкретной ткани млекопитающего, которое подвергается лечению. Примеры указанных тканей-мишеней предусматривают, без ограничения, головной мозг и другие отделы центральной нервной системы, лимфатическую систему, печень и любое место инфекции, воспаления или опухоли.
Например, в одном аспекте изобретение предполагает способы и композиции для лечения субъекта, имеющего воспалительное заболевание или расстройство, предусматривающие введение указанному субъекту множества поверхностно-модифицированных частиц; указанные поверхностно-модифицированные частицы содержат ядро частицы и покрытие, связанное с ядром частицы, в которых ядро частицы содержит активный агент, покрытие содержит опсонин (например, антитело, имеющее изотип IgG, или комплементный белок, такой как C3b или С5), поверхностно-модифицированная частица имеет средний размер приблизительно от 1 нм до 2000 нм, а указанное введение является эффективным для облегчения, лечения и/или профилактики симптомов или патологических состояний, связанных с указанным воспалительным заболеванием или расстройством. В одном аспекте активный агент представляет собой противовоспалительный агент.
В другом аспекте изобретение предполагает способы и композиции для лечения субъекта, имеющего нейродегенеративное заболевание или расстройство, предусматривающие введение указанному субъекту множества поверхностно-модифицированных частиц; указанные поверхностно-модифицированные частицы содержат ядро частицы и покрытие, связанное с ядром частицы, в которых ядро частицы содержит активный агент, покрытие содержит опсонин (например, антитело, имеющее изотип IgG, или комплементный белок, такой как C3b или С5), поверхностно-модифицированная частица имеет средний размер приблизительно от 1 нм до 2000 нм, а указанное введение является эффективным для облегчения, лечения и/или профилактики симптомов или патологических состояний, связанных с указанным нейродегенеративным заболеванием или расстройством. В одном аспекте активный агент представляет собой антинейродегенеративный агент.
В еще одном аспекте изобретение предполагает способы и композиции для лечения субъекта, имеющего пролиферативное заболевание или расстройство, предусматривающие введение указанному субъекту множества поверхностно-модифицированных частиц; указанные поверхностно-модифицированные частицы содержат ядро частицы и покрытие, связанное с ядром частицы, в которых ядро частицы содержит активный агент, покрытие содержит опсонин (например, антитело, имеющее изотип IgG, или комплементный белок, такой как C3b или С5), поверхностно-модифицированная частица имеет средний размер приблизительно от 1 нм до 2000 нм, а указанное введение является эффективным для облегчения, лечения и/или профилактики симптомов или патологических состояний, связанных с указанным пролиферативным заболеванием или расстройством. В одном аспекте активный агент представляет собой антипролиферативный агент, такой как антинеопластический агент.
В еще одном аспекте изобретение предполагает способы и композиции для лечения субъекта, имеющего инфекционное заболевание или расстройство, предусматривающие введение указанному субъекту множества поверхностно-модифицированных частиц; указанные поверхностно-модифицированные частицы содержат ядро частицы и покрытие, связанное с ядром частицы, в которых ядро частицы содержит активный агент, покрытие содержит опсонин (например, антитело, имеющее изотип IgG, или комплементный белок, такой как C3b или С5), поверхностно-модифицированная частица имеет средний размер приблизительно от 1 нм до 2000 нм, а указанное введение является эффективным для облегчения, лечения и/или профилактики симптомов или патологических состояний, связанных с указанным инфекционным заболеванием или расстройством. В одном аспекте активный агент представляет собой антиинфекционный агент, такой как противогрибковый агент, противовирусный агент, антибактериальный агент или антипаразитарный агент.
Таким образом, способы введения, описанные в настоящем документе, предполагают введение терапевтически эффективного количества указанных поверхностно-модифицированных частиц. Используемый в настоящем документе термин «терапевтически эффективное количество» относится к количеству частиц с покрытием, которое достаточно для облегчения, улучшения, устранения, лечения и/или профилактики симптомов или патологических состояний, связанных с заболеванием или расстройством, предполагаемым для лечения в соответствии со способами лечения, описанными в настоящем документе.
Используемый в настоящем документе термин «опсонин» относится к белкам или пептидам, которые связываются с частицами или клетками, повышая, таким образом, чувствительность указанной частицы или клетки к фагоцитозу. Фрагменты известных опсонинов, обладающих биологической активностью, сравнимой с соответствующим опсонином полной длины, считаются опсонинами, как это используется в настоящем документе. Например, фрагменты IgG обычно содержат фрагмент, достаточный для связывания с фагоцитом. Указанные фрагменты могут также содержать гидрофобные части, достаточные для нековалентного связывания с поверхностью гидрофобной частицы, как описано в настоящем документе. Подходящие фрагменты IgG содержат, например, фрагменты IgG-Fab и фрагменты IgG-Fc. Подобно этому, миметики опсонинов также считаются опсонинами, как это используется в настоящем документе. Используемый в настоящем документе термин «миметики опсонинов» относится к соединениям (включая пептиды), обладающим биологической активностью, сравнимой с опсонином, и к соединениям, которые имитируют активность опсонина. Специалист может легко определить, является ли соединение миметиком опсонинов в том, что касается известной биологической активности опсонина.
Следующее описание поверхностно-модифицированной частицы обычно используется во всех вариантах осуществления настоящего изобретения, описанных в настоящем документе. Активный агент поверхностно-модифицированной частицы может быть плохо растворимым в воде или водорастворимым. Активный агент может представляет собой терапевтический агент или диагностический агент. Активные агенты, используемые в соответствии с композициями и способами, описанными в настоящем документе, демонстрируют фармацевтическую активность, обычно присущую указанным активным агентам, даже если активные агенты захватываются и впоследствии доставляются фагоцитарными или нефагоцитарными клетками.
Активный агент может быть выбран из ряда известных фармацевтических соединений, таких как, без ограничения, анальгетики, анестетики, аналептики, адренергические агенты, адреноблокаторы, адренолитики, адренокортикоиды, адреномиметики, антихолинергические агенты, антихолинэстеразные агенты, противосудорожные агенты, алкилирующие агенты, алкалоиды, аллостерические ингибиторы, анаболические стероиды, анорексианты, антациды, агенты против диареи, антидоты, жаропонижающие агенты, противоревматические агенты, психотерапевтические агенты, нейроблокирующие агенты, противовоспалительные агенты, противоглистные агенты, антикоагулянты, антидепрессанты, противоэпилептические агенты, антиинфекционные агенты (например, противогрибковые агенты, противовирусные агенты, такие как антиретровирусные агенты, и антибиотики), антигистаминные агенты, антимускариновые агенты, антимикобактериальные агенты, антинеопластические агенты, антипротозойные агенты, анксиолитические седативные агенты, бета-адреноблокаторы, кортикостероиды, агенты, подавляющие кашель, дофаминергические агенты, гемостатики, гематологические агенты, снотворные, иммунологические агенты, мускариновые агенты, парасимпатомиметики, простагландины, радиофармацевтические агенты, седатирующие агенты, стимуляторы, симпатомиметики, витамины, ксантины, факторы роста, гормоны и антиприонные агенты.
Примеры антинеопластических агентов включают в себя, без ограничения, пакситаксел, производные пакситаксела, алкалоиды, антиметаболиты, ингибиторы ферментов, алкилирующие агенты и их комбинации.
Активный агент может также представлять собой ингибитор протеаз, такой как ингибитор ВИЧ-протеазы. Примеры ингибиторов протеаз включают в себя, без ограничения, индинавир, ритонавир, саквинавир, нелфинавир и их комбинации.
Активный агент может представлять собой нуклеозидный ингибитор обратной транскриптазы. Примеры нуклеозидных ингибиторов обратной транскриптазы включают в себя, без ограничения, зидовудин, диданозин, ставудин, зальцитабин, ламивудин и их комбинации.
Активный агент может представлять собой ненуклеозидный ингибитор обратной транскриптазы. Примеры ненуклеозидных ингибиторов обратной транскриптазы включают в себя, без ограничения, эфавиренц, невирапин, делавирадин и их комбинации.
Примеры противовоспалительных агентов включают в себя, без ограничения, нестероидные противовоспалительные агенты, неселективные ингибиторы циклооксигеназы (СОХ), ингибиторы СОХ-1, ингибиторы СОХ-2, ингибиторы липоксигеназы, кортикостероиды, антиоксиданты, ингибиторы фактора некроза опухолей (TNF) и их комбинации. Примеры ингибиторов СОХ-2 включают в себя, без ограничения, целекоксиб, рофекоксиб, вальдекоксиб, парекоксиб, лумиракоксиб, эторикоксиб и их комбинации.
Диагностические агенты включают в себя рентгенологические агенты и контрастные среды. Примеры рентгенологических агентов включают в себя WIN-8883 (этил 3,5-диацетамидо-2,4,6-трийодобензоат), также известный как этиловый эфир диатразоевой кислоты (EEDA), WIN 67722, т.е., (6-этокси-6-оксогексил-3,5-бис(ацетамидо)-2,4,6-трийодобензоат; этил-2-(3,5-бис(ацетамидо)-2,4,6-трийодобензоилокси)бутират (WIN 16318); этил диатризоксиацетат (WIN 12901); этил-2-(3,5-бис(ацетамидо)-2,4,6-трийодобензоилокси)пропионат (WIN 16923); N-этил 2-(3,5-бис(ацетамидо)-2,4,6-трийодобензоилокси ацетамид (WIN 65312); изопропил 2-(3,5-бис(ацетамидо)-2,4,6-трийодобензоилокси) ацетамид (WIN 12855); диэтил 2-(3,5-бис(ацетамидо)-2,4,6-трийодобензоилокси) малонат (WIN 67721); этил-2-(3,5-бис(ацетамидо)-2,4,6-трийодобензоилокси) фенилацетат (WIN 67585); [[3,5-бис(ацетиламино)-2,4,5-трийодобензоил]окси]бис(1-метил) эфир пропандиоевой кислоты (WIN 68165) и 3,5-бис(ацетиламино)-2,4,6-трийодо-4-(этил-3-этокси-2-бутеноат) эфир бензойной кислоты (WIN 68209). Контрастные агенты включают в себя такие агенты, от которых ожидают относительно быстрого разложения в физиологических условиях, что сводит к минимуму любые воспалительные реакции, связанные с частицами. Разложение может происходить в результате ферментативного гидролиза, солюбилизации карбоновых кислот при физиологических значениях рН или в результате других механизмов. Таким образом, включены плохо растворимые йодированные карбоновые кислоты, такие как йодипамид, диатризоевая кислота и метризоевая кислота, а также гидролитически лабильные йодированные виды, такие как WIN 67721, WIN 12901, WIN 68165 и WIN 68209.
Другие контрастные среды включают в себя, без ограничения, состоящие из частиц препараты веществ для магнитно-резонансной томографии, такие как хелаты гадолиния или другие парамагнитные контрастные агенты. Примерами указанных соединений являются гадопентетат димеглумина (MAGNEVIST®) и гадотеридол (PROHANCE®).
Описание классов терапевтических агентов и диагностических агентов и перечень видов в каждом классе можно найти в Martindale, The Extra Pharmacopoeia, 31-е издание, The Pharmaceutical Press, Лондон, 1996 г., включенном в настоящий документ в качестве ссылки и составляющим его часть. Перечисленные терапевтические агенты и диагностические агенты имеются в продаже и/или их можно изготовить с использованием известных методик.
В конкретном варианте осуществления настоящего изобретения активный агент представляет собой плохо растворимое в воде соединение. Под «плохой растворимостью в воде» подразумевается растворимость соединения в воде менее приблизительно 10 мг/мл, и, предпочтительно, менее приблизительно 1 мг/мл. Указанные плохо растворимые в воде соединения являются особенно подходящими для водных суспензионных препаратов, поскольку существует ограниченное количество альтернатив помещения указанных соединений в водную среду. Преимущественно, опсонины, такие как IgG, которые обеспечивают покрытия по настоящему изобретению, могут адсорбироваться на поверхности частиц, включая указанные плохо растворимые в воде активные агенты, для формирования на них практически однородного покрытия. Например, гидрофобные хвостовые части опсонинов, таких как IgG, способны связываться с гидрофобными областями на поверхности частицы. Помимо этого, опсонины, такие как IgG, имеют положительный заряд, в случаях, когда рН ниже изоэлектрической точки для опсонина, и, таким образом, сильное электростатическое взаимодействие между опсонином и гидрофобной частицей (которая может иметь отрицательный заряд) может стабилизировать покрытие, содержащее опсониновый белок. Альтернативно, опсонины, такие как IgG, имеют отрицательный заряд, в случаях, когда рН выше изоэлектрической точки для опсонина, и, таким образом, сильное электростатическое взаимодействие между опсонином и гидрофобной частицей (которая также может иметь положительный заряд) может стабилизировать покрытие, содержащее опсониновый белок. В одном предпочтительном аспекте плохо растворимый в воде активный агент представляет собой органическое соединение, имеющее молекулярную массу менее 2500 граммов/моль, менее 2000 граммов/моль, и, наиболее типично, менее 1000 граммов/моль, например, от 200 граммов/моль до 900 граммов/моль. Указанные органические соединения иногда называют «малыми молекулами».
Альтернативно, на практике в настоящем изобретении можно использовать водорастворимые соединения. Указанные водорастворимые активные соединения можно заключать в твердый матрикс-носитель (например, сополимер полилактат-полигликолят, альбумин, крахмал) или инкапсулировать в пузырек, который является практически непроницаемым для активного агента. Указанный инкапсулирующий пузырек может представлять собой полимерное покрытие, такое как полиакрилат. Кроме того, маленькие частицы, изготовленные из указанных водорастворимых соединений, можно модифицировать, чтобы улучшить химическую стабильность и контролировать фармакокинетические свойства соединений путем контролирования высвобождения соединений из частиц. Примеры водорастворимых соединений включают в себя, без ограничения, простые органические соединения, белки, пептиды, нуклеотиды, олигонуклеотиды и углеводы.
Следующее описание частиц также используется во всех вариантах осуществления настоящего изобретения, изложенных в настоящем документе. Частицы могут быть аморфными, полукристаллическими, кристаллическими или представлять собой их комбинацию, как определяется с использованием подходящих аналитических методик, таких как дифференциальная сканирующая калориметрия (DSC) или рентгеновская дифракция. Перед введением частицы можно гомогенизировать с использованием процесса гомогенизации. Частицы можно также гомогенизировать с использованием процесса микропреципитации/гомогенизации.
Частицы с покрытием обычно имеют средний действительный размер приблизительно от 1 нм до 2 мкм (или 2000 нанометров), по измерению динамическими методами рассеяния света (например, фотокорреляционная спектроскопия, лазерная дифракция, малоугловая лазерная фотометрия светорассеяния (LALLS), среднеугловая лазерная фотометрия светорассеяния (MALLS)), методами light obscuration (например, методом Коултера), реологическими методами или микроскопией (световой или электронной). Предпочтительный средний действительный размер частиц зависит от таких факторов, как планируемый путь введения, композиция, растворимость, токсичность и биодоступность соединения. Другие подходящие размеры частиц содержат, без ограничения, приблизительно от 10 нм до 1 мкм, приблизительно от 50 нм до 500 нм и/или приблизительно от 100 нм до 250 нм.
Изготовление ядра частицы
Процессы изготовления частиц, используемых в настоящем изобретении, можно осуществлять с использованием множества методик. Далее приводится репрезентативное, но не исчерпывающее, обсуждение методик изготовления частиц.
I. Методики приложения энергии для формирования дисперсий малых частиц
В целом, способ изготовления дисперсий малых частиц с использованием методики приложения энергии предусматривает этап добавления в форме массы активного агента или фармацевтически активного соединения, которое иногда будет называться лекарственным средством, к подходящему носителю, такому как вода или водный раствор, обычно содержащий одно или более поверхностно-активных веществ, перечисленных ниже, или другая жидкость, в которой фармацевтическое соединение не растворяется значительным образом, с получением первой суспензии, которая будет называться далее пресуспензией. Энергию прикладывают к пресуспензии для получения дисперсии частиц, которая является физически более стабильной, чем пресуспензия. Энергию прикладывают путем механического измельчения (например, с использованием бисерной мельницы, шаровой мельницы, молотковой мельницы, мельницы с использованием энергии жидкости, струйной мельницы или мокрого измельчения). Указанные технологии описаны в патенте США № 5145684, который включен в настоящий документ в качестве ссылки и составляет его часть.
Методики приложения энергии также включают в себя воздействие на пресуспензию условиями высокого усилия сдвига, включая кавитацию, усилие сдвига или ударную силу, с использованием микрофлюидизатора. Настоящее изобретение также использует приложение энергии к пресуспензии с использованием пистонного гомогенизатора или противоточного гомогенизатора, которые описаны в патенте США № 5091188, который включен в настоящий документ в качестве ссылки и составляет его часть. Подходящие пистонные гомогенизаторы имеются в продаже под торговыми наименованиями EMULSIFLEX™ (Avestin) и FRENCH® Pressure Cell (Thermo Spectronic). Подходящие микрофлюидизаторы можно приобрести у компании Microfluidics Corp.
Этап приложения энергии также можно осуществлять с использованием ультразвуковых технологий. Этап ультразвуковой обработки можно осуществлять с использованием любого подходящего ультразвукового устройства. Подходящие устройства включают в себя Branson модель S-450A и Cole-Parmer модель 500/750 ватт. Указанные устройства хорошо известны в промышленности. Обычно ультразвуковые устройства имеют ультразвуковой щуп или зонд, который погружают в пресуспензию для испускания ультразвуковой энергии в раствор. Ультразвуковое устройство в предпочтительном варианте осуществления настоящего изобретения действует на частоте приблизительно от 1 кГц до 90 кГц, и, более предпочтительно, приблизительно от 2 кГц до 40 кГц или в любых пределах или комбинациях указанных пределов. Размеры зонда могут варьировать и предпочтительно имеют определенный размер, такой как Ѕ дюйма или ј дюйма или т.п.
Дисперсию малых частиц можно стерилизовать перед введением. Стерилизацию можно осуществлять нагреванием, гамма-излучением, фильтрованием (как непосредственно, в виде дисперсии с размером частиц менее 200 нм, так и стерильным фильтрованием растворов, использованных в процессе преципитации, до формирования дисперсии твердого вещества) и приложением очень высокого давления (более 2000 атмосфер) или комбинацией высокого давления и повышенной температуры.
II. Способы преципитации для изготовления дисперсий частиц субмикронных размеров
Дисперсии малых частиц можно также изготавливать с использованием методик преципитации. Далее описаны примеры методик преципитации.
Способы микропреципитации. Один пример способа микропреципитации описан в патенте США № 5780062, который включен в настоящий документ в качестве ссылки и составляет его часть. Патент 5780062 описывает способ преципитации органических соединений, предусматривающий: (i) растворение органического соединения в смешивающемся с водой первом растворителе; (ii) изготовление раствора полимера и амфифильного соединения в водном втором растворителе (в указанном втором растворителе органическое соединение является практически нерастворимым), благодаря чему образуется комплекс полимер/амфифильное соединение; и (iii) смешивание растворов с этапов (i) и (ii), чтобы вызвать преципитацию агрегата органического соединения и комплекса полимер/амфифильное соединение.
Другие подходящие способы преципитации описаны в патентах США №№ 6607784, 7037528, 6869617, 6884436, которые включены в настоящий документ в качестве ссылки и составляют его часть. Описанные способы предусматривающие этапы: (1) растворение органического соединения в смешивающемся с водой первом органическом растворителе для получения первого раствора; (2) смешивание первого раствора со вторым растворителем или водой для осаждения органического соединения, с получением пресуспензии; и (3) приложение энергии к пресуспензии в форме перемешивания с высоким усилием сдвига, с получением дисперсии малых частиц. Необязательно, первый органический растворитель удаляют из смеси с использованием любых подходящих средств, таких как способы центрифугирования или фильтрования. Помимо этого, непрерывную фазу дисперсии можно, необязательно, заменить другой непрерывной фазой посредством удаления первой непрерывной фазы с использованием таких способов как центрифугирование и фильтрование, и добавления второй непрерывной фазы и последующего редиспергирования твердого материала во второй непрерывной фазе. Одно или более поверхностно-активных агентов, перечисленных ниже, можно добавлять в первый органический растворитель или второй водный раствор.
Эмульсионные способы преципитации. Одна подходящая эмульсионная методика преципитации описана в патентной публикации США № 2005/0037083, которая включена в настоящий документ в качестве ссылки и составляет его часть. При указанном подходе способ предусматривает этапы: (1) изготовление мультифазной системы, имеющей органическую фазу и водную фазу; органическая фаза включает в себя фармацевтически активное соединение; и (2) воздействие на систему ультразвуком для выпаривания части органической фазы, чтобы вызвать преципитацию соединения в водной фазе с образованием дисперсии малых частиц. Этап изготовления мультифазной системы включает в себя этапы: (1) смешивание не смешивающегося с водой растворителя с фармацевтически активным соединением с получением органического раствора, (2) изготовление раствора на водной основе с одним или более поверхностно-активных соединений и (3) смешивание органического раствора с водным раствором с получением мультифазной системы. Этап смешивания органической фазы и водной фазы может включать в себя использование пистонных гомогенизаторов, коллоидных мельниц, высокоскоростного перемешивающего оборудования, экструзионного оборудования, оборудования для ручного перемешивания или встряхивания, микрофлюидизатора или другого оборудования или технологии для создания условий высокого усилия сдвига. Необработанная эмульсия будет содержать масляные капли в воде размером приблизительно менее 1 мкм в диаметре. На необработанную эмульсию воздействуют ультразвуком с получением микроэмульсии и, в конечном итоге, получают дисперсию малых частиц.
Эмульсионные способы преципитации. Одна подходящая эмульсионная методика преципитации описана