Фармацевтическая композиция на основе педифена для лечения поражения нелетальными раздражающими средствами
Иллюстрации
Показать всеПредложена фармацевтическая композиция в виде спрея для лечения поражений нелетальными раздражающими средствами (например, морфолида пеларгониевой кислоты), содержащая педифен, при соотношении ингредиентов, мас./об.%: педифен гидрохлорид 0,01-10,0; натрия хлорид 0,1-10,0; вода для инъекций до 100 мл. Показана эффективность педифена по заявленному назначению благодаря местно-анестезирующему действию и другим фармакологическим свойствам, при этом предупреждалось развитие осложнений со стороны глаз (патология роговицы или конъюнктивы), вызванных раздражающими средствами. Препарат не обладает аллергенными и иммунотоксичными свойствами. 1 з.п. ф-лы, 3 ил., 40 табл.
Реферат
Предполагаемое изобретение относится к области медицины, а именно, к химико-фармацевтической промышленности, конкретно, к производству лекарственных средств, предназначенных для лечения поражения нелетальными раздражающими средствами. Основным действующим лекарственным соединением предлагаемой фармацевтической композиции является педифен.
Педифен представляет собой гидрохлорид N,N-диэтил-5,5-дифенил-2-пентиниламина.
(C6H5)2CN-СН2-С≡С-CH2N(С2Н5)2·HCl
Педифен относится к производным ацетиленовых аминов, обладающих н-холинолитическим действием.
Под термином «педифен» в медицинской литературе понимаются как соли педифена, так и его основание. В практической медицине этот термин используется для обозначения как растворов самого педифена, так и фармацевтических композиций, содержащих педифен.
Субстанция педифена выпускается ФГУП НПЦ «Фармзащита» ФМБА России № Р N002888/01 от 06.06.2008.
Фармако-токсикологическая оценка педифена дана в диссертации Онуфриенко М.Э. (Онуфриенко М.Э., Фармако-токсикологическая оценка педифена, Спб, 1995 г.). Установлена антистрессовая, иммуностимулирующая и ростстимулирующая активность педифена. Другие виды фармакологической активности в литературе не описаны.
Россия вместе с другими странами подписала Конвенцию о запрещении Химического оружия, к которому отнесены все отравляющие вещества смертельного действия. Ряд веществ раздражающего действия (ирританты) отныне, как и в других странах, рассматриваются в качестве «полицейских« газов и как химическая основа гражданского газового оружия. Несмотря на то, что ирританты в газовом оружие используются в раздражающих концентрациях, они могут вызывать химические ожоги глаз, которые характеризуются длительностью течения патологического процесса и развитием осложнений (посттравматический кератит, кератоувеит, травматическая катаракта и др.),, характеризующиеся длительностью течения патологического процесса и в ряде случаев приводящие к снижению остроты зрения и инвалидизации потерпевших. Это обусловливает необходимость разработки эффективных и безопасных средств профилактики и терапии поражений веществами раздражающего действия.
Известно лечение унитиолом химической травмы глаз, вызванной ирритантом хлорацетофеноном (Муковский Л.А., Панчешена В.М., Бржевский В.В. и др., Токсикол. вестник, 2009, №6, стр.7-10). Этому же вопросу посвящена диссертация Панчешиной В.М. «Особенности поражений глаз аэрозольным газовым оружием и их лечение» Спб, 2007 г. Где делается вывод о том, что в настоящее время наиболее эффективным способом оказания медицинской помощи при поражении глаз лакриматорами являются промывания конъюнктивальной полости раствором унитиола или частыми инстилляциями натрия азапентацена полисульфоната. Однако для этого необходимы условия стационара.
Наиболее близким к данному техническому решению является применение 4% спрея лидокаина для лечения поражения нелетальными раздражающими средствами (Заявка на патент РФ №2011125817/15 от 24.06.2012 г.). Недостатком известного лечения являются относительно частое побочное действие лидокаина, вызывающего аллергическую реакцию, в том числе анафилактический шок, и ограничения по дозам этого преапрата.
Задачей настоящего изобретения является улучшенный способ лечение поражений нелетальными раздражающими средствами.
Поставленная задача решается тем, что в предлагаемой фармацевтической композиции в виде спрея содержится в качестве действующее вещество - педифен. В предлагаемой фармацевтической композиции и экспериментальной части под термином педифен описывается гидрохлорид N,N-диэтил-5,5-дифенил-2-пентиниламина.
Как установлено в ходе настоящего исследования Педифен обладает выраженным местноанестезирующим действием. При изучении терминальной анестезии установлено, что по активности он не уступает дикаину, а при проводниковой превосходит новокаин.
Педифен обладает стимулирующим воздействием на центральную нервную систему.
Педифен является антиоксидантом. В опытах in vitro было показано, что Педифен, примерно в 10 раз превосходит аскорбиновую кислоту, уступая по активности токоферолу. Введение Педифена «интактным» животным сопровождается снижением свободно-радикального окисления тканей и повышением их антиокислительной активности. Предупреждает активацию перекисного окисления липидов (ПОЛ). У Педифена обнаружены и мембраностабилизирующие свойства, которые, возможно, также связаны с его антиокислительной активностью.
Педифен обладает выраженной спазмолитической активностью, превышая папаверин по данному показателю в 6,5 раз.
Показано, что педифен не обладает аллергенными свойствами.
Педифен обладает антимикробной активностью в отношении грамположительной (стафилококки) и грамотрицательной (синегнойная и кишечные палочки) микрофлоры, поэтому необходимость в консервантах при создании лекарственной формы отсутствует.
Согласно настоящему изобретению для лечения поражения нелетальными раздражающими средствами предлагается следующая фармацевтическая композиция:
| Педифен | 0,01-5,0 г |
| Натрия хлорид | 0,1-10,0 г |
| Вода для инъекций | до 100 мл |
Преимущественное содержание педифена в растворе 0,1-1,0 г в 100 мл раствора.
Отличительными особенностями предлагаемой фармацевтической композиции являются использование исходных ингредиентов (в указанных выше соотношениях), и хлористого натрия для создания оптимального осмотического давления композиции.
Учитывая особенности слизистой оболочки глаза, причем подвергнутого действию раздражающего средства, необходимо точное соблюдение соотношений исходных ингредиентов. Использование педифена ниже нижнего предела не позволяет гарантировать наступление желаемого эффекта. При концентрации педифена более 10% ограничены возможности разрешенного использования препарата по данному назеачению.
Окончательный подбор концентраций был основан на данных биологического исследования.
Возможно использование в предлагаемой композиции смягчающих компонент, например, гипромеллозы, гидроксипилгуара или гиалуроной кислоты, однако в этом нет особенной необходимости.
Преимущества педифена перед лидокаином в том, что последний часто оказывает аллергическое и даже анафилактическое действие.
Подострое (14 дней) ежедневное интраконъюнктивальное применение лекарственной формы педифена экспериментальным животным в дозах, превышающих терапевтические для человека в десятки-сотни раз, не оказывало вредного воздействия на основные адаптационные системы (нервную, сердечно-сосудистую, кроветворную, выделительную, антитоксическую), обмен веществ, общее состояние и развитие, основные гомеостатические параметры организма.
Следует отметить также отсутствие у лекарственной формы препарата Педифен 0.25% раздражающего действия на ткани в месте аппликации (интраконъюнктивальном). Все это относится как к грызунам, так и негрызунам, т.е. свидетельствует об универсальном характере безвредности нового препарата.
В результате изучения возможного аллергенного действия препарата Педифен 0.25% в виде спрея на морских свинках обоего пола было показано, что он не вызывает реакции общей анафилаксии при применении препарата даже в дозах, в 10 раз больше терапевтической. Кроме того, конъюнктивальные пробы, реакции дегрануляции тучных клеток и реакции иммунных комплексов были отрицательными. Эти данные позволяют сделать вывод о том, что препарат не обладает аллергезирующим действием.
Проведенные эксперименты показали, что введение препарата Педифен 0.25% в виде спрея не оказывает иммунотоксического действия
Нижеследующие примеры иллюстрируют, но не ограничивают притязания заявителей.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРИМЕРЫ
Для приготовления фармацевтической композиции в виде спрея берут примерно 70 мл воды для инъекций (ФС 42-2620-97), в которой растворяют необходимое количество педифена гидрохлорида (НД 42-14192-06) (в пересчете на безводное вещество), натрия хлорида (ФСП 42-0474-4119-03 или Евр. Фарм.) и перемешивают в течение 15 минут, доводят до необходимого объема водой для инъекций (ФС 42-2620-97), фильтруют через стерильный фильтр 0,22 µм, разливают в тару, обычно снабженную распылителем, упаковывают в полиэтиленовый пакет и стерилизуют радиационно.
На основании проведенных предварительных биологических исследований нами изучена предлагаемая в настоящем патенте фармакологическая композиция под условным названием «педифен 0,25% в виде спрея» следующего состава:
| Педифен гидрохлорид (НД 42-14192-06) (в пересчете на безводное вещество) | 0,25 г |
| Натрия хлорид (ФСП 42-0474-4119-03, Евр. Фарм.) | 0,6 г |
| Вода для инъекций (ФС 42-2620-97) | до 100 мл |
ОЦЕНКА ОСТРОЙ ТОКСИЧНОСТИ ЛЕКАРСТВЕННОЙ ФОРМЫ ПРЕПАРАТА ПЕДИФЕН 0.25%
Для определения показателей острой токсичности препарат per os вводили белым мышам и крысам обоего пола внутрижелудочно (в/ж) через атравматичный металлический зонд в возрастающих дозах по Литчфилду-Уилкоксону. Расчеты средних летальных доз проводили по В.Б. Прозоровскому (Фармакология и токсикология, 1978, №4, с.497-502). Для достижения больших доз препарата введение осуществляли повторно с интервалом 20-30 минут в течение 4 часов. Контрольные животные получали аналогичные по объемам введения растворителя - воды для инъекций.
Дозирование осуществляли на общую массу препарата (действующего начала и вспомогательных веществ), условно принимая, что 1 мл весит приблизительно (с учетом удельного веса) 1 г.
Для изучения воздействия препарата при закапывании в глаза его закапывали в конъюнктивальные мешки и на роговицу в максимальных дозах. Контрольным животным капали тем же способом аналогичную дозу воды для инъекций. После этого животные помещались на 14 дней в клетки для наблюдения.
Зависимые от доз эффекты препарата Педифен 0.25% представлены в таблицах 1-4.
| Таблица 1 | |||||
| Летальные эффекты (пало/всего) лекарственной формы препарата Педифен 0.25% при в/ж введении мышам-самцам | |||||
| Доза, г/кг | 3 | 5 | 7.5 | 10 | 15 |
| Педифен 0.25% | 0/6 | 0/6 | 0/6 | 0/6 | 0/6 |
| ЛД50>15.0 г/кг |
| Таблица 2 | |||||
| Летальные эффекты (пало/всего) лекарственной формы препарата Педифен 0.25% при в/ж введении мышам-самкам | |||||
| Доза, г/кг | 3 | 5 | 7.5 | 10 | 15 |
| Педифен 0.25% | 0/6 | 0/6 | 0/6 | 0/6 | 0/6 |
| ЛД50>15.0 г/кг |
| Таблица 3 | |||||
| Летальные эффекты (пало/всего) лекарственной формы препарата Педифен 0.25% при в/ж введении крысам-самцам | |||||
| Доза, г/кг | 6 | 8 | 10 | 12 | 15 |
| Педифен 0.25% | 0/6 | 0/6 | 0/6 | 0/6 | 0/6 |
| ЛД50>15.0 г/кг |
| Таблица 4 | |||||
| Летальные эффекты (пало/всего) лекарственной формы препарата Педифен 0.25% при в/ж введении крысам-самкам | |||||
| Доза, г/кг | 6 | 8 | 10 | 12 | 15 |
| Педифен 0.25% | 0/6 | 0/6 | 0/6 | 0/6 | 0/6 |
| ЛД50>15.0 г/кг |
Полученные данные показывают, что половых различий в показателях острой токсичности лекарственной формы препарата не проявляется. Это позволяет объединить данные по летальности у самцов и самок и выполнить расчет летальных доз без учета пола. Как можно видеть, различия в значениях ЛД50 лекарственной формы препарата Педифен 0.25% для двух видов лабораторных животных отсутствуют.
Внутрижелудочное введение
Гибели мышей и крыс при введении доз лекарственной формы до максимального значения (15 г/кг) не наблюдалось. Первым и единственным внешним проявлением токсического действия являлось кратковременное оцепенение животных, которое сохранялось первые минуты после введения. В дальнейшем состояние животных не отличалось от контрольной группы. Гибели животных в контрольных группах не отмечалось. В первый и второй дни отмечалось незначительное снижение потребленя корма. В остальные дни их состояние не отличалось от обычного.
Половых различий в течение интоксикации не отмечалось.
Результаты измерения массы тела животных, переживших интоксикацию в максимальной дозе представлены в таблицах 5 и 6.
| Таблица 5 | |||
| Влияние острого внутрижелудочного лекарственной формы препаратаПедифен 0.25% на массу тела мышей, г | |||
| Сроки исследования | Интактные | Контроль | «Педифен» |
| 1 | 2 | 3 | 4 |
| Самцы 14 дней | |||
| Фон | 19.9±0.3 | 20.1±0.4 | 19.6±0.1 |
| 7 дней | 20.7±0.2 | 19.9±0.3 | 21.0±0.1 |
| 14 дней | 21.9±0.4 | 21.8±0.5 | 22.0±0.3 |
| Самки 14 дней | |||
| Фон | 18.7±0.1 | 19.2±0.4 | 19.7±0.1 |
| 7 дней | 20.4±0.1 | 21.0±0.3 | 20.1±0.4 |
| 14 дней | 21.0±0.4 | 21.4±0.4 | 20.4±0.1 |
| Таблица 6 | |||
| Влияние острого внутрижелудочного лекарственной формы препаратаПедифен 0.25% на массу тела крыс, г | |||
| Сроки исследования | Интактные | Контроль | «Педифен» |
| 1 | 2 | 3 | 4 |
| Самцы 14 дней | |||
| Фон | 180.2±1.4 | 180.6±1.1 | 180.6±1.4 |
| 7 дней | 182.8±1.4 | 194.7±2.1 | 180.2±1.3 |
| 14 дней | 200.9±1.7 | 201.8±1.2 | 198.3±1.7 |
| Самки 14 дней | |||
| Фон | 174.6±1.9 | 181.3±1.0 | 177.2±0.9 |
| 7 дней | 186.4±1.9 | 187.6±1.6 | 188.6±1.7 |
| 14 дней | 188.6±2.4 | 189.8±1.9 | 190.0±1.8 |
Анализ полученных данных показывает некоторое снижение средней массы тела у всех животных, получавших препарат, на второй день после введения. Этот же эффект отмечался и в контроле (хотя и в меньшей степени), так что он может быть вызван общим стрессом.
Педифен обладает сравнительно низкой токсичностью. Не кумулирует.
Изучение токсичности при закапывании в глаза
При закапывании препарата в глаза, гибели животных не наблюдалось. Объем вводимого препарата при определении параметров острой токсичности при интраконъюнктивальной аппликации соответствовал максимально технически возможному для введения в течение дня. Соответственно для крыс и кроликов указанные объемы равны 1,0 и 8,0 мл. Никаких внешних патологических проявлений, которые можно было бы принять за признаки интоксикации, не отмечалось. Однако, у животных, получавших модельный образец и воду для инъекций в глаза, отмечены гиперемия слизистых оболочек глаз, слезотечение. Достоверных изменений диаметра зрачка и реакции на свет (зрачковый рефлекс) не зарегистрировано. При обследовании животных через 24 часа у кроликов наблюдались симптомы конъюнктивита в легкой степени (гиперемия в 1 балл, серозное отделяемое из конъюнктивальной полости). У животных контрольной группы указанные симптомы были менее выражены. Результаты пробы с флуоресцеином у кроликов всех экспериментальных групп отрицательные (отсутствие органических повреждений роговицы).
Состояние и поведение подопытных животных в дальнейшие сроки наблюдения не отличалось от поведения контрольных и во всех группах соответствовало нормальному состоянию и поведению интактных крыс и кроликов. Динамика массы тела животных во всех опытных группах также не отличалась от контроля.
Данные вскрытия (некропсии)
На вскрытии крыс и мышей в конце эксперимента (через 14 дней) различий между животными, получавшими препарат, не установлено.
Шерсть опытных животных имела опрятный вид, была блестящей, без очагов облысения. Питание животных было удовлетворительным.
При осмотре грудной и брюшной полостей нарушений в расположении внутренних органов не отмечалось.
Подчелюстные лимфатические узлы и слюнные железы имели овальную или округлую форму, однородный розоватый или желтоватый цвет и умеренную плотность.
Щитовидная железа плотно прилежала к гортани, имела обычные размеры и плотность, розовато-красноватый цвет. Тимус имел треугольную форму, беловатый цвет и умеренно плотную консистенцию.
Величина и форма сердца изменений не представляли. Мышца сердца была коричневатой, плотной.
Поверхность легких имела бледно-розовую окраску; легкие спадались при вскрытии грудной клетки. Ткань на разрезе также имела однородную бледно-розовую окраску. Слизистая оболочка внелегочных бронхов была гладкой, блестящей, бледно-розовой.
Селезенка имела темно-вишневый цвет, гладкую поверхность и плотноватую консистенцию.
Поджелудочная железа была бледно-розовой, дольчатой.
Величина и форма печени изменений не представляли. Капсула печени была тонкой, прозрачной. Ткань печени имела коричневатый цвет и умеренно плотную консистенцию.
Величина и форма почек не отличались от контроля, капсула легко снималась. Поверхность органа была гладкой, однородной коричневато-сероватой окраски. На разрезе почек отчетливо различались корковое и мозговое вещество.
Форма, размеры и плотность надпочечников, яичников или яичек не отличались от контроля.
Оболочки головного мозга были тонкими, прозрачными. Вещество головного мозга имело умеренную плотность. Расширения желудочков мозга не наблюдалось.
У животных, получивших препараты и воду для инъекций внутрижелудочно, видимых нарушений со стороны органов желудочно-кишечного тракта не наблюдалось. Слизистая пищевода была блестящей, гладкой, бледного цвета. Величина и форма желудка изменений не представляли. Его просвет был заполнен пищевым содержимым. Гиперемии, эрозий, кровоизлияний, свидетельствующих о раздражающем действии введенного препарата, не наблюдалось. Просвет 12-перстной кишки изменений не представлял, слизистая кишки была блестящей, гладкой, бледно-розовой. Слизистая оболочка тонкой кишки была так же бледно-розовой, блестящей, гладкой. Слизистая оболочка толстой кишки имела слегка сероватый оттенок, была гладкой, блестящей.
У животных, получавших модельный образец и воду для инъекций в глаза, отмечены гиперемия слизистых оболочек глаз, слезотечение. Достоверных изменений диаметра зрачка и реакции на свет (зрачковый рефлекс) не зарегистрировано. При обследовании животных через 24 часа у кроликов наблюдались симптомы конъюнктивита в легкой степени (гиперемия в 1 балл, серозное отделяемое из конъюнктивальной полости). У животных контрольной группы указанные симптомы были менее выражены. Результаты пробы с флуоресцеином у кроликов всех экспериментальных групп отрицательные (отсутствие органических повреждений роговицы).
В таблицах 7 и 8 приведены массовые коэффициенты внутренних органов мышей и крыс, усредненные по группам.
| Таблица 7 | |||
| Массовые коэффициенты (МК) органов у белых мышей при остром внутрижелудочном введении лекарственной формы препарата Педифен 0.25% (г/кг веса тела) | |||
| Орган | Интактные | Контроль | «Педифен» |
| 1 | 2 | 3 | 4 |
| Самцы 14 дней | |||
| Сердце | 3.3±0.1 | 3.2±0.2 | 3.6±0.09 |
| Легкие с трахеей | 6.4±0.2 | 6.4±0.2 | 6.2±0.09 |
| Тимус | 0.88±0.02 | 0.90±0.02 | 0.87±0.02 |
| Печень | 38.6±1.7 | 40.0±1.3 | 39.8±2.6 |
| Селезенка | 2.9±0.08 | 2.9±0.1 | 3.3±0.09 |
| Почка (левая) | 4.2±0.2 | 4.2±0.1 | 4.3±0.2 |
| 1 | 2 | 3 | 4 |
| Надпочечники | 0.18±0.01 | 0.18±0.01 | 0.17±0.01 |
| Головной мозг | 15.1±0.5 | 15.7±0.4 | 15.6±0.4 |
| Яички или яичники | 4.0±0.09 | 4.0±0.1 | 3.9±0.2 |
| Самки 14 дней | |||
| Сердце | 3.4±0.3 | 3.4±0.2 | 3.2±0.3 |
| Легкие с трахеей | 6.5±0.1 | 6.7±0.2 | 6.7±0.2 |
| Тимус | 0.85±0.06 | 0.87±0.06 | 0.88±0.06 |
| Печень | 35.6±1.4 | 37.0±1.4 | 36.9±2.3 |
| Селезенка | 3.2±0.1 | 3.0±0.09 | 3.0±0.2 |
| Почка (левая) | 4.3±0.2 | 4.3±0.3 | 4.6±0.09 |
| Надпочечники | 0.17±0.009 | 0.15±0.01 | 0.17±0.01 |
| Головной мозг | 16.5±0.4 | 15.9±0.3 | 16.2±0.4 |
| Яички или яичники | 0.20±0.01 | 0.24±0.02 | 0.19±0.01 |
| Таблица 8 | |||
| Массовые коэффициенты (МК) органов у белых крыс при остром внутрижелудочном введении лекарственной формы препарата Педифен 0.25% (г/кг веса тела) | |||
| Орган | Интактные | Контроль | «Педифен» |
| 1 | 2 | 3 | 4 |
| Самцы 14 дней | |||
| Сердце | 3.8±0.02 | 3.8±0.1 | 3.7±0.03 |
| Легкие с трахеей | 7.4±0.09 | 7.2±0.2 | 7.6±0.07 |
| Тимус | 1.36±0.04 | 1.34±0.11 | 1.41±0.06 |
| Печень | 42.6±0.9 | 36.8±1.5 | 43.7±0.9 |
| Селезенка | 4.7±0.07 | 4.2±0.1 | 4.4±0.2 |
| Почка (левая) | 4.0±0.01 | 4.4±0.09 | 4.0±0.009 |
| Надпочечники | 0.12±0.002 | 0.10±0.02 | 0.10±0.001 |
| Головной мозг | 6.9±0.01 | 8.7±0.4 | 7.0±0.05 |
| Яички или яичники | 12.5±0.09 | 12.7±0.09 | 11.7±0.09 |
| Самки 14 дней | |||
| Сердце | 3.4±0.03 | 3.6±0.02 | 3.6±0.02 |
| Легкие с трахеей | 8.2±0.07 | 8.4±0.07 | 8.3±0.1 |
| Тимус | 1.46±0.05 | 1.52±0.04 | 1.50±0.05 |
| Печень | 40.5±0.9 | 40.8±0.7 | 41.0±0.9 |
| Селезенка | 4.8±0.05 | 4.8±0.07 | 4.9±0.09 |
| Почка (левая) | 4.1±0.02 | 4.3±0.01 | 4.2±0.02 |
| Надпочечники | 0.12±0.001 | 0.11±0.001 | 0.10±0.001 |
| Головной мозг | 7.31±0.09 | 7.03±0.08 | 7.13±0.06 |
| Яички или яичники | 0.61±0.03 | 0.61±0.04 | 0.60±0.05 |
Анализ величин массовых коэффициентов не выявил каких-либо достоверных отличий как между группами животных, получавшими модельный образец препарата по отношению к контрольной группе.
Заключение по результатам исследования острой токсичности исследуемого лекарственной формы препарата:
Исследование острой токсичности на грызунах - нелинейных белых мышах и крысах - показало, что препарат Педифен 0.25% по параметрам острой токсичности относится к практически нетоксичным веществам. Об этом свидетельствуют следующие экспериментальные данные.
Значения ЛД50 препарата Педифен 0.25% для беспородных белых мышей и крыс обоего пола при в/ж введении лежат заведомо выше 15 г/кг, что приблизительно в семьсот раз больше максимальной суточной дозы для человека - 20 мг/кг.
Препарат Педифен 0.25% при его остром в/ж введениях в дозах до 15 г/кг беспородным бельм мышам и крысам обоего пола не приводил к гибели животных, не вызывал макроскопических изменений головного мозга, внутренних и эндокринных органов, не вызывал дистрофии внутренних органов, что подтверждается величинами их массовых коэффициентов, а также не отмечалось его раздражающего действия на слизистые органов ЖКТ.
Интраконъюнктивальное введение препарата в максимально возможной дозе более 5 г/кг не оказывает выраженного раздражающего действия на слизистые оболочки глаз лабораторных животных.
В острых экспериментах по применению препарата Педифен 0.25% не отмечалось признаков, свидетельствующих о раздражающем действии препарата на слизистые органов ЖКТ и глаз лабораторных животных.
Таким образом, результаты токсикометрии, данные наблюдений за экспериментальными животными в 14-дневном периоде после острого применения, а также данные патоморфологических исследований позволяют отнести препарат Педифен 0.25% к VI классу относительно безвредных лекарственных веществ (Н.Hodge et al. Clinical Toxicology of Commercial Products. Acute Poisoning. Ed.IV, Baltimore, 1975, 427 p.; K.K. Сидоров, 1973) (таблица 9). Состояние переживших острые эксперименты животных свидетельствует о хорошей переносимости и безвредности препарата в дозах, превышающих максимальные терапевтические в сотни раз.
Проведенные исследования свидетельствуют об отсутствии противопоказаний по показателям острой токсичности для клинических испытаний или медицинского применения препарата Педифен 0.25%.
| Таблица 9 | |||
| Степени токсичности лекарственных препаратов (по Hodge и Sterner) | |||
| Степень токсичности | Термин | ЛД50, однократно per os, крысы (мг/кг) | ЛД50, однократно i/v*, крысы (мг/кг) |
| 1 | Чрезвычайно токсично | <1 | <0.1 |
| 2 | Высокотоксично | 1-50 | 0.1-50 |
| 3 | Умеренно токсично | 50-500 | 5-50 |
| 4 | Малотоксично | 500-5000 | 50-500 |
| 5 | Практически не токсично | 5000-15000 | 500-1500 |
| 6 | Относительно безвредно | >15000 | >1500 |
| * - градации степеней токсичности при внутривенном пути введения определяются посредством умножения значений стандартных доз для оценки токсичности препарата при пероральном пути введения на коэффициент 0,1 |
ИССЛЕДОВАНИЕ ПОДОСТРОЙ ТОКСИЧНОСТИ ЛЕКАРСТВЕННОЙ ФОРМЫ ПРЕПАРАТА ПЕДИФЕН 0.25% ПРИ ИНТРАКОНЪЮНКТИВАЛЬНОМ ВВЕДЕНИИ
Суточная терапевтическая доза для человека составляет по 2 капли в каждый глаз однократно, с возможностью повторного введения через 30 минут, но не более чем 0,8 мл однократно, с возможностью повторного введения через 30 минут, но не более чем 0,8 мл на взрослого человека. Максимальная терапевтическая доза для человека средней массой 60 кг составит 0,013 мл/кг (приблизительно 0,01 мл/кг). По правилам экстраполяции терапевтическая доза для грызунов в 5,7 раз больше, чем для человека, то есть составляет 0,057 мл/кг (0,006 мл/100 г). Это будет первая терапевтическая доза. Ее дозировали каплями с помощью автоматической микропипетки. Терапевтическая доза для кроликов массой от 2 кг по расчетам с использованием коэффициента перерасчета доз в 3 раза больше, чем для человека - 0,039 мл/кг (приблизительно 0,04 мл/кг). Для удобства дозирования и расчетов в качестве максимальной терапевтической дозы было решено принять 0,05 мл/кг.
Исследуемые дозы
1. Для крыс: 1 доза 0,006 мл в один глаз. Соответственно 0,012 мл в сутки - максимальная терапевтическая доза (0,06 мл/кг). 2-я доза составила по 0,018 мл в оба глаза. Соответственно 0,036 мл в сутки - трехкратная максимальная терапевтическая доза (0,18 мл/кг). 3-я доза составила по 0,6 мл в оба глаза, что составляет 0,12 мл в сутки (0,6 мл/кг), доза в 60 раз превышающая максимальную терапевтическую дозу для человека, или 12 капель на одно животное; закапывание производилось в несколько приемов в оба глаза.
2. Для кроликов: 1 доза 0,05 мл в один глаз. Соответственно 0,1 мл в сутки - максимальная терапевтическая доза (0,05 мл/кг). 2-я доза составила по 0,15 мл в оба глаза. Соответственно 0,3 мл в сутки - трехкратная максимальная терапевтическая доза (0,15 мл/кг). 3-я доза составила по 0,5 мл в оба глаза, что составляет 1,0 мл в сутки (0,5 мл/кг), доза в 50 раз превышающая максимальную терапевтическую дозу, или 10 капель на одно животное; закапывание производилось в несколько приемов в оба глаза.
Частота нанесения 1 раз в день в течение 14 дней.
Общая продолжительность наблюдения - 21 день.
Физиологические параметры регистрировались до начала эксперимента (фон), через 14 и 21 день.
Гематологические и биохимические параметры оценивали на 14 и 21 день исследования.
Макроскопическое и гистологическое исследование внутренних органов проводилось посмертно после окончания введения и в конце периода наблюдения.
При офтальмологическом исследовании у животных оценивали состояние слизистых оболочек, наличие роговичных рефлексов, измеряли величину зрачка (р) и ширину глазной щели (f) левого (s) и правого (d) глаз. В течение всего периода наблюдения у животных контрольной и опытных групп отечности или гиперемии слизистых не отмечалось.
В таблице 10 представлены результаты измерения величины зрачка и ширины глазной щели. При анализе представленных данных достоверных отличий показателей у всех экспериментальных групп не выявлено.
| Таблица 10 | ||||||||||
| Влияние лекарственной формы препарата Педифен 0.25% на величину зрачка и ширину глазной щели у белых крыс (мм, М±m) | ||||||||||
| Показатель | Интактные | Контроль | Дозы препарата | |||||||
| 0.06 мл/кг | 0.18 мл/кг | 0.6 мл/кг | ||||||||
| М | F | М | F | М | F | М | F | М | F | |
| Фон | ||||||||||
| pd | 1.08±0.09 | 1.08±0.09 | 1.02±0.04 | 1.08±0.09 | 1.06±0.01 | 1.08±0.09 | 1.02±0.11 | 1.03±0.04 | 1.01±0.05 | 1.08±0.1 |
| ps | 1.06±0.1 | 1.05±0.05 | 1.06±0.1 | 1.06±0.01 | 1.03±0.04 | 1.05±0.05 | 1.06±0.09 | 1.08±0.03 | 1.08±0.01 | 1.06±0.09 |
| Fd | 2.8±0.1 | 2.7±0.09 | 3.1±0.13 | 2.8±0.1 | 2.7±0.09 | 2.87±0.11 | 3.1±0.13 | 2.8±0.11 | 3.08±0.14 | 2.74±0.1 |
| Fs | 2.6±0.1 | 2.8±0.11 | 3.8±0.11 | 2.84±0.07 | 2.74±0.15 | 2.91±0.09 | 3.08±0.14 | 2.84±0.07 | 3.03±0.1 | 2.9±0.12 |
| Длитель-ность анестезии | 0 | 0 | 0 | 0 | 24.1±0.8 | 23.2±0.9 | 24.6±0.9 | 24.1±0.8 | 26.5±0.9 | 25.8±0.9 |
| 14 суток | ||||||||||
| pd | 1.08±0.09 | 1.08±0.09 | 1.02±0.05 | 1.1±0.1 | 1.02±0.11 | 1.02±0.04 | 1.08±0.05 | 1.10±0.09 | 1.03±0.05 | 1.1±0.09 |
| ps | 1.03±0.04 | 1.05±0.05 | 1.03±0.04 | 1.05±0.13 | 1.08±0.07 | 1.05±0.09 | 1.06±0.1 | 1.05±0.05 | 1.05±0.05 | 1.06±0.1 |
| fd | 3.0±0.01 | 3.0±0.01 | 3.03±0.11 | 2.84±0.07 | 2.83±0.11 | 2.95±0.16 | 3.03±0.1 | 2.76±0.15 | 3.1±0.13 | 2.72±0.09 |
| fs | 2.84±0.07 | 3.03±0.11 | 3.0±0.01 | 2.76±0.15 | 2.87±0.09 | 2.95±0.17 | 3.00±0.1 | 2.83±0.09 | 3.0±0.1 | 2.8±0.12 |
| Длитель-ность анестезии | 0 | 0 | 0 | 0 | 24.6±0.9 | 24.1±0.8 | 24.1±0.8 | 23.2±0.9 | 25.8±0.9 | 26.5±0.9 |
ВЛИЯНИЕ НА МАССУ ТЕЛА
Динамика изменений массы тела животных экспериментальных групп представлена в таблице 11.
Динамика роста массы тела во всех экспериментальных группах была одинакова.
Анализ данных подтверждает отсутствие какого-либо различия между группами: величина F-критерия для критерия значимости равна 0.73 при критическом значении F 0.95; 10,90=1.99.
| Таблица 11 | ||||||||||
| Влияние подострого интраконъюнктивального введения лекарственной формы препарата Педифен 0.25% на массу тела белых крыс | ||||||||||
| Сроки исследования | Интактные | Контроль | Доза препарата | |||||||
| 0.06 мл/кг | 0.18 мл/кг | 0.6 мл/кг | ||||||||
| (дни) | М | F | М | F | М | F | М | F | М | F |
| Фон | 184±2.0 | 179±2.7 | 186±2.6 | 185±1.8 | 188±2.9 | 183±2.8 | 185±1.9 | 187±2.9 | 187±1.9 | 180±2.8 |
| 7 день | 199±1.8 | 187±2.0 | 193±2.5 | 189±2.2 | 193±2.4 | 184±2.0 | 200±1.8 | 201±2.9 | 200±1.8 | 188±2.0 |
| 14 день | 211±2.5 | 207±2.3 | 215±1.9 | 206±2.4 | 210±2.0 | 204±2.4 | 211±2.5 | 201±2.3 | 211±2.5 | 204±2.3 |
| 21 день | 216±2.1 | 206±2.3 | 218±1.7 | 216±2.5 | 220±1.8 | 206±2.2 | 217±2.1 | 209±3.0 | 217±2.1 | 209±2.4 |
ВЛИЯНИЕ НА КОЛИЧЕСТВО ПОТРЕБЛЯЕМОГО КОРМА И ВОДЫ
С целью определения количества потребляемого корма и воды крысы помещались на сутки в обменные клетки.
Данные по всем экспериментальным группам представлены в таблицах 12 и 13.
| Таблица 12 | ||||||||||
| Влияние подострого интраконъюнктивального введения лекарственной формы препарата Педифен 0.25% на потребление корма белых крыс (г, М±m) | ||||||||||
| Сроки исследования | Группы животных | |||||||||
| Интактные | Контроль | Доза препарата | ||||||||
| 0.06 мл/кг | 0.18 мл/кг | 0.6 мл/кг | ||||||||
| (дни) | М | F | М | F | М | F | М | F | М | F |
| Фон | 20.2±0.9 | 19.2±0.4 | 19.4±0.8 | 19.1±1.0 | 19.6±0.7 | 19.3±1.0 | 19.3±0.9 | 19.7±0.9 | 19.4±1.0 | 19.3±0.9 |
| 7 день | 20.4±0.6 | 20.1±0.6 | 20.1±0.9 | 20.4±0.9 | 19.9±0.9 | 20.4±0.9 | 20.8±0.9 | 20.0±1.0 | 20.9±0.9 | 20.8±1.0 |
| 14 день | 21.5±0.6 | 21.3±0.9 | 21.3±0.9 | 20.3±0.9 | 21.2±1.0 | 20.5±1.0 | 21.3±0.9 | 20.2±0.8 | 21.4±0.9 | 21.2±0.9 |
| 21 день | 20.9±0.9 | 21.3±0.7 | 19.7±1.0 | 19.7±0.8 | 19.6±1.0 | 19.9±0.9 | 20.8±0.8 | 20.9±0.9 | 20.9±0.8 | 20.7±0.9 |
| Таблица 13 | ||||||||||
| Влияние подострого интраконъюнктивального введения лекарственной формы препарата Педифен 0.25% на потребление воды белыми крысами (г, М±m) | ||||||||||
| Срокиисследования | Группы животных | |||||||||
| Интактные | Контроль | Доза препарата | ||||||||
| 0.06 мл/кг | 0.18 мл/кг | 0.6 мл/кг | ||||||||
| (дни) | М | F | М | F | М | F | М | F | М | F |
| Фон | 15.5±0.5 | 16.0±0.7 | 15.3±0.7 | 15.6±0.5 | 15.3±0.8 | 16.1±0.6 | 16.3±1.5 | 15.3±1.0 | 16.4±1.5 | 15.5±0.5 |
| 7 день | 15.6±0.8 | 16.6±0.9 | 15.5±0.9 | 16.4±0.8 | 16.4±0.6 | 16.4±1.0 | 16.8±1.1 | 16.4±0.7 | 16.9±1.1 | 16.4±0.8 |
| 14 день | 16.7±0.7 | 17.0±1.1 | 17.0±1.0 | 15.2±0.8 | 15.5±0.6 | 17.2±1.1 | 17.7±0.6 | 17.4±0.9 | 17.6±0.5 | 15.4±0.9 |
| 21 день | 16.6±0.9 | 16.5±0.9 | 16.4±0.6 | 16.4±0.7 | 16.4±0.8 | 16.2±0.9 | 17.1±0.9 | 16.6±0.9 | 17.3±0.8 | 16.4±0.7 |
ВЛИЯНИЕ НА ДВИГАТЕЛЬНУЮ И ИССЛЕДОВАТЕЛЬСКУЮ АКТИВНОСТЬ
В таблице 14 представлены данные по влиянию лекарственной формы препарата Педифен 0.25% на спонтанную двигательную активность крыс.
| Таблица 14 | |||||
| Влияние лекарственной формы препарата Педифен 0.25% на структуру поведения белых крыс (М±m) | |||||
| Исследуемые показатели | Интактные | Контроль | Доза препарата | ||
| 0.06 мл/кг | 0.18 мл/кг | 0.6 мл/кг | |||
| 1 | 2 | 3 | 4 | 5 | 6 |
| Самцы, фон | |||||
| Латентный период | 96±12 | 86±10 | 99±22 | 92±15 | 86±12 |
| Горизонтальная активность | 1.7±0.1 | 2.1±0.5 | 2.1±1.2 | 2.2±0.2 | 1.4±0.1 |
| Вертикальная активность | 2.0±0.3 | 1.8±0.4 | 2.0±0.6 | 1.3±0.2 | 1.9±0.1 |
| Заглядывания | 1.5±0.2 | 4.4±0.5 | 1.8±0.3 | 2.1±0.4 | 1.9±0.1 |
| Груминг | 0.8±0.2 | 1.3±0.09 | 1.7±0.3 | 0.9±0.3 | 1.5±0.1 |
| Болюсы | 1.6±0.09 | 1.8±0.4 | 1.7±0.2 | 1.2±0.2 | 1.1±0.2 |
| Самки, фон | |||||
| Латентный период | 88±18 | 89±14 | 86±10 | 93±20 | 86±9 |
| Горизонтальная активность | 2.2±0.3 | 2.2±0.2 | 2.0±0.4 | 1.6±0.4 | 2.0±0.4 |
| Вертикальная активность | 2.6±0.2 | 2.1±0.2 | 1.5±0.3 | 1.8±0.4 | 1.7±0.3 |
| Заглядывания | 3.0±0.7 | 2.5±0.2 | 2.1±0.2 | 3.0±0.6 | 2.4±0.5 |
| Груминг | 1.8±0.09 | 0.7±0.2 | 0.4±0.2 | 1.6±0.1 | 0.6±0.1 |
| Болюсы | 1.4±0.2 | 1.7±0.2 | 1.6±0.4 | 1.4±0.1 | 1.5±0.08 |
| Самцы, 14 дней | |||||
| Латентный период | 90±13 | 91±13 | 91±19 | 90±11 | 89±11 |
| Горизонтальная активность | 1.6±0.5 | 2.3±0.6 | 2.3±1.1 | 2.1±0.1 | 2.0±0.5 |
| Вертикальная активность | 1.9±0.3 | 1.6±0.4 | 1.9±0.6 | 2.3±0.2 | 1.7±0.4 |
| Заглядывания | 3.5±0.2 | 3.4±0.3 | 1.8±0.3 | 2.5±0.5 | 3.4±0.5 |
| Груминг | 1.1±0.09 | 1.9±0.4 | 1.6±0.3 | 0.6±0.3 | 1.3±0.09 |
| Болюсы | 1.3±0.1 | 1.8±0.3 | 1.7±0.2 | 1.5±0.09 | 1.7±0.3 |
| Самки, 14 дней | |||||
| Латентный период | 88±16 | 84±14 | 88±18 | 92±21 | 93±17 |
| Горизонтальная активность | 1.4±0.4 | 2.3±0.4 | 2.1±0.3 | 1.5±0.4 | 1.2±0.09 |
| Вертикальная активность | 1.4±0.7 | 2.1±0.6 | 2.5±0.1 | 1.7±0.3 | 1.8±0.6 |
| Заглядывания | 4.1±0.4 | 2.1±0.2 | 2.7±0.3 | 2.9±0.6 | 3.4±0.7 |
| Груминг | 1.4±0.1 | 0.5±0.1 | 0.7±0.2 | 1.6±0.2 | 1.6±0.2 |
| Болюсы | 1.5±0.1 | 1.6±0.3 | 1.8±0.4 | 1.3±0.3 | 1.5±0.3 |
| Самцы 21 день | |||||
| Латентный период | 91±11 | 85±12 | 90±13 | 94±21 | 88±16 |
| Горизонтальная активность | 1.7±0.2 | 1.4±0.09 | 2.1±0.2 | 1.4±0.4 | 1.2±0.4 |
| Вертикальная активность | 2.0±0.3 | 1.9±0.09 | 1.3±0.3 | 1.8±0.3 | 1.6±0.7 |
| Заглядывания | 1.4±0.1 | 1.9±0.09 | 2.0±0.3 | 2.9±0.8 | 4.3±0.5 |
| Груминг | 0.8±0.1 | 1.5±0.2 | 0.7±0.2 | 1.6±0.1 | 1.3±0.1 |
| Болюсы | 1.5±0.08 | 1.0±0.2 | 1.3±0.2 | 1.3±0.2 | 1.5±0.1 |
| Самки 21 день | |||||
| Латентный период | 95±10 | 95±18 | 94±21 | 94±17 | 96±18 |
| Горизонтальная активность | 1.5±0.1 | 1.8±0.4 | 2.3±1.1 | 2.2±0.3 | 1.7±0.4 |
| Вертикальная активность | 2.0±0.1 | 2.1±0.3 | 2.0±0.6 | 2.5±0.2 | 1.9±0.5 |
| Заглядывания | 1.5±0.2 | 3.8±0.3 | 1.8±0.3 | 2.5±0.2 | 3.8±0.3 |
| Груминг | 0.8±0.1 | 1.4±0.2 | 1.6±0.4 | 0.8±0.2 | 1.3±0.1 |
| Болюсы | 1.7±0.09 | 1.1±0.3 | 1.2±0.3 | 1.7±0.1 | 1.1±0.2 |
Какого-либо различия между группами не выявляется: значение F0 - 0.11, что заставляет исключить влияние применения препарата на исследованный показатель.
ВЛИЯНИЕ НА ПРОДОЛЖИТЕЛЬНОСТЬ ГЕКСЕНАЛОВОГО СНА
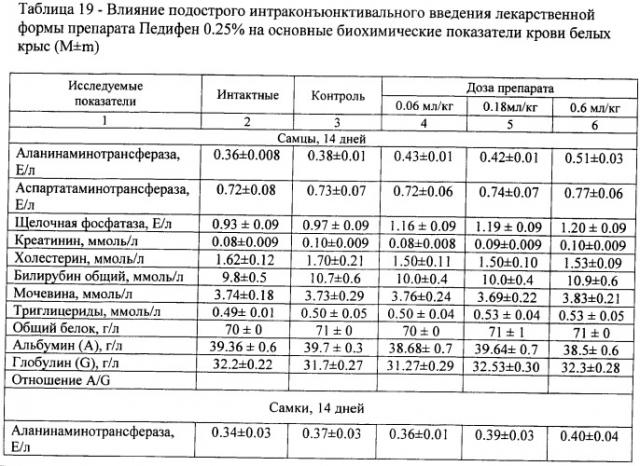
Детоксицирующую функцию печени оцени