Способы профилактики и лечения нейродегенеративных заболеваний
Иллюстрации
Показать всеИзобретение относится к медицине, неврологии, способам профилактики, лечения нейродегенеративных заболеваний, таких как таупатии, болезни Альцгеймера, Гентингтона, Паркинсона. Индивиду, нуждающемуся в этом, вводят эффективное количество фармацевтической композиции, содержащей экстракт виноградных косточек, имеющий менее чем приблизительно 12% по массе галлоилированных проантоцианидинов в расчете на общую массу проантоцианидинов в экстракте. Композицию вводят в количестве, эффективном для уменьшения образования олигомеров Aβ, агрегации тау-белков, агрегации htt белков или их комбинаций, в частности - в дозе приблизительно 100-1000 мг в сутки, с частотой введения раз в месяц, раз в две недели, раз в неделю или раз в сутки. Способ обеспечивает усиление нейропротективного действия композиции в виде предотвращения образования или растворения уже существующих амилоидных фибрилл и других подобных субстанций при указанных заболеваниях, снижение побочных эффектов лечения по сравнению с использованием композиций, где содержание галлоилированных проантоцианидинов выше 12%. 20 з.п. ф-лы, 28 ил., 9 пр., 1 табл.
Реферат
ПРИОРИТЕТ
По данной заявке испрашивается приоритет согласно 35 U.S.C. §119 по заявке США с серийным № 61/051866, поданной 9 мая 2008 года, содержание которой включено в настоящий документ в качестве ссылки в полном объеме.
ИНФОРМАЦИЯ О ГРАНТЕ
Это изобретение было осуществлено при поддержке правительства грантом под номером NIH 1 PO1 AT004511-02, выданным National Institute of Health. Правительство США имеет определенные права на это изобретение.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению экстракта виноградных косточек для профилактики и лечения нейродегенеративного заболевания. В частности, настоящее изобретение относится к способу лечения пациента, у которого диагностировано нейродегенеративное заболевание или который имеет риск его развития, путем введения фармацевтической композиции, содержащей экстракт виноградных косточек или одно или несколько полученных из него соединений пациенту в эффективном количестве для уменьшения накопления, агрегации и/или отложения амилоида-бета или его олигомеров и/или для уменьшения неправильного сворачивания, накопления и/или агрегации тау-белков или других белков.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Нейродегенеративные заболевания ассоциированы с состояниями, при которых нейрональные клетки повреждаются, утрачивают функцию и часто погибают. Поскольку они, как правило, являются прогрессирующими, последствия нейродегенеративных заболеваний часто являются тяжелыми. Пациенты с нейродегенеративным заболеванием могут страдать тяжелым нарушением познавательных или двигательных навыков.
В результате качество их жизни и продолжительность жизни могут значительно снижаться. У человека эти заболевания включают, но не ограничиваются ими, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Гентингтона, лобно-височную деменцию и кортико-базальную дегенерацию, среди прочих.
Болезнь Паркинсона представляет собой прогрессирующее нарушение, которое поражает нейроны головного мозга, контролирующие движение мышц. Эти нейроны продуцируют дофамин, который является важным химическим веществом для передачи сигналов между клетками, обеспечивающих движение тела. Таким образом, утрата этих нейронов ведет к двигательным нарушениям, таким как тремор и нарушение речи, которые, как правило, проявляются у пациентов с болезнью Паркинсона. Согласно National Institute of Neurological Disorders and Stroke, по меньшей мере 1 миллион человек страдает болезнью Паркинсона, и каждый год в США описывают приблизительно 50000 новых случаев.
В патологию болезни Паркинсона вовлечен высоко консервативный пресинаптический белок, α-синуклеин. Полагают, что конформационные изменения α-синуклеина приводят к скоплению белка и образованию фибрилл, характерным для этого заболевания. Смотрите патент США № 7045290 (выданный Lindquist et al). Современные способы лечения включают леводопу и агонисты дофамина. Однако эти лекарственные средства дают только временное смягчение симптомов и имеют тяжелые побочные эффекты, если их используют в больших количествах. Депренил, ингибитор моноаминоксидазы B, является первым лекарственным средством, предложенным для этиотропной терапии болезни Паркинсона путем смягчения симптомов и замедления прогрессирования заболевания, однако терапевтическая эффективность депренила является спорной. Смотрите патент США № 6417177 (выданный Nelson).
Болезнь Гентингтона (HD) представляет собой генетическое неврологическое нарушение с симптомами аномальных движений тела и сниженных умственных способностей. Болезнь Гентингтона вызывается экспансией тринуклеотидных повторов в гене хантингтина (htt), с которого, в свою очередь, продуцируется мутантная форма белка htt, имеющая патологическую экспансию полиглутаминовой (PolyQ) последовательности. Мутантный белок htt неправильно сворачивается и образует агрегаты в головном мозге и других пораженных тканях, что приводит к гибели нейронов (Wolfgang et al., Proc Nat Acad Sci 2005; 102: 11563-11568). Большинство лекарственных средств, используемых для лечения болезни Гентингтона, имеют побочные эффекты, такие как усталость, беспокойство или повышенная возбудимость.
Болезнь Альцгеймера (AD) представляет собой прогрессирующее заболевание головного мозга, общеизвестное как старческая деменция. Более 4,5 миллиона имеют диагноз AD, и ожидается, что это количество утроится в последующие 40-50 лет (Lyketsos et al., Am J Geriatr Psychiatry 2006; 14(7): 561-72).
Полагают, что патофизиологическая причина AD состоит, частично, в нарушении процессинга или в мутации амилоидного белка-предшественника. Белок с нарушением процессинга может образовывать увеличенное количество амилоидных бета-пептидов (Aβ) или их вариантных форм. Накопление Aβ ведет к отложению нерастворимых бляшек Aβ, и, в конечном итоге, к синаптической недостаточности, повреждению нейронов, образованию клубков гиперфосфорилированного тау-белка и апоптотической гибели нейронов. Повреждение или гибель нейронов приводят к потере множества нейротрансмиттеров, которая, в свою очередь, приводит к возникновению когнитивных и функциональных симптомов заболевания.
Доступные в настоящее время лекарственные средства обеспечивают относительно небольшую симптоматическую пользу для некоторых пациентов и не замедляют прогрессирование заболевания. Таким образом, существуют различные симптоматические стратегии лечения или профилактики AD. Например, было выявлено, что AD ассоциирована с воспалением головного мозга, и, таким образом, для снижения риска развития AD используют нестероидные противовоспалительные лекарственные средства, такие как ибупрофен и индометацин. Однако эти лекарственные средства имеют долгосрочный риск желудочно-кишечного кровотечения и заболевания почек, и они ассоциированы с редкой сердечно-сосудистой токсичностью. Связь свободных радикалов кислорода с AD также привела к возможности терапии антиоксидантами. Как American Psychiatric Association, так и American Academy of Neurology Treatment Guidelines for AD, рекомендовали высокие дозы витамина E в качестве дополнительного средства для лечения. Однако эта рекомендация ограничивается недавними открытиями, что терапия витамином E не замедляет прогрессирование мягкого когнитивного нарушения, ассоциированного с AD, и что витамин E в очень высоких дозах повышает смертность пожилых людей. Смотрите Lyketsos et al., 2006, выше.
Другим вариантом лечения AD является снижение естественной деградации ацетилхолина ферментом, известным как ацетилхолинэстераза (AChE). Ингибирование AChE приводит к повышению уровней ацетилхолина. Food and Drug Administration США одобрили для лечения AD четыре лекарственных средства на основе ингибитора холинэстеразы: такрин, донепезил, ривастигмин и галантамин. Кратковременные (вплоть до 6 месяцев) клинические испытания ингибиторов холинэстеразы показали, что эти лекарственные средства приводили к улучшению или замедляли снижение когнитивной функции, ассоциированное с AD, однако результаты клинических испытаний их длительной пользы не являются окончательными. При очень мягкой или более тяжелой AD, польза ингибиторов холинэстеразы является менее существенной. Смотрите Lyketsos et al., 2006, выше.
Разрабатывается лечение AD, которое нацелено на удаление Aβ из головного мозга. Например, в патенте США № 7262223 (выданном Kong et al.) описано применение соединений амидина для лечения связанных с амилоидом заболеваний; в патенте США № 7279501 (выданном Kim) описано применение природных соединений, выделенных из растений (например, куркумы, гинкго двухлопастного и имбиря) и их синтетических химических аналогов для лечения индуцируемого Aβ заболевания. Последние данные указывают на то, что умеренное употребление красного вина может снизить заболеваемость AD и может уменьшить когнитивное нарушение по типу AD и амилоидную нейропатологию (Dartigues et al, Therapie 1993; 48: 185-187; Dorozynski, BMJ 1997; 314: 997; Luchsinger et al, J Am Geriatr Soc 2004; 52: 540-546). Накопление растворимых внеклеточных высокомолекулярных (HMW) олигомерных молекул Aβ в головном мозге считается главным фактором риска возникновения и прогрессирования когнитивного нарушения (Klyubin et al, Nat Med 2005; 11: 556-561; Selkoe, J Alzheimer's Dis 2001; 3: 75-80). Было предположено, что происходящие из винограда полифенольные соединения могут ингибировать олигомеризацию Aβ in vitro (Porat et al, Chem Biol Drug Des 2006; 67: 27-37). Однако до сегодняшнего дня исследования были ограничены тестированием in vitro.
Многие типы нейродегенеративных заболеваний связаны с аномальным сворачиванием белка, накоплением, агрегацией и/или отложением белков. Например, существует два типа аномальных отложений белка в головном мозге пациентов с болезнью Альцгеймера. Существуют амилоидные бляшки, состоящие из амилоидных бета-пептидов, которые депонируются внутриклеточно в паренхиме головного мозга и вокруг стенок сосудов головного мозга, и нейрофибриллярные клубки, которые состоят из агрегатов гиперфосфорилированного тау-белка, расположенного в цитоплазме дегенерирующих нейронов. У пациентов с болезнью Паркинсона в цитоплазме нейронов черной субстанции наблюдают тельца Леви. Основными составляющими телец Леви являются фрагменты белка, называющегося α-синуклеином. Типичным признаком головного мозга пациентов с болезнью Гентингтона являются внутриядерные отложения богатого полиглутамином варианта мутантного белка хантингтина. Пациенты с наследственным боковым амиотрофическим склерозом имеют агрегаты, главным образом, состоящие из супероксиддисмутазы, в телах клеток и аксонах двигательных нейронов. Кроме того, различные формы трансмиссивной губчатой энцефалопатии характеризуются скоплениями устойчивых к протеазе агрегатов прионного белка.
Данные биохимических, генетических и нейропатологических исследований указывают на активное вовлечение неправильного сворачивания и/или агрегации белка в патологию нейродегенеративных заболеваний. Например, присутствие аномальных агрегатов, как правило, встречается в областях головного мозга, наиболее поврежденных заболеванием. Мутации в гене, кодирующем неправильно свернутый белок, вызывают врожденные формы заболевания, которые, как правило, имеют более раннее начало и более тяжелый фенотип, чем спорадические формы. У трансгенных животных, у которых экспрессируется мутантный ген человека для неправильно свернутого белка, развиваются некоторые из типичных нейропатологических и клинических признаков заболевания человека. Также неправильно свернутые агрегаты белка, продуцируемые in vitro, являются нейротоксичными и индуцируют гибель клеток.
Таупатии представляют собой семейство нейродегенеративных заболеваний, в которые вовлечено нарушение функции тау-белков (семейство близкородственных внутриклеточных ассоциированных с микротрубочками белков). Эти нейродегенеративные заболевания включают, например, болезнь Альцгеймера, прогрессирующий супрануклеарный паралич, кортикобазальную дегенерацию, болезнь аргирофильных зерен, болезнь Пика, а также другие заболевания. Общими признаками таупатий является аномальное гиперфосфорилирование тау и скопления тау в устойчивых к детергенту внутриклеточных включениях, известных как нейрофибриллярные клубки (NFT) среди нейронов или глиальных клеток головного мозга. Аномально гиперфосфорилированные тау-белки легко диссоциируют от микротрубочек и агрегируют в олигомерные парные спиралевидные тау-фибриллы, которые в конечном итоге откладываются в качестве внутриклеточных NFT. (Mi, K. et al, Curr Alzheimer Res 2006; 3: 449-463). Образование олигомеров служит в качестве участков ядрообразования, которые объединяют дополнительный гиперфосфорилированный тау, а также нормальный нефосфорилированный тау, в фибриллярные агрегаты. (Sorrentino et al, Neurol Sci 2007; 28: 63-71). Таким образом, теория тау-опосредуемой нейродегенерации основана на модели "токсического приобретения функции", в которой аномально фосфорилированные тау-белки стимулируют удаление как гиперфосфорилированных, так и нормальных белков тау из микротрубочек. Это приводит к нестабильности микротрубочек и изменениям опосредуемых микротрубочками процессов, таких как аксональный транспорт, которые, в свою очередь, приводят к нарушению функции и снижению жизнеспособности нейрональных и глиальных клеток в головном мозге (Sorrentino et al., 2007, выше).
В публикации патентной заявки США № 2007/0122504 (выданной Moon et al.) описан процесс производства экстракта виноградных косточек и способы применения такого экстракта виноградных косточек для лечения нейродегенеративных заболеваний, включая AD. Экстракт получают путем (1) экстракции виноградных косточек в щелочном растворе, имеющем pH от 8 до 11, при предпочтительно 20-50°C с получением растворимого в щелочи вещества; (2) нейтрализации кислотного раствора для доведения до pH в диапазоне от 2 до 4, и центрифугирования полученного раствора и получения осажденного слоя; (3) добавления низшего спирта и получения слоя супернатанта, затем концентрирования слоя супернатанта; и (4) добавления неполярного растворителя и удаления растворимого в неполярном растворителе слоя с получением очищенной фракции и проведения повторяющейся очистки и лиофилизации для получения высушенного экстракта виноградных косточек. (смотрите Moon, абзацы [0030]-[0035]).
Вследствие распространенности нейродегенеративных заболеваний и отсутствия подтвержденных эффективных фармацевтических композиций или способов лечения симптомов, ассоциированных с нейродегенеративными заболеваниями, все еще существует необходимость в улучшенных фармацевтических композициях и способах их лечения и профилактики.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу лечения нейродегенеративного заболевания у индивида путем введения индивиду, нуждающемуся в этом, фармацевтической композиции, где фармацевтическая композиция содержит экстракт виноградных косточек или одно или несколько соединений, полученных из него. В определенных вариантах осуществления, фармацевтическая композиция также может содержать активный ингредиент, выбранный из группы, состоящей из антиоксиданта, ингибитора ацетилхолинэстеразы и их комбинаций. В конкретном варианте осуществления, экстракт виноградных косточек содержит менее чем приблизительно 12% по массе галлоилированного проантоцианидина в расчете на общую массу проантоцианидинов в экстракте.
В одном варианте осуществления фармацевтическую композицию вводят перорально. Пероральные дозированные формы включают порошок, таблетку, капсулу, диспергирующуюся в полости рта таблетку, мягкую капсулу, водное лекарственное средство, сироп, эликсир или саше. В другом варианте осуществления, фармацевтическую композицию вводят трансдермально. В другом варианте осуществления, фармацевтическую композицию вводят трансназально.
В конкретных вариантах осуществления индивидом является человек. Частота введения представляет собой введение раз в месяц, раз в две недели, раз в неделю или раз в сутки, и введение можно проводить в однократной дозе или разделенными дозами. Эффективное количество соединений экстракта виноградных косточек представляет собой дозировку от приблизительно 100 до приблизительно 1000 мг в сутки, предпочтительно от приблизительно 200 до приблизительно 600 мг в сутки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
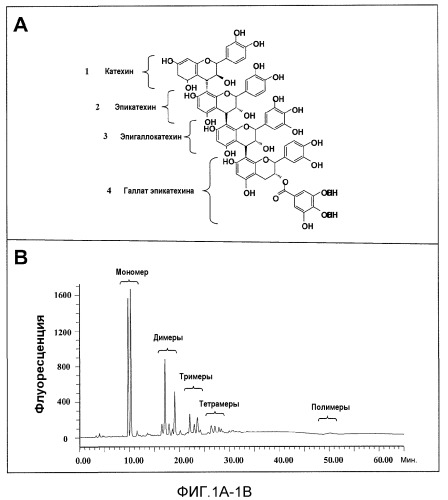
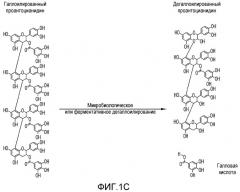
Фиг.1A-1F. На фиг.1 проиллюстрирован результат анализа компонентов продукта экстракта виноградных косточек (GSE), MegaNatural®-AZ (или MNG-AZ). На фиг.1A проиллюстрирована молекулярная структура типичного гетерополимерного проантоцианидина. На фиг.1B представлен анализ MNG-AZ посредством ВЭЖХ на нормальной фазе. На фиг.1C схематично представлен гомотетрамерный проантоцианидин, состоящий из галлата эпикатехина (левая панель), и полученный дегаллоилированный проантоцианидин вместе отделенной структурой галловой кислоты (правая панель). На фиг.1D показан процент галлоилированных проантоцианидинов (из всех проантоцианидинов) в MNG-AZ по сравнению с четырьмя другими коммерчески доступными препаратами GSE: MegaNatural®-Gold, торговое название GSE A, торговое название GSE B и торговое название GSE C (фиг.1D) (торговое название A представляет собой "Activin", GSE, полученный от San Joaquin Valley Concentrates; торговое название B представляет собой "Masquelie® OPC", GSE из Франции; и торговое название C представляет собой GSE от Indena S.p.A., Италия). На фиг.1E и 1F представлены уровни галлоилированного проантоцианидина в MNG-AZ и некоторые другие коммерчески доступные GSE.
Фиг.2A-2D. На фиг.2 представлен эффект GSE MNG-AZ на превращение Aβ-пептидов в их растворимые олигомерные формы in vitro. На фиг.2A и 2B представлен полиакриламидный гель-электрофорез (SDS-PAGE) с додецилсульфатом натрия продукта инкубации Aβ1-42 (2A) и Aβ1-40 (2B) с различными количествами GSE MNG-AZ. На фиг.2C и 2D продемонстрирован результат SDS-PAGE Aβ1-42 (2C) и Aβ1-40 (2D) в присутствии или отсутствие GSE MNG-AZ после проведения химической реакции фотоиндуцированного поперечного сшивания немодифицированных белков (PICUP).
Фиг.3A-3D. На фиг.3 представлен эффект ингибирования MNG-AZ в отношении Aβ, исследованный спектроскопией кругового дихроизма (CD). На фиг.3A и 3C представлены спектры CD необработанных Aβ1-40 и Aβ1-42, соответственно; на фиг.3B и 3D представлены спектры CD Aβ1-40 и Aβ1-42, соответственно, обработанных MNG-AZ. Спектры получали сразу после начала периода инкубации и через 2 , 3 , 6 и 7 суток. Спектры, представленные для каждого момента времени, соответствуют спектрам, полученным в ходе каждого из 3 независимых экспериментов.
Фиг.4A-4D. На фиг.4 представлен эффект MNG-AZ в отношении ингибирования Aβ, при исследовании в анализе связывания ThT. На фиг.4A и 4C представлены спектры флуоресценции необработанных Aβ1-40 и Aβ1-42, при различных концентрациях контрольного соединения Med1, соответственно; на фиг.4B и 4D представлены спектры флуоресценции Aβ1-40 и Aβ1-42, соответственно, обработанных MNG-AZ. На каждой из фиг.4A-4D концентрации Med1 (или MNG-AZ) представляют собой 0 (♦), 5 (■) или 25 (▲) мкМ.
Фиг.5A-5F. На фиг.5 проиллюстрирован эффект MNG-AZ в отношении ингибирования Aβ при исследовании электронной микроскопией. На фиг.5A и 5B представлена иллюстративная морфология необработанных Aβ1-40 и Aβ1-42, соответственно. На фиг.5C и 5E представлена морфология Aβ1-40 в присутствии более низких (5 мкМ) и более высоких (25 мкМ) концентраций MNG-AZ, соответственно. На фиг.5D и 5F представлена морфология Aβ1-42, в присутствии более низкой (5 мкМ) и более высокой (25 мкМ) концентрации MNG-AZ, соответственно.
Фиг.6A-6D. На фиг.6 проиллюстрирован эффект MNG-AZ в отношении ингибирования Aβ при исследовании по метаболизму МТТ. На фиг.6A (и 6C) представлена токсичность низкомолекулярного Aβ1-40 (и Aβ1-42) и эффект MNG-AZ в отношении снижения токсичности. На фиг.6B (и 6D) представлена токсичность агрегации Aβ1-40 (и агрегации Aβ1-42) и эффект MNG-AZ в отношении снижения токсичности.
Фиг.7A-7G. На фиг.7 проиллюстрированы эффекты GSE MNG-AZ на нейропатологию у мышей Tg2576. На фиг.7A-7B представлены эффекты GSE MNG-AZ на массу тела (7A) или употребление жидкости (7B). На фиг.7C-7D представлена оценка содержания растворимого внеклеточного пептида HMW-Aβ в головном мозге мышей Tg2576. На фиг.7E представлена оценка концентраций пептида Aβ1-42 и Aβ1-40 в головном мозге у мышей, которым вводили GSE MNG-AZ, и контрольных мышей. На фиг.7F представлена стереологическая оценка нагрузки Aβ-амилоидными бляшками коры головного мозга и парагиппокампальной извилины у мышей, которым вводили GSE MNG-AZ, и у контрольных мышей. На фиг.7G проиллюстрирована оценка концентраций пептидов Aβ1-42 и Aβ1-40 в головном мозге мышей, которым вводили MegaNatural®-Gold, и у контрольных мышей.
Фиг.8A-8F. На фиг.8 представлены результаты различных экспериментов по установлению потенциальных механизмов благоприятных эффектов GSE MNG-AZ. На фиг.8A проиллюстрирован вестерн-анализ тотальной экспрессии APP у мышей Tg2576, которым вводили MNG-AZ в течение приблизительно 5 месяцев. На фиг.8B проиллюстрирована оценка активности α-, β- и γ-секретазы. На фиг.8C проиллюстрирован вестерн-анализ экспрессии растворимого APPα и APPβ у мышей Tg2576, которым вводили GSE MNG-AZ, относительно контрольной группы. На фиг.8D и 8E представлена экспрессия деградирующего Aβ фермента неприлизина и деградирующего инсулин фермента в головном мозге мышей Tg2576, которым вводили GSE MNG-AZ, относительно контрольных мышей. На фиг.8F проиллюстрирована оценка содержания в сыворотке Aβ1-40 (левая панель) и Aβ1-42 (правая панель) посредством твердофазного иммуноферментного анализа (ELISA).
Фиг.9A-9C. На фиг.9 проиллюстрировано ослабление когнитивного нарушения у мышей Tg2576, которым вводили GSE MNG-AZ. На фиг.9A и 9B представлено влияние GSE MNG-AZ на связанную с Aβ пространственную память у мышей Tg2576 при определении с помощью тестов в водном лабиринте Морриса. На фиг.9C представлена оценка содержания растворимого внеклеточного высокомолекулярного пептида Aβ в головном мозге мышей Tg2576.
Фиг.10A-10B. На фиг.10A и 10B проиллюстрирован эффект введения GSE MNG-AZ на когнитивную функцию у мышей дикого типа, совпадающих по линии, возрасту и полу, при определении в тестах с водным лабиринтом Морриса.
Фиг.11A-11B. На фиг.11 проиллюстрирована кинетика агрегации тау-пептида в отсутствие или присутствии GSE MNG-AZ. На фиг.11A представлены зависимые от времени спектры флуоресценции ThS для агрегированного тау при различных концентрациях MNG-AZ; на фиг.11B представлено максимальное накопление агрегатов тау при различных концентрациях MNG-AZ.
Фиг.12A-12B. На фиг.12 проиллюстрирован эффект GSE MNG-AZ на диссоциацию заранее сформированных агрегатов тау-пептида. На фиг.12A представлены зависимые от времени спектры флуоресценции ThS для агрегированного тау при различных концентрациях MNG-AZ; На фиг.12B представлены скорости диссоциации агрегатов тау как функция концентрации MNG-AZ.
Фиг.13A-13D. На фиг.13 проиллюстрированы преимущества GSE MNG-AZ в модели с Drosophila. На фиг.13A представлен результат развития глаз у Drosophila в отсутствие GSE; на фиг.13B представлен результат развития глаз у Drosophila в присутствии GSE; на фиг.13C представлена визуальная оценка глаз самцов Drosophila в иллюстративном эксперименте (в присутствии и в отсутствие GSE); на фиг.13D представлено количество отсутствующих глаз в том же испытании, что и на фиг.13C.
Фиг.14. На фиг.14 проиллюстрирован процент выживаемости на протяжении данного количества суток в модели болезни Гентингтона у Drosophila. Пустые круги соответствуют результатам для группы, в которой вводили экстракт виноградных косточек, и а закрашенные круги соответствуют результатам для контрольной группы.
Фиг.15A-15C. На фиг.15 проиллюстрирован эффект GSE MNG-AZ на олигомеризацию Aβ. На фиг.15A представлены результаты для Aβ1-40; на фиг.15B представлены результаты для Aβ1-42; на фиг.15C представлены результаты для глутатион-S-трансферазы. Дорожки 1: маркеры молекулярной массы; дорожки 2: белок отдельно, без поперечного сшивания; дорожки 3: белок отдельно; дорожки 4: белок вместе с Med1 (25 мкМ); дорожки 5: белок вместе с Med1 (250 мкМ); дорожки 6: белок вместе с MNG-AZ (25 мкМ); дорожки 7: белок вместе с MNG-AZ (250 мкМ). Гель соответствует каждому из трех независимых экспериментов.
Фиг.16. На фиг.16 проиллюстрирован эффект GSE MNG-AZ на агрегацию тау-пептида с использованием анализа PICUP. Гель демонстрирует иллюстративный анализ 25 мкМ тау-пептида, поперечно-сшитого в присутствии (дорожки 2, 4, 6, 8) или отсутствие (дорожки 1, 3, 5, 7) равного количества моль (25 мкМ) GSE. Вследствие ожидаемого неэффективного окрашивания небольших пептидов, мономерные тау-пептиды не поддаются детекции в этом эксперименте. Полосы размером ~2,1 и ~3,5 кДа соответствуют, соответственно, тримерным и пентамерным агрегатам тау-пептидов. CTR: не поперечно-сшитый тау-пептид; дорожки 1-8: тау-пептид с персульфатом аммония (APS) и 1× (дорожки 1, 2), 2× (дорожки 3, 4), 3× (дорожки 5, 6) и 4× (дорожки 7, 8) Ru(Bpy).
Фиг.17A и 17B. На фиг.17 проиллюстрирован эффект GSE MNG-AZ на агрегацию тау-пептида с использованием спектроскопии кругового дихроизма. Агрегация тау-пептида в отсутствие MNG-AZ представлена на фиг.17A, в то время как агрегация тау-пептида в присутствии MNG-AZ в молярном отношении 1:1 относительно тау-пептидов представлена на фиг.17B. Кривые, обозначенные с помощью легенд d0, d1, d2 и d3, на фиг.17A и 17B соответствуют спектрам, полученным на 0, 1, 2, 3 сутки в процессе инкубации синтетического тау-пептида (при 37°C), соответственно. Стрелки указывают на спектры, характерные для упорядоченных конформеров.
Фиг.18A и 18B. На фиг.18 проиллюстрирован эффект GSE MNG-AZ на морфологию тау-фибрилл с использованием электронной микроскопии. Морфология тау-фибрилл в отсутствие MNG-AZ представлена на фиг.18A; морфология тау-фибрилл в присутствии MNG-AZ представлена на фиг.18B. Планками масштаба показано 100 нм.
Фиг.19A-19D. На фиг.19 проиллюстрирован эффект GSE MNG-AZ на ультраструктурные характеристики нативных парных спиралевидных фибрилл (PHF), выделенных из образцов головного мозга при AD. На фиг.19A представлена электронная микрофотография очищенных PHF в отсутствие GSE MNG-AZ; на фиг.19B и 19C представлены электронные микрофотографии очищенных PHF в присутствии 100 мкМ GSE MNG-AZ в течение 5 с (фиг.19B) или 1 ч (фиг.19C). На фиг.19A и 19C электронноплотные частицы соответствуют мечению pSer214tau (стрелки на C). На фиг.19D представлен количественный анализ PHF при обработке GSE как функция времени обработки (от 5 до 60 мин), где столбец диаграммы соответствует средней максимальной ширине со стандартным отклонением; измеренные количества PHF представлены в скобках. Статистический анализ проводили посредством одностороннего ANOVA (P<0,0001), с последующим анализом с помощью критерия множественных сравнений Бонферрони, **p<0,001 по сравнению с необработанными PHF (время 0).
Фиг.20A-20D. На фиг.20 проиллюстрирован эффект GSE MNG-AZ на расщепление трипсином PHF. На фиг.20A представлена электронная микрофотография нативных PHF, выделенных из головного мозга при AD, не инкубированных с трипсином; на фиг.20B представлена электронная микрофотография PHF, предварительно обработанных MNG-AZ (100 мкМ, 1 ч), не инкубированных с трипсином; на фиг.20C представлена электронная микрофотография нативных PHF, инкубированных с трипсином (1 мкг/мл, 10 мин); на фиг.20D представлена электронная микрофотография PHF, предварительно инкубированных с MNG-AZ (100 мкМ, 1 ч) и инкубированных с трипсином (1 мкг/мл, 10 мин).
Фиг.21A-21G. На фиг.21 проиллюстрирован эффект GSE MNG-AZ на аномальные фенотипы глаз в модели Drosophila с мутантным тау. На фиг.21A и 21D представлены иллюстративные фенотипы глаз у мух дикого типа; на фиг.21B и 21E представлены глаза мух с мутантным тау R406W в отсутствие введения GSE; на фиг.21C и 21F представлены глаза мух с мутантным тау R406W, которым вводили MNG-AZ; на фиг.21G представлен количественный анализ морфологии взрослого глаза, с использованием четырехточечной системы оценки (где 0=нет глаза и 4=нормальный глаз) у самцов и самок мух в трех независимых испытаниях. Указано количество оцененных мух на испытание. Столбиковые диаграммы соответствуют среднему значению +SEM.
Фиг.22A-22D. На фиг.22 представлена схема оценки с использованием анализа вытягивания задних конечностей в модели таупатии на трансгенных мышах JNPL3. Природную тенденцию животных к вытягиванию их задних конечностей латерально, когда их подвешивают в перевернутом состоянии за их хвосты, оценивают согласно четырехточечной системе оценки: 4=нормальная функция (фиг.22A), 3=мягкое нарушение (фиг.22B), 2=умеренное нарушение (фиг.22C) и 1=тяжелое нарушение (фиг.22D).
Фиг.23A и 23B. На фиг.23 проиллюстрирован эффект введения GSE в модели таупатии на трансгенных мышах JNPL3. На фиг.23A представлено двигательное нарушение у мышей JNPL3 в возрасте 5 месяцев и 13 месяцев, соответственно, при введении GSE по сравнению с мышами, которым не вводили GSE. На фиг.23B представлено сравнение уровня смертности среди мышей JNPL3, которым вводили GSE и которым не вводили GSE, где линейные графики соответствуют % выживанию с течением времени.
Фиг.24A и 24B. На фиг.24 проиллюстрирован эффект GSE MNG-AZ в отношении уменьшения агрегата белка htt с использованием флуоресцентной микроскопии. На фиг.24A представлены изображения контрольных клеток (Ctrl), обработанных носителем, и клеток, обработанных 12,5 мкМ и 25 мкМ GSE после индукции муристероном A. На фиг.24B представлен вестерн-блот анализ агрегации агрегатов слитого белка GFP-Htt в высокомолекулярные агрегаты в отсутствие (Ctrl) или в присутствии обработки 12,5 мкМ и 25 мкМ GSE (левая панель: вестерн-блот, исследованный с помощью антитела против GFP, для идентификации агрегации слитого белка GFP-Htt в более высокомолекулярные частицы; правая панель: денситометрический анализ вестерн-блота, демонстрирующий распределение белка GFP-Htt и более высокомолекулярных агрегатов htt).
Фиг.25A и 25B. На фиг.25 проиллюстрирован эффект введения GSE на двигательные нарушения в модели HD на Drosophila при оценке анализом подъема. На фиг.25A и 25B проиллюстрирован результат анализа подъема на 9 сутки и на 16 сутки, соответственно. В каждый день тестирования проводили три независимых испытания подъема. Столбиковые диаграммы соответствуют среднему значению +SEM для % мух, которые успешно выполнили задачу подъема. Статистический анализ проводили с помощью t-критерия Стьюдента, **p<0,001, путем сравнения группы введения GSE с группой без введения GSE.
Фиг.26. На фиг.26 проиллюстрирован процент выживания с течением данного количества суток в модели HD у Drosophila. Закрашенные перевернутые треугольники соответствуют результатам для группы, в которой вводили GSE MNG-AZ, а закрашенные ромбы соответствуют результатам для контрольной группы. Данные соответствуют результатам 4 независимых испытаний.
Фиг.27. На фиг.27 проиллюстрирован эффект обработки GSE на двигательное нарушение в модели HD на мышах, оцененный с использованием анализа на вращающемся стержне в возрасте, составляющем различное количество недель. Данные соответствуют результатам, полученным для 3 независимых испытаний.
Фиг.28. На фиг.28 проиллюстрирован эффект введения GSE на смертность в модели HD на мышах. Линейные графики соответствуют % выживанию с течением времени.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение преимущественно относится к способу снижения неправильного сворачивания, накопления, агрегация или отложения белков Aβ, олигомерного Aβ, тау или других белков, ассоциированных с нейродегенеративным заболеванием. Способ вовлекает введение эффективного количества фармацевтической композиции, содержащей экстракт виноградных косточек или одно или несколько соединений, полученных из него. Эти и другие аспекты изобретения подробно описаны в описании и примерах, предоставленных ниже.
Настоящее изобретение основано на открытии, что соединения из экстракта виноградных косточек функционируют в качестве эффективных ингибиторов неправильного сворачивания, накопления, агрегации и/или отложения Aβ, тау-белка и других белков, которые ассоциированы с различными нейродегенеративными заболеваниями. Конкретно, изобретение основано, частично, на открытии, что конкретные типы экстракта виноградных косточек снижали или ингибировали (1) образование олигомеров синтетических Aβ1-40 (Aβ40) и Aβ1-42 (Aβ42) in vitro; (2) количество олигомерного Aβ в головном мозге мышей Tg2576 (трансгенных мышей, экспрессирующих мутантный белок амилоидного предшественника и проявляющих когнитивное нарушение по типу AD) и приводили к заметному улучшению при утрате когнитивной функции или ее замедлению у мышей Tg2576 (по сравнению с мышами без введения); (3) инициацию ядрообразования, ведущего к агрегации тау в структуры, характеризующиеся парными спиралевидными фибриллами, встречающимися при различных таупатиях, а также стабильность агрегатов тау, in vitro; (4) вредоносные эффекты белка в фенотипе трансгенных R406W Drosophila, а также вредоносные эффекты тау-белка в модели на трансгенных мышах JNPL3, in vivo, (5) агрегацию содержащих полиглутамин белковых частиц htt in vitro; (6) вредоносные эффекты мутантного белка htt в трансгенном фенотипе elav>Q93httexonl Drosophila, а также вредоносные эффекты мутантного белка htt в модели трансгенных мышей R6/2, in vivo. Эти наблюдения неожиданно демонстрируют, что экстракт виноградных косточек или соединения, полученные из них, можно использовать для снижения образования амилоида, htt, и связанной с тау нейропатологии.
Таким образом, настоящее изобретение относится к фармацевтическим композициям, содержащим экстракт виноградных косточек или одно или несколько соединений, полученных из них, и к способам применения таких фармацевтических композиций для лечения или профилактики нейропатологических признаков нейродегенеративного заболевания, таких как нейродегенерация, клеточная токсичность, когнитивное нарушение или повреждение и двигательное нарушение. Предпочтительно экстракт виноградных косточек характеризуется наличием менее чем приблизительно 12% по массе галлоилированных проантоцианидинов в расчете на общее количество проантоцианидинов.
Термины, использованные в данном описании, как правило, обладают значениями, общепринятыми для них в данной области, в контексте этого изобретения и в конкретном контексте, где каждый термин используется. Некоторые термины определены ниже для обеспечения дополнительного руководства для описания композиций и способов по изобретению.
Определения
Термин "деменция" относится к клиническому синдрому, ассоциированному с общим когнитивным ухудшением памяти и других областей познавания.
Термин "дегенеративное заболевание" относится к заболеванию, в котором функция или структура поврежденных тканей или органов постепенно ухудшается с течением времени, в противоположность инфекционным заболеваниям.
Термин "нейродегенеративное заболевание" относится к состоянию или нарушению, при котором нейрональные клетки утрачиваются вследствие гибели клеток.
Термин "болезнь Альцгеймера" (или "старческая деменция") относится к умственному нарушению, ассоциированному с конкретным дегенеративным заболеванием головного мозга, которое характеризуется старческими бляшками, клубками нейритов и прогрессирующей утратой нейронов.
Термин "болезнь Паркинсона" представляет собой хроническое и прогрессирующее дегенеративное нарушение центральной нервной системы, которое часто нарушает двигательные навыки и речь. Болезнь Паркинсона относится к группе состояний, называемых двигательными нарушениями, и характеризуется ригидностью мышц, тремором, замедлением движения тела и, в крайних случаях, утратой движения тела.
Термин "болезнь Гентингтона" относится к наследственному неврологическому нарушению, вызываемому экспансией тринуклеотидных повторов в гене, кодирующем белок хантингтин. Симптомы болезни Гентингтона включают аномальные движения тела и отсутствие координации.
Термин "таупатия" относится к семейству нейродегенеративных заболеваний, которые вовлекают нарушение функции тау-белков (семейство близкородственных внутриклеточных ассоциированных с микротрубочками белков). Эти нейродегенеративные заболевания (таупатии) включают, например, болезнь Альцгеймера, прогрессирующий супрануклеарный паралич, кортикобазальную Дегенерацию, болезнь аргирофильных гранул, болезнь Пика и семейную лобно-височную деменцию.
Термин "амилоид-бета" (Aβ) относится к пептиду, продуцируемому расщеплением белка-предшественника амилоида-бета (APP), накопление и отложение которого формирует бляшки в головном мозге индивида. Наиболее распространенными изоформами Aβ являются Aβ1-40 (Aβ40) и Aβ1-42 (Aβ42). Выражение "олигомер Aβ" относится к пептиду, имеющему более одного элемента Aβ, связанного химическими связями, или множество пептидов Aβ, связанных химическими связями и/или ассоциированных физическими силами. Термин "олигомеризация" относится к комбинированию или сборке множества меньших химических или биологических молекул, таких как Aβ, в более крупный агрегат путем химического связывания и/или физической ассоциации.
Термин "снижать" относится к уменьшению или сокращению количества или концентрации химического или биологического вещества, или к замедлению или реверсии протекающего химического или физического процесса.
Термин "накопление" относится к увеличению концентрации или количества химического или биологического вещества, такого как пептид, в определенной