Гидрогель производного полисахарида
Иллюстрации
Показать всеИзобретение относится к медицине. Описано применение материала для восстановления дисфункции нервов, который включает гидрогель производного полисахарида, при котором в 0,5 масс.% водном растворе комплексный модуль составляет от 1 до 1000 Н/м2, а коэффициент потерь составляет от 0,01 до 2,0, что измерено при угловой скорости 10 рад/сек с помощью устройства для измерения динамической вязкоупругости. Материал для восстановления дисфункции нервов может быть гидрогелем, который инъецируется шприцем, обладает прекрасным удержанием в организме и оказывает восстанавливающее действие на функцию поврежденных или дегенерированных нервов. 2 н. и 17 з.п. ф-лы, 6 ил., 6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к инъецируемому материалу для излечения дисфункции нервов, который включает производное полисахарида.
Уровень техники
Серьезная травма, перегрузка организма или подобные причины вызывают повреждение и/или дегенерацию нервов, ослабление их функции. В частности, примеры заболеваний, сопровождающихся дисфункцией нервов, связанной с периферическими нервами, включают повреждение нервов, синдром запястного канала и локтевой туннельный синдром. Восстановление такого нерва с ослабленной функцией занимает продолжительный период времени, при этом нагрузка на пациента велика.
Недавно сообщили об эффективном осуществлении декомпрессии, такой как невролиз, против синдрома запястного канала, локтевого туннельного синдрома и тому подобных синдромов ущемления. Однако существует ряд связанных проблем, включающих послеоперационное рубцевание ткани вокруг нерва, фиброз в пучке нервных волокон и т.п.Например, хотя частота неудач устранения синдрома запястного канала составляет 3%, основная причина для рецидива симптомов, как считается, заключается в послеоперационной адгезии или фиброзе внутри или снаружи нерва, и ожидается, что при снижении послеоперационной адгезии эффективность исцеления нервной дисфункции будет повышаться.
Между тем, для решения таких проблем в США был предложен и утвержден под названием «ADCON» (Gliatech) биоабсорбируемый противоадгезионный материал, применяемый в клинической практике. Однако этот противоадгезионный материал вызывает беспокойство, связанное с побочными эффектами из-за задержки заживления на участке хирургического вмешательства. То есть даже если послеоперационную адгезию можно предотвратить, исцеление нервной дисфункции после декомпрессии может быть затруднено задержкой заживления и т.п.
Ранее для восстановления нарушенной функции нерва были предложены различные применения полисахарида, биосовместимого материала. Например, был раскрыт терапевтический материал для неврологических нарушений, в котором в качестве активного ингредиента использовали связанный с липидом глюкозаминогликан или его соли (JP-A-9-30979). Хотя данный терапевтический материал для неврологических нарушений может быть введен в рецептуру любой лекарственной формы, нет описания геля, обладающего средней вязкостью, которая связана с удержанием в организме. Кроме того, нет описания или предположения связанного с послеоперационной адгезией.
Далее был раскрыт материал для регенерации нервов, который включает перекрестно-сшитый полисахарид, полученный ковалентным связыванием полисахарида, содержащего карбоксильную группу и/или его соли с перекрестно-сшивающим реактивом, включающим соединение на основе амина (JP-A-2000-198738). Однако сохраняется обеспокоенность относительно безопасности, например, относительно воспалительной реакции на остаточный перекрестно-сшивающий реактив. Кроме того, из-за гетерогенности химически перекрестно-сшитый гель может претерпевать изменения свойств, и в связи с этим возможно улучшение стабильности. Кроме того, не существует описания или предположения о послеоперационной адгезии.
Кроме того сообщалось, что в кроличьей модели адгезии седалищного нерва, гиалуроновая кислота ингибирует послеоперационную адгезию периферических нервов, а также ингибирует задержку латентного периода периферического нерва (The British Association of Plastic Surgeons 56, pp 342-347, 2003). При этом такая гиалуроновая кислота не эффективна, если не применяется в начале операции, и это служит препятствием в случае хирургии в реальных условиях, и в связи с этим возможно улучшение удобства применения.
Между тем, что касается гелевого материала, в котором в качестве полисахарида применена целлюлоза, то в WO 2007/015579 в описании раскрывается производное, полученное модификацией карбоксиметилцеллюлозы фосфофатидилэтаноламином, которое растворено в воде с образованием геля. Однако нет описания или предположения об эффекте излечения нервной дисфункции.
Сообщалось об эффективности при облегчении боли в руках после хирургии периферических нервов или синдрома Тинеля (Microsurgery 27 (1), стр.2-7, 2007) авто-перекрестносшитой гиалуроновой кислоты, используемой в качестве материала для профилактики послеоперационной адгезии периферических нервов «HYALOGLIDE®» («Fidia Advanced Biopolymers») в клинической практике в Европе.
Хотя для восстановления функции нервов с помощью полисахаридов были выдвинуты описанные выше различные предложения, не было проведено исследований гидрогеля с применением модифицированного фосфолипидом производного полисахарида, который обладает эффектом излечения дисфункции нервов, обладает средней вязкостью, вызывает меньше послеоперационной адгезии, и который прост в обращении. В частности, производное полисахарида, демонстрирующее эффект улучшения скорости проводимости нерва, до сих пор не известно.
Раскрытие изобретения
Задача изобретения заключается в обеспечении материала для излечения дисфункции нервов для восстановления функции поврежденных или дегенерированных нервов, и, в частности, в обеспечении материала для излечения дисфункции нервов, который может быть гидрогелем, обладающим способностью инъецироваться с помощью шприца и обладающим прекрасным удержанием в организме.
Авторы провели обширные исследования материалов для излечения нервной дисфункции, которые восстанавливают функции разрушенных или дегенерированных нервов. В результате, они обнаружили гидрогель производного полисахарида отличающийся тем, что в 0,5 масс.% водном растворе комплексный модуль составляет от 1 до 1000 Н/м2, а коэффициент потерь составляет от 0,01 до 2,0, что измерено при угловой скорости 10 рад/сек с помощью устройства для измерения динамической вязкоупругости. Они также обнаружили, что такой гидрогель полезен при восстановлении функции поврежденных нервов и вызывает меньше послеоперационной адгезии, чем достигаются цели изобретения.
В частности, изобретением является материал для исцеления дисфункции нервов, включающий гидрогель производного полисахарида, отличающийся тем, что в 0,5 масс.% водном растворе комплексный модуль составляет от 1 до 1000 Н/м2, а коэффициент потерь составляет от 0,01 до 2,0, что измерено при угловой скорости 10 рад/сек с помощью устройства для измерения динамической вязкоупругости.
Когда используемое в изобретении производное полисахарида растворяют в воде, оно превращается в гидрогель, обладающий конкретным модулем и вязкостью, которые позволяют делать инъекции. Когда такой гидрогель применяют в качестве инъекционного геля для медицинского применения, то он обладает эффектами материала для излечения дисфункции нервов, например, эффектом повышения скорости проводимости нерва.
Кроме того, материал для излечения дисфункции нервов по изобретению обладает средней вязкоупругостью и/или прекрасным удержанием в организме, и, таким образом, весьма удобен в обращении и может быть применен в областях со сложными конфигурациями в момент хирургического вмешательства с помощью эндоскопа, и т.д.
Краткое описание чертежей
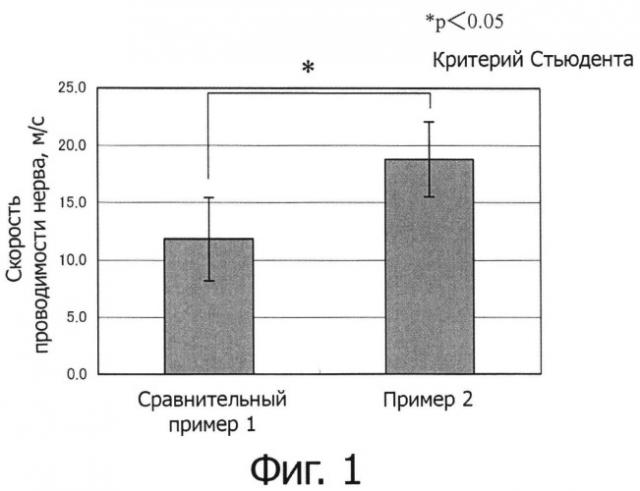
На фиг.1 показан эффект повышения скорости проводимости нервов материалом для излечения дисфункции нервов по изобретению через 20 дней после хирургического вмешательства.
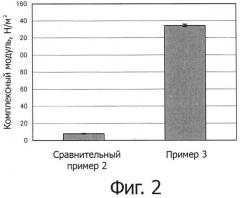
На фиг.2 показано увеличение комплексного модуля материала для излечения дисфункции нервов по изобретению при физиологической концентрации солей.
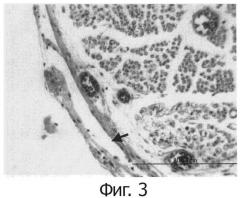
На фиг.3 показана регенерация периневрия гидрогелем производного полисахарида по изобретению через одну неделю после хирургического вмешательства. Стрелка указывает на периневрий.
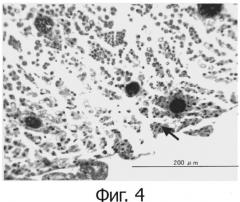
На фиг.4 показана регенерация периневрия через одну неделю после хирургического вмешательства в случае без применения гидрогеля производного полисахарида по изобретению. Стрелка указывает на периневрий.
На фиг.5 показана регенерация миелиновой оболочки гидрогелем производного полисахарида по изобретению через 6 недель после хирургического вмешательства. Стрелка указывает на миелиновую оболочку.
На фиг.6 показана регенерация миелиновой оболочки через 6 недель после хирургического вмешательства в случае без применения гидрогеля производного полисахарида по изобретению. Стрелка указывает на миелиновую оболочку.
Лучший вариант осуществления изобретения
Изобретением является материал для излечения дисфункции нервов, включающий гидрогель производного полисахарида, отличающийся тем, что в 0,5 масс.% водном растворе комплексный модуль составляет от 1 до 1000 Н/м2, а коэффициент потерь составляет от 0,01 до 2,0, что измерено при угловой скорости 10 рад/сек с помощью устройства для измерения динамической вязкоупругости.
Комплексный модуль находится в диапазоне от 1 до 200 Н/м2, а более предпочтительно в диапазоне от 1 до 100 Н/м2. Кроме того, коэффициент потери предпочтительно находится в диапазоне от 0,01 до 1,5.
Производное полисахарида применяемое в изобретении, предпочтительно представляет собой производное целлюлозы, и предпочтительно может быть производным целлюлозы, имеющим повторяющиеся единицы, представленные следующей формулой:
где R1, R2 и R3 каждый независимо выбраны из группы, состоящей из следующих формул (a), (b) (c) и (d):
; и
где
X в формуле (c) является щелочным или щелочноземельным металлом,
R4 и R5 в формуле (d) каждый независимо являются С9-27 алкильной группой или алкенильной группой,
общая степень замещения (b) и (с) составляет от 0,3 до 2,0, и
степень замещения (d) находится в диапазоне от 0,001 до 0,05, а более предпочтительно от 0,005 до 0,015.
В приведенной выше формуле, R4 и R5 каждый независимо являются С9-27 алкильной группой или алкенильной группой. В частности, предпочтительно, если R4 и R5 являются С9-19 алкенильными группами. Среди них предпочтительно, если R4CO- и/или R5CO- является олеоиловой группой, а особенно предпочтительно, если R4CO- и R5CO- являются олеоиловыми группами.
Материал для излечения дисфункции нервов по изобретению предпочтительно является материалом для излечения дисфункции нервов, который является инъецируемым гидрогелем, содержащим от 0,1 до 1,5 масс, частей производного полисахарида, использованного в изобретении, на 100 масс. частей воды. Еще более предпочтительно от 0,5 до 1,0 масс. частей.
Среди них, предпочтительно, если комплексный модуль в 0,5 масс.% водном растворе находится в диапазоне от 1 до 200 Н/м2, измеренный при угловой скорости 10 рад/сек с помощью устройства измерения динамической вязкоупругости. Еще более предпочтительно, если находится в диапазоне от 1 до 100 Н/м2. Кроме того, предпочтительно, если коэффициент потерь в это время составляет от 0,01 до 1,5.
Кроме того, предпочтительно, если материал для излечения дисфункции нервов по изобретению включает гидрогель производного полисахарида, и что при физиологической концентрации соли, комплексный модуль в 1,0 масс.% водном растворе повышается от 1 до 1000 Н/м2, измеренный при угловой скорости 10 рад/сек, с помощью устройства для измерения динамической вязкоупругости. Диапазон увеличения вязкоупругости более предпочтительно является увеличением от 50 до 700 Н/м2, и еще более предпочтительно увеличением от 100 до 500 Н/м2.
Физиологическая концентрация соли в данном документе означает концентрацию соли физиологического раствора соли, скорректированную для выживания клеток. В качестве конкретных концентраций соли физиологический раствор (0,9% водный раствор NaCl), раствор Рингера, фосфатный буфер и т.п.могут быть упомянуты в качестве примеров.
Изобретение является материалом для излечения нервной дисфункции. Например, его надлежащим образом применяют для восстановления функции нервов поврежденных и/или дегенерированных в результате серьезной травмы, перегрузки организма и т.п.
Если в качестве полисахаридного производного для приготовления материала для излечения нервной дисфункции по изобретению используют производное целлюлозы, то получение, например, может быть следующим.
Способ получения производного целлюлозы
Упомянутое выше производное целлюлозы, использованное в изобретении, может быть получено способом, включающим стадию, в которой карбоксиметилцеллюлоза, имеющая повторяющиеся единицы представленной ниже формулы и молекулярную массу от 5х103 до 5х106:
и фосфатидилэтаноламин, представленный следующей формулой:
в таких долях, при которых количество фосфатидилэтаноламина составляет от 0,1 до 100 эквивалентов на 100 эквивалентов карбоксильных групп карбоксиметилцеллюлозы (т.е. общего количества заместителей (b)+(c)) растворены в смешанном растворителе, включающем воду и водосовместимый органический растворитель, в котором вода составляет от 20 до 70 об.%, с последующей реакцией в присутствии конденсирующего средства.
R1, R2 и R3 в данном документе каждый независимо выбран из следующих формул (a), (b) и (c):
; и
где
X в формуле (с) является щелочным или щелочноземельным металлом, общая степень замещения (b) и (c) составляет от 0,3 до 2,0, и
R4 и R5 каждый независимо являются С9-27 алкильной группой или алкенильной группой.
Карбоксиметилцеллюлоза в качестве исходного материала предпочтительно имеет молекулярную массу от 5×103 до 5×106, более предпочтительно от 5×104 до 5×106, и еще более предпочтительно от 5×104 до 1×106.
Карбоксиметилцеллюлоза в качестве исходного материала может быть получена, например, растворением пульпы в растворе гидроксида натрия, и этерификацией ее же монохлоруксусной кислотой или ее натриевой солью, с последующей очисткой.
Щелочной металл X в формуле (c), предпочтительно является натрием, калием, литием или т.п., а щелочноземельный металл предпочтительно является магнием, кальцием или т.п.
Общая степень замещения (b) и (c) составляет от 0,3 до 2,0, предпочтительно от 0,5 до 1,8, а более предпочтительно от 0,6 до 1,5. Доли (b) и (c) ничем конкретным не ограничены. Однако в контексте растворимости в воде, предпочтительно, если (c) находится в избытке относительно (b).
Конкретная структурная формула предпочтительной карбоксиметилцеллюлозы как исходного материала показана в формуле ниже. Что касается положения замены карбоксиметильной группой в каркасе целлюлозы, то предпочтительным является положение C-6.
В фосфатидилэтаноламине представленном в формуле выше для применения в способе получения производного целлюлозы, R4 и R5 каждый независимо являются С9-27 алкильной группой или алкенильной группой. Предпочтительно, если R4 и R5 каждый является С9-27 алкенильной группой. Предпочтительно, если R4CO- и/или R5CO- являются олеоиловой группой, а особенно предпочтительно, если R4CO- и R5CO- являются олеоиловыми группами.
Фосфатидилэтаноламин в качестве исходного материала может быть либо экстрагирован из животной ткани, либо получен синтетически. Конкретные его примеры включают дилауроилфосфатидилэтаноламин, димиристоилфосфатидилэтаноламин, дипальмитоилфосфатидилэтаноламин, диарахидоил фосфатидилэтаноламин, лауролеоилфосфатидилэтаноламин, пальмитеоил фосфатидилэтаноламин, дилинолеоилфосфатидилэтаноламин, дистеароилфосфатидилэтаноламин, дибегеноилфосфатидилэтаноламин, миристолеоилфосфатидилэтаноламин, диолеоил фосфатидилэтаноламин, дилиноленоил фосфатидилэтаноламин, диарахидоноилфосфатидилэтаноламин и дидокозагексаеноилфосфатидилэтаноламин. Среди них диолеоилфосфатидилэтаноламин является предпочтительным по показателю растворимости в органическом растворителе, используемом для синтеза. Фосфатидилэтаноламин является безопасным веществом биологического происхождения.
Считается, что в производном целлюлозы, использованном в изобретении, фосфатидилэтаноламин усиливает гидрофобное взаимодействие между молекулами производного целлюлозы, и, в результате, производное целлюлозы, использованное в изобретении, образует гидрогель.
Карбоксиметилцеллюлоза и фосфатидилэтаноламин, которые являются исходными материалами, применяемыми в изобретении, могут реагировать в таких долях, в которых количество фосфатидилэтаноламина находится в диапазоне от 0,1 до 50 эквивалентов, предпочтительно от 1 до 40 эквивалентов, более предпочтительно от 3 до 30 эквивалентов, на 100 эквивалентов карбоксильных групп карбоксиметилцеллюлозы. Если количество составляет меньше чем 0,1 эквивалента, получаемое производное целлюлозы не образует гидрогель. Если количество больше чем 40 эквивалентов, никакого увеличения вязкоупругости не наблюдается при физиологических концентрациях солей.
В реакции конденсации между карбоксиметилцеллюлозой и фосфатидилэтаноламином, эффективность реакции может быть снижена в зависимости от реактивности конденсирующего средства, используемого для конденсации или в зависимости от условий реакции. Следовательно, предпочтительно, если фосфатидилэтаноламин применяют в избытке относительно рассчитанного значения требуемой степени замещения.
Карбоксиметилцеллюлоза и фосфатидилэтаноламин растворяют в смешанном растворителе, включающем воду и водосовместимый органический растворитель (A), в котором вода присутствует в количестве от 20 до 70 об.%. Если содержание воды составляет меньше чем 20 об.%, карбоксиметилцеллюлоза менее растворима, тогда как если содержание воды составляет больше 70 об.%, фосфатидилэтаноламин менее растворим, в результате чего реакция не проходит. Содержание воды предпочтительно составляет от 30 до 60 об.%.
Конкретные примеры водосовместимых органических растворителей (A) включают органические растворители, имеющие циклическую эфирную связь, такие как тетрагидрофуран, 1,4-диоксан, 1,3-диоксан, 1,3-диоксолан и морфолин, органические растворители, имеющие амидную связь, такие как диметилацетамид, диметилформамид и N-метил-2-пирролидон, амины, такие как пиридин, пиперидин и пиперазин и сульфоксиды, такие как диметилсульфоксид. Среди них, циклические эфиры и сульфоксиды являются предпочтительными. В частности, тетрагидрофуран, диоксан и диметилсульфоксид являются более предпочтительными.
Как реактивы, используемые в реакции, карбоксилактивирующие средства и конденсирующие средства являются предпочтительными. Примеры карбоксилактивирующих средств включают N-гидроксисукцинимид, р-нитрофенол, N-гидроксибензотриазол, N-гидроксипиперидин, N-гидррксисукцинамид, 2,4,5-трихлорфенол и N,N-диметиламинопиридин. Примеры конденсирующих средств включают 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолин хлорид, 1-этил-3-(диметиламинопропил)-карбодиимид и его гидрохлорид, диизопропилкарбодиимид, дициклогексилкарбодиимид и N-гидрокси-5-норборнен-2,3-дикарбоксимид. Среди них, предпочтительно использовать N-гидроксибензотриазол в качестве карбоксилактивирующего средства, а 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолин хлорид или 1-этил-3-(диметиламинопропил)-карбодиимид гидрохлорид в качестве конденсирующего средства.
Температура реакции предпочтительно составляет от 0°C до 60°C. Для ингибирования производства побочных продуктов, реакцию более предпочтительно осуществляют при температуре от 0 до 10°C. Среда реакции предпочтительно является слабо кислой, а более предпочтительно, если pH находится в диапазоне от 6 до 7.
Способ очистки производного целлюлозы
Способ получения производного целлюлозы, используемого в изобретении, для полученного производного целлюлозы может включать, стадию очистки производного целлюлозы с помощью органического растворителя (B), который существенно не растворяет карбоксиметилцеллюлозу, но является совместимым с водой.
Органический растворитель, который существенно не растворяет карбоксиметилцеллюлозу, в данном документе означает такой органический растворитель, в котором растворимость натриевой соли карбоксиметилцеллюлозы или карбоксиметилцеллюлозы (СООН типа) доступных в порошкообразной или лиофилизированной форме, если растворимость карбоксиметилцеллюлозы в органическом растворителе проверяют в отсутствии воды, составляет 3% или менее. Конкретные примеры включают спирты, такие как метанол, этанол, n-пропиловый спирт, изопропиловый спирт, н-бутиловый спирт, и трет-бутиловый спирт, многоатомные спирты, такие как этиленгликоль, 1,2-пропиленгликоль, 1,3-пропиленгликоль, и глицерин, кетоны, такие как ацетон, и ароматические спирты, такие как фенол. Среди них те, которые имеют точку кипения меньше чем 100°C, являются предпочтительными. Например, метанол, этанол, изопропиловый спирт и являются предпочтительными. Учитывая применение in vivo, этанол является особенно предпочтительным.
Если очистку осуществляют с помощью органического растворителя (B) из этих групп, то возможно использовать способ, в котором органический растворитель добавляют к производному целлюлозы в смеси с водой, органическим растворителем (A) и т.п. для образования осадка, что приводит, таким образом, к удалению производного целлюлозы. В ином случае, также возможно использовать способ, в котором органический растворитель (B) добавляют к полученному ранее осадку, сухому порошку или губке или подобному телу, полученному лиофилизацией, тем самым осуществляя отмывку. С помощью этих способов очистки могут быть удалены катализаторы, такие как конденсирующее средство и карбоксилактивирующее средство, используемые в реакции, непрореагировавший фосфолипид, оставшийся в системе и т.п.Для получения требуемого продукта, суспендированного в органическом растворителе (B), применяют способ, такой как центрифугирование или фильтрация. Также для отмывки органическим растворителем (B) можно применить экстракцию в аппарате Сокслета.
Гидрогель производного целлюлозы
Материал для излечения дисфункции нервов по изобретению является гидрогелем, содержащим вышеупомянутое производное целлюлозы. Гидрогель содержит производное целлюлозы в количестве от 0,1 до 1,5 масс. частей, предпочтительно от 0,5 до 1,0 масс. частей, на 100 масс. частей воды.
Такой гидрогель может быть легко деформирован при прикосновении металлического шпателя, и находится в состоянии, которое позволяет легкое нанесение на пораженную область. Гидрогель также может быть инъецирован с помощью инструмента, имеющего тонкую трубку, такого как шприц.
Гель предпочтительно имеет комплексный модуль в диапазоне от 1 до 200 Н/м2, еще более предпочтительно в диапазоне от 1 до 100 Н/м2, измеряемый при угловой скорости 10 рад/сек с помощью устройства для измерения динамической вязкоупругости в условиях, при который концентрация полимера составляет 0,5 масс.%, а температура равна 37°C. Кроме того, предпочтительно, если коэффициент потерь в это время составляет от 0,01 до 1,5. Данный диапазон является наиболее эффективным в восстановлении функции поврежденных или дегенерированных нервов.
Кроме того, гидрогель изобретения является прозрачным и бесцветным. При промышленном производстве это выгодно тем, что даже если в процессе получения включаются посторонние вещества, такие как пыль, такие посторонние вещества могут быть обнаружены.
Возможные примеры отличных от воды компонентов, содержащихся в гидрогеле, включают конденсирующие средства, используемые в качестве катализаторов; побочные продукты, такие как мочевина, производимая конденсирующим средством в ходе заданной химической реакции; карбоксилактивирующие агенты, непрореагировавший фосфатидилэтаноламин, посторонние вещества, которые могут быть включены на каждой стадии реакции; и ионы, используемые для корректировки рН. Однако эти компоненты удаляются очисткой или отмывкой с помощью упомянутого выше органического растворителя (В), и предпочтительно, если уровни всех соединений поддерживаются на низком уровне, так что их проникновение в организм не распознается как реакция на инородное тело.
Способ хранения материала для излечения дисфункции нервов по изобретению ничем не ограничен. Например, материал может храниться в холодном, темном месте и переносится в комнатную температуру перед использованием. Способ стерилизации материала для излечения дисфункции нервов по изобретению также ничем не ограничен, и может быть применен способ для обычной стерилизации медицинских инструментов и материалов, такой как стерилизация газообразным этиленоксидом, стерилизация автоклавированием, стерилизация гамма-излучением или стерилизация электронным лучом.
Кроме того, в случае применения после хирургического вмешательства материала для излечения дисфункции нервов по изобретению, например, при нанесении на участок хирургического вмешательства и окружающую область от около 0,1 до 5,0 мл с помощью шприца для покрытия всех площади хирургического вмешательства, ожидается восстановление функции поврежденных или дегенерированных нервов.
Примеры
(1) В примерах использовали следующие материалы:
(1) CMCNa: натриевая соль карбоксиметилцеллюлозы (производства «Dai-Ichi Kogyo Seiyaku», степень замещения: 0,73; или производства «Nippon Paper Chemicals», степень замещения: 0,69),
(ii) тетрагидрофуран (производства «Wako Pure Chemical Industries))),
(iii) 0,1 M HCl (производства «Wako Pure Chemical Industries))),
(iv) 0,1 M NaOH (производства «Wako Pure Chemical Industries))),
(v) 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолин хлорид (производства «Kokusan Chemical))),
(vi) L-α-диолеоилфосфатидилетаноламин (COATSOME ME-8181, производства «NOF Corporation))),
(vii) этанол (производства «Wako Pure Chemical Industries))),
(viii) дистиллированная вода для инъекций (производства «Otsuka Pharmaceutical))),
(ix) танол для дезинфекции (производства «Wako Pure Chemical Industries))),
(x) пентобарбитал натрия (инъекция нембутала, производства «Dainippon Sumitomo Pharma»), и
(xi) NaCl (производства «Wako Pure Chemical Industries))).
(2) Измерение содержания фосфолипидов в производном целлюлозы
Долю фосфолипида в производном целлюлозы определяли анализом общего содержания фосфора ванадомолибдатной абсорбциометрией.
(3) Измерения комплексного модуля и коэффициента потерь гидрогеля. Комплексный модуль и коэффициент потерь гидрогеля измеряли при 37°C и угловой скорости 10 рад/сек с помощью «Rheometer RFIII» («TA Instrument))), устройства для измерения динамической вязкоупругости.
Комплексным модулем называется константа, которая представляет соотношение между напряжением и деформацией упругого тела. Коэффициентом потерь называется константа, которая представляет собой соотношение между модулем накопления и модулем потерь при сдвиге.
Пример 1
Производное целлюлозы
3000 мг CMCNa (производства «Dai-Ichi Kogyo Seiyaku», степень замещения: 0, 73), растворяли в 600 мл воды, после чего добавляли 600 мл тетрагидрофурана. К этому раствору добавляли 1405 мг (1,889 моль) L-α-диолеоилфосфатидилэтаноламина (20 эквивалентов на 100 эквивалентов карбоксильных групп CMCNa) и 575 мг (2,08 моль) 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолин хлорида в качестве конденсирующего средства, а затем перемешивали в течение ночи. После перемешивания, тетрагидрофуран удаляли, воду выпаривали до некоторой степени и затем в смесь добавляли этанол для того, чтобы вызвать осаждение. Этанол удаляли фильтрацией, с последующим повторным промыванием этанолом. Остаток сушили вакуумной сушкой для получения производного целлюлозы и измеряли содержание фосфолипидов в нем. Если предположить, что степень замещения карбоксиметилцеллюлозы до реакции составляла 0,73, и что все карбоксиметильные группы были катионированы ионами натрия, степень замещения формулой (d) определяли расчетом содержания фософолипидов. Степень замещения формулы (d) составляла 0,78 моль%/сахар.
Гидрогель
Композицию, изготовленную из высушенного вакуумом производного целлюлозы, стерилизовали, а затем растворяли в дистиллированной воде для инъекций для приготовления 0, 5 масс.% гидрогеля. Измеряли комплексный модуль и коэффициент потерь полученного гидрогеля, результаты составили 18,3 Н/м2 и 0,63, соответственно.
Пример 2
Создание дисфункции седалищного нерва у крыс
Дисфункцию седалищного нерва получали в соответствии со способом Ohsumi et al., [Hidehiko ohsumi, Hitoshi Hirata, Takeshi Nagakura, Masaya Tsuj ii, Toshiko Sugimoto, Keiichi Miyamoto, Takeshi Horiuchi: Plastic and Reconstructive Surgery 116 (3): 823-30, 2005] на крысах Льюиса (на трех крысах) из «Charles River Laboratories)), Япония. А именно, крысу фиксировали в латеральной позиции с анестезией внутрибрюшинно введенным пентобарбиталом натрия, ягодичную область брили и затем дезинфицировали этанолом для дезинфекции. От абдоминальной области по направлению к дорсальной области, делали разрез 4-5 см в глутеральной области для раскрытия седалищного нерва. Эпиневрий и периневрий седалищного нерва снимали на 1,5 см, и дополнительно прижигали окружающую мышечную ткань. Затем гидрогель примера 1 (0,5 мл) наносили вокруг седалищного нерва, со снятым эпиневрием и периневрием, и мышечный слой и кожу разреза сшивали. Участок раны дезинфицировали с помощью дезинфектанта «Isodine», после чего крысу возвращали в клетку. Через 20 дней после хирургического вмешательства, у животных снова обнажали седалищный нерв под воздействием анестезией пентобарбиталом натрия, и измеряли скорость проводимости нерва с помощью «NeuroPack» («Nihon Kohden»). Значимые различия проверяли с помощью t-теста Стьюдента (критерия Стьюдента). В результате скорость проводимости нерва через 20 дней после хирургического вмешательства составила 18,8±3,3 м/с (средняя±стандартное отклонение) в каждом случае.
Сравнительный пример 1
В качестве контроля, такую же операцию как в примере 2 осуществляли без применения гидрогеля и измеряли скорость проводимости нерва. В результате, скорость проводимости нерва составила 11,8±3,6 м/с (среднее±стандартное отклонение).
Результаты измерения скорости проводимости нерва через 20 дней после хирургического вмешательства в примере 2 и сравнительном примере 1 представлены на фиг.1.
Как и выше, скорость проводимости нерва через 20 дней после хирургического вмешательства в примере 2 была статистически более значимой, чем в сравнительном примере 1. Следовательно, было представлено подтверждение того, что гидрогель, полученный в примере 1, высокоэффективен при восстановлении поврежденных или дегенерированных нервов in vivo.
Пример 3
Повышение комплексного модуля добавлением соли
3500 мг CMCNa (производства «Nippon Paper Chemicals», степень замещения: 0,69) растворяли в 100 мл воды и затем добавляли 100 мл тетрагидрофурана. К этому раствору добавляли 413,7 мг (0,0000795 моль) L-a-диолеоилфосфатидилэтаноламина (5 эквивалентов на 100 эквивалентов карбоксильных групп CMCNa) и 169,4 мг (0,0000874 моль) 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолин хлорида в качестве конденсирующего средства, а затем перемешивали в течение ночи. После перемешивания, к смеси добавляли этанол для того, чтобы вызвать осаждение. Затем, для получения производного целлюлозы осуществляли такую же операцию, как и в примере 1. Степень замещения составила 1,0 моль%/сахар. 20 мг композиции изготовленного производного целлюлозы растворяли в 1800 мг дистиллированной воды для инъекций и затем 200 мг 9% NaCl добавляли для получения конечной концентрации 0,9%. Таким образом готовили гидрогель с конечной концентрацией 1,0 масс.%. Измеряли комплексный модуль полученного гидрогеля. Результат составил 134,5±1,4 Н/м2 (среднее±стандартное отклонение).
Сравнительный пример 2
Гидрогель готовили так же как и в примере 3, за исключением того, что вместо 9% NaCl добавляли 200 мг дистиллированной воды для инъекций. Измеряли комплексный модуль полученного гидрогеля. Результат составил 8,0±0,5 Н/м2 (среднее±стандартное отклонение).
Результаты комплексного модуля в примере 3 и сравнительном примере 2 показаны на фиг.2.
Как и выше, увеличение комплексного модуля больше в примере 3, чем в сравнительном примере 2, и было подтверждено, что комплексный модуль гидрогеля, составляющий всего лишь от 5 до 200 Н/м2, значительно повышается при добавлении NaCl до концентрации 0,9 масс.%, того же уровня что и in vivo.
Пример 4
Производное целлюлозы
3000 мг CMCNa (производства «Dai-Ichi Kogyo Seiyaku», степень замещения: 0, 73), растворяли в 600 мл воды и также добавляли 600 мл тетрагидрофурана. К этому раствору добавляли 1405 мг (1,889 моль) L-α-диолеоилфосфатидилэтаноламина (20 эквивалентов на 100 эквивалентов карбоксильных групп CMCNa) и 575 мг (2,08 моль) 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолин хлорида в качестве конденсирующего средства, а затем перемешивали в течение ночи. После перемешивания, тетрагидрофуран удаляли, воду выпаривали до некоторой степени и затем в смесь добавляли этанол для того чтобы вызвать осаждение. Этанол удаляли фильтрацией, с последующим повторным промыванием этанолом. Остаток сушили вакуумной сушкой для получения производного целлюлозы и измеряли в нем содержание фосфолипидов. Если предположить, что степень замены карбоксиметилцеллюлозы до реакции составляла 0,73, и что все карбоксиметильные группы были катионированы ионами натрия, степень замещения формулы (d) определяли расчетом содержания фосфолипидов. Степень замены формулы (d) составляла 0,78 моль%/сахар.
Гидрогель
Композицию, изготовленную из высушенного вакуумом производного целлюлозы, стерилизовали и затем растворяли в дистиллированной воде для инъекций для приготовления 0,5 масс.% гидрогеля. Измеряли комплексный модуль и коэффициент потерь полученного гидрогеля, результаты составили 18,3 Н/м2 и 0,63, соответственно.
Пример 5
Создание дегенерации седалищного нерва у крыс
Дегенерацию седалищного нерва вызывали в соответствии со способом Ohsumi et al., [Hidehiko ohsumi, Hitoshi Hirata, Takeshi Nagakura, Masaya Tsuj ii, Toshiko Sugimoto, Keiichi Miyamoto, Takeshi Horiuchi: Plastic and Reconstructive Surgery 116 (3): 823-30, 2005] на крысах Льюиса (на трех крысах) из «Charles River Laboratories)), Япония. А именно, крысу фиксировали в латеральной позиции с анестезией внутрибрюшинно введенным пентобарбиталом натрия, ягодичную область брили и затем дезинфицировали этанолом для дезинфекции. От абдоминальной области по направлению к дорсальной области, делали разрез 4-5 см в глутеральной области для раскрытия седалищного нерва. Эпиневрий и периневрий седалищного нерва снимали на 1,5 см, и дополнительно прижигали окружающую мышечную ткань. Затем гидрогель примера 4 (0,5 мл) наносили вокруг седалищного нерва, со снятым эпиневрием и периневрием, и мышечный слой и кожу разреза сшивали. Участок раны дезинфицировали с помощью дезинфектанта «Isodine)», после чего крысу возвращали в клетку. Через неделю после хирургического вмешательства, у животных отбирали седалищный нерв в условиях анестезии пентобарбиталом натрия, и осуществляли окраску трихром по Массону для гистологического наблюдения седалищного нерва. В результате регенерацию периневрия обнаружили через неделю после хирургического воздействия.
Сравнительный пример 3
В качестве контроля, такую же операцию, как и в примере 5 осуществляли без применения гидрогеля и гистологически наблюдали седалищный нерв. В результате, регенерация периневрия через неделю после хирургического вмешательства была недостаточной.
Результаты окраски трихром по Массону через неделю после хирургического вмешательства примера 5 и сравнительного примера 3 представлены на фиг.3 и 4, соответственно. Как и выше, в случае гистологических наблюдений через неделю после хирургического вмешательства, регенерация периневрия в примере 5 прошла лучше, чем в сравнительном примере 3. Следовательно, было представлено подтверждение того, что гидрогель, полученный в примере 4, высокоэффективен при восстановлении поврежденных или дегенерированных нервов in vivo.
Пример 6
Создание дегенерации седалищного нерва у крыс
Дегенерацию седалищного нерва в