Применение пэгилированных интерферонов типа iii для лечения гепатита с
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к инфекционным болезням, и может быть использовано для лечения и профилактики гепатита С у не получавшего лекарственной терапии человека, который инфицирован или для которого существует риск инфекции. Для этого пациенту подкожно вводят, примерно, 1,5-5,0 мкг/кг пэгилированного мПЭГ-пропиональдегидом полипептида, имеющего молекулярную массу примерно 20 кД. При этом полипептид содержит аминокислотные остатки 1-176 SHQ ID NO: 106 и является пэгилированным интерфероном типа III. Группа изобретений обеспечивает лечение гепатита С у указанной группы пациентов, а также снижение токсических эффектов вводимых препаратов. 3 н. и 8 з.п. ф-лы, 113 ил., 18 табл., 1 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
Установлено, что 3% всей популяции в мире, т.е. 130 миллионов человек, инфицированы гепатитом C. Stauber R.E. and Stadlbauer V., Journal of Clinical Virology, 36: 87-94 (2006). Большинство было инфицировано при парентеральном воздействии с использованием зараженных инъекций либо в случае применения инъекционных лекарственных средств, либо в случае инъекций или трансфузии зараженных продуктов крови, получаемых в виде части медицинской помощи пациенту. Современным стандартом лечения гепатита C является лечение пэгилированным интерфероном (ПЭГ-IFN) альфа (принимаемым один раз в неделю) в сочетании с пероральным рибавирином (принимаемым ежедневно). Heathcote J. and Main J., Journal of Viral Hepatitis, 12: 223-235 (2005).
Хроническая инфекция вирусом гепатита C (HCV) является лидирующей причиной цирроза, печеночной недостаточности и гепатоклеточной карциномы в США и во всем мире. Основной целью лечения является истребление вируса и предотвращение развития отдаленных осложнений. Успешное лечение определяют как достижение устойчивого вирусологического ответа (УВО), который подтверждается нерегистрируемыми уровнями РНК HCV по меньшей мере 6 месяцев после прекращения терапии (Pearlman B. L. Hepatitis C treatment update. Am. J. Med. 2004; 117(5): 344-352).
В случае пациентов, инфицированных HCV генотипа 1, наиболее широко распространенного генотипа в США, лечение заключается в еженедельном введении пэгилированного интерферона альфа (PEG-IFN-α) в сочетании с ежедневным приемом рибавирина в течение 48 недель. Две одобренные в настоящее время формы PEG-IFN-α представляют собой пэгинтерферон альфа-2a (PEGASYS®) и пэгинтерферон альфа-2b (PEG-INTRON®), которые оба ассоциированы с показателями УВО примерно 50% у пациентов, инфицированных HCV генотипа 1 (Seeff L.B. Natural history of chronic hepatitis C. Hepatology 2002A; 36(5 Suppl. 1): S35-46; Strader DB, Wright T, Thomas DL, Seeff LB. Diagnosis, management, and treatment of hepatitis C. Hepatology 2004; 39(4): 1147-1171). Для таких пациентов, у которых не удается достичь УВО, в настоящее время нет стандартного лечения.
Пациенты с рецидивами, которые составляют примерно 20% всех подвергаемых лечению пациентов, инфицированных HCV генотипа 1, представляют уникальную популяцию, в случае которой лечение ПЭГ-IFN-α является неудачным (Hadziyannis SJ, Sette H, Jr., Morgan TR, Balan V, Diago M, Marcellin P, Ramadori G, Bodenheimer H, Jr., Bernstein D, Rizzetto M, Zeuzem S, Pockros PJ, Lin A, Ackrill AM. Peginterferon-alpha2a and ribavirin combination therapy in chronic hepatitis C: a randomized study of treatment duration and ribavirin dose. Ann Intern Med 2004;140(5):346-355). Хотя такие пациенты имеют нерегистрируемые уровни РНК HCV в конце лечения, у них наблюдаются рецидивы с регистрируемыми уровнями РНК HCV менее чем через 6 месяцев (Hoofnagle JH, Seeff LB. Peginterferon and ribavirin for chronic hepatitis C. N. Engl. J. Med. 2006; 355(23): 2444-2451). Факторы, которые вносят вклад в рецидив, могут включать уменьшение дозы рибавирина, особенно в первые 24 недели лечения (Shiffman ML. Chronic hepatitis C: treatment of pegylated interferon/ribavirin nonresponders. Curr. Gastroenterol. Rep. 2006; 8(1): 46-52.). При повторном лечении с использованием основанной на IFN-α терапии у пациентов с рецидивами может наблюдаться снижение уровней РНК HCV, подобное снижению, наблюдаемому во время предшествующего курса терапии (Strader DB, Wright T, Thomas DL, Seeff LB. Diagnosis, management, and treatment of hepatitis C. Hepatology 2004; 39(4): 1147-1171), и в случаях, когда предшествующая терапия включала в себя использование непэгилированного IFN-α, может быть достигнут УВО при повторном лечении с использованием ПЭГ-IFN-α и рибавирина (Jacobson IM, et al, A randomized trial of pegylated interferon alpha-2b plus ribavirin in the retreatment of chronic hepatitis С Am J Gastroenterol 2005;100(11):2453-2462; Mathew A, et al., Sustained viral response to pegylated interferon alpha-2b and ribavirin in chronic hepatitis С refractory to prior treatment. Dig Dis Sci 2006;51(11):1956-1961; Shiffman ML., Chronic hepatitis C: treatment of pegylated interferon/ribavirin nonresponders. Curr Gastroenterol Rep 2006;8(1):46-52). Указанная картина неблагоприятного исхода и ответа на повторное лечение свидетельствует, что у пациентов с рецидивами сохраняется способность отвечать на основанную на интерфероне терапию, и следовательно, пациенты составляют уникальную популяцию, в которой можно исследовать потенциальные эффекты новых подобных интерферону молекул (Hoofnagle JH, Seeff LB. Peginterferon and ribavirin for chronic hepatitis C. N Engl J Med 2006;355(23):2444-2451; FDA CDER Antiviral Drugs Advisory Committee. Summary Minutes of the Antiviral Drugs Advisory Committee, October 19-20. 2006).
Лечение ПЭГ-IFN-α и рибавирином ассоциировано с существенными побочными эффектами. Основные токсические эффекты ПЭГ-IFN-α включают подобные гриппу симптомы; гематологические отклонения, включая нейтропению, тромбоцитопению и анемию; и нейропсихиатрические расстройства, обычно депрессию. Другие токсические эффекты включают желудочно-кишечные заболевания и дерматологические, аутоиммунные и сердечные состояния. Также сообщалось о повышении печеночных трансаминаз, в частотности при использовании пэгинтерферона альфа 2a (Gish RG. Treating hepatitis C: the state of the art. Gastroenterol Clin. North Am. 2004; 33(1 Suppl.): S1-9; Hoffmann-La Roche Inc. вкладыш в упаковку: PEGASYS® пэгинтерферон альфа-2a). 2005B: 1-46). Рибавирин ассоциирован с рядом неблагоприятных эффектов, особенно с гемолитической анемией, которая в сочетании с миелосупрессивными эффектами IFN-α может представлять существенную клиническую проблему (Kowdley KV. Hematologic side effects of interferon and ribavirin therapy. J Clin Gastroenterol 2005;39(1 Suppl):S3-8; Strader DB, Wright T, Thomas DL, Seeff LB. Diagnosis, management, and treatment of hepatitis C. Hepatology 2004;39(4):1147-1171).
Токсические эффекты, ассоциированные с ПЭГ-IFN-α и рибавирином часто приводят к задержке исходной терапии, а также к снижению дозы и раннему прекращению лечения (Pearlman BL. Hepatitis C treatment update. Am. J. Med. 2004; 117(5): 344-352), все это уменьшает вероятность достижения УВО. Соблюдение терапии (определяемое как получение ≥80% назначенной дозы ПЭГ-IFN-α и ≥80% дозы рибавирина в ходе терапии) было ассоциировано с более высокими оценками УВО у пациентов с HCV генотипа 1 (McHutchison JG, et al., Adherence to combination therapy enhances sustained response in genotype-1-infected patients with chronic hepatitis С. Gastroenterology 2002;123(4):1061-1069).
С учетом ограничений по эффективности и токсичности современной терапии, сохраняется необходимость в усовершенствованных способах лечения HCV. Один из подходов заключается в разработке новых подобных интерферону молекул, которые по меньшей мере улучшают переносимость лечения, приводя к меньшим снижениям доз и более редкому прекращению лечения, и к более строгому соблюдению предписанной терапии, что затем может проявляться в повышенной эффективности. Применение интерферонов типа III может обеспечить такие терапевтические усовершенствования лечения HCV.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. ОПРЕДЕЛЕНИЯ
Термины «аминоконцевой» и «находящийся на карбоксильном конце» используют в настоящем описании для обозначения положений в полипептидах. В тех случаях, когда контекст это позволяет, такие термины используют в отношении к конкретной последовательности или части полипептида для обозначения близости или относительного положения. Например, некоторая последовательность, расположенная со стороны карбоксильного конца эталонной последовательности в полипептиде, расположена проксимально по отношению к карбоксильному концу эталонной последовательности, но не обязательно на карбоксильном конце полного полипептида.
Термин «средство против гепатита C» означает молекулу, при введении которой до, одновременно или после введения интерферона типа III (пэгилированного или непэгилированного) пациенту-человеку («комбинированная терапия») количество РНК HCV, присутствующей у подвергаемого комбинированной терапии пациента-человека, меньше, чем количество РНК HCV, присутствующей у пациента после получения лечения только интерфероном типа III отдельно. Интерферон типа III может быть введен до, одновременно или после введения, по меньшей мере, одного или нескольких из следующих средств против гепатита C: ингибиторов полимеразы и/или протеазы, агонистов A3AR, агонистов толл-подобных рецепторов, моноклональных антител, лекарственных средств из растительного сырья, антифосфолипидов, иммуномодуляторов, противовоспалительных лекарственных средств, тиазолидов, иммуностимуляторов широкого спектра, ингибиторов воспаления/фиброза, ингибиторов циклофилина, ингибиторов панкаспазы, HCV-иммуноглобулинов, противовирусных средств, противоинфекционных средств, ингибиторов РНК, ингибиторов глюкозидазы I, ингибиторов IRES, безафибратов, аналогов нуклеозидов, интерферона типа I или интерферона типа II. Необязательно, ингибитором полимеразы и/или протеазы может быть VCH-916 (Virochem), GS9190 (Gilead), GSK625433 (GlaxcoSmithKline), ITMN-191 (R-7227; InterMune), R7128 (Pharmasset/Roche), VCH-759 (Virochem), R1626 (Roche), TMC435350 (Medivir/Tibotec), SCH503034 (Boceprevir, Schering-Plough), A-831 (Arrow Therapeutics), валопицитабин (NM283, Idenix Pharmaceuticals) или VX950 (Telaprevir, Vertex). Необязательно, агонистом A3AR является CF102 (Can-Fite). Необязательно, агонистом толл-подобного рецептора является IMO-2125 (Idera Pharmaceuticals), исаторибин (ANA971, Anadys Pharmaceuticals) или актилон (CPG10101, Coley Pharmaceutical Group). Необязательно, моноклональным антителом является AB68 (XTL bio). Необязательно, лекарственным средством из растительного сырья является PYN 17 (Phynova). Необязательно, антифосфолипидом является бавитуксимаб (ранее тарвацин; Peregrine). Необязательно, иммуномодулятором является NOV-205 (Novelos Therapeutics), оглуфанид динатрия (Implicit Bioscience) или тимальфазин (тимозин альфа 1; SciClone/Sigma-Tau). Необязательно, противовоспалительным средством является CTS-1027 (Conatus) или JBK-122 (Jenken Biosciences). Необязательно, тиазолидом является алиния (нитазоксанид; Romark Laboratories). Необязательно, иммуностимулятором широкого спектра является SCV-07 (SciClone). Необязательно, ингибитором воспаления/фиброза является MitoQ (митохинон; Antipodean Pharmaceuticals). Необязательно, ингибитором циклофилина является DEBIO-025 (Debio Pharm Group). Необязательно, ингибитором панкаспазы является PF-03491390 (ранее IDN-6556; Pfizer Pharmaceuticals). Необязательно, HCV-имуноглобулином является цивацир (Nabi). Необязательно, противовирусным средством является сувус (метиленовй синий, ранее BIVN-104 (виростат); Bioenvision). Необязательно, противоинфекционным средством является нитазоксанид (Alinia®, Romark Pharmaceuticals). Необязательно, ингибитором глюкозидазы I является MX-3253 (целгосивир; Migenix). Необязательно, ингибитором IRES является VGX-410C (мифепристон; VGX Pharmaceuticals). Необязательно, безафибратом является гепаконда (гиаконда). Необязательно, аналогом нуклеозида является рибавирин (например, копегус Roches или ребетол Schering-Plough) или вирамидин (тарибавирин (пролекарство рибавирина); Valeant Pharmaceuticals). Необязательно, рибавирин или вирамидин вводят пациенту перорально один раз или дважды в сутки в дозе около 800-1200 мг. Необязательно, интерфероном типа I является интерферон альфа или пэгилированный интерферон альфа. Необязательно, интерфероном альфа или пэгилированным интерфероном альфа является пегасис (пэгилированный интерферон-альфа-2a или ПЭГ-IFN-α-2a; Roche), ПЭГ-интрон (пэгилированный интерферон-альфа-2b или ПЭГ-IFN-α-2b; Schering-Plough), белерофон (Nautilus Biotech), пероральный интерферон альфа (Amarillo Biosciences), BLX-883 (Locteron; Biolex Therapeutics/OctoPlus), мультиферон (Viragen), альбуферон (Human Genome Sciences), консенсусный интерферон (инферген; Three Rivers Pharma). Необязательно, интерфероном типа I является омега-интерферон (Intarcia Therapeutics). Необязательно, интерфероном типа II является интерферон гамма, например, Actimmune® (Intermune).
Термин «вырожденная нуклеотидная последовательность» означает последовательность нуклеотидов, которая включает в себя один или несколько вырожденных кодонов (по сравнению с эталонной молекулой полинуклеотида, которая кодирует полипептид). Вырожденные кодоны содержат разные триплеты нуклеотидов, но кодируют один и тот же аминокислотный остаток (например, каждый из триплетов GAU и GAC кодирует Asp).
Термин «экспрессирующий вектор» используют для обозначения молекулы ДНК, линейной или кольцевой, которая содержит участок, кодирующий представляющий интерес полипептид, оперативно связанный с дополнительными участками, которые обеспечивают его транскрипцию. Такие дополнительные участки включают в себя последовательности промотора и терминатора, и также могут включать в себя одно или несколько начал репликации, один или несколько селектируемых маркеров, энхансер, сигнал полиаденилирования и т.д. Экспрессирующие векторы обычно получают из плазмидной или вирусной ДНК, или они могут содержать элементы и плазмид и вирусов.
«Фиксированная» доза терапевтического средства в настоящем описании относится к дозе, которую вводят пациенту-человеку, независимо от массы (WT) или площади поверхности тела (BSA) пациента. Поэтому фиксированную дозу не приводят в виде дозы в мкг/кг или мг/кг, а указывают в виде абсолютного количества интерферона типа III, пэгилированного интерферона типа III или средства против гепатита C.
Термин «изолированный» в отношении полинуклеотида означает, что полинуклеотид был извлечен из своей природной генетической среды и, таким образом, освобожден от других посторонних или нежелательных кодирующих последовательностей и находится в форме, подходящей для применения в системах продуцирования генетически сконструированных белков. Такие изолированные молекулы представляют собой молекулы, которые отделены от их природного окружения, и представляют собой кДНК и геномные клоны. Изолированные молекулы ДНК согласно настоящему изобретению не содержат других генов, с которыми они обычно ассоциированы, но могут включать в себя встречающиеся в природе 5'- и 3'-нетранслируемые области, такие как промоторы и терминаторы. Идентификация ассоциированных областей будет очевидна специалисту в данной области (см., например, Dynan and Tijan, Nature 316: 774-78, 1985).
«Изолированный» полипептид или белок представляет собой полипептид или белок, который находится в других условиях, отличных от его природного окружения, таких как условия вне крови и ткани животных. В предпочтительной форме изолированный полипептид по существу не содержит других полипептидов, в частности, других полипептидов животного происхождения. Предпочтительно получение полипептидов в высоко очищенной форме, т.е. очищенных более чем на 95%, более предпочтительно, больше чем на 99%. При использовании в данном контексте термин «изолированный» не исключает присутствия такого же полипептида в альтернативных физических формах, таких как димеры, или в альтернативно гликозилированных или дериватизованных формах.
«Ударная» доза в настоящем описании в общем относится к начальной дозе терапевтического средства, например, интерферона типа III, пэгилированного интерферона типа III или средства против гепатита C, вводимой пациенту, и за ударной дозой следует одна или несколько поддерживающих доз. Обычно вводят одну ударную дозу, но в данном случае предусмотрено несколько ударных доз. Обычно количество вводимых ударных доз превышает количество вводимых поддерживающих доз и/или ударные дозы вводят более часто, чем поддерживающие дозы, для того чтобы достичь требуемой равновесной концентрации терапевтического средства раньше, чем можно достигать с использованием поддерживающих доз.
«Поддерживающая» доза в настоящем описании относится к одной или нескольким дозам терапевтического средства, например, интерферона типа III, пэгилированного интерферона типа III или средства против гепатита C, вводимого пациенту в течение периода лечения. Поддерживающие дозы можно вводить при лечении с определенными интервалами, например, примерно дважды в неделю, каждую неделю, примерно каждые 2 недели, примерно каждые 3 недели или примерно каждые 4 недели.
Термин «оперативно связанный» в отношении к участкам ДНК указывает, что участки расположены таким образом, что они функционируют взаимосвязано в достижении целей, для которых они предназначены, например, транскрипция инициируется в промоторе и продолжается вдоль кодирующего участка до терминатора.
«Полинуклеотид» представляет собой однонитевой или двунитевой полимер из дезоксирибонуклеотидных или рибонуклеотидных оснований, считываемый, начиная с 5'-конца к 3'-концу. Полинуклеотиды включают РНК и ДНК и могут быть выделены из природных источников, синтезированы in vitro или получены в результате комбинирования природных и синтетических молекул. Размеры полинуклеотидов выражают в парах оснований (сокращенно «п.о.»), нуклеотидах («н.») или тысячах оснований («т.о.»). Там, где позволяет контекст, последние два термина могут описывать полинуклеотиды, которые являются однонитевыми или двунитевыми. В том случае, когда термин применяют по отношению к двунитевым молекулам, его используют для обозначения общей длины, и будет понятно, что он эквивалентен термину «пары оснований». Специалистам в данной области будет понятно, что две нити двунитевого полинуклеотида могут немного отличаться по длине, и что его концы могут быть ступенчатыми в результате ферментативного расщепления; таким образом, не все нуклеотиды в двунитевой полинуклеотидной молекуле могут быть спарены.
«Полипептид» является полимером, состоящим из аминокислотных остатков, связанных пептидными связями, полученный либо естественным образом, либо синтетически. Полипептиды длиной менее чем примерно 10 аминокислотных остатков обычно называют «пептидами».
Фраза «предыдущее лечение» относится к введению предшествующей комбинированной терапии, которая включала в себя пэгилированный интерферон альфа (например, пэгинтерферон альфа-2a (PEGASYS®) или пэгинтерферон альфа-2b (PEG-INTRON®)) и аналог нуклеозида (например, рибавирин или вирамидин) пациенту-человеку, инфицированному вирусом гепатита C, при этом указанная предшествующая комбинированная терапия приводит к элиминации вируса гепатита C, т.е., к нерегистрируемому уровню РНК вируса гепатита C. Спустя примерно шесть (6) месяцев после указанного предшествующего лечения пациента подвергают тестированию, чтобы определить, имеется ли рецидив появления вируса гепатита C (т.е. регистрируемый уровень РНК HCV больше или равен 100000 международных единиц в миллилитре). Такие пациенты составляют субпопуляцию «отвечающих HCV-пациентов/HCV-пациентов с рецидивами».
Термин «промотор» используют в настоящем описании в его известном в данной области значении для обозначения части гена, содержащей последовательности ДНК, которые предназначены для связывания РНК-полимеразы и инициации транскрипции. Промоторные последовательности обычно, но не всегда, находятся в 5'-некодирующих областях генов.
«Белок» представляет собой макромолекулу, содержащую одну или несколько полипептидных цепей. Белок также может содержать непептидные компоненты, такие как углеводные группы. Углеводы и другие непептидные заместители могут быть добавлены к белку в клетке, в которой белок продуцируется, и могут варьировать в зависимости от типа клетки. Белки определяют в настоящем описании на основе структур их основной аминокислотной цепи; заместители, такие как углеводные группы, обычно не указывают, но тем не менее, они могут присутствовать.
Термин «рецептор» означает ассоциированный с клеткой белок, который связывается с биологически активной молекулой (т.е., лигандом) и опосредует влияние лиганда на клетку. Связанные с мембранами рецепторы характеризуются многопептидной структурой, содержащей внеклеточный связывающий лиганд домен и внутриклеточный эффекторный домен, который обычно вовлечен в сигнальную трансдукцию. Связывание лиганда с рецептором приводит взаимодействие между эффекторным доменом и другой молекулой (молекулами) в клетке. Такое взаимодействие в свою очередь приводит к изменению метаболизма в клетке. Метаболические события, которые связаны с взаимодействиями рецептор-лиганд, включают в себя транскрипцию гена, фосфорилирование, дефосфорилирование, увеличение продукции циклического АМФ, мобилизацию клеточного кальция, мобилизацию мембранных липидов, адгезию клеток, гидролиз инозитсодержащих липидов и гидролиз фосфолипидов. В общем, рецепторы могут быть связанными с мембраной, цитозольными или ядерными; мономерными (например, рецептор тиреотропина, бета-адренергический рецептор) или мультимерными (например, рецептор PDGF, рецептор гормона роста, рецептор IL-3, рецептор GM-CSF, рецептор G-CSF, рецептор эритропоэтина и рецептор IL-6).
Термин «сигнальная последовательность секреции» означает последовательность ДНК, которая кодирует полипептид («секреторный пептид»), который в виде компонента более крупного полипептида направляет более крупный полипептид по секреторному пути клетки, в которой он синтезируется. Обычно более крупный полипептид расщепляется с удалением секреторного пептида во время прохождения по секреторному пути.
«Лечение» или «осуществление лечения» относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам. Нуждающимися в лечении являются те, кто уже инфицирован вирусом гепатита C, а также те, у которых необходимо предотвратить заболевание гепатитом C. Следовательно, у пациента, которого необходимо лечить согласно настоящему изобретению, может быть диагностировано наличие гепатита C, или он может быть предрасположен или чувствителен к такому заболеванию.
«zcyto20» является прежним обозначением «IL-28A», а IL-28A является прежним обозначением «интерферона лямбда-2» (IFN-λ2). См., например, патенты США № 7038032, 6927040, 7135170, 7157559, 7351689 и публикации WIPO № WO 05/097165, WO 07/012033, WO 07/013944 и WO 07/041713, которые все включены в настоящее описание в виде ссылки в полном объеме. Zcyto20, IFN-λ2 и IL-28A используют в настоящем описании взаимозаменяемо. Полипептиды IFN-λ2 согласно настоящему изобретению включают, например, полипептиды с SEQ ID NO:2, 4, 6, 8, 10 и 12.
«zcyto21» является прежним обозначением «IL-29», а IL-29 является прежним обозначением «интерферона лямбда-1» (IFN-λ1). См., например, патенты США № 7038032, 6927040, 7135170, 7157559, 7351689 и публикации WIPO № WO 05/097165, WO 07/012033, WO 07/013944 и WO 07/041713, которые все включены в настоящее описание в виде ссылки в полном объеме. Zcyto21, IFN-λ1 и IL-29 используют в настоящем описании взаимозаменяемо. Полипептиды IFN-λ1 согласно настоящему изобретению, включают, например, полипептиды с SEQ ID NO: 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 115, 117, 119, 121 и 123.
«zcyto22» является прежним обозначением «IL-28B», а IL-28B является прежним обозначением «интерферона лямбда-3» (IFN-λ3). См., например, патенты США № 7038032, 6927040, 7135170, 7157559, 7351689 и публикации WIPO № WO 05/097165, WO 07/012033, WO 07/013944 и WO 07/041713, которые все включены в настоящее описание в виде ссылки в полном объеме. Zcyto22, IFN-λ3 и IL-28B используют в настоящем описании взаимозаменяемо. Полипептиды IFN-λ3 согласно настоящему изобретению включают, например, полипептиды с SEQ ID NO: 14, 16, 18, 20, 22, 24, 26, 28, 30 и 32.
«zcytor19» является прежним обозначением α-субъединицы рецептора IL-28 или IL-28RA, который показан в SEQ ID NO: 111. Полинуклеотиды, кодирующие zcytor19 или IL-28RA, и полипептиды zcytor19 или IL-28RA описаны в заявке PCT WO 02/20569, принадлежащей Schering, Inc., и в WO 02/44209, переуступленной ZymoGenetics, Inc., обе публикации включены в настоящее описание в виде ссылки в полном объеме. «Рецептор IL-28» означает α-субъединицу IL-28 (полипептид SEQ ID NO: 111) и субъединицу CRF2-4 (полипептид SEQ ID NO: 113), образующие гетеродимерный рецептор.
II. ИНТЕРФЕРОНЫ ТИПА III
Интерфероны лямбда представляют собой недавно описанное семейство цитокинов, родственных как интерферонам типа-1, так и представителям семейства IL-10. Семейство, классифицируемое как интерфероны «типа III», состоит из трех недавно идентифицированных цитокинов, имеющих структуру четырехспирального пучка, названных IFN-λ1, IFN-λ2 и IFN-λ3 (также называемых IL-29 или zcyto21, IL-28A или zcyto20 и IL-28B или zcyto22, соответственно). Jordan WJ et al., Genes and Immunity, 8:13-20 (2007). Все три интерферона лямбда передают сигнал через гетеродимерный рецепторный комплекс, состоящий из рецепторов цитокинов класса II IL-28RA (также известного как рецептор-альфа IL-28) и CRF2-4 (также известного как IL-10RB или IL-10R2). Рецептор IL-28 полностью отличается от рецептора, используемого интерферонами типа I.
IFN-λ1 является представителем недавно описанного семейства интерферонов типа III (Kotenko SV et al., «IFN-lambdas mediate antiviral protection through a distinct class II cytokine receptor complex», Nat. Immunol. 2003; 4(1): 69-77; Sheppard P et al., «IL-28, IL-29 and their class II cytokine receptor IL-28R», Nat. Immunol. 2003; 4(1): 63-68)), обладающих функциональным сходством с интерферонами типа I, которые включают IFN-α и IFN-β (Ank, et al., Journal of Virology, «Lambda interferon (IFN-lambda), a type III IFN, is induced by viruses and IFNs and displays potent antiviral activity against select virus infections in vivo», 2006; 80(9); 4501-4509). Подобно IFN-α (который является интерфероном типа I) интерфероны типа III индуцируются в ответ на вирусную инфекцию и стимулируют внутриклеточный ответ, в который вовлечено фосфорилирование передающего сигнал активатора транскрипции (STAT) белков и индукция отвечающих на интерферон генов, также известных как стимулируемые интерфероном гены (ISG). ISG кодируют белки, вовлеченные в противовирусные ответы и иммунную стимуляцию, включая белок киназы R (PkR), резистентность к миксовирусам (Mx), 2'5'-олигоаденнилатсинтетазу (OAS) и β2-микроглобулин (B2M) (Samuel CE. Antiviral actions of interferons. Clin Microbiol Rev 2001;14(4):778-809; Stark GR, Kerr IM, Williams BR, Silverman RH, Schreiber RD. How cells respond to interferons. Annu Rev Biochem 1998;67:227-264).
Экспрессия рецептора IL-28 для интерферонов типа III больше ограничена, чем экспрессия рецептора IFN-α. Например, в то время как все типы клеток в печени экспрессируют рецептор IFN-α, рецептор IL-28 для интерферонов типа III встречается только на гепатоцитах. Подобным образом в периферической крови высокие уровни рецептора IL-28 для интерферонов типа III выявляются только на B-клетках, тогда как все лейкоциты периферической крови (PBL), включая B-, T- и NK-клетки, нейтрофилы и моноциты, экспрессируют рецептор IFN-α. В соответствии с указанной картиной экспрессии рецепторов обработка PBL интерферонами типа III приводит к низким уровням фосфорилирования STAT-1 в B-клетках, но не приводит к фосфорилированию в других PBL. Такой эффект отличается от эффекта IFN-α, который индуцирует фосфорилирование STAT-1 во всех тестируемых PBL.
Настоящее изобретение относится к молекулам полинуклеотидов, включая молекулы ДНК и РНК, которые кодируют полипептид IL-29 или IFN-λ1. Например, в настоящем изобретении предлагаются вырожденные нуклеотидные последовательности, кодирующие полипептиды IL-29, которые описаны в настоящей публикации. Специалистам в данной области будет понятно, что с точки зрения вырожденности генетического кода возможная значительная изменчивость последовательностей таких полинуклеотидных молекул. Полипептиды IL-29 или IFN-λ1 согласно настоящему изобретению включают, например, полипептиды с SEQ ID NO: 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 115, 117, 119, 121 и 123, которые кодируются полинуклеотидами IL-29 или IFN-λ1, показанными в SEQ ID NO: 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105, 107, 109, 114, 116, 118, 120 и 122, соответственно.
Настоящее изобретение также относится к молекулам полинуклеотидов, включая молекулы ДНК и РНК, которые кодируют полипептид IL-28A или IFN-λ2. Например, в настоящем изобретении предлагаются вырожденные нуклеотидные последовательности, кодирующие полипептиды IL-28A, которые описаны в настоящей публикации. Специалистам в данной области будет понятно, что с точки зрения вырожденности генетического кода возможна значительная изменчивость последовательностей указанных молекул полинуклеотидов. Полипептиды IL-28A или IFN-λ2 согласно настоящему изобретению включают, например, полипептиды с SEQ ID NO: 2, 4, 6, 8, 10 и 12, которые кодируются полинуклеотидами IL-28A, которые показаны в SEQ ID NO: 1, 3, 5, 7, 9 и 11, соответственно.
Настоящее изобретение также относится к молекулам полинуклеотидов, включая молекулы ДНК и РНК, которые кодируют полипептид IL-28B или IFN-λ3. Например, в настоящем изобретении предлагаются вырожденные нуклеотидные последовательности, кодирующие полипептиды IL-28B, которые описаны в настоящей публикации. Специалистам в данной области будет понятно, что с точки зрения вырожденности генетического кода возможна значительная изменчивость последовательностей указанных молекул полинуклеотидов. Полипептиды IL-28B или IFN-λ3 согласно настоящему изобретению включают, например, полипептиды с SEQ ID NO: 14, 16, 18, 20, 22, 24, 26, 28, 30 и 32, которые кодируются полинуклеотидами IL-28B, которые показаны в SEQ ID NO: 13, 15, 17, 19, 21, 23, 25, 27, 29 и 31, соответственно.
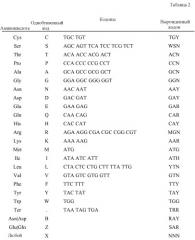
В таблице 1 указаны однобуквенные коды, используемые для обозначения вырожденных положений нуклеотидов. «Расшифровка» означает нуклеотиды, обозначенные буквенным кодом. «Комплемент» указывает код комплементарного нуклеотида(ов). Например, код Y означает либо C, либо T, и его комплемент R означает A или G, при этом A комплементарен T, а G комплементарен C.
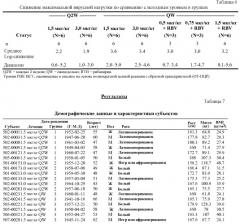
Вырожденные кодоны, охватывающие все возможные кодоны для данной аминокислоты, указаны в таблице 2.
Специалисту в данной области будет понятно, что некоторая неопределенность вводится в определение вырожденного кодона, представляющего все возможные кодоны, кодирующие каждую аминокислоту. Например, вырожденный кодон для серина (WSN) в некоторых случаях может кодировать аргинин (AGR), а вырожденный кодон для аргинина (MGN) в некоторых случаях может кодировать серин (AGY). Сходная взаимосвязь существует между кодонами, кодирующими фенилаланин и лейцин. Таким образом, некоторые полинуклеотиды, подпадающие под вырожденную последовательность, могут кодировать варианты аминокислотных последовательностей, но специалист в данной области легко может идентифицировать такие варианты последовательностей при обращении к аминокислотным последовательностям IL-28A, IL-28B и IL-29, которые описаны в настоящей публикации. Варианты последовательностей можно легко тестировать в отношении функциональности, как описано в настоящей публикации.
Изолированные полинуклеотиды согласно настоящему изобретению включают, например, ДНК и РНК. Способы получения ДНК и РНК хорошо известны в данной области. В общем, РНК выделяют из ткани или клетки, которая продуцирует большие количества РНК IL-28A, IL-28B или IL-29. Такие ткани и клетки идентифицируют с использованием Нозерн-блоттинга (Thomas, Proc. Natl. Acad. Sci. USA 77: 5201, 1980) или посредством скрининга кондиционированной среды от разных типов клеток в отношении активности на клетках-мишенях или тканях-мишенях. После идентификации активности или продуцирующей РНК клетки или ткани может быть получена суммарная РНК с использованием экстракции изотиоцианатом гуанидиния с последующим выделением центрифугированием в градиенте CsCl (Chirgwin et al., Biochemistry 18: 52-94, 1979). Поли-(A)+-РНК получают из суммарной РНК, используя способ, описанный Aviv и Leder (Proc. Natl. Acad. Sci. USA 69: 1408-12, 1972). Комплементарную ДНК (кДНК) получают на основе поли(A)+-РНК, используя известные способы. Альтернативно может быть выделена геномная ДНК. Затем идентифицируют и выделяют полинуклеотиды, кодирующие полипептиды IL-28A, IL-28B или IL-29, например, с помощью гибридизации или ПЦР.
Полноразмерный клон, кодирующий полипептид IL-28A, IL-28B или IL-29, может быть получен обычными способами клонирования. См. патент США № 7157559 и WO 07/041713. Предпочтительны клоны комплементарной ДНК (кДНК), хотя в случае некоторых применений (например, экспрессия в трансгенных животных) может быть предпочтительным использование геномного клона или модификация клона кДНК так, чтобы он включал в себя, по меньшей мере, один геномный интрон. Способы получения клонов кДНК и геномных клонов хорошо известны и входят в средний уровень компетентности в данной области, и к таким способам относится применение последовательности, описанной в настоящей публикации, или ее частей в качестве зондов или праймеров для библиотеки. Библиотеки экспрессии можно исследовать, используя в качестве зондов антитела к фрагментам рецепторов IL-28, или другие специфичные партнеры для связывания.
В настоящее изобретение включены аллельные варианты IL-28A, IL-28B и IL-29. Аллельные варианты таких последовательностей могут быть клонированы благодаря зондированию библиотек кДНК или геномных библиотек от разных людей стандартными способами. Аллельные варианты последовательности ДНК включают варианты, содержащие молчащие мутации, и варианты, в которых мутации приводят к изменениям аминокислотной последовательности в дополнение к цистеиновым мутациям, и они входят в объем настоящего изобретения, также как белки, которые представляют собой аллельные варианты, например, SEQ ID NO: 2 (IL-28A), 14 (IL-28B) и 34 (IL-29). кДНК, образованные на основе альтернативно сплайсированных мРНК, которые сохраняют свойства полипептидов IL-28A, IL-28B или IL-29, входят в объем настоящего изобретения, также как полипептиды, кодируемые такими кДНК и мРНК. Аллельные варианты и варианты сплайсинга таких последовательностей могут быть клонированы с использованием зондирования библиотек кДНК или геномных библиотек от разных людей или тканей стандартными способами, известными в данной области, и могут быть введены мутации в полинуклеотиды, кодирующие цистеины или остатки цистеина, как описано в настоящей публикации.
Полипептиды IL-28A, IL-28B или IL-29, имеющие по существу сходную степень идентичности последовательностей, характеризуются наличием одной или нескольких аминокислотных замен, делеций или добавлений. Такие изменения предпочтительно являются минорными, то есть являются консервативными аминокислотными заменами (см. таблицу 3) и другими заменами, которые существенно не влияют на фолдинг или активность полипептида: небольшие делеции, обычно от одной до примерно 30 аминокислот; и удлинения на амино- или карбоксильном конце, такие как аминоконцевой остаток метионина, или небольшой линкерный пептид примерно до 20-25 остатков.
| Таблица 3 | |
| Консервативные аминокислотные замены | |
| Основные: | аргинин |
| лизин | |
| гистидин | |
| Кислые: | глутаминовая кислота |
| аспарагиновая кислота | |
| Полярные: | глутамин |
| аспарагин | |
| Гидрофобные: | лейцин |
| изолейцин | |
| валин | |
| Ароматические: | фенилаланин |
| триптофан | |
| тирозин | |
| Небольшие: | глицин |
| аланин | |
| серин | |
| треонин | |
| метионин |
Могут быть определены аминокислотные остатки, которые составляют области или домены, которые являются важными для поддержания структурной целостности. В таких областях могут быть определены конкретные остатки, которые будут более или менее допустимы с точки зрения изменения и сохранения общей третичной структуры молекулы. Способы анализа структуры последовательности включают без ограничения выравнивание нескольких последовательностей с высокой идентичностью аминокислоты или нуклеотида, анализ склонности к образованию вторичной структуры, бинарных картин, комплементарной упаковки и внутренних полярных взаимодействий (Barton, Current Opin. Struct. Biol. 5: 372-376, 1995 и Cordes et al., Current Opin. Struct. Biol. 6: 3-10, 1996). В общем, при конструировании модификаций в молекулах или идентификации специфичных фрагментов определение структуры будет сопровождаться оценкой активности модифицированных молекул.
Изменения аминокислотной последовательности осуществляют в полипептидах IL-28A, IL-28B и IL-29 так, чтобы минимизировать нарушение структуры более высокого порядка, важной для биологической активности. Например, когда полипептид IL-28A, IL-28B и IL-29 образует одну или несколько спиралей, изменения аминокислотных остатков будет осуществлено так, чтобы не нарушить геометрию спиралей и другие компоненты молекулы, где изменения конформации ослабят важную функцию, например, связывание молекулы с ее связывающими партнерами. Эффекты изменений аминокислотной последовательности можно предсказать, например, с помощью компьютерного моделирования, как описано выше, или определить с помощью анализа кристаллической структуры (см., например, Lapthorn et al., Nat. Struct. Biol. 2: 266-268, 1995). В других способах, которые хорошо известны в данной области, сравнивают фолдинг варианта белка со стандартной молекулой (например, нативным белком). Например, можно осуществить сравнение картины распределения цистеинов в варианте белка и стандартной молекуле. Масс-спектрометрия и химическая модификация с использованием восстановления и алкилирования обеспечивают способы определения остатков цистеина, которые ассоциированы с дисульфидными связями или являются свободными от таких ассоциаций (Bean et al., Anal. Biochem. 201: 216-226, 1992; Gray, Protein Sci. 2: 1732-1748, 1993; и Patterson et al., Anal. Chem. 66: 3727-3732, 1994). Обычно полагают, что если модифицированная молекула не имеет такой же картины распределения цистеинов, как стандартная молекула, то может быть затронут фолдинг. Другим хорошо известным и общепринятым способом измерения фолдинга является круговой дихроизм (CD). Измерение и сравнение CD-спектров, полученных для модифицированной молекулы и стандартной молекулы, является стандартной процедурой (Johnson, Proteins 7: 205-214, 1990). Кристаллография является другим хорошо из