Способ получения препарата, содержащего вирусные антигены, и применение препарата
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии, генной инженерии и вирусологии. Предложен способ получения препарата, содержащего вирусные антигены, включающий а) инокуляцию клеток инфекционным вирусом в жидкости, b) репродукцию указанного вируса в указанных клетках, с) сбор указанного репродуцированного вируса, d) инактивацию указанного собранного вируса, и е) обработку указанного инактивированного вируса детергентом, приводящий к получению препарата, содержащего вирусные антигены. Способ может быть использован в медицине и фармакологии при получении вакцин. 3 н. и 18 з.п. ф-лы, 1 ил., 2 табл., 3 пр.
Реферат
Область техники
Данное изобретение относится к способам получения противовирусных вакцин.
Вакцина представляет собой иммуногенную композицию антигенного вещества, например, (неинфекционного) патогена, такого как вирус, его оболочки, частицы или их белковых антигенов. Введение или вакцинация приводит к иммунизации субъекта, например, млекопитающего, такого как человек или птица. Вакцинация может вызвать специфическую реакцию на вакцину и некоторое незначительное воспаление, что, однако, как правило, существенно менее вредно, чем инфекция, вызванная полноценным жизнеспособным вирусом, для предупреждения которой и предназначена вакцина. Иммунная система субъектов может адаптироваться к специфическому узнаванию антигенов вакцины и быстро инактивировать патоген после дополнительного воздействия патогена на субъект. Так, через вакцинацию развивается повышенная резистентность к патогену.
С целью приготовления вакцины, вирус обычно культивируют на соответствующей клеточной культуре или, как правило, на клеточном субстрате. В случае гриппа, обычно используют оплодотворенные куриные яйца. “Урожай” инфекционного вируса собирают и очищают, удаляя нежелательные невирусные составляющие клеток. В частности, в случае вакцин, полученных из куриных субстратов, у некоторых восприимчивых индивидуумов возможна аллергическая реакция на белки куриных яиц.
Определяющей стадией в получении противовирусных вакцин является инактивация инфекционных вирусов. При получении вакцин наиболее часто используемым инактивирующим средством является формалин (водный раствор формальдегида). Его обычно используют в виде насыщенного водного раствора при концентрации формальдегида около 37%. Формальдегид инактивирует вирус путем необратимого сшивания первичных аминогрупп в поверхностных белках с другими близлежащими атомами азота в белке или ДНК посредством -CH2-связи. В частности, эти поперечные связи могут привести к образованию связей с невирусными веществами и, поэтому, необходимо осуществление некоторой предварительной очистки на живом инфекционном вирусе, поскольку инактивация до очистки может вызвать образование большого количества необратимых химических мостиковых связей между вирусными белками и примесями, которые наносят ущерб эффективности проведения операций очистки и качеству продукта. По этой причине, согласно прототипу живые инфекционные вирусы сначала, по крайней мере, частично очищают, например, посредством зонального ультрацентрифугирования, и затем инактивируют (патент США 6048537). Стадия инактивации обработкой формалином была подтверждена устоявшимися аналитическими методами.
В дополнение к обработке формалином, для интеграции в производственный процесс предусматривалась инактивация ультрафиолетовыми лучами. Использование инактивации облучением ультрафиолетовыми лучами для человеческих вакцин было продемонстрировано ранее для безоболочечного и имеющего оболочку вируса (патент США 2006/0270017). Поскольку вирусный геном более чувствителен к УФ-поражению, чем вирусные поверхностные антигены, то УФ-инактивация, как было показано, почти не оказывает негативного действия на биохимические характеристики или иммуногенность продукта. Мишенями для УФ-инактивации являются, в основном, нуклеиновые кислоты, в противоположность белкам, которые являются мишенями формалина.
Путем комбинирования инактиваций обработкой формалина и УФ-облучением, исследователи пытались преодолеть ограничения, сопутствующие раздельному использованию УФ-инактивации или инактивации обработкой формалином, соответственно, при инактивировании, в частности, семейств упругих (resilient) вирусов.
Альтернативно, многие производители используют технологическую операцию, базирующуюся на обработке детергентом, как для инактивации живого вируса, так и для модификации вируса. Эти способы с использованием обработки детергентом разрушают липидную оболочку вирусов гриппа, что приводит к получению либо расщепленного (частично разрушенного), либо субъединичного (полностью разрушенного) антигена, используемого для приготовления вакцины. Обработка детергентом часто снижает реакционную способность вирусного антигена, и тем самым снижает проявление нежелательных побочных действий во время вакцинации. Вирус, обработанный детергентом, может быть дополнительно инактивирован, например, обработкой формалином. Примеры этих способов можно найти в патенте США 6048573, патенте США 4522809, и WO 02/09702. Недостаток этого подхода заключается в том, что вирус подвергается различным стадиям очистки до стадии разрушения и, поэтому, производственному персоналу приходится манипулировать с живым инфекционным вирусом на нескольких стадиях. Это особенно важно, когда получают вакцину против, главным образом, вирулентных форм гриппа, таких как штаммы H5N1.
Краткое изложение сущности изобретения
Целью настоящего изобретения является разработка способа получения противовирусных вакцин с меньшим числом стадий, требующих манипулирования с инфекционным материалом, при продуцировании вирусных антигенов с пониженной реакционной способностью.
Поэтому, настоящее изобретение предлагает способ получения препарата, содержащего вирусные антигены, включающий
а) инокуляцию клеток инфекционным вирусом в жидкости,
b) репродукцию указанного вируса в указанных клетках,
c) сбор указанного репродуцированного вируса в супернатанте клеточной культуры,
d) инактивацию указанного собранного вируса, и
e) обработку указанного инактивированного вируса детергентом, приводящий к получению препарата, содержащего вирусные антигены.
Во втором аспекте предлагается способ получения препарата, содержащего вирусные антигены, включающий
a) получение жидкости, содержащей инфекционный вирус,
b) полную инактивацию указанного собранного вируса,
c) обработку указанного инактивированного вируса детергентом, и
d) очистку указанного инактивированного вируса, приводящую к получению препарата, содержащего вирусные антигены.
Другие аспекты данного изобретения предусматривают вакцинные препараты, полученные из вирусных антигенов, продуцированных согласно способам данного изобретения.
В другом аспекте настоящего изобретения, предлагается способ повышения резистентности к вирусной инфекции у субъекта, включающий получение препарата, содержащего вирусные антигены, и введение указанного препарата субъекту.
Краткое описание чертежей
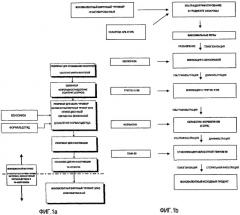
Фиг.1a - схема производственного процесса заявляемого способа от сбора вируса после репродуцирования до сбора “урожая” инактивированного вируса.
Фиг.1b - продолжение производственного процесса заявляемого способа от сбора “урожая” инактивированного вируса инактивированного сбора до получения моновалентного исходного препарата.
Подробное описание изобретения
Предлагается способ получения препарата, содержащего вирусные антигены, включающий
а) инокуляцию клеток инфекционным вирусом в жидкости,
b) репродукцию указанного вируса в указанных клетках,
c) сбор указанного репродуцированного вируса в супернатанте клеточной культуры,
d) полную инактивацию указанного собранного вируса, и
e) обработку указанного инактивированного вируса детергентом, приводящую к получению препарата, содержащего вирусные антигены.
Главным в этом способе является то, что удается уменьшить число стадий, осуществляемых на активном вирусе, и, соответственно, вирус инактивируют после первичного сбора “урожая” до обработки детергентом и/или необязательных стадий очистки.
Термин "вирусный антиген" согласно данному изобретению представляет собой вирус или часть вируса, который может индуцировать у субъекта иммунную реакцию на указанный антиген. Абсолютного успеха, в смысле достижения у субъекта полной иммунизации, не требуется, однако, должен быть очевиден успех в смысле повышения иммунной защиты или иммунной реакции в ответ на введение указанного вируса, что снижает риск развития заболевания, связанного с указанным вирусом, после (его) последующего воздействия. Такой вирусный антиген может, например, представлять собой полный инактивированный вирус, расщепленный вирус, модифицированный вирус, вирусные белки, в частности, поверхностные белки, подобные гемагглютинину или нейраминидазе. Термин "вакцина" представляет собой препарат указанного вирусного антигена в конкретной форме для введения, такой как, препарат для инъекции, назального или трансдермального введения. "Очистка" согласно данному изобретению относится к стадиям удаления невирусных составляющих жидкости, содержащей “урожай” (репродуцированного вируса). Содержащая “урожай” жидкость, получаемая после стадии сбора, представляет собой предпочтительно осветвленный супернатант, из которого твердые или крупные частицы примесей, например, оставшиеся интактные клетки или дебрис, содержащий продукты распада инфицированных клеток, которые разрушаются во время репродуцирования вируса, удалены осаждением, например, посредством центрифугирования. Поэтому, "сбор" относится к любым стадиям, которые дают полноценные инфекционные вирусы в жидкости, в частности, прозрачную жидкость. Помимо удаления дебриса, содержащего продукты распада клеток, стадия сбора может также включать стадии для удаления других твердых составляющих среды или субстрата для культивирования клеток, например, любой тип субстрата, на котором культивируют клетки. Репродуцированный полноценный вирус выделяется в указанный супернатант клеточной культуры, из которого его можно собрать. Поэтому, в конкретном варианте данного изобретения, стадия сбора репродуцированного вируса включает отделение вируса от клеток и/или продуктов распада указанных клеток после инфицирования. Этому разделению может способствовать, например, центрифугирование с низкими скоростями в диапазоне динамических перегрузок от около 2000 g до 3000 g, вплоть 5000 g, 10000 g, 15000 g или 20000 g, которое позволяет отделить видимые частицы от жидкости. Альтернативно, разделение может быть осуществлено фильтрацией. В конкретных предпочтительных вариантах, указанная жидкость, по существу, не содержит аллантоина, коллагена и/или альбумина, такого как овальбумин, например, благодаря выбору клеток, используемых для репродуцирования вируса, например, клеточных культур, относящихся к млекопитающим, птицам или насекомым, вместо яйцеклеток эмбрионов. В конкретных вариантах данного изобретения, для репродуцирования вируса используют клетки почек африканской зеленой мартышки (VERO).
После стадии сбора вирус инактивируют любым известным способом для инактивации вируса, например, способом, раскрытым в публикации патента США 2006/0270017 A1, которая входит в настоящее описание в виде ссылки. В частности, инактивация может быть осуществлена обработкой формальдегидом и/или Уф-облучением, в одиночку или в комбинации. Используемый в этой заявке термин "полная инактивация" или "полностью инактивированный", при упоминании его в связи с вирусным препаратом, означает, что вирусный препарат не содержит бляшкообразующих единиц (pfu), определяемых при культивировании вирусного препарата на фибробластах куриных эмбрионов (CEF) или VERO клетках.
Одним из положительных результатов способов по данному изобретению является снижение числа стадий, которые осуществляют с участием среды инфекционного вируса, для чего требуется соблюдение особых мер безопасности. При современном уровне в данной области техники, считается необходимым осуществление стадии очистки после первичного сбора “урожая” (вируса) для удаления или снижения в значительной степени содержания невирусных белков или нуклеиновых кислот, которые могут взаимодействовать с вирусом с образованием межмолекулярных связей во время обработки формалином. Нанесение такого ущерба было преодолено настоящим изобретением, которое показало, что, в действительности, возможно и даже полезно проведение инактивации сразу после сбора вируса до его очистки. Для того, чтобы избежать протекания вышеупомянутой неблагоприятной реакции во время инактивации, вирус-содержащую жидкость, или ее невирусные составляющие, предпочтительно дополнительно не концентрируют или концентрируют на фактор ниже 10, 9, 8, 7, 6, 5, 4, 3 или 2 во время или после стадии сбора. Предпочтительно концентрацию невирусного белка и/или ДНК нативного супернатанта из клеточной культуры сохраняют до стадии инактивации. В конкретных вариантах, концентрация цельного белка или невирусного белка в жидкости во время инактивации или после сбора вируса находится в диапазоне, выраженном в мкг/мл, таком как ниже 950 мкг/мл, 900 мкг/мл, 850 мкг/мл, 800 мкг/мл, 700 мкг/мл, 650 мкг/мл, 600 мкг/мл, 550 мкг/мл, 500 мкг/мл, 450 мкг/мл, 400 мкг/мл, 350 мкг/мл, 300 мкг/мл, 250 мкг/мл, 200 мкг/мл, 150 мкг/мл, 100 мкг/мл, 80 мкг/мл, 60 мкг/мл, 40 мкг/мл, 30 мкг/мл, 20 мкг/мл, 10 мкг/мл, 8 мкг/мл, 6 мкг/мл, 4 мкг/мл, 3 мкг/мл, 2 мкг/мл или ниже 1 мкг/мл.
Для инактивирования может быть выбрано любое количество формальдегида или любая доза ультрафиолетового облучения, которые будут эффективными для инактивации вируса, по одиночке, или в комбинации. В предпочтительном варианте настоящей заявки, снижение титра вируса вследствие инактивации вируса в образце составляет, по крайней мере, около 1×105, в более предпочтительном варианте, по крайней мере, около 1×107, в более предпочтительном варианте, по крайней мере, около 1×1010, и в наиболее предпочтительном варианте, по крайней мере, около 1×1014.
В предпочтительном варианте настоящего изобретения, образец обрабатывают эффективной концентрацией формалина в течение периода времени от около 12 до около 96 часов. В более предпочтительных вариантах, образец обрабатывают эффективной концентрацией формалина в течение периода времени от около 24 до около 48 часов, и более предпочтительно на протяжении периода времени от около 24 до около 30 часов. В особенно предпочтительном варианте настоящего изобретения, образец обрабатывают эффективной концентрацией формалина на протяжении периода времени от около 24 до около 24,5 часов. Специалистам в области вакцин очевидно, что для осуществления полной инактивации, либо только обработкой формалином, либо в комбинации с воздействием УФ-лучей, для каждого конкретного штамма обрабатываемого вируса может потребоваться оптимизация параметров обработки, таких как концентрация формалина и время обработки. В дополнительном варианте, стадию обработки образца эффективной концентрацией формалина осуществляют при температуре в диапазоне от около 10 до около 40°C. В особенно предпочтительном варианте настоящей заявки, стадию обработки образца эффективной концентрацией формалина осуществляют при температуре около 32°C.
Предпочтительный вариант настоящего изобретения включает обработку образца эффективной концентрацией формалина, и эта эффективная концентрация формалина изменяется предпочтительно в диапазоне от около 0,01% до около 1% (мас./мас.), предпочтительно от около 0,01% до около 0,1%, более предпочтительно между около 0,025% и около 0,1%, что соответствует около 92 мг/л и около 368 мг/л формалина, соответственно, при использовании 37% раствора формалина для установления эффективной концентрации.
В настоящей заявке термин "УФ-излучение" означает ультрафиолетовое излучение, имеющее длины волн от 100 до 400 нм. Уф-излучение может быть выбрано из группы, состоящей из УФ C (диапазон длин волн от 100 до 280 нм), УФ B (280 до 320 нм) и УФ A (320 до 400 нм). Фотосенсибилизирующие средства, подобные фотосенсибилизаторам, которые встраивают в ДНК и активируются под воздействием Уф-излучения, например, псоралены, могут быть использованы для усиления инактивирующего действия ультрафиолетового излучения. В предпочтительном варианте настоящего изобретения, УФ-излучение представляет собой диапазон УФ С, имеющий длину волны от около 100 до около 280 нм. В более предпочтительном варианте настоящего изобретения, Уф-излучение имеет длину волны от около 240 до около 290 нм. В особенно предпочтительном варианте настоящего изобретения, около 85% или больше УФ-излучения имеют длину волны около 254 нм.
Уф-излучение может быть непрерывной формой ультрафиолетового излучения, например, при использовании ртутной лампы, или импульсной формой ультрафиолетового излучения, например, при использовании лазера монохроматического излучения. Требуемая интенсивность Уф-излучения может быть генерирована комбинированием двух или большего числа ламп. Предмет изобретения охватывает любую эффективную дозу ультрафиолетового излучения, т.е., любую дозу Уф-излучения, которая надежно и безопасно инактивирует заданный вирус, предпочтительно при комбинировании с обработкой формалином. Специалистам в области вакцин очевидно, что для осуществления полной инактивации, либо только воздействием Уф-лучей, либо в комбинации с обработкой формалином, для каждого конкретного штамма обрабатываемого вируса может потребоваться оптимизация параметров обработки, таких как длины волны и продолжительность действия Уф-излучения. Эффективная доза может зависеть от ряда факторов, которые общеизвестны в данной области, например, физические параметры Уф-инактивационных камер, такие как размер и диаметр лампы и камеры, расстояние между вирус-содержащей средой и источником Уф-излучения, светопоглощающие и светоотражающие характеристики материала, из которого изготовлена камера. Справедливо и то, что длина волны и интенсивность УФ-излучения в диапазоне С, а также время контакта, на протяжении которого вирус подвергается воздействию УФ-излучения, также являются определяющими при выборе эффективной дозы. Кроме того, на выбор эффективной дозы оказывает влияние вирус, сам по себе; среда, содержащая вирус, и их светопоглощающие характеристики. Предпочтительно, эффективной дозой является доза, достаточная для инактивирования, по крайней мере, 99,99% вируса, содержащегося в образце, более предпочтительно для инактивирования вируса до уровня, при котором в тесте с использованием клеточной культуры, относящейся к птицам или млекопитающим, активный вирус не детектируется, или он полностью инактивирован. В предпочтительном варианте, используя УФ-излучение в диапазоне С, образец, содержащий вирус, подвергают воздействию эффективной дозы в диапазоне от около 5 до около 200 мДж/см2. В предпочтительном варианте, эффективная доза находится в диапазоне в диапазоне от около 20 до около 100 мДж/см2, и в других предпочтительных вариантах, эффективная доза находится в диапазоне от около 40 до около 90 мДж/см2. В предпочтительном варианте, эффективная доза снижает первоначальный титр вируса в 1×105. При инактивации исходной вакцины в объеме, эффективная доза должна быть достаточной для устранения любого остаточного живого вируса, который может присутствовать после стадии химической инактивации (формалином). Как иллюстрировано в примерах, это может быть определено с помощью очень чувствительных тестов на инфективность с использованием клеточной среды, относящейся к млекопитающим, таким как тест с использованием культуры Vero клеток, описанный в Примере 1.3.
После инактивации, вирусные антигены очищают.Очистку предпочтительно осуществляют ультрацентрифугированием при динамических перегрузках, например, около 100000 g, а именно, по крайней мере, 50000 g, 60000 g, 70000 g, 80000 g, или 90000 g, или вплоть до 200000 g, 180000 g, 160000 g, 140000 g, 120000 g или 110000 g. Способ центрифугирования является общеизвестным в данной области и его используют в стандартном получении противовирусных вакцин, описанном, например, в патенте 6048537, который, поэтому, входит в настоящее описание в виде ссылки. Предпочтительно, ультрацентрифугирование осуществляют в градиенте плотности сахарозы, который устанавливается во время центрифугирования. В конкретных предпочтительных вариантах, градиент сахарозы получают, используя раствор сахарозы с концентрацией от около 42% до 55% (мас./мас.%) (или любой другой адекватный углевод или сахар, известный в данной области). Для ультрацентрифугирования может быть использована проточная центрифуга. Параметры для фракционирования после ультрацентрифугирования зависят от характеристик используемых штаммов вируса. Параметры для сбора фракций максимального пула оценивают и определяют индивидуально для каждого штамма вируса, и они находятся в диапазоне концентраций сахарозы от около 46-50% до 34-38%. Предпочтительно, невирусное вещество (например, на этой стадии полный инактивированный вирус) удаляют путем разделения по плотности. Фрагменты клеточной мембраны, включая липосомы и белки, каждый, имеют характерную плотность. Вирусы, которые имеют характерный состав белков, нуклеиновых кислот и в случае вирусов, имеющих оболочку, также мембрану, могут быть очищены от невирусного вещества, используя их различие в характерной плотности. В частности, цельные вирусные антигены могут быть очищены от частей неполноценного вируса, или наоборот.
Эта стадия очищения инактивированного вируса включает, по крайней мере, частично отделение растворимого невирусного вещества от вируса. В частности, растворимое невирусное вещество включает клеточные белки и клеточные нуклеиновые кислоты из клеток исходной клеточной среды или культуры. Количество невирусного вещества, включая части неполноценного вируса, предпочтительно снижается во время очистки на, по крайней мере, 20%, предпочтительно на 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% или, по крайней мере, 90%.
В конкретных предпочтительных вариантах, собранную жидкость обрабатывают нуклеазой для того, чтобы деградировать нуклеиновые кислоты клеток-хозяев. Такой нуклеазой может быть, например, бензоназа.
В дополнительном варианте настоящего изобретения, клетки, используемые для культивирования клеток и репродуцирования вируса, могут представлять собой эмбриональные клетки или любую культивируемую клеточную линию, подходящие для продуцирования вируса. Примеры клеток, которые могут быть использованы, включают клетки, относящиеся к млекопитающим (например, клетки CHO, BHK, VERO, HELA, или perC6), клетки, относящиеся к птицам (например, куриные эмбриональные фибробласты, или стабильные клеточные линии от птиц) и клетки, относящиеся к насекомым (например, клетки Sf9). В конкретных предпочтительных вариантах, клетки находятся в форме клеточной культуры. Заявляемый способ позволяет обеспечить эффективную очистку, включая расщепление материала, несмотря на потенциал сшивающей способности предшествующих инактивационных реагентов. В отличие от вируса, культивированного на куриных эмбрионах, вирус, культивированный на клеточной культуре, обладает более высокой исходной чистотой и свободен от альбумина и коллагенов, что является важным преимуществом для очистки обработанного формалином сбора “урожая”. Новаторский состав полученного продукта свободен от хлопьеобразования без необходимости присутствия стабилизаторов, таких как токоферол или laureth-9.
В настоящем изобретении, вирусы, подлежащие инактивации, выбирают из имеющих оболочку ДНК- или РНК-содержащих вирусов, с геномами, представленными одноцепочечной или двухцепочечной ДНК, смысловых или антисмысловых, непрерывных или сегментированных. В предпочтительных вариантах данного изобретения, вирусы выбирают из группы, состоящей из имеющих оболочку (каспидных) вирусов, включая флавивирусы, тогавирусы, ретровирусы, коронавирусы, филовирусы, рабдовирусы, буньявирусы, ортомиксовирусы, парамиксовирусы, ареновирусы, гепаднавирусы, вирусы герпеса, и поксвирусы. В других предпочтительных вариантах, вирусы представляют собой флавивирусы, коронавирусы, ортомиксовирусы, или тогавирусы. Особенно предпочтительными являются имеющие оболочку вирусы, такие как вирусы гриппа, включая штаммы гриппа A, B или C, вирус Западного Нила, и вирус реки Росс (RRV.) В других предпочтительных вариантах данного изобретения, вирусы выбирают из группы имеющих оболочку РНК-содержащих вирусов, включая, флавивирусы, тогавирусы, ретровирусы, коронавирусы, филовирусы, рабдовирусы, буньявирусы, ортомиксовирусы, парамиксовирусы, и ареновирусы. В одном особенно предпочтительном варианте, вирус выбран из ортомиксовирусов, например, штамма вируса гриппа: штаммы вируса гриппа могут содержать изменяющиеся комбинации поверхностных белков, гемагглютинина и нейраминидазы. В другом особенно предпочтительном примере, вирус выбран из тогавирусов, например, альфавирусов, такого как RRV. Другой предпочтительной группой вирусов для использования в виде исходного раствора вирусов, являются коронавирусы, включая вирус, связанный с тяжелым острым респираторным синдромом (SARS). Другой группой предпочтительных вирусов являются флавивирусы, включая японский энцефалит, клещевой энцефалит (TBE), вирус тропической лихорадки, вирус желтой лихорадки, вирус Западного Нила и вирус геморрагической лихорадки. Другой предпочтительной группой вирусов являются поксвирусы, включая ортопоксвирусы (такие как вирус вакцинии или модифицированный вирус вакцинии Ankara), и авипоксвирусы.
В дополнительных вариантах, очищенный вирус подвергают дополнительной обработке. После очистки, дополнительные стадии могут включать разбавление очищенного вируса, в частности, после ультрацентрифугирования в градиенте сахарозы, для разбавления вязкой фракции максимального пула, которая, как предполагают, содержит около 40% сахарозы. Очищенный вирус может быть гомогенизирован, дополнительно обработан нуклеазой, подвергнут фильтрованию под давлением и/или ультра/диафильтрации.
В вариантах данного изобретения, вирус модифицируют обработкой детергентом с получением вакцины на основе модифицированного цельного вируса или расщепленного инактивированного вируса. Модификацию липидной оболочки вируса осуществляют путем солюбилизации с помощью детергента, такого как Тритон X100 при концентрации, подходящей для дестабилизации или дезинтеграции вируса, в частности, мембраны липидной оболочки вируса. Обработка детергентом может, по крайней мере, частично удалить мембрану указанного вируса. Предпочтительно, избыточный детергент удаляют, например, диафильтрацией или хроматографическими способами. Детергенты для использования на стадии обработки детергентом включают ионогенные детергенты (катионного, анионного, цвиттер-ионного типа) или неионогенные детергенты. Подходящие детергенты включают группу детергентов типа Tween (например, Твин 80), и группу детергентов типа Triton (например, Тритон 100).
Необязательно, препарат, содержащий вирусный антиген, дополнительно стабилизируют дополнительной обработкой формальдегидом или добавлением стабилизатора, как например, путем использования детергентов, раскрытых в WO 02/097072 A2, содержание которой входит в настоящее описание в виде ссылки. Такие детергенты представляют собой, например, детергенты, подходящие для стабилизации 11A белка, такие как Твин 80, Тритон X100, дезоксихолат, laureth-9 и токоферол. Считают, что поверхностные белки остаются в солюбилизированном состоянии благодаря многослойным мицеллам составляющих мембраны и детергентам.
В конкретных предпочтительных вариантах, вирус подвергают дополнительной обработке, превращая его в расщепленный вирус, и эта обработка включает любую одну из нижеприведенных стадий разбавления, гомогенизации, обработки нуклеазой, фильтрации под давлением, ультра/диафильтрации, солюбилизации, диафильтрации, стабилизации путем обработки формальдегидом, разбавления, ультра/диафильтрации, добавления стабилизатора (детергента), второй гомогенизации и стерильной фильтрации.
В других конкретных предпочтительных вариантах, вирус подвергают дополнительной обработке, превращая в препарат, содержащий модифицированный вирус, и эта обработка включает любую одну из нижеследующих стадий разбавления, гомогенизации, обработки нуклеазой, фильтрацией под давлением, ультра/диафильтрации, солюбилизации, обработки детергентом, добавления стабилизатора, второй гомогенизации и стерильной фильтрации. В частности, стабилизацию детергентом осуществляют, вводя детергент в мембрану вируса в случае имеющего оболочку вируса, для повышения стабильности полноценного вируса, который тем самым модифицируют.
В дополнительных вариантах, вирус подвергают обработке с получением субъединичной вакцины, включая выделение отдельных вирусных субъединиц или вирусных белков, в частности, поверхностных белков, подобных гемагглютинину и нейраминидазе. Выделение может, например, осуществляться методами аффинной очистки и/или хроматографическими методами, таким как ионообменная хроматография.
Неожиданно, способ по данному изобретению оказался пригодным для производства в промышленном масштабе вакцин, содержащих вирусные антигены. Поэтому, предпочтительно инактивацию или любую другую стадию, такую как инокуляция, репродуцирование, сбор или очистка, осуществляют при использовании жидкости, содержащей вирус или вирусный антиген, в исходных количествах или количествах, отвечающих выходу продукции, равных, по крайней мере, 0,5 л, 1 л, 2 л, 3 л, 4 л, 5 л, 6 л, 7 л, 8 л, 9 л, 10 л, 12 л, 14 л, 16 л, 18 л, 20 л, 25 л, 30 л, 35 л, 40 л, 60 л, 80 л, 100 л, 120 л, 140 л, 160 л, 180 л, 200 л жидкости, содержащей вирус или вирусный антиген.
В дополнительном аспекте, данное изобретение также предлагает способ получения препарата, содержащего вирусные антигены, включающий
а) получение жидкости, содержащей инфекционный вирус,
b) полное инактивирование указанного собранного вируса,
c) обработку указанного инактивированного вируса детергентом,
d) очистку указанного инактивированного вируса, что приводит к получению препарата, содержащего вирусные антигены.
Конечно, можно также использовать содержащие инфекционный вирус жидкости, как таковые, которые могут представлять собой любой клеточный супернатант, описанный выше, для инактивации, обработки детергентом и очистки. Предпочтительно, указанную жидкость, содержащую инфекционный вирус, получают из клеточной культуры.
В конкретных предпочтительных вариантах, вирусные антигены, в частности, антигены расщепленного вируса или модифицированного вируса, стабилизируют добавлением эффективного количества Твина 80, в частности, предпочтительно при концентрации около 0,125%, например, выше 0,01%, 0,05% или 0,4%, и ниже 0,6%, 0,5%, 0,4%, 0,3% или 0,2%. Поэтому, настоящее изобретение предлагает в дополнительном аспекте способ стабилизации вирусных антигенов добавлением Твина 80. Согласно настоящему изобретению было обнаружено, что Твин 80, в качестве детергента, является менее эффективным для солюбилизации вирусных мембран, чем Тритон Х100, но значительно более биосовместим и, поэтому, может присутствовать в вакцинном препарате. Эффективное количество для стабилизации вирусных антигенов предпочтительно ниже, чем количество, необходимое для солюбилизации вирусных мембран, как в способе солюбилизации расщепленного вируса, использующем высокие концентрации Тритона Х100, например, 0,5%. В других вариантах, вирусные антигены свободны от стабилизаторов. В конкретных вариантах, предлагается получение расщепленной инактивированной вакцины способом, в котором вирусный ”урожай” полностью инактивируют до расщепления и очистки. Неожиданно оказалось, что способ инактивации обработкой формалином и Уф-обработкой не мешает последующей обработке детергентом и способам очистки.
В дополнительных вариантах, предлагается вакцина или фармацевтическая композиция, которая содержит один или несколько вирусных антигенов. Такая фармацевтическая композиция может, кроме того, содержать фармацевтический носитель и/или вспомогательное вещество. Такими фармацевтические носителями являются, например, стабилизирующие соли, эмульгирующие средства, солюбилизаторы или средства, регулирующие осмотическое давление; суспендирующие средства, загустители, окислительно-восстановительные компоненты, поддерживающие физиологический окислительно-восстановительный потенциал. Предпочтительные вспомогательные вещества включают соли алюминия, микроэмульсии, липидные частицы, и/или олигонуклеотиды, используемые для повышения иммунной реакции. Дополнительным аспектом настоящего изобретения является фармацевтическая композиция или препарат в виде вакцины, содержащей антиген. Вакцина может быть использована, например, для инъекции как профилактическое средство против заболевания, связанного с вирусом. В конкретных предпочтительных вариантах, композиция или вакцина содержит более чем один антиген, например, 2, 3, 4, 5, 6, 7 или 8, в частности, различных вирусных штаммов, подтипов или типов, таких как грипп типа A и грипп типа B, в частности, выбранных из одного или нескольких из человеческих подтипов H1N1, H2N2, H3N2, H5N1, H7N7, H1N2, H9N2, H7N2, H7N3, H10N7, подтипов H1N1, H1N2, H3N1 и H3N2 свиного гриппа, подтипов H7N7, H3N8 собачьего или лошадиного гриппа или подтипов H5N1, H7N2, H1N7, H7N3, H13N6, H5N9, H11N6, H3N8, H9N2, H5N2, H4N8, H10N7, H2N2, H8N4, H14N5, H6N5, H12N5 птичьего гриппа.
Подходящие вспомогательные вещества могут быть выбраны из минеральных гелей, гидроксида алюминия, поверхностно-активных веществ, лизолецитина, плюроникполиолов, полианионов или масляных эмульсий, таких как вода-в-масле или масло-в-воде, или их комбинаций. Конечно, выбор вспомогательного вещества зависит от использования по назначению. Например, токсичность может зависеть от предполагаемого предметного организма и может варьироваться в диапазоне от отсутствия токсичности до высокой токсичности.
Другой предпочтительный вариант композиции или вакцины по данному изобретению дополнительно включает буферные вещества. Буферные вещества могут быть подобраны специалистом в данной области так, чтобы состояние раствора композиции по данному изобретению отвечало физиологическому. Характеристики, подобные pH и ионной силе, а также содержание ионов, могут быть выбраны, по желанию.
Дополнительная предпочтительная композиция или вакцина по данному изобретению содержит фармацевтически приемлемый носитель.
Термин "носитель" относится к разбавителю, например, вода, физиологический раствор, наполнитель, или среде-наполнителю, с которым можно вводить композицию. В случае твердой композиции, носители для фармацевтических композиций могут включать связующее, такое как микрокристаллическая целлюлоза, поливинилпирролидон (поливидон или повидон), трагакантовая камедь, желатин, крахмал, лактоза или моногидрат лактозы; дезинтегрирующее средство, такое как альгиновая кислота, кукурузный крахмал и т.п.; смазку или поверхностно-активное вещество, такое как стеарат магния или лаурилсульфат натрия; скользящее средство, такое как коллоидный диоксид кремния; подслащивающее вещество, такое как сахароза или сахарин.
Кроме того, предлагается способ повышения резистентности к вирусной инфекции у субъекта, включающий получение препарата, содержащего один или несколько различных вирусных антигенов, и введение субъекту указанного препарата, содержащего один или несколько различных вирусных антигенов, описанных выше. Препарат представляет собой предпочтительно вакцину. Рассматривается также разработка вирусных антигенов, получаемых согласно данному изобретению, в качестве вакцины или для повышения резистентности к вирусной инфекции у субъекта путем введения указанных вирусных антигенов.
Примеры
Пример 1: Инактивация инфекционного вируса
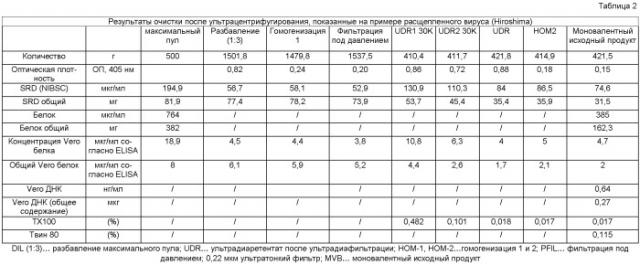
Три различных штамма гриппа, два A-штамма Hiroshima (HR, H3N2), New Caledonia (NC, H1N1) и B-штамм, Malaysia (MA), продуцируют в культурах Vero клеток. После репродукции вируса “урожай” инфекционного вируса инактивируют до очистки, как представлено на схеме производственного процесса Фиг.1а.
1.1. Инактивация формалином
Первую стадию инактивации обработкой формалином осуществляют на бесклеточном, инфекционном моновалентном вирусном “урожае” т.е., “урожае” биореактора, после осветления посредством центрифугированием. После сбора при температуре в диапазоне от 30 до 34°C, моновалентный вирусный “урожай” обрабатывают бензоназой при концентрации от около 0,9 до около 1,1 Е/мл при температуре от 30 до 34°C в течение периода времени от 4 до 8 часов. Затем его обрабатывают формалином с концентрацией=92 мг/л в течение периода в