Комбинация крови и керамических частиц двухфазных фосфатов кальция
Иллюстрации
Показать всеГруппа изобретений относится к области медицины. Способ получения биоматериала, обеспечивающего регенерацию костной ткани, содержит двухфазный фосфат кальция (ВСР) в форме гранул, диспергированных гомогенно в трехмерной сетке белков крови или в сетке белков костного мозга, включает следующие стадии: (i) смешивание двухфазного фосфата кальция в виде гранул размером от 40 до 500 мкм с кровью или аспиратом костного мозга в соотношении от 10 до 90% масс. ВСР от объема крови или костного мозга в г/мл; (ii) прибавление к смеси, полученной на стадии (i), по меньшей мере одного коагулянта в количестве, достаточном для вызывания коагуляции крови или костного мозга. Биоматериал дополнительно содержит одну добавку, выбранную из полимеров, керамических частиц, соединений фармацевтического назначения, природных или синтетических факторов роста, биомаркеров, контрастных веществ, препаратов из тканей или клеток. Набор для осуществления способа содержит: (а) устройство, имеющее внутреннюю стерильную полость, в которой размещен ВСР; (b) стерильную емкость, содержащую коагулянт. Биоматериал применяют in vitro или ex vivo в качестве подложки для продуцирования костной ткани или для получения костного имплантата. Группа изобретений обеспечивает регенерацию костной ткани. 7 н. и 17 з.п. ф-лы, 10 ил.
Реферат
Настоящее изобретение относится к новому биоматериалу на основе коагулированной крови или аспирата коагулированного костного мозга и керамических частиц двухфазных фосфатов кальция, к способу его получения и его применению для получения имплантата с целью обеспечения регенерации костной ткани.
Восстановление костного вещества, утраченного, главным образом, вследствие травмы и, в более редких случаях, при поражении опухолью, представляет собой одну из наибольших трудностей, с которыми сталкиваются хирурги-ортопеды. Дефекты малого размера, от "резко выраженного" ложного сустава (вследствие дефекта консолидации перелома, где вероятна потеря вещества) до потери кости длиной 5-6 см, наиболее часто представляют собой объекты аутологичной трансплантации губчатой или кортикально-губчатой костной ткани, отобранной из подвздошного гребня (золотой стандарт). Дефекты большого размера (≥6 см) требуют существенно более серьезных хирургических операций типа переноса васкуляризированной костной ткани или процедуры Маскле. При этом доступное количество аутологичной костной ткани ограничено, консолидация костей носит случайный характер, а такие методики разного типа часто являются причиной послеоперационных осложнений по месту отбора трансплантата.
Различные биоматериалы, доступные в клинической практике, теоретически позволяют обходить недостатки аутологичного трансплантата. К сожалению, ни один из них не сравним с костным трансплантатом по результатам и не обеспечивает восстановление вещества, утраченного в большом количестве.
Большинство изученных в настоящее время костных заменителей связано с биоматериалами штаммов мезенхимных клеток, полученных исходя из костного мозга после нескольких недель селекции и культивирования клеток in vitro. Такой подход является трудоемким и дорогостоящим, что ограничивает клинические результаты.
L. Okazaki et al., Clin. Oral Impl. Res., 16, 2005, 236-243, описаны имплантаты на основе как порошка деминерализованной кости, так и коагулированной крови. Несколькими авторами изучена комбинация крови с синтетическими биоматериалами. J. Schmid et al., Clin. Oral Impl. Res., 1997:8:75-8, описаны имплантаты на основе порошка деминерализованной бычьей кости и крови. A. Chevrier et al., Osteoarthritis and Cartilage (2007), 15, 316-327, описаны имплантаты на основе раствора полимера, содержащего хитозан в буферном глицерино-фосфатном растворе, и крови, скоагулированной in situ. B. Wallkamm et al., Clin. Oral Imp. Res., 14, 2003, 734-742, описаны имплантаты на основе крови и производного полимера молочной кислоты (Polyfibre® или Polyfoam®). Yildérim M. et al., Clin. Oral Impl. Res., 2000, 11, 217-219, описаны имплантаты на основе бычьего апатита и венозной крови. В US 2008/0014279 описан биоматериал, который представляет собой зернистый материал, покрытый гелем полимера, и может быть смешан с любой жидкостью, предпочтительно с кровью, для получения пасты, которую шпателем или шприцем наносят в место, в котором должен быть восполнен дефект костной ткани. В WO 02/068010 описан композиционный материал на основе костного мозга, причем данный материал содержит имплантируемую биологически совместимую и пористую матрицу и коагулированный материал, такой, как коагулят костного мозга, крови, плазмы.
Тем не менее, ни один из этих имплантируемых материалов, описанных на предшествующем уровне техники, не лишен недостатков.
Применение материалов, требующих культивирования клеток костного мозга перед комбинированием с подложкой (деминерализованной костью, синтетическим полимером или иным материалом), занимает много времени и вынуждает отбирать костный мозг у пациента за несколько недель до внедрения имплантата, что увеличивает число хирургических операций и риски, связанные с ними.
Биоматериалы, в которых комбинируется подложка и некоагулированная кровь, не позволяют конструировать имплантат.
Хотя была предложена комбинация некоторых материалов подложек с коагулированной кровью, но полученные результаты не всегда были удовлетворительными, в частности, потому, что данный способ не позволяет получать однородный биоматериал.
Такие материалы, представляющие собой результат комбинации подложки и необязательно коагулированной крови, до настоящего времени использовали в челюстно-лицевой хирургии, где проблемы консолидации костей являются менее критичными, и мало использовали или не использовали совсем при восстановлении диафизарных костей.
Способ, описанный в WO 02/068010, состоит в применении материала подложки, представляющего собой деминерализованную пористую кость в виде гранул размером по меньшей мере 1 мм и связанного с волокнами деминерализованной кортикальной кости размером по меньшей мере 5 мм и коагулированным материалом, предпочтительно получаемым из костного мозга. Все предложенные образцы содержат клетки костного мозга.
Настоящее изобретение позволяет устранить недостатки предшествующего уровня техники, в частности оно позволяет получать приемлемый для имплантации биоматериал, исходя из синтетической подложки, легко получаемой с постоянными и однородными свойствами, и коагулированной крови, без необходимости прибегать к стадиям культивирования, причем данный материал обладает превосходной биологической совместимостью, обеспечивающей восстановление костной ткани быстрым образом. Настоящее изобретение позволяет также получать костную ткань превосходного качества в отношении твердости и васкуляризации. Кроме того, способ получения такого биоматериала является простым, легким в осуществлении, не требует многократного хирургического вмешательства в организм пациента и является малозатратным по сравнению со способами предшествующего уровня техники.
Биоматериал по настоящему изобретению представляет собой пасту, содержащую по меньшей мере двухфазный фосфат кальция в виде гранул, смешанных почти гомогенно с коагулированной кровью.
Двухфазный фосфат кальция, BCP, используют во многих случаях врачебной и стоматологической практики. Двухфазный фосфат кальция в качестве материала для восстановления костей впервые был описан Nery E.B. et al., J. Periodontol. 1992, Sept., 63(9): 729-35. BCP представляет собой смесь гидроксиапатита (HA) Ca10(PO4)6(OH)2 и бета-формы трикальцийфосфата Ca3(PO4)2 (β-TCP). Его биологическая активность и биорезорбируемость могут регулироваться изменением содержания гидроксиапатита и β-TCP, входящих в его состав.
Биоматериалы на основе BCP обладают тем преимуществом, что по сравнению с другими синтетическими биоматериалами они благоприятствуют остеогенезу.
BCP был объектом многочисленных исследований. Fellah B.H. et al., J. Mater. Sci.: Mater. Med. (2007), 18, 287-294, показали, что выбор крупности меньше 20 мкм благоприятствовал воспалительной реакции тканей, что может быть объяснено тем, что такой размер частиц является особенно благоприятным для остеогенеза, что было отмечено Malard O. et al., J. Biomed. Mater. Res., 46(1), 1999, 103.
Mankani M.H. et al., Biotechnology and Bioengineering, 72(1), 2001, 96-107, в противоположность этому, показали, что частицы BCP, отсортированные в интервале от 100 до 250 мкм, представляли собой частицы, которые вызывали наиболее значительное восстановление костной ткани в случае их комбинации с культивированными клетками костного мозга, в то время как при крупности меньше 44 мкм какое-либо образование костной ткани не наблюдалось, при этом хорошие результаты были получены с частицами размером в интервале до 2 мм.
Trojani C. et al., Biomaterials, 27, 2006, 3256-3264, показали, что хорошая остеоиндукция могла быть достигнута имплантацией композиционного материала "BCP/гидрогель Si-гидроксипропилметилцеллюлозы", к которому были прибавлены культивированные клетки костного мозга, в случае частиц BCP, отсортированных в интервале от 40 до 80 мкм.
Однако оба последних способа требуют осуществления стадии отбора клеток костного мозга, а также их культивирования.
Настоящее изобретение основано на следующих фактах:
- заявителями замечено, что BCP обладает антикоагулянтными свойствами;
- заявителями замечено, что BCP, имеющий выбранный гранулометрический состав и комбинируемый с коагулированной кровью или аспиратом коагулированного костного мозга, обеспечивает очень хороший остеогенез и ведет к получению костной ткани весьма приемлемого качества способом, отличающимся большой простотой по сравнению со способами предшествующего уровня техники.
Таким образом, первым объектом настоящего изобретения является особая комбинация BCP, описанная далее, с коагулированной кровью или с аспиратом коагулированного костного мозга. Такая комбинация преимущественно представляет собой однородную пластичную пасту.
С этой пастой можно осуществлять манипуляции для адаптации размеров и формы соответственно дефекту, подлежащему восполнению, при этом избегая приложения избыточного давления, которое может повредить или разрушить ее трехмерную структуру.
BCP, используемый по настоящему изобретению, имеет крупность в интервале от 40 до 500 мкм, предпочтительно от 40 до 400 мкм, наиболее предпочтительно от 40 до 300 мкм и преимущественно от 80 до 200 мкм.
BCP, используемый по настоящему изобретению, представляет собой дробленую высокотемпературную фритту, отсортированную, например, просеиванием гранул в интервале выбранного диаметра. BCP, используемый по настоящему изобретению, преимущественно содержит гидроксиапатит и β-трикальцийфосфат с массовым соотношением "HA/β-TCP" в интервале от 5/95 до 95/5, предпочтительно от 30/70 до 80/20 и преимущественно от 40/60 до 60/40.
Предпочтительно он представляет собой пористом BCP с размерами пор в интервале от 50 нм до 150 мкм и предпочтительно от 1 до 50 мкм.
Гранулы или порошок трикальцийфосфата и гидроксиапатита могут быть получены способами, описанными Bouler et al., J. Biomed. Mater. Res., 1996, 32, 603-609, Bouler et al., J. Biomed. Mater. Res., 2000, 51, 680-684, Obadia et al., J. Biomed. Mater. Res., 2006, 80(B), 32-42. Они могут быть приобретены у компании GRAFTYS SARL.
Если применяют способы предшествующего уровня техники с использованием гранулята BCP, то есть если, например, смешивают BCP с образцом крови, то коагулят крови не образуется, поскольку BCP обладает антикоагулянтными свойствами. Согласно способу по настоящему изобретению BCP смешивают с образцом крови, который предварительно отбирают необязательно с прибавлением антикоагулянта и сразу приводят в контакт с BCP донора, совместимого с реципиентом биоматериала, затем при перемешивании к смеси прибавляют по меньшей мере один коагулянт. Коагулянт предпочтительно представляет собой производное кальция. Коагулянт на основе кальция предпочтительно выбирают из биологически совместимых солей кальция, таких, как CaCl2, Ca(NO3)2, Ca(AcOEt)2, CaSO4.
Среди других коагулянтов, приемлемых для использования при осуществлении настоящего изобретения, можно упомянуть тромбин. Смешивание BCP, крови или аспирата костного мозга и коагулянта осуществляют в течение любой стадии коагуляции с интенсивностью, приемлемой для обеспечения образования гомогенной смеси гранул или частиц BCP и коагулированной крови или коагулированного костного мозга и, в частности, для поддержания частиц BCP в состоянии суспензии. Очень сильное или достаточно сильное перемешивание не позволяет получать гомогенные смеси. Специалисты в данной области техники могут визуально регулировать образование гомогенной смеси.
Помимо BCP композиция биоматериала может содержать необходимые добавки, такие как полимеры, керамические частицы, соединения фармацевтического назначения, причем условиями применения таких материалов являются их биологическая совместимость и отсутствие отрицательного действия на реакцию приживления биоматериала. Такие добавки хорошо известны специалистам в данной области техники и предназначены для изменения реологических свойств биоматериала, его поведения in vivo (твердость, резорбция, остеогенез) или действия в отношении инфекций или воспалительных явлений (антибиотики, противоинфекционные, противовоспалительные средства).
Также может быть предусмотрено введение в биоматериал по настоящему изобретению активных веществ, таких, как соединения терапевтического назначения, в качестве соединений, предназначенных для профилактики или лечения патологий, выбранных, например, из рака, остеопороза.
В биоматериал по настоящему изобретению также можно вводить природные или синтетические факторы роста. Также может быть предусмотрено присутствие биомаркеров или контрастных веществ, благоприятствующих визуализации резорбции биоматериала и его изменения в организме посредством медицинской техники получения изображений.
В биоматериал по настоящему изобретению может быть предусмотрено введение жировой ткани или любого другого препарата из тканей или клеток, отобранных у пациента, которому предназначен биоматериал, причем такую ткань или такой препарат предварительно суспендируют в крови, плазме или физиологическом растворе. Среди тканевых или клеточных препаратов можно упомянуть жировую ткань, тромбоциты, клетки костного мозга.
Также может быть предусмотрено содержание BCP иного гранулометрического состава, но предпочтительно в малом количестве, предпочтительно <5% масс. от общей массы BCP, поскольку было установлено, что регулирование гранулометрического состава обеспечивает лучшее образование костной ткани (более быстрое и лучшего качества) и хорошую резорбцию.
Согласно способу по настоящему изобретению BCP помещают в полость закрытого и стерильного контейнера, такую как внутренняя полость шприца. Кровь или аспират костного мозга, предварительно отобранные у донора, совместимого с реципиентом, вводят в данный контейнер.
Если отобранные кровь или аспират костного мозга должны храниться в течение времени, превышающего несколько секунд (от 5 до 10 с), то сразу после отбора их смешивают с антикоагулянтом во избежание их преждевременной коагуляции. Кровь донора может быть отобрана, например, при прямом введении ее в пробирку, содержащую соответствующее количество антикоагулянта.
Антикоагулянт может представлять собой агент, образующий хелатные комплексы с ионами кальция, такой как, например, цитрат натрия, а также, например, гепарин.
Смешивание BCP и крови или костного мозга осуществляют предпочтительно в следующих пропорциях: от 10 до 90% масс. BCP по отношению к объему крови (или костного мозга), предпочтительно от 50 до 90% и более предпочтительно от 60 до 80%,
в г/мл.
Кровь преимущественно отбирают у самого реципиента с целью обеспечения лучшей биологической совместимости имплантата. В одном из вариантов настоящего изобретения кровь заменяют продуктом, представляющим собой производное крови, таким, как плазма. Предпочтительно используют цельную кровь. В описании данной заявки, включая формулу изобретения, в случае использования термина "кровь" понимают, что данный термин относится и к продуктам, представляющим собой производные крови, такие как плазма.
При осуществлении настоящего изобретения предпочтительно используют кровь или плазму, отбор которых не требует хирургической операции.
Согласно одному из вариантов настоящего изобретения кровь может быть отобрана шприцем, в полость которого предварительно был помещен BCP и при необходимости прочие добавки.
После первичного смешивания BCP и крови к смеси прибавляют коагулянт, например, посредством набора в шприц в случае использования такого устройства.
В закрытом контейнере, содержащем BCP, кровь и коагулянт, сразу осуществляют перемешивание с целью получения гомогенного материала. Например, если осуществляют смешивание в пробирке или в полости шприца, то контейнер помещают в роторный смеситель, скорость которого регулируют в зависимости от гранулометрического состава BCP таким образом, чтобы частицы BCP оставались в состоянии суспензии в течение времени прохождения коагуляции. В одном из вариантов настоящего изобретения перемешивание может быть осуществлено магнитными шариками посредством магнитной мешалки.
Согласно предпочтительному варианту настоящего изобретения закрытый контейнер, содержащий смесь BCP, крови и коагулянта, оставляют стоять в покое в течение стадии коагуляции крови для седиментации BCP и образования имплантата, насыщенного BCP.
По завершении данной стадии смесь представляет собой однородную пластичную пасту, содержащую трехмерную сетку фибрина, окклюдирующего частицы крови, плазмы и другие соединения, введенные в композицию.
Исходя из типа устройства, использованного для получения биоматериала по настоящему изобретению, биоматериал может быть внесен затем посредством устройств, более приспособленных для перемещения в место, в котором должен быть восполнен дефект костной ткани, например, посредством инструмента, такого как шпатель, однако без разрушения трехмерной структуры имплантата, или посредством шприца или иного устройства цилиндрической формы, торец которого предварительно разрезают для формирования отверстия, адаптированного к реологическим свойствам биоматериала по настоящему изобретению.
Таким образом, другим объектом настоящего изобретения является способ получения биоматериала, причем способ включает по меньшей мере следующие стадии:
(i) смешивание BCP в виде гранул размером от 40 до 500 мкм с кровью или аспиратом костного мозга в соотношении от 10 до 90% масс. BCP от объема крови или костного мозга;
(ii) прибавление к смеси, полученной на стадии (i), по меньшей мере одного коагулянта в количестве, достаточном для вызывания коагуляции (крови или костного мозга);
(iii) перемешивание в условиях, благоприятствующих гомогенизации BCP, в течение времени прохождения коагуляции.
Как уже было упомянуто, в способе по настоящему изобретению стадии (i)-(iii) могут быть осуществлены во внутренней полости шприца или в закрытой по концам трубке. Коагулянт может быть выбран из производных кальция, перечисленных ранее, или из других коагулянтов, таких как, например, тромбин.
Настоящее изобретение относится также к способу восполнения дефекта костной ткани, причем этот способ включает перечисленные ранее стадии и, кроме того, стадию помещения биоматериала, полученного на стадии (III), в пространство, в котором был отмечен дефект костной ткани. Кроме того, этот способ может включать в себя стадии рассечения ткани и наложения шва.
Исходя из размеров и конфигурации дефекта кости, восполнение биоматериалом по настоящему изобретению может сочетаться с остесинтезом, позволяющим придать поврежденной ткани механическую прочность, необходимую в течение времени восстановления кости по месту имплантации биоматериала по настоящему изобретению.
Заявителем было установлено, что имплантация биоматериала по настоящему изобретению позволила индуцировать образование костной ткани в короткие сроки (несколько недель), причем данная костная ткань имела очень хорошую васкуляризацию.
В противоположность этому, было отмечено, что имплантация биоматериала, полученного таким же способом с BCP крупностью меньше 40 мкм, не обеспечивала образование костной ткани удовлетворительного качества и в удовлетворительные сроки. При этом имплантация биоматериала, полученного таким же способом с BCP крупностью больше 500 мкм, приводит к образованию имплантата с менее хорошей резорбируемостью.
Другим объектом настоящего изобретения является набор для осуществления способа по настоящему изобретению, причем этот набор содержит комбинацию BCP крупностью в интервале от 40 до 500 мкм, предпочтительно от 40 до 400 мкм, преимущественно от 40 до 300 мкм и более предпочтительно от 80 до 200 мкм по меньшей мере с одним коагулянтом. Коагулянт предпочтительно представляет собой производное кальция. Коагулянт предпочтительно представляет собой CaCl2.
Количество коагулянта рассчитывают для компенсации антикоагулянтного эффекта BCP и, при необходимости, действия антикоагулянта, прибавленного к отобранной крови.
Концентрация коагулянта в смеси крови и BCP предпочтительно должна находиться в интервале от 1 до 50 мМ и более предпочтительно в интервале от 3 до 35 мМ, в частности, в случае, когда коагулянт представляет собой коагулянт на основе кальция. Коагулянт предпочтительно следует прибавлять в виде водного раствора, так чтобы не превышать 2 объемов раствора коагулянта на единицу массы BCP в мл/г.
Концентрацией раствора коагулянта можно варьировать, соблюдая оба упомянутых ограничения и используя предпочтительно раствор коагулянта с концентрацией меньше 120 мМ, в частности, в случае, когда коагулянт представляет собой соль кальция.
Если кровь отбирают с прибавлением антикоагулянта, то необходимо компенсировать действие и антикоагулянта, и биоматериала.
Например, в случае крови, отобранной с прибавлением цитрата натрия в общепринятых условиях (с использованием контейнеров марки Vacuette®, поставляемых компанией Greiner Bio-One, или марки Vacutainer®, поставляемых компанией Becton Dickinson) в пропорции 50 мг BCP на 100 мкл крови, заявители прибавляли 1/5 конечного объема (или 20 мкл) раствора соли кальция с концентрацией 80 мМ (конечная концентрация 13,3 мМ). Концентрация раствора может доходить до 120 мМ. Кроме того, может наличествовать избыток кальция, который снова ингибирует коагуляцию.
Если кровь отбирают без прибавления антикоагулянта, то кровь отбирают, прямо прибавляя ее к биоматериалу, а кальций прибавляют во вторую очередь. В данном случае можно прибавлять водный раствор соли кальция с концентрацией в интервале приблизительно от 12 до 60 мМ в объеме, равном 1/5 объема крови.
Такая комбинация может представлять собой стерильный набор, в который входят:
(a) устройство, имеющее внутреннюю стерильную полость, в которой размещен BCP;
(b) стерильная емкость, содержащая коагулянт.
Емкость (b) может представлять собой часть устройства (a) или отдельное изделие, такое как пробирка или флакон, из которых может быть отобран коагулянт для перемещения во внутреннюю полость устройства (a), или шприц, позволяющий вводить коагулянт в полость, в которую помещен BCP.
Устройство (a) предпочтительно содержит средства, обеспечивающие введение крови во внутреннюю полость: например, средства, обеспечивающие отбор пробы крови непосредственно у пациента или из емкости, или средства, обеспечивающие введение пробы крови во внутреннюю полость с целью смешивания с BCP. Могут быть предусмотрены варианты, в которых отбираемую кровь вводят непосредственно в полость, содержащую BCP, или кровь отбирают в емкость, в которую внесен антикоагулянт, а затем смесь переносят в полость, в которой находится BCP. В случае когда используют аспират костного мозга, предусматривают средство для аспирации костного мозга.
Внутренняя полость устройства (a) имеет размеры, позволяющие вводить в нее кровь или костный мозг в количестве, необходимом для получения биоматериала по настоящему изобретению, а также другие компоненты смеси, такие как коагулянты, активные вещества, препараты тканей или клеток.
Устройство (a) преимущественно содержит также средства, обеспечивающие нанесение биоматериала в зоне, имеющей дефект костной ткани.
Такое устройство может представлять собой устройство цилиндрической формы, такое как пробирка или шприц соответственно описанию в экспериментальной части.
Также может быть предусмотрено применение устройства, такого как устройство, описанное в WO 02/068010, которое представляет собой трубку, внутри которой хранится BCP, в которую вводят кровь и коагулянт и которая может быть снабжена поршнем для вытеснения биоматериала после его образования.
Также можно предусматривать применение устройства типа Vacutainer®, то есть вакуумированной пробирки, снабженной шприцем, позволяющим отбирать предопределенное количество крови, причем такие пробирки во внутренней полости содержат предварительно внесенный BCP.
Другим объектом настоящего изобретения является приемлемый для имплантации биоматериал, содержащий BCP в виде гранул определенного ранее размера, диспергированных почти гомогенно в трехмерной сетке белков крови или в сетке белков костного мозга.
Такой биоматериал предпочтительно содержит определенный ранее BCP и коагулят белков крови (или костного мозга) в виде почти гомогенной смеси, имеющей вид пластичной пасты.
Под пластичной пастой понимают материал, который не течет самостоятельно аналогично жидкости, но механическая прочность которого является достаточно низкой, чтобы давать возможность формовать его под действием усилия руки человека и при необходимости посредством инструмента, такого, как шпатель или поршень шприца.
Такой биоматериал может быть использован для получения костного имплантата в случае заполнения места перелома, восполнения потери ткани вследствие травмы или поражения опухолью, дефекта, являющегося результатом хирургической операции, или для содействия установке протеза.
Биоматериал может быть введен соответственно поясняющим примерам посредством хирургической операции в зону, в которой должен быть восполнен дефект костной ткани. После рассечения биоматериал имплантируют, а рану закрывают.
Биоматериал по настоящему изобретению может сочетаться с остесинтезом, придающим более высокую механическую прочность, с целью обеспечения стабильности фиксации в период колонизации зоны, имеющей дефект костной ткани.
Может быть предусмотрена комбинация с протезом. Покрытие протеза биоматериалом по настоящему изобретению благоприятствует внедрению живой костной ткани в протез или вокруг него.
Биоматериал по настоящему изобретению также может быть использован in vitro или ex vivo в качестве подложки для продуцирования костной ткани.
На практике культивирование костных клеток вокруг такого биоматериала позволяет продуцировать костную ткань, которая затем может быть имплантирована.
Другим объектом настоящего изобретения является применение in vitro или ex vivo описанного ранее биоматериала для получения костного имплантата.
Согласно настоящему изобретению можно культивировать костные клетки на биоматериале по настоящему изобретению в форме, соответствующей конфигурации имплантата, подлежащего изготовлению. Культивирование клеток в таких условиях позволяет получать биологически совместимый имплантат соответствующих форм и размеров.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Фигуры
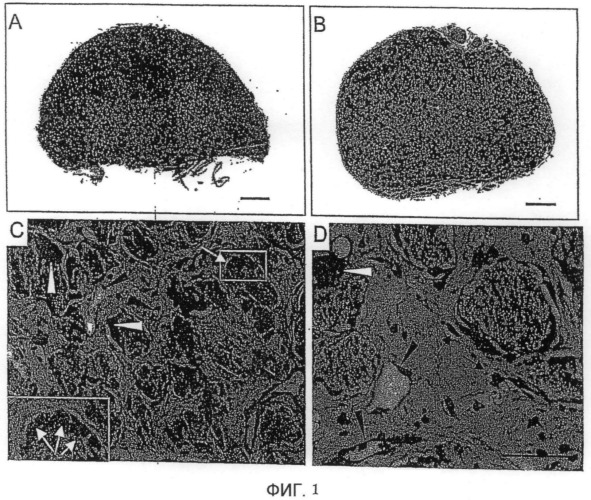
Фиг. 1. Образование костной ткани в случае имплантата на основе крови, коагулированной вокруг частиц BCP
Показаны поперечные сечения имплантатов, окрашенных HES, через 4 недели при имплантации подкожно (A и C) и внутримышечно (B и D).
Масштаб: A и B: 500 мкм
C и D: 50 мкм
Стрелки белого цвета: остеобласты
Стрелки черного цвета: остеоциты
Головки стрелок черного цвета: кровеносные сосуды
Головки стрелок белого цвета: остеокласты
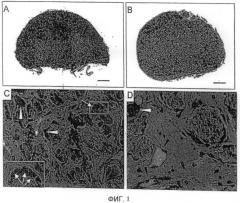
Фиг. 2. Срезы имплантатов типа "кровь/BCP" через 4 недели после имплантации
(A): Гибридизация иммунной сывороткой, показывающая коричневое окрашивание остеокальцина в цитоплазме клеток (стрелка белого цвета)
(B): Гибридизация неиммунной сывороткой - Масштаб: 10 мкм
(C): Окрашивание по Голднеру - Масштаб: 50 мкм
Стрелки черного цвета: сосуды и остеоциты
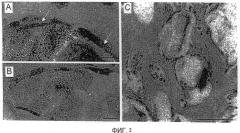
Фиг. 3. Сканирующая электронная микроскопия имплантатов типа "кровь/BCP" через 4 недели
(A) Коллагеновая матрица в пространстве между гранул - Масштаб: 10 мкм
(B) Увеличенное изображение (A) - Масштаб: 1 мкм
(C) Два прикрепленных к гранулам остеокласта с 2-3 видимыми ядрами - Масштаб: 10 мкм
(D) Функциональный капилляр - Масштаб: 10 мкм
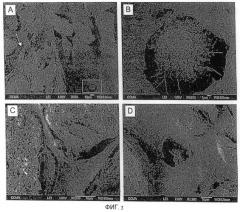
Фиг. 4. Сканирующая электронная микроскопия имплантатов
(A) BCP/коагулированная кровь
(B) BCP/коагулированная плазма
Масштаб: 1 мкм
Фиг. 5. Образование костной ткани в случае имплантатов типа "BCP/плазма" через 4 недели после имплантации
Имплантация подкожно (A, C)
Имплантация внутримышечно (B, D)
Масштаб: 500 мкм (A, B)
50 мкм (C, D)
Фиг. 6. Сравнение остеогенных свойств биоматериала, полученного исходя из крови мышей C57BL/6 (A, B) и крови человека (C, D), связанных с микрочастицами BCP (40-80 мкм), после имплантации подкожно мышам типа "нюд" с подавленным иммунитетом. Изображения при малом (A, C) и большом (B, D) увеличении.
Масштаб: 100 мкм
Фиг. 7. Влияние размера микрочастиц BCP на образование костной ткани после имплантации подкожно мышам. Имплантаты получали исходя из крови мышей C57BL/6, связанной с BCP в виде большого количества мелкодисперсного порошка крупностью меньше 40 мкм, смешанного (A) с частицами крупностью 80-200 мкм, (B) с частицами крупностью 40-80 мкм (C, D), с частицами крупностью 80-200 мкм (E, F), с частицами крупностью 200-500 мкм. На фиг. D и F показаны имплантаты C и E соответственно с более сильным увеличением. Масштаб: 100 мкм.
Фиг. 8. Имплантаты, полученные исходя из 100 мкл крови мышей C57BL/6 и увеличивающегося количества микрочастиц BCP крупностью 40-80 мкм: (A) 10 мг, (B) 30 мг, (C) 50 и (D) 70 мг. Масштаб: 100 мкм.
Фиг. 9. Рентгенографические исследования собак - Имплантаты, полученные исходя из цельной крови, коагулированной вокруг отсортированных микрочастиц BCP (80-200
мкм): (A) смесь "BCP/кровь" с соотношением 50%, причем микрочастицы поддерживаются в состоянии суспензии в крови в течение стадии коагуляции (способ 1); (B) BCP с максимальной концентрацией в крови, причем микрочастицы седиментировали в течение стадии коагуляции (способ 2). Стрелки белого цвета указывают на рентгенопрозрачную кайму между диафизарными краями и имплантатом.
Фиг. 10. Имплантация собакам породы BEAGLE. Послеоперационные рентгенографические исследования. (A) Имплантат слева состоит только из BCP. (B) Имплантат справа состоит из смеси "BCP/кровь" с максимальным содержанием BCP соответственно методике 2 получения имплантатов.
1. Принцип
Эта процедура представляет собой экстемпоральную процедуру, осуществляемую в операционном блоке. Процедура представляет собой смешивание в полости шприца из полипропилена частиц BCP и аутологичной цельной крови (50% масс./об.), отобранной с прибавлением антикоагулянта, образующего хелатные комплексы с ионами кальция. Прибавление CaCl2 обеспечивает инициирование коагуляции. Затем шприц помещают на 10 минут при комнатной температуре в роторный смеситель, что позволяет поддерживать частицы BCP в состоянии суспензии в крови в течение стадии коагуляции. Таким образом, достигается гомогенное распределение частиц в среде коагулированной крови. Затем торец шприца отрезают и имплантат вытесняют из шприца поршнем для нанесения по месту имплантации.
Результаты, полученные на животных (мыши C57BL/6)
Имплантация биоматериала в эктопическом положении (подкожно и внутримышечно) демонстрирует его остеоиндуцирующие свойства, при этом через 4 недели имплантаты полностью колонизованы минерализованной незрелой костной тканью с очень хорошей васкуляризацией.
2. Материалы и методики
2.1. Частицы двухфазного фосфата кальция
Биоматериал из двухфазного фосфата кальция (BCP) состоит из 60% гидроксиапатита (HA; Ca10(PO4)6(OH)2) и 40% трикальцийфосфата (TCP; Ca3(PO4)2). Частицы BCP, отсортированные в интервале от 80 до 200 мкм, были поставлены компанией GRAFTYS SARL (Экс-ан-Прованс, Франция). Частицы были стерилизованы нагреванием при 180°C в течение двух часов.
2.2. Получение имплантатов и хирургическая процедура
- Имплантация подкожно мышам
Испытания были проведены согласно регламентации Управления ветеринарной службы и разрешению Регионального комитета по этике экспериментов на животных (CREEA). Цельную кровь отбирали с прибавлением цитрата натрия (для предотвращения коагуляции) интракардиальной пункцией у мышей C57BL/6 в возрасте десяти недель после анестезии. В некоторых опытах плазму получали из цельной крови центрифугированием при 1800 g в течение 15 минут.
Способ 1. Имплантаты получают, смешивая 100 мкл цельной крови (или плазмы) с 50 мг частиц BCP в шприце вместимостью 1 мл. Затем осуществляют активацию коагуляции прибавлением 20 мкл 1%-ного раствора CaCl2. В течение стадии коагуляции (5-10 минут) шприц помещают на ротор типа New Brunswick (перемешивающее устройство для культур тканей, модель TC-7 M1053-4005). Устройство обеспечивает вращательное движение шприца и поддерживает нахождение частиц BCP в сгустке в состоянии суспензии. После отрезания торца шприца имплантаты вытесняют из шприца поршнем и имплантируют подкожно (SC) или внутримышечно (IM) мышам C57BL/6.
Способ 2. Имплантаты получают с максимальной концентрацией частиц и, таким образом, с максимальным соотношением "BCP/кровь". С этой целью в течение стадии коагуляции смесь "BCP/кровь/кальций" выдерживают в фиксированном положении с целью обеспечения естественной седиментации микрочастиц в крови. Полагают, что таким образом получают максимальную концентрацию микрочастиц в коагулированной крови.
Подкожные имплантаты помещали под кожей на спине, а внутримышечные имплантаты помещали в мышечной массе каждого бедра после рассечения. В каждом из мест (SC и IM) проверяли, что в ходе имплантации не было индуцировано какое-либо кровотечение.
При каждой операции имплантации мышей C57BL/6 анестезировали ингаляцией 4%-ного изофлюрана. Каждой из мышей внедряли по два имплантата SC и по два имплантата IM. В некоторых опытах каждой из мышей в каждое из мест внедряли имплантат типа "кровь/BCP" и имплантат типа "плазма/BCP". Через 4-8 недель животных умерщвляли ингаляцией CO2, а имплантаты отбирали для анализа.
- Имплантация на костях крыс
Методика, примененная заявителями, была утверждена Региональным комитетом по этике экспериментов на животных (NCA/2007/12-06). Данные предварительные испытания были осуществлены в центральном питомнике медицинского факультета Ниццы.
Заявителями была использована модель потери диафизарного костного вещества бедренной кости при прерывистом сегментировании критического размера (6 мм) в сочетании с остеосинтезом "пластина-винт" соответственно модели, разработанной в лаборатории заявителей. У крыс оперировали только по одной бедренной кости, а потерю вещества восполняли биоматериалом по настоящему изобретению из смеси "аутологичная цельная кровь/BCP (80-200 мкм)". Осуществляли серийный клинический контроль (отсутствие боли, подвижность, общее состояние) и рентгенологический контроль за крысами по протоколу J0, J7, J15, J30, J45, J60 и J90. По окончании третьего месяца животных умерщвляли, бедренные кости извлекали и после удаления материала остеосинтеза кости фиксировали в формалине перед покрытием метилметакрилатной смолой и гистологическим исследованием.
Во время первой хирургической операции имплантаты изготавливали соответственно размерам дефекта кости с содержанием частиц 50% масс./об. или 75 мг BCP на 150 мкл цельной крови, отобранной у животного перед операцией. Коагуляцию инициировали прибавлением 15 мкл 2%-ного раствора CaCl2, а гомогенизацию обеспечивали непрерывным вращением до окончания коагуляции с целью поддержания частиц BCP в состоянии суспензии в крови и обеспечения однородности биоматериала.
- Имплантация на костях собак породы BEAGLE
Эта модель представляет собой модель потери вещества полой трубчатой кости в критическом размере на уровне латеральных мыщелков бедренной кости, реализованной на взрослых собаках породы Beagle. У каждой из собак удаляли по 2 мыщелка бедренной кости. Цельную кровь (3,5 мл) отбирали до начала хирургической операции пункцией из яремной вены животного и использовали для получения биоматериала. Удаление фрагмента трубчатой кости размером 8×10 мм осуществляли на уровне каждого внешнего мыщелка бедренной кости и секвестры тщательно удаляли промыванием физиологическим раствором и аспирацией.
Каждому из животных внедрили по два имплантата различного состава, подготовленных для полного восполнения смоделированного дефекта, а именно:
- с одной стороны, имплантат из испытуемого биоматериала, состоявшего из смеси BCP (80-200 мкм) и крови с соотношением 50% масс./об. или 330 мг BCP и 660 мкл цельной крови. Частицы BCP поддерживали в состоянии суспензии в течение стадии коагуляции вращением шприца, использованного для получения смеси;
- с другой стороны, имплантат, состоявший только из BCP, гидратированного в физиологическом растворе или 660 мг, что занимало такой же объем, что и контралатеральный имплантат.
Длительность эксперимента составляла 8 недель.
Рентгеновские снимки получали непосредственно после операции и в конце экспер