Тетра-(мезо-арил)-порфирин с диизоборнилфенольными заместителями в макроцикле
Иллюстрации
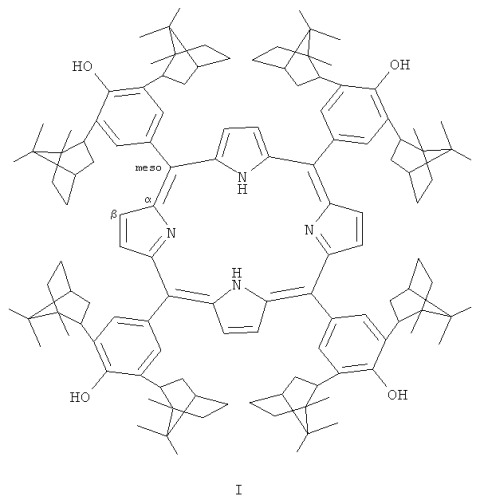
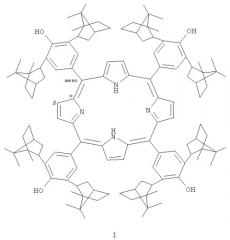
Показать всеТетра-(мезо-арил)-порфирин с диизоборнилфенольными заместителями формулы I
где изоборнильные фрагменты имеют конфигурацию хиральных центров (1S,2R,4R,1'R,2'S,4'S) или (1S,2R,4R,1'S,2'R,4'R) и (1R,2S,4S,1'R,2'S,4'S). Соединение представляет интерес в качестве биологически активного вещества и гибридного антиоксиданта и может быть использовано в медицине. 1 пр.
Реферат
Изобретение относится к новым химическим соединениям класса порфиринов, а именно к тетра-(мезо-арил)-порфирину с диизоборнилфенольными заместителями формулы I.
где изоборнильные фрагменты имеют конфигурацию хиральных центров (1S,2R,4R,1'R,2'S,4'S) или (1S,2R,4R,1'S,2'R,4'R) и (1R,2S,4S,1'R,2'S,4'S).
Изобретение относится к к новым химическим соединениям класса порфиринов, а именно к тетра-(мезо-арил)-порфирину с диизоборнилфенольными заместителями формулы I. Заявляемое соединение представляет интерес в качестве биологически активного вещества и гибридного антиоксиданта и может быть использовано в медицине.
где изоборнильные фрагменты имеют конфигурацию хиральных центров (1S,2R,4R,1'R,2'S,4'S) или (1S,2R,4R,1'S,2'R,4'R) и (1R,2S,4S,1'R,2'S,4'S).
Известно, что изоборнилфенолы проявляют противовоспалительную и гемореологическую активность [Cirri M., Mura P., Corvi Mora P. Int. J. Pharm. 2007, 30, 84-91. Chukicheva I.Yu., Fedorova I.V., Buravlev E.V., Lumpov A.E., Vikharev Yu.B., Anikina L.V., Grishko V.V., Kuchin A.V. Chem. Nat. Compd. 2010, 46, 478-480. Plotnikov M.B., Smol'yakova V.I., Ivanov I.S., Kuchin A.V., Chukicheva I.J., Buravlev E.V., Krasnov E.A. Pharm. Chem. J. 2011, 44, 530-533. Buravlev E.V., Chukicheva I.Y., Suponitsky K.Y., Vikharev Y.B., Grishko V.V., Kutchin A.V. Lett. Org. Chem. 2011, 8, 301-308.], обладают мембранопротекторными свойствами [Buravlev E.V., Chukicheva I.Yu., Shevchenko O.G., Suponitsky K.Yu., Kutchin A.V. Russ J. Bioorg. Chem. 2011, 37, 614-618.] и таким образом показано, что наличие изоборнильных фрагментов в качестве углеводородных заместителей в фенольных соединениях может значительно расширить их потенциал для создания новых физиологически активных молекул. Помимо широкого спектра биологической активности терпенофенолы и их производные могут использоваться как антиоксиданты в процессах окисления [Chukicheva I.Yu., Buravlev E.V., Fedorova I.V., Borisenkov M.F., Kutchin A.V. Russ. Chem. Bull. Int. Ed. 2010, 59, 2276-2280.]. В последние годы большое внимание уделяется получению гибридных антиоксидантов. Перспективным с этой точки зрения является сочетание алкилфенольных единиц с порфириновым макроциклом [Milaeva E.R. Russ. Chem. Bull. Int. Ed. 2001, 50, 573-586. Gerasimova O.G., Shpakovskii D.B., Milaeva E.R., Louloudi M., Hadjiliadis N. Moscow Univ. Chem. Bull. 2007, 62, 264-268. Gerasimova O.G., Milaeva E.R., Shpakovskii D.B., Semeikin A.S., Syrbu S.A. Russ. Chem. Bull. Int. Ed. 2007, 56, 831-834. Milaeva E.R., Gerasimova O.A., Zhang Jingwei, Shpakovsky D.B., Syrbu S.A., Semeykin A.S., Koifman O.I., Kireeva E.G., Shevtsova E.F., Bachurin S.O., Zefirov N.S. J. Inorg. Biochem 2008, 702, 1348-1358. Antonova N.A., Osipova V.P., Kolyada M.N., Movchan N.O., Milaeva E.R., Pimenov Yu.T. Macroheterocycles 2010, 3, 140-144.].
Ближайшим аналогом заявляемого соединения можно считать тетра-(мезо-арил)-порфирин с трет-бутильными фрагментами, который получают конденсацией пиррола с 2,6-дитретбутил-4-формил-фенолом [Milaeva E.R., Gerasimova O.A., Zhang Jingwei, Shpakovsky D.B., Syrbu S.A., Semeykin A.S., Koifman O.I., Kireeva E.G., Shevtsova E.F., Bachurin S.O., Zefirov N.S. J. Inorg. Biochem. 2008, 102, 1348-1358. Antonova N.A., Osipova V.P., Kolyada M.N., Movchan N.O., Milaeva E.R., Pimenov Yu.T. Macroheterocycles 2010, 3, 140-144.].
Описания заявляемого соединения и его свойств в источниках информации не обнаружено. Технической задачей изобретения является получение нового тетра-(мезо-арил)порфирина с диизоборнилфенольными заместителями формулы I.
Синтез заявляемого соединения осуществлен методом тетрапиррольной конденсации при взаимодействии 4-гидрокси-3,5-диизоборнилбензальдегида с пирролом в условиях большого разбавления при кипячении в пропионовой кислоте с последующим медленным окислением кислородом воздуха. Оценка потенциальной биологической активности заявляемого соединения проведена при помощи программы PASS В.В. Поройкова. Заявляемое соединение является потенциальным противоопухолевым агентом (Antineoplastic, Pa 0.804). Оценка антиоксидантной активности заявляемого соединения осуществлена при помощи электрохимического ДФПГ-теста. Антиоксидантная активность порфирина с фрагментами фенолов заметно превосходит активность исходного 2,6-диизоборнил-4-метилфенола [В.Ю. Тюрин, Цзинвей Чжан, А.А. Моисеева, Е.Р. Милаева, Д.В Белых, Е.В. Буравлев, Т.К. Рочева, И.Ю. Чукичева, А.В. Кучин. Доклады Академии Наук. 2013].
Соединение I представляет собой фиолетовый мелкокристаллический порошок, растворимо в хлороформе, хлористом метилене, диметилсульфоксиде, бензоле, диэтиловом эфире, не растворимо в воде. Структура соединения I подтверждена методами ИК и ЯМР спектроскопии, а так же масс-спектрометрии (МАЛДИ). ИК-спектры регистрировали на ИК-Фурье-спектрометре Shimadzu IR Prestige 21 (Япония) в таблетках с KBr. Спектры ЯМР 1Н, 13С записывали на спектрометре Bruker Avance II 300 (Германия) при рабочей частоте прибора 300 и 75.5 МГц соответственно в CDCl3. Масс-спектры MALDI записывали на масс-спектрометре Ultraflex TOF/TOF фирмы Bruker (матрица дигидроксибензойная кислота).
Сущность предлагаемого решения и возможность его осуществления подтверждается примером и результатами физико-химических исследований.
Пример 1. Получение мезо-тетракис{3,5-ди(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)-4-гидроксифенил}порфирина (соединение I).
4-гидрокси-3,5-диизоборнилбензальдегид (1.8 г, 4.56 ммоль) растворяли при небольшом нагревании в 20 мл пропионовой кислоты, приливали 0.32 мл (4.56 ммоль) свежеперегнанного пиррола и полученную смесь прикапывали к 20 мл кипящей пропионовой кислоты. Раствор кипятили с обратным холодильником в течение 0.5 ч и охлаждали. Для осаждения продукта реакционную смесь оставляли выдерживаться при комнатной температуре в течение 7 дней на воздухе. Выпавший осадок отфильтровывали, промывали гексаном и водой, высушивали на воздухе и очищали методом колоночной хроматографии последовательно на Al2O3 и SiO2 (элюент - хлороформ). Выход 0.38 г (19%). Фиолетовый мелкокристаллический порошок, смесь атропоизомеров. ЭСП (CH2Cl2; λ, нм): 653.0, 595.5, 560.5, 522.5, 462.0, 424.5, 418.5. Спектр ЯМР 1H (CDCl3, 300 МГц), δH м.д., (*) разрешившиеся сигналы отдельных атропоизомеров: -2.65 уш. с. (2Н, NH), 0.92 уш. с. (24Н, С10,10'H3), 0.99/1.00/1.02(*) с (24Н, с, С9,9'Н3), 1.18 (24Н, с, С8,8'Н3), 1.37-2.06 м (48 H, С3,3'H2, 16Н, С6,6'H2, С5,5'H2), 2.30-2.48 м (8Н, H4,4'), 3.39 уш. т (8Н, ок. 8.0 Гц Н2,2'), 5.26/5.25(*) с (4Н, ОН), 8.09/8.08(*) с (8Н, H14,16), 8.89/8.85/8.83/8.81(*) с (8Н, Нβ). MS (MALDI) m/z рассчитано для МН (C124H158N4O4) 1768.236, найдено 1768.265 (МН+).
Тетра-(мезо-арил)порфирин с диизоборнилфенольными заместителями формулы I где изоборнильные фрагменты имеют конфигурацию хиральных центров (1S,2R,4R,1'R,2'S,4'S) или (1S,2R,4R,1'S,2'R,4'R) и (1R,2S,4S,1'R,2'S,4'S).