Пиперазиновое соединение, ингибирующее простагландин-d-синтазу
Иллюстрации
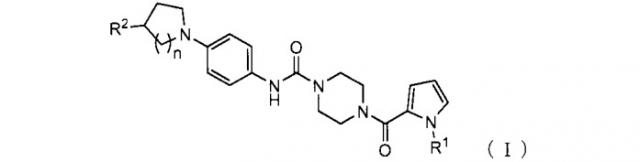
Показать всеНастоящее изобретение относится к пиперазиновому соединению, представленному формулой (I),
где R1 представляет собой С1-6алкил; R2 представляет собой гидрокси, C1-6алкил, который может содержать заместитель, выбранный из насыщенного или ненасыщенного 5-6 членного гетероцикла с 1-3 гетероатомами, выбранными из кислорода и азота, -(C=O)-N(R3)(R4) или -(C=O)-OR5; R3 и R4 могут быть одинаковыми или отличаться, и каждый представляет собой водород или С1-6алкил, который может содержать заместитель, выбранный из насыщенного или ненасыщенного 5-6 членного гетероцикла с 1-3 гетероатомами, выбранными из кислорода и азота, или R3 и R4, связанные через атом азота, к которому присоединены R3 и R4, могут образовывать насыщенную гетероциклическую группу, выбранную из 5-6 членного гетероцикла с 1-3 гетероатомами, выбранными из кислорода и азота; R5 представляет собой водород или C1-6алкил; и n представляет собой 1 или 2; или его соль. Также изобретение относится к фармацевтической композиции и средству, проявляющим активность в отношении простагландин-D-синтазы, на основе соединения формулы I, а также к способу предотвращения и лечения заболевания, в котором участвует простагландин D2. Технический результат: получены и описаны новые соединения, которые могут быть полезны в лечении заболеваний, в котором участвует простагландин D2. 6 н. и 5 з.п. ф-лы, 19 пр., 4 табл.
Реферат
Область техники
Настоящее изобретение относится к пиперазиновому соединению или его соли и фармацевтической композиции, содержащей пиперазиновое соединение или его соль в качестве активного компонента, и, в частности, к средству для предотвращения и/или лечения аллергического заболевания, воспалительного заболевания и миодегенеративного заболевания, обусловленному его ингибирующим действием в отношении гематопоэтической простагландин-D-синтазы.
Уровень техники
Простагландин D2 (PGD2) представляет собой воспалительный медиатор, продуцируемый и в больших количествах высвобождаемый тучными клетками, которые активируются при связывании антигенов с иммуноглобулином E (НПЛ 1), и, как предполагается, играет важную роль при объяснении механизма аллергических реакций. Высокие концентрации PGD2 обнаружены в бронхоальвеолярной жидкости астматиков (НПЛ 2), и сообщалось о том, что бронхоспазм был индуцирован ингаляцией простагландина D2 у пациентов с астмой, в отличие от здоровых субъектов (НПЛ 3).
С другой стороны, синтазы, которые генерируют PGD2, называются простагландин-D-синтазами. Известно два различных типа: гематопоэтическая простагландин-D-синтаза и простагландин-D-синтаза липокаинового типа. PGD2 участвует в начале и обострении различных заболеваний, включая аллергии, и в регуляторных механизмах организма; поэтому фармацевтические составы, которые могут повысить качество избыточного продуцирования, рассматриваются как очень эффективные в лечении различных заболеваний.
Человеческие гематопоэтические простагландин-D-синтазы (H-PGDS) в основном распределены в плаценте, легких, печени плода, лимфатических узлах, мозге, сердце, тимусе, костном мозге и селезенке. Кроме того, на клеточном уровне, они, как сообщают, экспрессируются в микроглии в мозге, мегакариоцитах и клетках Лангерганса в коже; клетках Купфера в печени; макрофагах; и многих других антиген-презентирующих клетках, таких как дендритные клетки, тучные клетки и Th2-клетки.
Кроме того, из-за того что H-PGDS в больших количествах экспрессируются в тучных клетках или воспалительных клетках в слизистой оболочке носа при аллергическом рините или в полипах носа при хроническом синусите, считается, что PGD2, продуцированный H-PGDS, играет важную роль в начале и обострении аллергических заболеваний, таких как астма, риносинусит, дерматит и хроническое обструктивное заболевание легких (НПЛ 4). Дополнительно была подтверждена экспрессия H-PGDS в некротизированной части скелетных мышц, в которых экспрессия H-PGDS обычно не встречается (НПЛ 5). На основании изложенного было предположено, что PGD2, продуцируемый гематопоэтической простагландин-D-синтазой, принимает участие в заболеваниях, сопровождаемых повреждением ткани, таких как мышечная дистрофия, амиотрофический боковой склероз, рассеянный склероз, неспецифический язвенный колит, ревматоидный артрит и хроническое обструктивное артериальное заболевание (НПЛ 6).
Поэтому ожидается, что ингибитор H-PGDS может быть использован в качестве фармацевтического препарата, который применяется в качестве средства предотвращения и/или лечения заболеваний, таких как аллергическое заболевание и воспалительное заболевание, в котором участвует PGD2, продуцированный гематопоэтической простагландин-D-синтазой, или его метаболит, а также некроз мышц и травматические повреждения головного мозга.
В некоторых источниках, касающихся ингибитора H-PGDS (например, ПТЛ 1 и 2) и источник Патентной Литературы 3, раскрывается ингибитор H-PGDS, имеющий структуру, подобную соединению по настоящему изобретению. Кроме того, широко изучались фармакологические свойства пиперазиновых соединений, помимо ингибиторов H-PGDS.
Источник Патентной Литературы 4 раскрывает в качестве hedgehog сигнального ингибитора пиперазиновое соединение, имеющее фурилкарбонильную пиперазиновую структуру. Источник Патентной Литературы 5 раскрывает широкий ряд пиперазиновых соединений в качестве соединений, взаимодействующих с калиевыми каналами.
Источник Патентной Литературы 6 раскрывает соединение мочевины с пиперазиновым кольцом в качестве соединения, полезного для лечения заболеваний, в которые вовлечена гидролаза амидов жирных кислот.
Список цитируемых источников
Патентная Литература
ПТЛ 1: WO2007-007778
ПТЛ 2: WO2007-041634
ПТЛ 3: WO2008-122787
ПТЛ 4: WO2007-054623
ПТЛ 5: WO99/007672
ПТЛ 6: WO2008-023720
Непатентная Литература
НПЛ 1: J. Immunol., 129, 1627-1631 (1982)
НПЛ 2: N. Eng. J. Med., 315, 800-804 (1986)
НПЛ 3: N. Eng. J. Med., 311, 209-213 (1984)
НПЛ 4: Arch. Otolaryngol Head Neck Surg., 133, 693-700 (2007)
НПЛ 5: Acta Neuropathol., 104, 377-384 (2002)
НПЛ 6: Am J Pathol., 174(5), 1735-1744 (2009)
Краткое описание изобретения
Техническая задача
Основная цель настоящего изобретения заключается в том, чтобы обеспечить новое соединение, которое показывает, в низкой дозе, высокую ингибирующую активность в отношении простагландин-D-синтазы, и, в частности, H-PGDS.
Другая дополнительная цель настоящего изобретения заключается в том, чтобы обеспечить лекарственное средство с незначительным числом побочных эффектов и высокой безопасностью, где эффективность лекарственного средства обусловлена его ингибирующим H-PGDS действием, при предотвращении и/или лечении заболеваний, опосредованных PGD2, который генерируется синтазой, или его метаболитом.
Решение задачи
Авторы настоящего изобретения провели обширное исследование соединений, проявляющих ингибирующее H-PGDS действие, и обнаружили, что новое пиперазиновое соединение, представленное формулой (I), обладает крайне высокой ингибирующей активностью в отношении H-PGDS. Авторы провели дальнейшие исследования и осуществили настоящее изобретение.
Настоящее изобретение обеспечивает пиперазиновое соединение, фармацевтическую композицию, ингибитор простагландин-D-синтазы и средство для предотвращения и/или лечения заболевания, в котором участвует простагландин D2 или его метаболит, как описано ниже.
1. Пиперазиновое соединение, представленное формулой (I),
где
R1 представляет собой C1-6 алкил;
R2 представляет собой гидрокси, C1-6 алкил, который может содержать один или более заместителей, -(C=O)-N(R3)(R4) или -(C=O)-OR5;
R3 и R4 могут быть одинаковыми или отличаться, и каждый представляет собой водород или C1-6 алкил, который может содержать один или более заместителей, или
R3 и R4, связанные через атом азота, к которому присоединены R3 и R4, могут образовывать насыщенную гетероциклическую группу;
R5 представляет собой водород или C1-6 алкил, который может содержать один или более заместителей; и
n представляет собой 1 или 2;
или его соль.
2. Пиперазиновое соединение или его соль в соответствии с пунктом 1, где
R1 представляет собой метил или этил;
R2 представляет собой гидрокси, C1-6 алкил, который может иметь одну или более насыщенных или ненасыщенных гетероциклических групп в качестве заместителей, -(C=O)-N(R3)(R4) или -(C=O)-OR5;
R3 и R4 могут быть одинаковыми или отличаться, и каждый представляет собой водород или C1-6 алкил, который может иметь одну или более насыщенных или ненасыщенных гетероциклических групп в качестве заместителей, или
R3 и R4, связанные через атом азота, к которому присоединены R3 и R4, могут образовать пирролидинил, пиперидинил, пиперазинил и морфолино;
R5 представляет собой водород, метил, этил, трет-бутил или бензил; и
n представляет собой 1 или 2.
3. Пиперазиновое соединение или его соль в соответствии с пунктом 1 или 2, где
R1 представляет собой метил;
R2 представляет собой C1-3 алкил, который может содержать морфолино, пиразолил или триазолил в качестве заместителей, -(C=O)-N(R3)(R4) или -(C=O)-OR5; и триазолил может содержать один или два заместителя;
R3 и R4, связанные через атом азота, к которому присоединены R3 и R4, могут образовывать морфолино;
R5 представляет собой водород, метил или этил; и
n представляет собой 2.
4. Пиперазиновое соединение или его соль по любому из пунктов 1-3, где
R1 представляет собой метил;
R2 представляет собой линейный C1-3 алкил, который может содержать любой из 1,2,3-триазолила, 3,5-диметил-1,2,4-триазолила и морфолино в качестве заместителя, -(C=O)-N(R3)(R4) или -(C=O)-OR5;
R3 и R4, связанные через атом азота, к которому присоединены R3 и R4, могут образовать морфолино;
R5 представляет собой водород или этил; и
n представляет собой 2.
5. Пиперазиновое соединение или его соль в соответствии с пунктом 1, выбранное из группы, состоящей из следующего:
N-(4-(4-гидроксипиперидин-1-ил)фенил)-4-((1-метилпиррол-2-ил)карбонил)-1-пиперазинкарбоксамид,
4-((((1-метилпиррол-2-ил)карбонил)-1-пиперазинил)карбонил)амино-4-фенилпиперидин-4-карбоновая кислота,
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолинометилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(3-(2-(1,2,4-триазол-1-ил)этил)пирролидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолиноэтилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-(1-метилпиррол-2-ил)карбонил)-N-(4-(4-(2-(1,2,3-триазол-1-ил)этил)пиперидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-(2-(1,2,4-триазол-1-ил)этил)пиперидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-(2-(3,5-диметил-1,2,4-триазол-1-ил)этил)пиперидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-(2-(пиразол-1-ил)этил)пиперидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-(3-(1,2,4-триазол-1-ил)пропил)пиперидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-(3-(1,2,3-триазол-1-ил)пропил)пиперидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-((1-этилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-пиперидин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-(4-метилпиперазин-1-ил-карбонил)пиперидин-1-ил)фенил)-1-пиперазинкарбоксамид,
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-(2-морфолиноэтилкарбамоил)пиперидин-1-ил)фенил)-1-пиперазинкарбоксамид и
4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-(пиридин-3-илметилкарбамоил)пиперидин-1-ил)фенил)-1-пиперазинкарбоксамид.
6. Фармацевтическая композиция, включающая эффективное количество по меньшей мере одного из соединений по пунктам 1-5 или его фармацевтически приемлемые соли и фармацевтически приемлемый носитель.
7. Ингибитор простагландин-D-синтазы, включающий эффективное количество соединения по любому из пунктов 1-5 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
8. Средство для предотвращения и/или лечения заболевания, в котором участвует простагландин D2 или его метаболит, где средство включает эффективное количество соединения по любому из пунктов 1-5 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
9. Средство в соответствии с пунктом 8, где заболевание, в котором участвует простагландин D2 или его метаболит, является аллергическим заболеванием, воспалительным заболеванием или миодегенеративным заболеванием.
10. Способ предотвращения и/или лечения заболевания, в котором участвует простагландин D2 или его метаболит, где способ включает введение млекопитающему соединения по любому из пунктов 1-5 в количестве, эффективном для предотвращения или лечения заболевания.
11. Применение соединения по любому из пунктов 1-5 для получения средства для предотвращения и/или лечения заболевания, в котором участвуют простагландин D2 или его метаболит.
12. Соединение по любому из пунктов 1-5 для применения в способе предотвращения и/или лечения заболевания, в котором участвуют простагландин D2 или его метаболит.
Полезные эффекты изобретения
Настоящее изобретение обеспечивает новое пиперазиновое соединение, представленное вышеприведенной формулой (I), или его соль, которое является ингибитором простагландин-D-синтазы и, в частности, ингибитором H-PGDS.
Пиперазиновое соединение или его соль в соответствии с настоящим изобретением проявляет превосходную активность в отношении ингибирования H-PGDS in vitro. Кроме того, поскольку у морских свинок с антиген-индуцированным ринитом наблюдали ингибирующую H-PGDS активность на промывную жидкость из полости носа и ингибирующую эозинофильную инфильтрацию активность, было показано, что пиперазиновое соединение или его соль обладают превосходной активностью в отношении улучшения состояний заложенности носа и ингибирующей эозинофильное воспаление активностью. Кроме того, в исследованиях на силу захвата передней части конечностей мышей mdx было показано значительное улучшение при потере мышечной силы, что демонстрирует, что пиперазиновое соединение или его соль по настоящему изобретению могут применяться для лечения миодегенеративного заболевания, такого как мышечная дистрофия.
Таким образом, поскольку пиперазиновое соединение или его соль по настоящему изобретению проявляет превосходную ингибирующую H-PGDS активность, оно может применяться в качестве средства для предотвращения и/или лечения заболевания, в котором участвуют PGD2 или его метаболит, такого как аллергическое заболевание, воспалительное заболевание и миодегенеративное заболевание, и предполагаются также и другие области применения.
Описание вариантов осуществления
Пиперазиновое соединение, представленное формулой (I),
,
где
R1 представляет собой C1-6 алкил;
R2 представляет собой гидрокси, C1-6 алкил, который может содержать один или более заместителей, -(C=O)-N(R3)(R4) или -(C=O)-OR5;
R3 и R4 могут быть одинаковыми или отличаться, и каждый представляет собой водород или C1-6 алкил, который может содержать один или более заместителей, или
R3 и R4, связанные через атом азота, к которому присоединены R3 и R4, могут образовывать насыщенную гетероциклическую группу;
R5 представляет собой водород или C1-6 алкил, который может содержать один или более заместителей; и
n представляет собой 1 или 2;
или его соль.
Пиперазиновое соединение по настоящему изобретению, которое представлено формулой (I), представляет собой соединение с (N-алкилпиррол-2-ил)карбонилом и фениламинокарбонилом, которое является новым соединением и конкретно не раскрывается в вышеуказанных ссылках.
Например, в источнике Патентной Литературы 3 (WO2008/122787) раскрывается широкий ряд пиперазиновых соединений, ингибирующих H-PGDS; однако полностью умалчивается о пиперазиновом соединении с (N-алкилпиррол-2-ил)карбонилом, который содержится в соединении по настоящему изобретению. Дополнительно, как показано в контрольных примерах, описанных ниже, соединения, продемонстрированные в примерах (Справочные примеры 13-8) источника Патентной Литературы 3, не проявляют ингибирующего PGD2 действия на промывную жидкость из полости носа у морских свинок с антиген-индуцированным ринитом.
Источник Патентной Литературы 4 (WO2007/054623) раскрывает ингибирующее hedgehog сигнальный путь пиперазиновое соединение, имеющее фурилкарбонильную пиперазиновую структуру; однако, в отличие от источника Патентной Литературы 4, настоящее изобретение заключается в том, что (N-алкилпиррол-2-ил)карбонил, содержащийся в соединении по настоящему изобретению, ограничен фурилкарбонилом. Кроме того, источник Патентной Литературы 4 полностью умалчивает об ингибирующей H-PGDS активности.
Источник Патентной Литературы 5 (WO99/007672) раскрывает фурилкарбонильное пиперазиновое соединение, бензоилпиперазиновое соединение и т.д. в качестве соединения, которое взаимодействует с калиевыми каналами. Однако в источнике патентной литературе 5 не раскрывается соединение, содержащее (N-алкилпиррол-2-ил)карбонил, как в настоящем соединении, и полностью умалчивается об ингибирующей H-PGDS активности.
Источник Патентной Литературы 6 (WO2008/023720) раскрывает соединение мочевины, содержащее пиперидиновое кольцо, в качестве соединения для лечения заболевания, ассоциируемого с гидролазой амидов жирных кислот. Однако источник Патентной Литературы 6 не раскрывает соединение, содержащее (N-алкилпиррол-2-ил)карбонил, как в настоящем соединении, и полностью умалчивает об ингибирующей H-PGDS активности.
Как показано в контрольных примерах ниже, пиперазиновое соединение, не содержащее (N-алкилпиррол-2-ил)карбонил, практически не проявляет ингибирующего H-PGDS действия.
Примеры «заместителей» в настоящем описании включают галоген, гидрокси, циано, нитро, алкил, галогеналкил, циклоалкил, циклоалкилалкил, аралкил, алкенил, алкинил, алкокси, галогеналкокси, циклоалкокси, циклоалкилалкокси, аралкилокси, алкилтио, циклоалкилалкилтио, амино, моно- или диалкиламино, циклоалкилалкиламино, ацил, ацилокси, оксо, карбокси, алкоксикарбонил, аралкилоксикарбонил, карбамоил, насыщенные или ненасыщенные гетероциклические группы, ароматический углеводород, насыщенную гетероциклоксигруппу и т.д. Если такие заместители присутствуют, то их количество, как правило, составляет от 1 до 3.
В заместителях примеры галогена включают хлор, бром, фтор и йод.
В заместителях алкил или галогеналкил представляют собой предпочтительно линейную или разветвленную C1-6 алкильную группу или группу, в которой от одного до всех водородных атомов алкильной группы замещены галогеном, описанным выше. Примеры включают алкильные группы, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил и гексил, и галогеналкильные группы, такие как трифторметил.
В заместителях циклоалкил представляет собой предпочтительно C3-7 циклоалкильную группу, и его примеры включают циклопропил, циклобутил, циклофенил, циклогексил и циклофенил.
В заместителях циклоалкилалкил представляет собой предпочтительно C1-6 алкильную группу, замещенную C3-7 циклоалкилом, и его примеры включают циклопропилметил, циклопропилэтил, циклобутилметил, циклопентилметил и циклогексилметил.
В заместителях аралкил представляет собой предпочтительно линейную или разветвленную C1-6 алкильную группу, замещенную C6-14 ароматической углеводородной группой, и его примеры включают бензил, фенилэтил, фенилпропил, нафтилметил и нафтилэтил.
В заместителях алкенил представляет собой предпочтительно C2-6 алкенильную группу, содержащую двойную углерод-углеродную связь, и его примеры включают винил, аллил, метилвинил, пропенил, бутенил, пентенил и гексенил.
В заместителях алкинил представляет собой предпочтительно C2-6 алкинильную группу, содержащую тройную углерод-углеродную связь, и его примеры включают этинил и пропаргил.
В заместителях алкокси или галогеналкокси представляет собой предпочтительно линейную или разветвленную C1-6 алкокси группу или алкокси группу, замещенную галогеном, описанным выше, и его примеры включают метокси, этокси, н-пропокси, изопропокси, 1-метилпропокси, н-бутокси, изобутокси, трет-бутокси, 2-метилбутокси, неопентилокси, пентан-2-илокси, фторметокси, дифторметокси, трифторметокси, 1,1-дифторэтокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, 1,1,2,2-тетрафторэтокси, перфторэтокси, 3-фтор-2-(фторметил)пропокси, 1,3-дифторпропан-2-илокси и 2,2,3,3,3-пентафтор-1-пропокси.
В заместителях циклоалкокси представляет собой предпочтительно C3-7 циклоалкокси группу, и его примеры включают циклопропокси, циклобутокси, циклопентилокси, циклогексилокси и циклогептилокси.
В заместителях циклоалкилалкокси представляет собой предпочтительно C1-6 алкокси группу, замещенную C3-7 циклоалкилом, и его примеры включают циклопропилметокси, циклопропилэтокси, циклобутилметокси, циклопентилметокси и циклогексилметокси.
В заместителях алкилтио представляет собой предпочтительно линейную или разветвленную C1-6 алкилтио группу, и его примеры включают метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, пентилтио и гексилтио.
В заместителях циклоалкилалкилтио представляет собой предпочтительно C1-6 алкилтио группу, замещенную C3-7 циклоалкилом, и его примеры включают циклопропилметилтио, циклопропилэтилтио, циклобутилметилтио, циклопентилметилтио и циклогексилметилтио.
В заместителях аралкилокси представляет собой предпочтительно окси группу с вышеупомянутой аралкил группой, и их примеры включают бензилокси, фенэтилокси, фенилпропилокси, нафтилметилокси и нафтилэтилокси.
В заместителях моно- или диалкиламино представляют собой моно- или диаминогруппы, замещенные линейной или разветвленной C1-6 алкильной группой, и его примеры включают метиламино, диметиламино, этиламино, диэтиламино и метилэтиламино.
В заместителях циклоалкилалкиламино представляет собой алкиламино группу, замещенную вышеупомянутой циклоалкильной группой, и его примеры включают циклопропилметиламино, циклобутилметиламино и циклопентилметиламино.
В заместителях ацил представляет собой линейную или разветвленную C1-6 ацильную группу или бензоильную группу, и его примеры включают формил, ацетил, пропионил, н-бутирил, изобутирил, валерил, изовалерил и пивалоил.
В заместителях ацилокси представляет собой линейную или разветвленную C1-6 ацилокси группу или бензоилокси группу, и его примеры включают формилокси, ацетокси, пропионилокси, н-бутирилокси, изобутирилокси, валерилокси, изовалерилокси и пивалоилокси.
В заместителях алкоксикарбонил представляет собой карбонильную группу, замещенную вышеупомянутой алкокси группой, и его примеры включают метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, 1-метилпропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, трет-бутоксикарбонил, 2-метилбутоксикарбонил, неопентилоксикарбонил и пентан-2-илоксикарбонил.
В заместителях аралкилоксикарбонил представляет собой предпочтительно карбонильную группу, замещенную вышеупомянутой аралкилокси группой, и его примеры включают бензилоксикарбонил, фенэтилоксикарбонил, фенилпропилоксикарбонил, нафтилметилоксикарбонил и нафтилэтилоксикарбонил.
В заместителях примеры карбамоила включают -CONH2, (моно- или диалкил)карбамоил, (моно- или диарил)карбамоил, (N-алкил-N-арил)карбамоил, пирролидинокарбамоил, пиперидинокарбамоил, пиперазинокарбамоил и морфолинокарбамоил.
В заместителях насыщенные или ненасыщенные гетероциклические группы представляют собой предпочтительно моноциклические или бициклические насыщенные или ненасыщенные гетероциклические группы, которые могут содержать любой из следующего: кислород, азот или сера, предпочтительно в количестве от 1 до 4. Их примеры включают пирролидинил, пиперидинил, пиперазинил, гексаметиленимино, морфолино, тиоморфолино, гомопиперазинил, тетрагидрофуранил, тетрагидропиранил, имидазолил, тиенил, фурил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, триазолил, тетразолил, пиридил, пиразил, пиримидинил, пиридазинил, индолил, изоиндолил, индазолил, метилендиоксифенил, этилендиоксифенил, бензофуранил, дигидробензофуранил, бензоимидазолил, бензоксазолил, бензотиазолил, пуринил, хинолил, изохинолил, хиназолил и хиноксалил.
В заместителях ароматический углеводород представляет собой предпочтительно C6-14 ароматическую углеводородную группу, и его примеры включают фенил и нафтил.
В заместителях насыщенная гетероциклокси группа представляет собой моноциклическую насыщенную гетероциклическую группу, содержащую любое из следующего: кислород, азот и сера, в количестве одного или двух, и его примеры включают окси группы, содержащие пирролидинил, пиперидинил, пиперазинил, гексаметиленимино, морфолино, тиоморфолино или гомопиперазинил, такие как тетрагидрофуранилокси и тетрагидропиранилокси.
"C1-6 алкил", представленный как R1 в формуле (I), представляет собой линейную или разветвленную C1-6 алкильную группу, и его примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил и н-гексил. Из них метил и этил являются предпочтительными, а метил более предпочтителен.
Примеры «C1-6 алкила, которые могут иметь один или более заместителей» из «Ci-6 алкила», представленные как R2 в формуле (I), включают C1-6 алкил, представленный как R1 в формуле (I). Из них C1-3 алкил является предпочтительным, a C1-3 алкил, такой как метил, этил и н-пропил, более предпочтителен.
Примеры «заместителей» «C1-6 алкила, которые могут иметь один или более заместителей», представленных R2, включают вышеупомянутые заместители. Гидрокси и насыщенные или ненасыщенные гетероциклические группы являются предпочтительными; морфолино, пиразолил и триазолил более предпочтительны; и морфолино, 1,2,3-триазолил и 1,2,4-триазолил особенно предпочтительны. Ненасыщенные гетероциклические группы могут содержать заместители. Предпочтительным заместителем является метил, а количество заместителей составляет 1 или 2. Предпочтительные примеры «C1-6 алкила, которые могут содержать один или более заместителей», представленного R2, включают морфолино, 1,2,3-триазолил и 3,5-диметил-1,2,4-триазолил.
Примеры «С1-6 алкила» из «C1-6 алкила, который может содержать один или более заместителей», представленного как R3 и R4 в формуле (I), включают C1-6, алкил, представленный как R1 в формуле (I). Из них С1-3 алкил является предпочтительным.
Примеры «заместителей» «C1-6 алкила, который может содержать один или более заместителей», представленного как R3 и R4, включают вышеупомянутые заместители. Из них насыщенные или ненасыщенные гетероциклические группы являются предпочтительными.
Примеры «насыщенных гетероциклических групп», которые могут быть образованы из R3 и R4 в формуле (I) и атома азота, к которому присоединены R3 и R4, включают пирролидинил, пиперидинил, пиперазинил и морфолино, и морфолино является предпочтительным.
Предпочтительные примеры «C1-6 алкила, которые могут иметь один или более заместителей», представленного как R5 в формуле (I), включают метил, этил, трет-бутил и бензил.
В формуле (I) n представляет собой 1 или 2, и предпочтительно составляет 2.
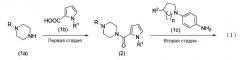
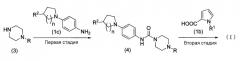
Пиперазиновое соединение по настоящему изобретению может быть получено в соответствии с нижеприведенными схемами реакции от 1 до 5.
Схема реакции 1
В приведенной выше схеме реакции 1 R1 и R2 являются такими, как указано выше, R представляет собой защитную группу аминогруппы или водорода, и n представляет собой 1 или 2.
Способ по настоящему изобретению включает первую стадию, в которой пиперазиновое соединение, представленное формулой (1a), или его соль конденсируется с соединением пирролкарбоновой кислоты, представленным формулой (1b), или его активным производным обычным методом с образованием амидного соединения, представленного формулой (2), и вторую стадию, в которой соединение амина, полученное путем удаления защитной группы аминогруппы, или его соль конденсируется с соединением амина, представленным формулой (1c), или его активным производным обычным методом с образованием соединения, представленного формулой (I).
Первая стадия
На первой стадии пиперазиновое соединение, представленное формулой (1a), или его соль конденсируется с соединением пирролкарбоновой кислоты, представленным формулой (1b), или его активным производным обычным методом, таким образом, получая соединение амида, представленное формулой (2).
Примеры активных производных соединения (1b) включают активные сложные эфиры, например обычные сложные эфиры, такие как метиловые сложные эфиры; галоидангидриды, такие как хлорангидриды; и Н-гидроксибензотриазол; и симметричные ангидриды кислот; и смеси ангидридов кислот с алкилкарбоновыми кислотами.
Если соединение (1b) вступает в реакцию со свободной кислотой или если активный сложный эфир или галогенангидрид вступают в реакцию без выделения, то могут быть использованы конденсирующие агенты, такие как 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид.
Если на 1 моль пиперазинового соединения, представленного формулой (1a), или его соли используется от 0,5 до 10 моль, и предпочтительно от 0,8 до 2 моль, соединения карбоновой кислоты, представленного формулой (1b), или его активного производного, то количество конденсирующего агента составляет от 0,5 до 20 моль, и предпочтительно от 0,8 до 3 моль на 1 моль пиперазинового соединения, представленного формулой (1a), или его соли.
Хотя в зависимости от используемых активных производных или конденсирующего агента реакцию обычно проводят в растворителе, который является неактивным в реакции при от -20 до 150°C, и предпочтительно от 0 до 100°C. Примеры такого растворителя включают галогенированый углеводород, такой как дихлорметан и хлороформ; ароматический углеводород, такой как толуол; простой эфир, такой как тетрагидрофуран; сложный эфир, такой как этилацетат; спирт, такой как метанол и этанол; воду; ацетонитрил; N,N-диметилформамид; N,N-диметилацетамид; диметилсульфоксид и пиридин.
Реакция может проходить спокойно, если ее проводить в присутствии приблизительно от 0,5 до 20 моль, и предпочтительно от 0,8 до 5 моль, основания, такого как триэтиламин, диизопропилэтиламин, N-метилморфолин, N,N-диэтиланилин, 4-(N,N-диметиламино)пиридин и пиридин, на 1 моль пиперазинового соединения, представленного формулой (1a), или его соли.
Вторая стадия
На второй стадии защитную группу R аминогруппы в соединении амида, представленного формулой (2), удаляют обычным известным методом, и полученное соединение и соединение амина, представленное формулой (1c), или его активное производное конденсируются обычным методом, образуя соединение, представленное формулой (I).
Удаление защитной группы может быть выполнено в кислой среде, если защитная группа R представляет собой формил или трет-бутоксикарбонил, и удаление защитной группы может быть выполнено каталитическим восстановительным методом, если защитная группа R представляет собой бензил или бензилоксикарбонил.
Для конденсации предпочтительно использовать активные производные c отщепляющимися группами, полученными в результате реакции соединения амина, представленного формулой (1c), с трифосгеном, 1,1'-карбонилдиимидазолом (CDI), фенилхлорформиатом, 4-нитрофенилхлорформиатом, этилхлорформиатом или т.п., в неактивном в реакции растворителе, таком как дихлорметан, тетрагидрофуран, ацетонитрил, этилацетат или N,N-диметилацетамид, при от -20 до 150°C, и предпочтительно от 0 до 100°C, в присутствии органического основания, такого как триэтиламин или пиридин, или без него.
Активные производные формулы (1c) могут содержать группу отщепления. Активные производные могут быть использованы в реакции после выделения или могут быть приготовлены в реакционной системе и использованы без выделения. Примеры групп отщепления включают хлор, имидазолил, фенокси, 4-нитрофенокси и этокси.
Примеры солей соединения амина, представленного формулой (2), включают кислотно-аддитивные соли с неорганическими кислотами, такими как соляная кислота, бромоводородная кислота и серная кислота, или с органическими кислотами, такими как угольная кислота и метансульфоновая кислота.
Если на 1 моль соединения амина, представленного формулой (1c), или его активного производного используют от 0,5 до 10 моль, и предпочтительно от 0,8 до 2 моль, соединения амина, представленного формулой (3), или его соли, то количество конденсирующего агента составляет от 0,5 до 20 моль, и предпочтительно от 0,8 до 3 моль, на 1 моль соединения амина, представленного формулой (1c), или его соли.
Хотя в зависимости от используемых активных производных или конденсирующего агента, реакцию обычно проводят в растворителе, который является неактивным в реакции при от -20 до 150°C, и предпочтительно от 0 до 100°C. Примеры такого растворителя включают галогенированый углеводород, такой как дихлорметан и хлороформ; ароматический углеводород, такой как толуол; простой эфир, такой как тетрагидрофуран; сложный эфир, такой как этилацетат; спирт, такой как метанол и этанол; воду; ацетонитрил; N,N-диметилформамид; N,N-диметилацетамид; диметилсульфоксид и пиридин.
Реакция может проходить спокойно, если ее проводить в присутствии приблизительно от 0,5 до 20 моль, и предпочтительно от 0,8 до 5 моль, основания, такого как триэтиламин, диизопропилэтиламин, N-метилморфолин, N,N-диэтиланилин, 4-(N,N-диметиламино)пиридин и пиридин, на 1 моль пиперазинового соединения, представленного формулой (1с), или его активного производного.
Соединение (I) по настоящему изобретению может быть получено при выполнении первой стадии и второй стадии.
Пиперазиновое соединение, представленное формулой (1a), или его соль, соединение пирролкарбоновой кислоты, представленное формулой (1b), или его активное производное и соединение амина, представленное формулой (1c), или его соль известны в данной области или могут быть получены известными в данной области методами.
Схема реакции 2
В приведенной схеме реакции 2 R1 и R2 определены выше, R представляет собой защитную группу аминогруппы или водорода, и n представляет собой 1 или 2.
Способ по настоящему изобретению включает первую стадию, на которой пиперазиновое соединение, представленное формулой (3), или его соль конденсируется обычным методом с соединением амина, представленным формулой (1c), или его активным производным, образуя соединение мочевины, представленное формулой (4), и вторую стадию, на которой соединение амина, полученное удалением защитной группы аминогруппы, или его соль конденсируется обычным методом с соединением пирролкарбоновой кислоты, представленным формулой (1b), или его активным производным, получая соединение, представленное формулой (I).
Первая стадия
На первой стадии пиперазиновое соединение, представленное формулой (3), и его соль конденсируется с соединением амина, представленным формулой (1c), в соответствии с обычным методом, как в реакции конденсации, выполненной на второй стадии схемы реакции 1, таким образом, получая соединение мочевины, представленное формулой (4).
Вторая стадия
На второй стадии защитная группа R аминогруппы в соединении мочевины, представленном формулой (4), удаляется, как в реакции удаления защитной группы, выполняемой на второй стадии схемы реакции 1, и затем соединение пирролкарбоновой кислоты, представленное формулой (1b), или его активное производное конденсируется обычным методом, как на первой стадии схемы реакции 1, таким образом, получая соединение, представленное формулой (I).
Схема реакции 3
В приведенной схеме реакции 3 каждый из X1, X2 и X3 представляет собой функциональную группу отщепления, Z1 представляет собой нитрогруппу или защитную аминогруппу, а R6 и R7 является такими, как «заместители» в «C1-6 алкильной группе, которая может содержать один или более заместителей», представленных R2. R6 и R7, в частности, представляет собой замещенные или незамещенные гетероциклические группы, m представляет собой от 0 до 3, и n представляет собой 1 или 2.
Способ получения, показанный на схеме реакции 3, является таким же, как и для соединения амина (1c) в схемах реакции 1 и 2. Способ включает следующие четыре стадии:
первая стадия, на которой аминосодержащее соединение, представленное формулой (3b), вступает в реакцию с отщеплением функциональной группы с соединением, содержащим X1, представленным формулой (3a), с образованием гидроксисодержаще