Твердые формы
Иллюстрации
Показать всеИзобретение относится к кристаллическим формам 4-[9-(тетрагидрофуран-3-ил)-8-(2,4,6-трифторфениламино)-9Н-пурин-2-иламино]циклогексан-1-ола, соответствующим формуле (I), которые обладают свойствами ингибирования киназной активности, и могут быть использованы для лечения или профилактики: (а) рака; (b) воспалительного состояния или (с) иммунологического состояния.
В частности изобретение относится к кристаллической форме А, которая имеет картину порошковой рентгеновской дифракции, содержащую пики примерно при 12,4, 16,0 и 18,5°2θ и дополнительно содержащую пики примерно при 17,7, 23,2 и 24,1°2θ; гидратной кристаллической форме А, которая имеет картину порошковой рентгеновской дифракции, содержащую пики примерно при 6,5, 13,0 и 23,0°2θ и дополнительно содержащую пики примерно при 13,4, 20,1 и 23,8°2θ; кристаллической форме гидрохлоридной соли А, которая имеет картину порошковой рентгеновской дифракции, содержащую пики примерно при 17,3, 18,7 и 22,4°2θ, и содержит примерно два мольных эквивалента ионов хлорида. Изобретение также относится к способам получения кристаллической формы А, фармацевтической композиции, содержащей указанные кристаллические формы и способу лечения. 8 н. и 7 з.п. ф-лы, 16 ил., 9 пр.
Реферат
Настоящая заявка испрашивает приоритет предварительной заявки 60/854757, поданной 27 октября 2006 года, содержание которой включено в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В заявке представлены твердые формы, содержащие 4-[9-(тетрагидрофуран-3-ил)-8-(2,4,6-трифторфениламино)-9Н-пурин-2-иламино]циклогексан-1-ол, композиции, содержащие твердые формы, способы получения твердых форм и способы их применения для лечения различных заболеваний и/или расстройств.
УРОВЕНЬ ТЕХНИКИ
Идентификация и подбор твердой формы фармацевтического соединения является сложной задачей, в связи с тем, что изменение в твердой форме может сказываться на целом ряде физических и химических свойств, что может давать преимущества или препятствия в обработке, технологии приготовления лекарственного средства, стабильности и биологической доступности, наряду с другими важными фармацевтическими характеристиками. Возможные фармацевтические твердые вещества включают в себя кристаллические твердые вещества и аморфные твердые вещества. Аморфные твердые вещества характеризуются отсутствием протяженной структурной упорядоченности, в то время как кристаллические твердые вещества характеризуются структурной периодичностью. Требуемый класс фармацевтического твердого вещества зависит от конкретного применения; аморфные твердые вещества иногда выбирают, исходя из, например, повышенного профиля растворения, в то время как кристаллические твердые вещества могут быть необходимы для таких свойств, как, например, физическая или химическая стабильность (смотрите, например, S.R. Vippagunta et al., Adv. Drug. Deliv. Rev., 2001, 48:3-26; L. Yu, Adv. Drug. Deliv. Rev., 2001, 48:27-42).
Кристаллические или аморфные, возможные твердые формы фармацевтического соединения включают в себя однокомпонентные или многокомпонентные твердые вещества. Однокомпонентные твердые вещества состоят по существу из фармацевтического соединения при отсутствии других соединений. Различие среди однокомпонентных кристаллических материалов может являться результатом явления полиморфизма, при котором для конкретного фармацевтического соединения существует несколько пространственных кристаллических структур (смотрите, например, S.R. Byrn et al, Solid State Chemistry of Drugs, 1999, SSCI, West Lafayette). Важность выявления полиморфизма была недооценена в случае Ритонавира (Ritonavir), ингибитора ВИЧ-протеазы, который был составлен в виде мягких желатиновых капсул. Приблизительно через два года после того, как было запущено производство продукта, непредвиденное выпадение осадка новой, менее растворимой полиморфной модификации в композиции повлекло за собой изъятие продукта из продажи до тех пор, пока не была разработана более подходящая композиция (смотрите S.R. Chemburkar et al, Org. Process Res. Dev., 2000, 4:413-417).
Дополнительное различие среди возможных твердых форм фармацевтического соединения может возникать из-за возможности многокомпонентных твердых веществ. Кристаллические твердые вещества, содержащие два или несколько типов ионов, называют солями (смотрите, например, Handbook of Pharmaceutical Salts: Properties, Selection и Use, P.H. Stahl и C.G. Wermuth, Eds., 2002, Wiley, Weinheim). Дополнительные типы многокомпонентных твердых веществ, которые потенциально могут обеспечить улучшение других свойств фармацевтического соединения или его соли, включают в себя, среди прочего, гидраты, сольваты, сокристаллы и клатраты (смотрите, например, S.R. Byrn et al. Solid State Chemistry of Drugs, 1999, SSCI, West Lafayette). Кроме того, многокомпонентные кристаллические формы могут потенциально быть подвержены полиморфизму, при котором указанная многокомпонентная композиция может существовать в виде более чем одной пространственной кристаллической структуры. Обнаружение твердых форм имеет большое значение при разработке безопасного, эффективного, стабильного и пригодного для продажи фармацевтического соединения.
Соединение с химическим названием 4-[9-(тетрагидрофуран-3-ил)-8-(2,4,6-трифторфениламино)-9Н-пурин-2-иламино]циклогексан-1-ол раскрыто в заявке на патент США № 11/332617, поданной 12 января 2006 года, и международной публикации WO 2006/076595, содержание каждой из которых включено в настоящее описание посредством ссылки. Заявители раскрыли несколько твердых форм 4-[9-(тетрагидрофуран-3-ил)-8-(2,4,6-трифторфениламино)-9Н-пурин-2-иламино]циклогексан-1-ола ("соединение I") и обнаружили, что не все твердые формы соединения I являются в равной степени пригодными, что определяется их физическими и химическими свойствами. Таким образом, определенные примеры осуществления изобретения в настоящем описании направлены на необходимость улучшения качества твердых форм соединения I в отношении, например, чистоты, стабильности, процесса изготовления, эффективности и биологической доступности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В заявке представлены твердые формы, содержащие 4-[9-(тетрагидрофуран-3-ил)-8-(2,4,6-трифторфениламино)-9Н-пурин-2-иламино]циклогексан-1-ол ("соединение I"), имеющие определенную полезность для лечения, профилактики или регулирования состояний или расстройств, включая, но без ограничения, рак, сердечнососудистое заболевание, заболевание почек, аутоиммунное патологическое состояние, воспалительное состояние, дегенерацию желтого пятна, ишемию/реперфузионное повреждение, боль и связанные с ней синдромы, связанное с заболеванием истощение, вызванное асбестом состояние, легочную гипертензию, повреждение/нарушение центральной нервной системы (ЦНС) или состояния, поддающиеся лечению или профилактики путем ингибирования киназного каскада.
В определенных примерах осуществления изобретения твердые формы представляют собой однокомпонентные кристаллические формы свободного основания соединения I. В других примерах осуществления изобретения твердые формы представляют собой многокомпонентные кристаллические формы, включая, но без ограничения, соли, сокристаллы, сольваты, гидраты и/или клатраты соединения I. В других примерах осуществления изобретения твердые формы представляют собой однокомпонентные аморфные формы свободного основания соединения I. В других примерах осуществления изобретения твердые формы представляют собой многокомпонентные аморфные формы, включая, но без ограничения, соли соединения I. Без намерения быть ограниченными какой-либо конкретной теорией, полагают, что устойчивость при хранении, прессуемость, насыпная плотность или растворимость - свойства твердых форм, которые являются полезными для производства, лекарственных форм и биологической доступности соединения I. В настоящем описании также представлены фармацевтические композиции, содержащие твердые формы, и способы их применения для лечения, профилактики или регулирования состояний или расстройств, включая, но без ограничения, рак, сердечнососудистое заболевание, заболевание почек, аутоиммунное патологическое состояние, воспалительное состояние, дегенерацию желтого пятна, ишемию/реперфузионное повреждение, боль и связанные с ней синдромы, связанное с заболеванием истощение, вызванное асбестом состояние, легочную гипертензию, повреждение/нарушение центральной нервной системы (ЦНС) или состояния, поддающиеся лечению или профилактики путем ингибирования киназного каскада.
Твердые формы образуются из соединения I, которое описано в заявке на патент США № 11/332617, поданной 12 января 2006 года, и международной публикации WO 2006/076595, содержание каждой из которых включено в настоящее описание посредством ссылки.
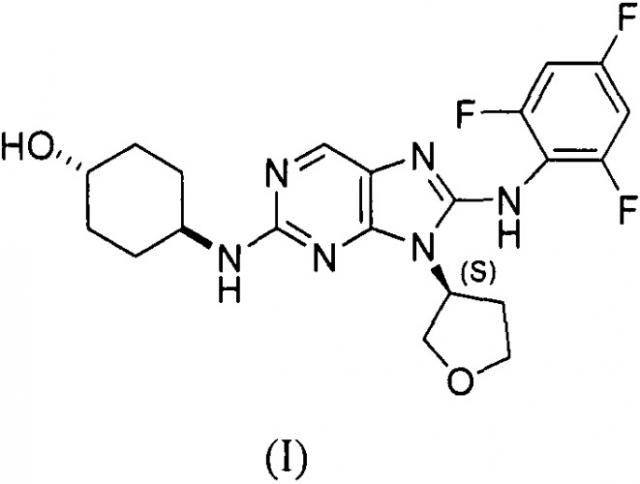
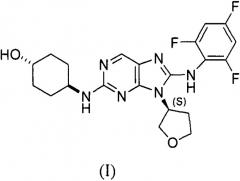
Соединение I имеет следующую структуру (I):
В настоящем описании также представлены фармацевтические композиции, содержащие однокомпонентную кристаллическую форму, многокомпонентную кристаллическую форму, однокомпонентную аморфную форму и/или многокомпонентную аморфную форму соединения I и фармацевтически приемлемый разбавитель, наполнитель или носитель.
В заявке также представлены способы лечения, профилактики или регулирования состояний или расстройств, включая, но без ограничения, рак, сердечнососудистое заболевание, заболевание почек, аутоиммунное патологическое состояние, воспалительное состояние, дегенерацию желтого пятна, ишемию/реперфузионное повреждение, боль и связанные с ней синдромы, связанное с заболеванием истощение, вызванное асбестом состояние, легочную гипертензию, повреждение/нарушение центральной нервной системы (ЦНС) или состояния, поддающиеся лечению или профилактики путем ингибирования киназного каскада, где такие способы предусматривают введение субъекту, например человеку, нуждающемуся в таком лечении, профилактики или регулирования, терапевтически и профилактически эффективного количества обеспеченной в настоящем описании твердой формы.
Дополнительные примеры осуществления изобретения в настоящем описании представляют способы получения, выделения и/или характеризации твердых форм по изобретению.
Представленные в настоящем описании определенные твердые формы являются полезными в качестве активных фармацевтических компонентов для получения препаратов для применения у животных или людей. Таким образом, определенные представленные в настоящем описании примеры осуществления охватывают применение данных твердых форм в качестве готового фармацевтического продукта. Определенные представленные в настоящем описании твердые формы и готовые фармацевтические продукты являются полезными, например, для лечения, профилактики или регулирования состояний или расстройств, перечисленных выше.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
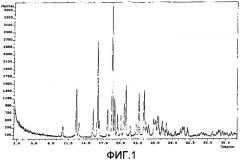
На фиг.1 представлена характерная картина порошковой рентгеновской дифракции (XRPD) формы А свободного основания соединения I.
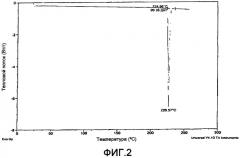
На фиг.2 представлена характерная термограмма дифференциальной сканирующей калориметрии (DSC, ДСК) формы А свободного основания соединения I.
На фиг.3 представлена характерная термограмма термогравиметрического анализа (TGA, ТГА) формы А свободного основания соединения I.
На фиг.4 представлена характерная картина XRPD кристаллической формы гидрата свободного основания соединения I.
На фиг.5 представлена характерная термограмма ДСК кристаллической формы гидрата свободного основания соединения I.
На фиг.6 представлена характерная термограмма ТГА кристаллической формы гидрата свободного основания соединения I.
На фиг.7 и фиг.8 представлены характерные картины XRPD формы A гидрохлоридной соли соединения I.
На фиг.9 представлена характерная термограмма ДСК формы A гидрохлоридной соли соединения I.
На фиг.10 представлена характерная термограмма ТГА формы A гидрохлоридной соли соединения I.
На фиг.11 представлена характерная картина XRPD формы A гидробромидной соли соединения I.
На фиг.12 представлена характерная картина XRPD формы A сульфатной соли соединения I.
На фиг.13 представлена иллюстративная схема реакций синтеза соединения I.
На фиг.14 представлены химические структуры соединений, которые, в некоторых примерах осуществления, могут быть представлены в композициях, содержащих соединение I.
На фиг.15 представлена иллюстративная схема реакций синтеза соединения I.
На фиг.16 представлена иллюстративная схема реакций синтеза соединения I.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
Используемый в настоящем описании термин "соединение I" означает соединение, которое имеет химическое название 4-[9-(тетрагидрофуран-3-ил)-8-(2,4,6-трифторфениламино)-9Н-пурин-2-иламино]циклогексан-1-ол, и включает в себя форму свободного основания и его ионизированные формы, которые претерпели образование соли, так что молекула является протонированной по одному или нескольким основным центрам. Термин "соединение I" также включает в себя твердые формы описанного в настоящем описании 4-[9-(тетрагидрофуран-3-ил)-8-(2,4,6-трифторфениламино)-9Н-пурин-2-иламино]циклогексан-1-ола.
Конкретные соли, описанные ниже, включают в себя "гидрохлоридные соли" или "HCl-соли" соединения I. Гидрохлоридная соль или HCl-соль соединения I является солью присоединения кислоты, которая может быть получена путем взаимодействия соединения I с хлористоводородной кислотой.
"Дигидрохлоридная соль" или "диHCl-соль" соединения I является солью, которая содержит приблизительно два мольных эквивалента хлористоводородной кислоты на моль соединения I.
Конкретные соли, описанные ниже, включают в себя "гидробромидные соли" или "HBr-соли" соединения I. Гидробромидная соль или HBr-соль соединения I является солью присоединения кислоты, которая может быть получена путем взаимодействия соединения I с бромистоводородной кислотой.
Конкретные соли, описанные ниже, включают в себя "сульфатные соли" соединения I. Сульфатная соль соединения I представляет собой соль присоединения кислоты, которая может быть получена путем взаимодействия соединения I с серной кислотой.
Используемый в настоящем описании термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых кислот, включая неорганические кислоты и органические кислоты. Подходящие кислоты включают в себя, но без ограничения этим, уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, угольную, лимонную, дигидрофосфорную, этансульфоновую, фумаровую, галактуроновую, глюконовую, глюкуроновую, глутаминовую, бромистоводородную, хлористоводородную, йодистоводородную, изомасляную, изэтионовую, молочную, малеиновую, яблочную, малоновую, миндальную, метансульфоновую, моногидроугольную, моногидрофосфорную, моногидросерную, муциновую, азотную, памовую, пантотеновую, фосфорную, фталевую, пропионовую, пробковую, янтарную, серную, винную, толуолсульфоновую, включая п-толуолсульфоновую, м-толуолсульфоновую и о-толуолсульфоновую кислоты, и тому подобные (смотрите, например, S.M. Berge et al, J. Pharm. ScL, 66: 1-19, 1977; и «Handbook of Pharmaceutical Salts: Properties, Selection и Use», P.H. Stahl и C. G. Wermuth, Eds., 2002, Wiley, Weinheim). Также охватываются соли других соединений, которые обладают кислотными свойствами, включая аминокислоты, такие как аспарагиновая кислота и тому подобное, и другие соединения, такие как аспирин, ибупрофен, сахарин и тому подобное. Соли присоединения кислоты могут быть получены путем взаимодействия нейтральной формы таких соединений с достаточным количеством желаемой кислоты, в чистом виде или в подходящем растворителе. В виде твердых веществ соли могут существовать в кристаллических или аморфных модификациях.
Термины "твердая форма", "твердые формы" и родственные термины, когда используются в настоящем описании в отношении соединения I, относятся к физической форме, содержащей соединение I, которая преимущественно не является жидким или газообразным состоянием. Примерами твердых форм являются кристаллические формы или аморфные формы.
Термин "кристаллический" и родственные термины, используемые в настоящем описании, когда используется для описания вещества, компонента продукта или формы, означает, что субстанция, компонент или продукт является по существу кристаллической, что определяется с помощью рентгеноструктурного анализа. Смотрите, например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA, 173, 1990; The United States Pharmacopeia, 23rd ed., 1843-1844, 1995.
Термин "форма кристалла", "кристаллическая форма" и родственные термины относятся в настоящем описании к кристаллической твердой форме, содержащей химическое соединение, и могут относиться к определенной однокомпонентной или мультикомпонентной кристаллической форме, включая, но без ограничения этим, полиморфную модификацию, сольват, гидрат, сокристалл или другой молекулярный комплекс, соль, сольват соли, гидрат соли, сокристалл или другой молекулярный комплекс соли или ее полиморфную модификацию.
Термины "полиморфные модификации", "полиморфные формы" и родственные термины относятся в настоящем описании к двум или нескольким кристаллическим формам, которые содержат ту же самую молекулу, молекулы или ионы. Различные полиморфные модификации могут обладать различными физическими свойствами, такими как, например, температуры плавления, удельные теплоты плавления, солюбилизация, скорости растворения и/или колебательные спектры, как результат группировки или конформации молекул или ионов в кристаллической решетке. Различия в физических свойствах, проявляемые полиморфными модификациями, сказываются на фармацевтических параметрах, таких как стабильность при хранении, прессуемость и плотность (важно при приготовлении лекарственной формы и производстве продукта), и скорость растворения (важный фактор для биологической доступности). Различия в стабильности могут быть результатом изменений в химической реакционной способности (например, различное окисление, так что лекарственная форма обесцвечивается быстрее, когда содержит одну полиморфную модификацию, чем когда содержит другую полиморфную модификацию) или механических изменений (например, таблетки разрушаются при хранении, поскольку кинетически благоприятная полиморфная модификация превращается в термодинамически более стабильную модификацию) или того и другого (например, таблетки одной полиморфной модификации являются более чувствительными к разрушению при высокой влажности). Как результат различий солюбилизации/растворимости, в крайнем случае, некоторые полиморфные превращения могут приводить к потере активности или, в другом крайнем случае, токсичности. Кроме того, физические свойства кристалла могут быть важны в обработке; например, одна полиморфная модификация может быть более способна к образованию сольватов или может быть трудной для фильтрования и отмывания от примесей (например, форма частиц и распределение по размерам может отличаться между полиморфными модификациями).
Используемый в настоящем описании термин "сольват" и "сольватированный" относится к кристаллической форме вещества, которое содержит растворитель. Термин "гидрат" и "гидратированный" относится к сольвату, где растворителем является вода. Термин "полиморфные модификации сольватов" относится к наличию более одной кристаллической формы для конкретного состава сольвата. Аналогично, "полиморфные модификации гидратов" относится к наличию более одной кристаллической формы для конкретного состава гидрата. Используемый в настоящем описании термин "десольватированный сольват" относится к кристаллической форме вещества, которое может быть получено только путем удаления растворителя из сольвата.
Используемые в настоящем описании термин "аморфный", "аморфная форма" и родственные термины означают, что вещество, компонент или продукт, о котором идет речь, по существу не является кристаллическим, как определено с помощью рентгеноструктурного анализа. В некоторых примерах осуществления образец, содержащий аморфную форму вещества, может быть по существу свободным от других аморфных форм и/или кристаллических форм.
Как используется в настоящем описании, если не указано иное, термины "приблизительно" и "примерно", когда используются в связи с дозами, количествами или массовыми процентами компонентов композиции или лекарственной формы, означают дозу, количество или весовой процент, которые устанавливаются специалистом в данной области техники, чтобы обеспечить фармакологический эффект, эквивалентный эффекту, полученному при точно определенных дозе, количеству или массовому проценту. В частности, термины "приблизительно" и "примерно", когда используются в данном контексте, предполагают дозу, количество или массовый процент в пределах 15%, более конкретно, в пределах 10%, более конкретно, в пределах 5% от точно определенной дозы, количества или массового процента.
Методы для получения характеристик кристаллических форм и аморфных форм включают в себя, но без ограничения этим, термогравиметрический анализ (ТГА), дифференциальную сканирующую калориметрию (ДСК), порошковую рентгеновскую дифрактометрию (XRPD), ренгеновскую кристаллографию (монокристальную рентгеновскую дифрактометрию), колебательную спектроскопию, например, инфракрасную (ИК) и Рамановскую спектроскопию, спектроскопию ядерного магнитного резонанса (ЯМР) в твердой фазе и растворе, оптическую микроскопию, оптическую микроскопию с нагревом, сканирующую электронную микроскопию (СЭМ, SEM), электронную кристаллографию и количественный анализ, гранулометрический анализ (PSA), анализ площади поверхности, исследования солюбилизации и исследования растворения.
Как используется в настоящем описании, если не указано иное, термины "приблизительно" и "примерно", когда используются в связи с числовым значением или диапазоном значений, которые представлены для характеризации конкретной твердой формы, например, конкретной температуры или диапазоном температур, такими как, например, которые описывают температуру плавления, дегидратации, десольватации или стеклования; изменения массы, такого как, например, изменение массы как функции температуры или влажности; содержания растворителя или воды, в единицах, например, массы или процента; или положения пика, такого как, например, в исследовании с помощью ИК или Раман-спектроскопии или XRPD; указывают, что значение или диапазон значений могут отклоняться в некоторой степени, что считается обоснованным любым специалистом в данной области техники, пока описывает конкретную твердую форму. В частности, термины "приблизительно" и "примерно", когда используются в данном контексте, указывают, что численное значение или диапазон значений могут варьировать, в конкретных примерах осуществления изобретения, в пределах 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1,5%, 1%, 0,5% или 0,25% от изложенного значения или диапазона значений.
Как используется в настоящем описании, твердая форма (например, кристаллическая форма или аморфная форма), которая является "по существу чистой", может содержать, в конкретных примерах осуществления изобретения, менее приблизительно 20%, 15%, 10%, 5%, 3%, 2%, 1%, 0,75%, 0,5%, 0,25% или 0,1% по массе одной или нескольких других кристаллических форм, аморфных форм и/или химических соединений. В некоторых примерах осуществления изобретения твердая форма, которая является по существу чистой, является по существу свободной от одной или нескольких других конкретных кристаллических форм, аморфных форм и/или химических соединений.
Как используется в настоящем описании, и если не указано иное, композиция, которая является "по существу свободной" от твердой формы и/или химического соединения, содержит менее приблизительно 20%, 15%, 10%, 5%, 3%, 2%, 1%, 0,75%, 0,5%, 0,25% или 0,1% по массе твердой формы и/или химического соединения.
Как используется в настоящем описании, и если не указано иное, термины "лечить", "лечащий" и "лечение" относятся к устранению или уменьшению интенсивности заболевания и расстройства или одного или нескольких симптомов, связанных с заболеванием и расстройством. В некоторых примерах осуществления изобретения термины относятся к минимизации распространения или усугубления заболевания или расстройства в результате введения одного или нескольких профилактических или терапевтических агентов субъекту с таким заболеванием или расстройством.
Как используется в настоящем описании, и если не указано иное, термины "предотвращать", "предотвращающий" и "профилактика" относятся к предотвращению начала, повторения или распространения заболевания или расстройства или одного или нескольких его симптомов.
Как используется в настоящем описании, и если не указано иное, термины "регулировать", "регулирующий" и "регулирование" относятся к предотвращению или замедлению прогрессирования, распространения или усугубления заболевания или расстройства или одного или нескольких его симптомов. Во многих случаях благоприятные эффекты, которые субъект получает от профилактического или терапевтического агента, не приводят в результате к вылечиванию заболевания или расстройства.
Как используется в настоящем описании, и если не указано иное, "терапевтически эффективное количество" соединения представляет собой количество, достаточное для обеспечения терапевтической пользы при лечении или регулировании заболевания или расстройства, или замедлении или уменьшении одного или нескольких симптомов, связанных с заболеванием или расстройством. Терапевтически эффективное количество соединения подразумевает количество терапевтического агента, одного или в комбинации с другой терапией, которое представляет терапевтическую пользу при лечении или регулировании заболевания или расстройства. Термин "терапевтически эффективное количество" может охватывать количество, которое повышает качество общей терапии, уменьшает или устраняет симптомы или причину заболевания или расстройства или усиливает терапевтическую эффективность другого терапевтического агента.
Как используется в настоящем описании, и если не указано иное, "профилактически эффективное количество" соединения представляет собой количество, достаточное для предотвращения заболевания или расстройства или предотвращения его повторения. Профилактически эффективное количество соединения подразумевает количество терапевтического агента, одного или в комбинации с другими агентами, которое представляет профилактическую пользу при профилактике заболевания. Термин "профилактически эффективное количество" может охватывать количество, которое усиливает общую профилактику или повышает профилактическую эффективность другого профилактического агента.
Используемый в настоящем описании термин "композиция" предназначен охватывать продукт, содержащий определенные компоненты (и в определенных количествах, если требуется), а также любой продукт, который является результатом, прямо или косвенно, комбинации определенных компонентов в определенных количествах. Под "фармацевтически приемлемым" подразумевается, что разбавитель, наполнитель или носитель должен быть совместимым с другими компонентами лекарственной формы и не быть вредным для его реципиента.
Термин "терапевтически и профилактически эффективное количество" относится к количеству испытуемой твердой формы, которое будет вызывать биологический или медицинский ответ у ткани, системы, животного или человека, которого добивается исследователь, ветеринар или врач или клиницист, или которое является достаточным для предотвращения развития или облегчения до некоторой степени одного или нескольких симптомов заболевания, подвергаемого лечению.
Термины "субъект" и "пациент", если не указано иное, определены в настоящем описании, чтобы включать в себя животных, таких как млекопитающие, включая, но без ограничения этим, приматов (например, людей), коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей и тому подобное. В определенных примерах субъектом или пациентом является человек.
В дополнение к твердым формам, содержащим соединение I, примеры осуществления представляют в настоящем описании твердые формы пролекарств соединения I. Пролекарства описанных в настоящем описании соединений являются структурно модифицированными формами соединения, которые легко подвергаются химическим изменениям в физиологических условиях с получением соединения. Кроме того, пролекарства могут быть превращены в соединение химическими или биохимическими методами в ex vivo окружении. Например, пролекарства могут быть медленно превращены в соединение, которое помещается в трансдермальный пластырь-резервуар с подходящим ферментом или химическим реагентом. Пролекарства часто являются полезными, поскольку, в некоторых случаях, они могут являться более легкими для введения, чем соединение или исходное лекарственное средство. Они могут, например, являться биологически доступными при пероральном введении, в то время как исходное лекарственное средство не является. Пролекарство может также иметь улучшенную солюбилизацию в фармацевтических композициях относительно исходного лекарственного средства. Из уровня техники известно широкое разнообразие производных пролекарств, таких как те, которые основаны на гидролитическим расщеплении или окислительной активации пролекарства. Примером, без ограничения, пролекарства может быть соединение, которое вводится в виде сложного эфира ("пролекарство"), но затем метаболически гидролизуется в карбоновую кислоту, эффективную форму. Дополнительные примеры включают в себя пептидильные производные соединения.
В некоторых примерах осуществления соединение I может содержать неприродное соотношение изотопов одного или нескольких атомов. Например, соединение может быть радиоактивно меченным радиоактивными изотопами, такими как, например, тритий (3H), йод-125 (125I), сера-35 (35S) или углерод-14 (14C). Радиоактивно меченные соединения являются полезными в качестве терапевтических агентов, например, противораковых терапевтических агентов, реагентов для исследования, например, реагентов для исследования связывания, и диагностических агентов, например, визуализирующих агентов in vivo. Все изотопные варианты соединения I, радиоактивные или нет, имеют целью осуществляться в пределах области примеров осуществления, представленных в настоящем описании.
ТВЕРДЫЕ ФОРМЫ, СОДЕРЖАЩИЕ СОЕДИНЕНИЕ I
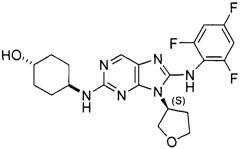
Определенные примеры осуществления изобретения представляют в настоящем описании однокомпонентные и многокомпонентные твердые формы, содержащие 4-[9-(тетрагидрофуран-3-ил)-8-(2,4,6-трифторфениламино)-9Н-пурин-2-иламино]циклогексан-1-ол ("соединение I"), который имеет химическую структуру, представленную ниже:
Соединение I может быть синтезировано или получено в соответствии с любым способом, очевидным специалисту в данной области техники, на основании представленных в настоящем описании идей, включая способы, детально описанные в примерах ниже. Соединение I может также быть получено в соответствии со способами, описанными в заявке на патент США № 11/332617, поданной 12 января 2006 года, и международной публикации WO 2006/076595, содержание каждой из которых включено в настоящее описание посредством ссылки.
В определенных примерах осуществления изобретения соединение I получают способом, предусматривающим стадии: (1) замещения нитропиримидина аминосодержащим соединением (например, аминосодержащим гетероциклом, таким как аминозамещенный тетрагидрофуран) или его солью; (2) дальнейшее замещение дополнительным аминосодержащим соединением (например, аминосодержащим карбоциклом, таким как аминосодержащий циклогексанол) или его солью; (3) восстановление нитрогруппы в соответствующий амин (например, в замещенный анилин); (4) реакции соединения с замещенным арилом или гетероарилом изотиоцианатным соединением (например, 2,4,6-трифторфенилизотиоцианат); и (5) циклизации, приводящей к образованию замещенного пурина. В определенных примерах осуществления изобретения две или несколько стадий способа могут быть объединены и/или проведены одна за другой без выделения промежуточного соединения(й). В определенных примерах осуществления стадии способа выполняются в порядке, в котором они перечисляются. В определенных примерах осуществления стадии способа выполняются в другом порядке, чем тот, в котором они перечисляются.
В конкретных примерах осуществления стадия (1) осуществляется в присутствии N,N-диизопропилэтиламина (ДИПЭА, DIPEA). В другом конкретном примере осуществления стадия (2) осуществляется в присутствии ДИПЭА. В другом конкретном примере осуществления стадия (3) осуществляется в присутствии Pd катализатора. В другом конкретном примере осуществления стадия (4) осуществляется в ТГФ (THF). В другом конкретном примере осуществления стадия (5) осуществляется в присутствии N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорида (ЭДК, EDC).
Обеспеченные в настоящем описании твердые формы, содержащие соединение I, включают в себя однокомпонентные и многокомпонентные формы, включая кристаллические формы и аморфные формы и включая, но без ограничения этим, полиморфные модификации, соли, сольваты, гидраты, сокристаллы и клатраты. Твердые формы, обеспеченные в настоящем описании, могут быть получены описанными в настоящем описании способами, включая описанные детально в примерах ниже способы, или методами, известными из уровня техники, включая нагревание, охлаждение расплава, быстрое охлаждение расплава, высушивание замораживанием, лиофилизацию, гашение охлаждением расплава, быстрое испарение растворителя, медленное испарение растворителя, перекристаллизацию из раствора, перекристаллизацию из суспензии, кристаллизацию из расплава, десольватацию, сублимацию, перекристаллизацию в замкнутых объемах, такую как, например, в нанопорах или капиллярах, перекристаллизацию на поверхностях или темплатах, такую как, например, на полимерах, перекристаллизацию в присутствии добавок, таких как, например, противоположные по свойствам молекулы сокристаллов, десольватацию, дегидратацию, быстрое охлаждение, медленное охлаждение, диффузию пара, сублимацию, измельчение, криоизмельчение, измельчение минорным количеством растворителя, индуцированное микроволновым излучением осаждение, индуцированное ультразвуком осаждение, индуцированное лазером осаждение и осаждение из сверхкритической жидкости.
Конкретные примеры осуществления представляют в настоящем описании композиции, содержащие одну или несколько твердых форм. Некоторые примеры осуществления представляют в настоящем описании композиции одной или нескольких твердых форм в комбинации с другими активными компонентами. Некоторые примеры осуществления представляют в настоящем описании способы применения данных композиций при лечении, профилактике или регулировании состояний или расстройств, включая, но без ограничения, рак, сердечнососудистое заболевание, заболевание почек, аутоиммунное патологическое состояние, воспалительное состояние, дегенерацию желтого пятна, ишемию/реперфузионное повреждение, боль и связанные с ней синдромы, связанное с заболеванием истощение, вызванное асбестом состояние, легочную гипертензию, повреждение/нарушение центральной нервной системы (ЦНС) или состояния, поддающиеся лечению или профилактике путем ингибирования киназного каскада.
Конкретные примеры осуществления представляют в настоящем описании композицию, содержащую кристаллическую форму и/или аморфную форму соединение I, дополнительно содержащую одно или несколько соединений, представленных на фиг.14. В определенных примерах осуществления композиция, содержащая кристаллическую форму и/или аморфную форму соединения I, дополнительно содержит соединение, представленное на фиг.14, в количестве менее приблизительно 0,01%, 0,05%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5%, 6%, 7%, 8%, 9% или 10% от общего количества соединения I в композиции, исходя из массы.
Хотя отсутствует намерение ограничиваться какой-либо конкретной теорией, некоторые обеспеченные в настоящем описании твердые формы характеризуются физическими свойствами, например, стабильностью, солюбилизацией и скоростью растворения, подходящими для клинических и терапевтических лекарственных форм. Кроме того, хотя отсутствует желание ограничиваться какой-либо конкретной теорией, некоторые обеспеченные в настоящем описании соли и кристаллические формы характеризуются физическими свойствами, например, морфологией кристаллов, прессуемостью, твердостью, подходящими для производства твердой лекарственной формы. Такие свойства могут быть определены с применением таких методов, как рентгеноструктурный анализ, микроскопия, ИК-спектроскопия и термический анализ, которые описаны в настоящем описании и известны из уровня техники.
Однокомпонентные твердые формы соединения I
Определенные примеры осуществления представляют в настоящем описании однокомпонентные твердые формы свободного основания 4-[9-(тетрагидрофуран-3-ил)-8-(2,4,6-трифторфениламино)-9Н-пурин-2-иламино]циклогексан-1-ола ("соединение I"), применяемого для лечения, профилактики и регулирования состояний и расстройств, включая, но без ограничения этим, рак, сердечнососудистое заболевание, заболевание почек, аутоиммунное патологическое состояние, воспалительное состояние, дегенерацию желтого пятна, ишемию/реперфузионное повреждение, боль и связанные с ней синдромы, связанное