Нейроэндокринные факторы для лечения дегенеративных заболеваний
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано в медицине. Белок SLIT применяется при производстве фармацевтической композиции для предупреждения или лечения повреждений хряща. Предложенное изобретение позволяет эффективно предупреждать или лечить повреждения хряща. 14 з.п. ф-лы, 9 ил., 9 пр.
Реферат
Настоящее изобретение имеет отношение к применению фактора и/или полипептида, изменяющего направление роста, в особенности белков нетрин1, SLIT3 или их фрагментов, для производства фармацевтической композиции для лечения или предупреждения дегенеративных заболеваний, в особенности повреждения хрящей. Изобретение дополнительно имеет отношение к фрагменту полипептида SLIT3, к фармацевтической композиции, включающей полипептид, и к его применению.
Восстановление и регенерация хряща при травматическом и дегенеративном поражении сустава остается по-прежнему основной проблемой в ортопедии. Повреждения хрящей и дегенеративные заболевания представляют собой основную причину возникновения сильных болей и постепенной потери функций суставов с потерей трудоспособности и ограничению подвижности во взрослой популяции. Собственная способность хряща к восстановлению ограничена низкой способностью хондроцитов к делению in vivo, и ткани взрослых обычно уступают по свойствам нормальному хрящу. Обычно считается, что поврежденный хрящ не получает достаточных стимулов для того, чтобы произошла стимуляция восстановления, поскольку, например, суставной хрящ не обладает системой сосудов. Хондроциты в хрящевой ткани в норме не подвергаются воздействию достаточного количества агентов, стимулирующих восстановление, таких как факторы роста и фибриновые сгустки, которые присутствуют в поврежденной ткани, обладающей системой сосудов.
Функциональная целостность суставов зависит от строгого разделения границ компартментов. Пересечение отделов хряща и разрушение хрящевого компартмента обнаруживают при воспалительном и дегенеративном поражении сустава, таком как ревматоидный артрит (RA) и остеоартрит (ОА).
Часто нарушения в хряще (например, ревматоидный артрит) характеризуются или усиливаются инвазивным и разрушительным поведением клеточных популяций в окружающих тканевых компартментах, таких как фибробласты синовиальной ткани (SF), которые мигрируют в хрящ из синовиальной ткани. Разрушение сочленовных структур сустава, таких как хрящ и кость, под действием синовиальных фибробластов (SF) представляет собой критическое событие в развитии RA и ОА (Рар, 2003; Pap, 2007; Yasuda, 2006; Huber, et al., 2006).
С разной степенью успеха было опробовано множество стратегий, направленных на ингибирование дальнейшего прогрессирования разрушительных структурных изменений, а также новых подходов, направленных на обращение заболевания с помощью восстановительного лечения пораженного хряща, включая поиск новых средств, способных восстанавливать разрушенный хрящ. Эти стратегии включают методики стимулирования костного мозга, аутологическую и аллогенную трансплантацию, аутологическую трансплантацию хондроцитов, имплантацию надкостницы, просверливание по Приди, абразивную хондропластику, включающую микроразрушение и мозаичную пластику. Однако эти процедуры не надежны и ограничены очаговыми хрящевыми и костно-хрящевыми нарушениями небольших и средних размеров. Мозаичная пластика ограничена тем, что приходится производить разрушения в области донорского участка, а также неудовлетворительным результатом восстановления и техническими трудностями, с которыми сталкиваются при восстановлении поверхности исходного изгиба сустава (Kuroda, et al., 2007). Методики аутологической трансплантации хондроцитов обладают несколькими недостатками, включая отсутствие достаточного числа хондроцитов, необходимости производить разрушения в области донорского участка, низкой эффективностью и высокой стоимостью лечения.
Было установлено, что несколько факторов роста, таких как TGF-β1, FGF-2, IGF-1, ТР-508, ОР-1 или другие BMP, включая GDF или их комбинации, индуцируют пролиферацию и дифференциацию клеток-предшественников в функционирующей кости и/или хрящевой ткани. В особенности, было показано, что TGF-R1 активирует хондрогенную дифференциацию клеток-предшественников и усиливает дифференциацию хондроцитов. IGF-1 исходно действует по анаболическому сценарию, увеличивая синтез протеогликана и коллагена II-го типа. Однако эти факторы роста довольно неспецифичны, и существует риск того, что они могут вызвать нежелательные побочные эффекты. Другие, такие как BMP, обладают возможностью индуцировать остеогенные гены и, следовательно, индуцировать нежелательное образование костной ткани. Другое ограничение применения этой методики с факторами роста заключается в относительно коротком времени биологической полужизни экзогенного фактора роста, который способен производить только временные биологические эффекты после доставки.
За некоторые признаки и симптомы, а также за структурные изменения, присутствующие у пациентов с ОА и RA, вероятно, ответственны провоспалительные цитокины, протеазы и металлопротеиназы. Ингибирование синтеза/активности этих ферментов, в качестве лечения ОА и RA, интенсивно изучается.
В настоящее время наиболее многообещающая стратегия по-прежнему заключается в применении небольших химических соединений, которые могут блокировать активность ММР. Однако ингибиторы ММР могут давать побочные эффекты, и пока не было продемонстрировано значительного снижения в прогрессировании заболевания.
Кроме того, ниже перечислены прочие новые стратегии, в настоящее время находящиеся в стадии разработки.
US2003068705 раскрывает триста пять последовательностей нуклеиновых кислот, кодирующих полипептиды PRO, некоторые из которых (например, гомологичные или родственные IL-17 полипептидам) по непроверенным данным полезны для стимуляции пролиферации или дифференциации хондроцитов и, как таковые, могут быть полезны для лечения различных нарушений в кости и/или в хряще, таких как спортивные травмы или артрит.
WO20001090357 обеспечивает белки для лечения пороков развития, воспалительного заболевания или для модуляции иммунных ответов.
US2003044917 имеет отношение к полипептидам PRO человека для стимуляции пролиферации и дифференциации хондроцитов и к их применению для лечения различных заболеваний кости и/или хряща, таких как артрит и спортивные травмы. Однако только последовательность 6029 дала положительный результат.
Предполагается, что другой класс белков, такие как молекулы, управляющие направлением роста аксонов (например, нетрины, белки Slit), модулируют движение клеток при воспалении (WO0164837, WO05074556, WO00055321, WO0190357). WO0164837, WO03075860, WO06019904 и US 2006/0153840 раскрывают способы стимуляции ангиогенеза, пролиферации и/или стимуляции миграции клеток для лечения нейропатии и рака.
WO2002081745 раскрывает применение SLIT3 для диагностики остеопороза/заболевания кости, стимуляции остеогенеза и/или предупреждения остеопороза/заболевания кости.
WO99/23219, JP11164690 и JP11075846 раскрывают последовательность полипептида SLIT3 человека.
WO00/55321 раскрывает последовательности DNA SLIT позвоночных (т.е. Slit2 Xenopus и человека), белок и их применение.
Однако ни один из способов и композиций, раскрытых в этой области техники, не продемонстрировал значительного снижения в прогрессировании подвергаемого лечению заболевания без побочных эффектов или не привел к прекращению разрушительных процессов и фактическому восстановлению и восполнению хрящевой ткани.
Следовательно, существует необходимость в композициях и их применении для усовершенствования лечения и/или предупреждения прогрессирующего разрушения хряща, в особенности, после травмы и в случае хронических заболеваний, таких как полнослойные нарушения и поверхностные нарушения и артрит (например, остеоартрит, ревматоидный артрит), слезы мениска, (ACL)-повреждение передней крестообразной связки, которые позволяют преодолеть проблемы, связанные с доступными на данный момент способами и композициями.
Следовательно, цель настоящего изобретения заключается в обеспечении способов восстановления или регенерации повреждений хрящей и/или ингибирования прогрессирования заболеваний или нарушений хряща, таких как артрит и спортивные травмы.
Еще одна цель настоящего изобретения заключается в обеспечении способов ингибирования миграции синовиальных клеток и, следовательно, ингибирования разрушения хряща.
Еще одна цель настоящего изобретения заключается в обеспечении способов, которые подходят для лечения заболеваний хряща, а точнее воспалительных заболеваний хряща, и заболеваний без вовлечения инвазии синовиальных фибробластов или образование паннуса.
Еще одна цель настоящего изобретения заключается в обеспечении композиций и их применении для притяжения/хемотаксиса мезенхимальных стволовых клеток для регенерации хряща из его окружения.
Еще одна цель настоящего изобретения заключается в обеспечении композиций и их применении для индукции образования хряща и/или стимуляции пролиферации или дифференциации хондроцитов.
Проблему, лежащую в основе настоящего изобретения, решают путем применения фактора, изменяющего направление роста, производства фармацевтической композиции для предупреждения и/или лечения повреждений хряща. Изобретение, в особенности, имеет отношение к применению фактора, изменяющего направление роста, для производства фармацевтической композиции для предупреждения и/или лечения дегенеративного заболевания, предпочтительно дегенеративного заболевания хряща, а) связанного с инфильтрацией или миграцией синовиальных фибробластов предпочтительно в суставной или несуставной хрящ и/или связанного с образованием паннуса, или b) связанного с ослабленным прикреплением клеток, предпочтительно фибробластов или синовиальных фибробластов, к суставному или несуставному хрящу. В особенности, фактор, изменяющий направление роста, модулирует или ингибирует миграцию фибробласто-подобных клеток, таких как синовиальные фибробласты, торможение гиперплазии синовиальных клеток и/или усиливает миграцию, пролиферацию и/или дифференциацию мезенхимальных стволовых клеток и/или хондроцитов для индукции и/или регенерации хряща и, таким образом, изменяет, ингибирует, предупреждает и/или лечит прогрессирование дегенеративного заболевания. В особенности, фактор, изменяющий направление роста, ингибирует, изменяет или предупреждает образование остеофитов, предпочтительно у пациента.
В особенности, изобретение имеет отношение к применению фактора, изменяющего направление роста, для производства фармацевтической композиции для предупреждения и/или лечения повреждений хряща, в которой фактор, изменяющий направление роста, представляет собой фрагмент белка SLIT3 (SEQ ID NO:1). Фрагмент предпочтительно имеет длину, равную <1523 АА, предпочтительно <1200 АА, более предпочтительно <1000 АА и наиболее предпочтительно ≤800 АА и, в особенности, >20 АА, предпочтительно >50 АА, более предпочтительно >100 АА. Предпочтительно, фрагмент белка SLIT3 включает последовательность SEQ ID NO:1 от 34 до 917 положения, от 47 до 863 положения, от 66 до 857 положения, от 279 до 863 положения, от 279 до 857 положения, от 279 до 724 положения, от 279 до 504 положения, от 311 до 432 положения, от 335 до 432 положения или от 312 до 437 положения. В соответствии с изобретением было обнаружено, что факторы, изменяющие направление роста, в особенности, SLIT3 экспрессируются на границах хрящевого компартмента, где они поддерживают целостность суставного хряща. Дополнительно, факторы, изменяющие направление роста, ингибируют миграцию фибробластов, нервных волокон и сосудов в суставной хрящ. Поскольку инвазия паннусной ткани в хрящ при хроническом заболевании сустава возможна только после измененной экспрессии фактора, изменяющего направление роста, эту инвазия можно модулировать с помощью факторов, изменяющих направление роста, в особенности, с помощью SLIT3, и, таким образом, становится возможным лечение связанных с этим дегенеративных заболеваний.
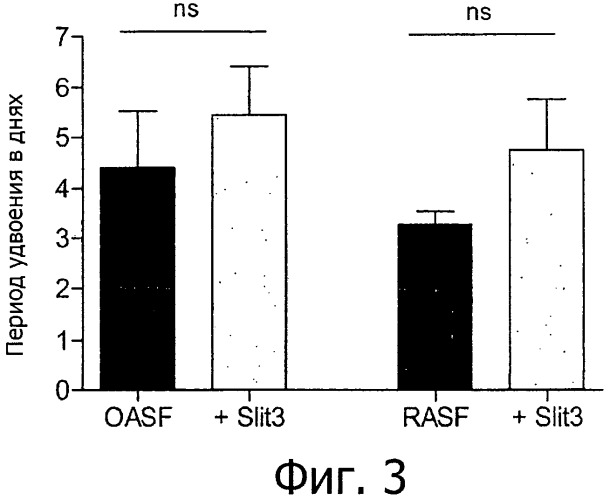
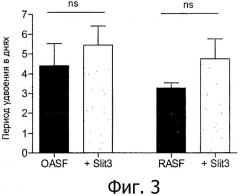
Авторы изобретения продемонстрировали, что факторы, изменяющие направление роста, и их рецепторы избирательно экспрессируются в синовиальных фибробластах пациентов, страдающих дегенеративными заболеваниями, такими как остеоартрит и артрит. Наблюдение было проанализировано методом количественной RT-PCR генов, выполненной с помощью cDNA компании «Lightcycler», изолированной из культуры первичных синовиальных фибробластов человека. Белки ROBO и SLIT сходным образом экспрессируются в синовиальных фибробластах пациентов с остеоартритом (OASF) и в синовиальных фибробластах пациентов с ревматоидным артритом (RASF), за исключением экспрессии mRNA ROBO3, которая поразительно увеличивается в RASF по сравнению с очень слабой экспрессией в OASF. Уровень mRNA SLIT1 явно снижается по сравнению с SLIT2 или SLIT3, но, похоже, что экспрессия всех белков SLIT в OASF бывает обычно выше, чем в RASF.
ROBO1 и ROBO2 экспрессируются как в дифференцированных, так и в ОА хондроцитах, но экспрессия в ОА хондроцитах в 10 раз (ROBO1) и даже в 100 раз (ROBO2) выше по сравнению с экспрессией в дифференцированных хондроцитах. В обоих типах клеток не удалось зарегистрировать никакой экспрессии ROBO3. Все три белка SLIT экспрессируются в дифференцированных и ОА хондроцитах, обнаруживая снова более высокие уровни в ОА, по сравнению с уровнем в дифференцированных хондроцитах.
UNC5B и UNC5C подвержены значительной стимулирующей регуляции в синовиальных фибробластах пациентов с ОА и RA.
Дополнительно было обнаружено, что значительная потеря в экспрессии ROBO3 в RASF на более поздних пассажах синовиальных фибробластов может быть важной стадией в процессе утраты активности, изменяющей направление роста, в отношении SLIT3. Эти данные, полученные авторами изобретения, позволяют предположить, что нарушение в регуляции рецептора ROBO3 в синовиальных фибробластах у RA (и ОА) коррелирует с агрессивностью фибробластов.
Кроме того, изобретение основано на обнаружении того, что факторы, изменяющие направление роста, такие как нетрин1, SLIT3, а также их фрагменты вовлечены в регуляцию агрессивного поведения клеток, таких как синовиальные фибробласты, и миграции этих клеток к хрящу или в него, что представляет собой основную проблему при дегенеративных заболеваниях, таких как ревматоидный артрит. Не будучи ограниченными специфическими молекулами, изобретение основано на обнаружении того, что факторы, изменяющие направление роста, такие как нетрин1 и SLIT3 и их фрагменты, ингибируют миграцию клеток OASF и RASF. Благодаря этому удивительному открытию, факторы, изменяющие направление роста, могут быть применены для лечения различных заболеваний, которые возникают в результате миграции и инфильтрации клеток, включая измененную миграцию фибробласто-подобных клеток, таких как синовиальные фибробласты и/или образование паннуса, которые не могут в дальнейшем вызвать разрушение или изменить функцию ткани, такой как суставной или несуставной хрящ. Принимая во внимание раскрытое в этом документе удивительное открытие, факторы, изменяющие направление роста, могут быть применены в качестве лекарственного средства для предупреждения и/или лечения различных заболеваний и болезненных состояний, описанных в этом документе. Соответствующие заболевания, среди прочих, представляют собой предпочтительно дегенеративные заболевания хряща, такие как дегенеративные заболевания сустава и/или межпозвоночного диска, включая те, что дополнительно описаны выше. В особенности, в соответствии с изобретением, заболевание выбирают из дегенеративного заболевания дисков, слез мениска, повреждения передней крестообразной связки (ACL), артрита, остеоартрита, ревматоидного артрита, псориатического артрита, юношеского хронического артрита, псевдоартрита тазобедренного или плечевого сустава, ревматоидного полиартрита, синовита или виллезонодулярного синовита.
В соответствии с изобретением повреждения хрящей или заболевания хряща можно предупредить или лечить.
Авторы изобретения обнаружили также влияние факторов, изменяющих направление роста на миграционное поведение мезенхимальных стволовых клеток человека, о которых известно, что они способны дифференцировать в хондроциты. За индукцией миграции наблюдают, применяя анализ в камере Бойдена после добавления таких факторов, как нетрин1, в нижнюю камеру, что указывает на то, что факторы, изменяющие направление роста, могут действовать как хемоаттрактанты для мезенхимальных стволовых клеток, таких как клетки синовиальной мембраны или выстилающие клетки. В свете этого открытия может быть заторможено не только разрушительное поведение мигрирующих клеток, но также могут быть вовлечены клетки, способные к регенерации разрушенной ткани. Факторы, изменяющие направление роста, следовательно, дополнительно улучшают лечение дегенеративных заболеваний.
Дополнительно, была обнаружена индукция дифференциации мезенхимальных стволовых клеток человека в сторону линии хондрогенных клеток, следовательно, факторы, изменяющие направление роста, такие как SLIT3, могут индуцировать хондрогенез и, следовательно, полезны для регенерации и лечения заболеваний хряща.
Следовательно, изобретение охватывает применение факторов, изменяющих направление роста, для производства фармацевтической композиции для лечения повреждений хряща, в особенности дегенеративного заболевания у пациента, вызываемого агрессивными фибробластами, путем введения эффективного количества фактора, изменяющего направление роста, который модулирует миграцию, пролиферацию и/или прикрепление клеток к хрящу.
Предпочтительно, эффективное количество фактора, изменяющего направление роста, которое вводят пациенту, равно от 0,001 мг/кг массы тела пациента до 100 мг/кг массы тела пациента, предпочтительно 0,01 мг/кг массы тела пациента до 20 мг/кг массы тела пациента, более предпочтительно от 0,01 до 10 мг/кг массы тела пациента, наиболее предпочтительно 0,1 мг/кг до 1 мг/кг массы тела пациента.
Для цели настоящего изобретения термин «фактор, изменяющий направление роста» означает активное средство, которое в определенной концентрации или диапазоне концентраций способно ингибировать миграцию клеток через границу ткани, например границу хряща. По этой причине, например, миграция агрессивных синовиальных фибробластов в хрящ и/или кость может быть заторможена или изменена. Это также включает ингибирование дальнейшего прогрессирования в образовании паннуса или инвазии паннуса в хрящ. Факторы, изменяющие направление роста, могут влиять на процесс прорастания нервных волокон в качестве стимулов, определяющих направление роста аксона, например, с помощью отталкивающего или привлекающего действия.
Факторы, изменяющие направление роста, включают большое число молекул, также известных как молекулы, определяющих направление роста аксона, которые модулируют аксональный рост в нервной системе. Они включают белки нетрин, белки SLIT, SEMAPHORE и ЭФРИН и их рецепторы НЕЙРОФИЛИН, ROUNDABOUT (ROBO) и членов семейств UNC5 и DCC (Klagsbrun и Eichmann, 2005).
Белки NETRIN представляют собой семейство секретируемых белков, обладающих гомологией к ламининовому домену. Это семейство состоит из нетрина 1, 2, 3 и 4. Они содержат домен ламинина-VI, EGF-подобные повторы и гепарин-связывающий С-концевой домен. Рецепторы нетрина представляют собой семейство рецепторов, удаленных в колоректальном раке (DCC), которое состоит из DCC и неогенина, или семейство некоординированных-5 (UNC5), которое включает UNC5A, 5В, 5С, 5D. Нетрины вовлечены в ангиогенез и в ход морфогенеза, такого как ветвление легких, развитие молочных желез и образование опухоли. Показано, что связывание нетрина с DCC и неогенином приводит к привлечению клеток, тогда как связывание с UNC-рецептором модулирует отталкивание.
Белки SLIT исходно были обнаружены в Drosophila как молекулы, направляющие рост аксона. Ортологи SLIT1, SLIT2 и SLIT3 у млекопитающих представляют собой более крупные секретируемые белки с четырьмя обогащенными лейцином повторяющимися (LRR) доменами, девятью EGF-доменами, доменом ламинина G (LamG) и С-концевым цистеиновым узлом. mRNA SLIT1 экспрессируется в мозге, анапластической олигодендроглиоме и Т-клетках линии Jwkat. mRNA SLIT2 и SLIT3 соэкспрессируются в эмбриональных стволовых клетках (ES) с образованием эмбриоидного тельца (Katoh и Katoh, 2005; Vargesson, et al., 2001). Slit3, но не Slit2, локализован внутри митохондрий, что позволяет предположить, что Slit3 потенциально обладает уникальными функциями, не свойственными другим Slit-белкам (Little, et al., 2001). Белок Slits действует посредством связывания с рецепторами Roundabout. Существует четыре трансмембранных рецептора Robo человека (Robo1, Robo2, Robo3 и Robo4), которым свойственны домены фибронектинового типа III и иммуноглобулин-подобные домены (Ig), но которые различаются по своим цитоплазматическим доменам (Itoh, et al., 1998; Howitt, et al., 2004; Hohenester, et al., 2006). Исходно было известно, что Slit-белки вовлечены в регуляцию взаимодействий по типу клетка-клетка и взаимодействий по типу клетка-подложка в мигрирующих клетках в ходе эмбрионального развития и регулируют направление роста аксона путем привлечения или отталкивания конуса роста. В последнее десятилетие было также описано, что система Robo-/Slit вовлечена в адгезию клеток и индуцирует опухолевый ангиогенез. Белки Slits также вовлечены в другие процессы развития, такие как миграция предшественников мышечных клеток у дрозофилы, направленная миграция лейкоцитов и индукция почки (Klagsbrun и Eichmann, 2005).
Семафорины представляют собой поверхностно или локально секретируемые факторы, изменяющие направление роста нервов, со специфическим отталкивающим действие на нервные волокна через определенные поверхностные рецепторы, такие как нейрофилин 1 и нейрофилин 2. Семафорины класса III включают SEMA А, В, С и F. Эфрины и их рецепторы Eph представляют собой лиганды и тирозинкиназные рецепторы, вовлеченные во множество процессов развития, включая развитие нервной системы и ангиогенез. Лиганды эфрина А (Эфрин A1, А2, A3, А4, А5) представляют собой заякоренные через GPI молекулы, которые связываются с рецепторами EphA, тогда как белки эфрина В (Эфрин В 1-3) связываются с рецепторами Eph В. Эфрины могут также, наоборот, функционировать в качестве рецепторов, которые связываются с помощью Ephs как лиганды.
В некоторых воплощениях фактор, изменяющий направление роста, настоящего изобретения представляет собой агониста или антагониста рецептора ROUNDABOUT (например, ROBO1, 2, 3), рецептор, отсутствующий при колоректальной карциноме (например, DCC) или UNC-рецептор (например, UNC5A-D). Так как применен в этом документе, агонист или антагонист активирует или ингибирует активность рецептора ROUNDABOUT, DCC- или UNC-рецептора, который предпочтительно представляет собой сигнал, передаваемый путем взаимодействия между рецептором и лигандом, или ингибирование сигнала, который передается с помощью рецептора, не занятого лигандом.
В некоторых предпочтительных воплощениях агонист, антагонист и/или фактор, изменяющий направление роста, настоящего изобретения выбирают из группы нетринов (такие как нетрин1, нетрин2, нетрин4, нетринG1), белков SLIT (таких как SLIT1, SLIT2, SLIT3), белков эфринов (таких как ЭФРИН А2, А4, А5) и белков SEMAPHRIN (таких как семафорим 3А, 3В, 3С и 3F), их фрагментов и аминокислотных последовательностей.
Термин «излечение или лечение», так как применен в этом документе, означает смягчение нарушения или заболевания или смягчение симптомов, связанных с нарушением или заболеванием, прекращение дополнительной прогрессии или нарастания выраженности симптомов.
Термин «предупреждение» включает предупреждение или профилактику заболевания или нарушения.
Термин «нарушение хряща» имеет отношение к любому отклонению от нормы в хряще, включая заболевания хряща, изменения в хряще, вызванные, например, травмой или дегенеративным процессом.
Термин «дегенеративные заболевания» означает заболевания или нарушения в пораженной структуре хряща, такие как деградация или разрушение хряща с вовлечением костной структуры или без этого. Предпочтительно, дегенеративные заболевания представляют собой дегенеративные заболевания хряща. Эти заболевания включают нарушения височно-челюстного сустава (TMD), нарушения хрящевого кольца сустава, артрит, остеоартрит, ревматоидный артрит, псориатический артрит, юношеский хронический артрит, псевдоартрит тазобедренного или плечевого сустава, ревматоидный полиартрит, дегенеративные заболевания межпозвоночных дисков, костно-хрящевые нарушения, поверхностные хрящевые нарушения, рассекающий остеохондрит, глубокие хрящевые нарушения, хрящевые нарушения средней глубины, слезы мениска, повреждение передней крестообразной связки, синовиальный остеохондроматоз, анкилозирующий спондилит, синовит, виллонодулярный синовит.
Термины нарушение хряща и дегенеративные заболевания, так как применены в этом документе, в частности, не включают остеопороз.
«Дегенеративные заболевания межпозвоночных дисков (DDD)» представляют собой хронический процесс, характеризующийся частично прогрессирующей потерей протеогликана и воды в студенистом ядре одного или нескольких межпозвоночных дисков, что впоследствии может проявиться во множественных нарушениях, таких как идиопатическая боль в нижней части спины, образование грыжи межпозвоночного диска, разрушение внутренних межпозвоночных дисков или растрескивание межпозвоночных дисков, радикулопатия, стеноз спинномозгового канала, индуцированное грыжей межпозвоночного диска воспаление седалищного нерва, воспаление седалищного нерва, идиопатический сколиоз и/или миелопатия. Степень деградации межпозвоночного диска может быть оценена с помощью дооперационного MRI-анализа.
Термин «суставной хрящ» означает ту поверхность части кости в суставах, которая функционирует как упругая прокладка между двумя костями и которая дает возможность суставам двигаться. Нормальный здоровый хрящ описывают как гиалиновый хрящ. Суставной хрящ состоит из специализированных клеток (хондроцитов), встроенных в подложку из внутриклеточного вещества, обогащенного протеогликанами, главным образом, аггреканом, волокнами коллагена типа II, другими белками и водой. Хондроциты, встроенные внутрь матрикса, создаются и поддерживаются его. Хрящевая ткань представляет собой ткань, лишенную нервов и сосудов, и ее питание осуществляется с помощью лежащей ниже ткани.
Несуставной хрящ не покрывает шарнирно-сочлененные поверхности и включает соединительнотканный хрящ (включая межсуставной соединительнотканный хрящ, например, мениск и соединительнотканный хрящ межпозвоночных дисков) и эластический хрящ.
Термин «синовиальный клетки», «синовиальный слой» или «синовиальные фибробласты», так как применен в этом документе, имеет отношение к клетке, физиологически связанной с синовиальной мембраной или присутствующей в синовиальном пространстве; к клетке, полученной из синовиальной мембраны сустава или синовиальной жидкости. Он также имеет отношение к клеточной выстилке, покрывающей нехрящевые поверхности синовиальных суставов. Синовиальный слой состоит из синовиальных выстилающих клеток и синовиальной подвыстилки (субсиновиального слоя), которая сливается с суставной капсулой.
Термин «паннусная ткань» означает пролиферацию синовиальных клеток и/или эрозию ткани, такой как отложение клеток или вещества внутри хряща (например, суставного хряща), инвазию или разрушение суставного хряща с вовлечением субхрящевой области или без нее. Термин также включает инвазию клеток в подхрящевой костный мозг.
В предпочтительном воплощении проблему, лежащую в основе настоящего изобретения, решают путем применения фактора, изменяющего направление роста, для производства фармацевтической композиции для предупреждения и/или лечения дегенеративного заболевания, которое, предпочтительно, не представляет собой остеопороз, в котором фактор, изменяющий направление роста, выбирают из группы, состоящей из полипептидов, имеющих последовательность, которая а) имеет, по меньшей мере, 85% гомологии, предпочтительно 90%, 95% гомологии, более предпочтительно, идентична аминокислотной последовательности белка SLIT3 (SEQ ID NO:1) или нетрина1 (SEQ ID NO:10), b) представляет собой активный фрагмент белка SLIT3 или нетрина1 или с) имеет, по меньшей мере, 85%, 90%, 95% гомологии с аминокислотной последовательностью активного фрагмента b).
Термин «активный фрагмент» предпочтительно означает активность полипептида, который связывается с тем же рецептором или партнером по связыванию, как и зрелый полноразмерный полипептид, например зрелый полипептид SLIT3. Связывание, например, может активировать или ингибировать рецептор и расположенный ниже каскад. Активность фрагмента SLIT3 может, например, быть определена с помощью связывания с его ROBO рецептором с помощью способов, известных в этой области техники, таких как анализ связывания методом «Biacore», in vitro методом «pulldown assay», как описано в работе (Mar-lot et al., 2007), исследование связывания белка методом ELISA или иммунопреципитации. Активность фрагмента также может быть определена с помощью анализов, описанных в примерах 2, 3, 4, 6, 7 или 9 изобретения, например, анализ миграции в камере Бойдена, анализ пролиферации или функциональный анализ in vivo, такие как описаны в примерах 6 и 7.
Для определения процента гомологии двух аминокислотных последовательностей последовательности выравнивают для оптимизации сравнения (например, в последовательность одного белка или нуклеиновой кислоты для оптимального сравнительного анализа первичной структуры с другим белком или нуклеиновой кислотой могут быть введены разрывы). Затем сравнивают аминокислотные остатки в соответствующих позициях аминокислот. Если позиция в одной из последовательности занята тем же аминокислотным остатком, что и соответствующая позиция в другой последовательности, то молекулы гомологичны по этой позиции.
Процент гомологии между двумя последовательностями представляет собой функцию числа идентичных позиций, являющихся общими для двух последовательностей (т.е. % гомологии = число идентичных позиций / общее число позиций × 100).
Кроме вышеописанных способов, определение процента гомологии между двумя последовательностями может быть завершено с помощью математического алгоритма. Предпочтительный неограничивающий пример математического алгоритма, применяемого для сравнения двух последовательностей, представляет собой алгоритм, приведенный в работе Karlin и Altschul (1990 Proc. Natl. Acad. Sci. USA 90:5873-5877). Такой алгоритм включен в программы NBLAST и XBLAST, предложенные Altschul, et al. (1990 J. Mol. Biol. 215:403-410).
Поиски белка BLAST могут быть выполнены с помощью программы XBLAST, счет = 50, длина слова = 3, для получения аминокислотных последовательностей, гомологичных последовательностям CCSRP настоящего изобретения. Для получения выравниваний с пропусками для сравнения первичных структур можно применить программу Gapped BLAST такую, как описана в работе Altschul et al. (1997 Nucleic Acids Res. 25:3389-3402). При применении программ BLAST и Gapped BLAST можно воспользоваться параметрами, используемыми по умолчанию, в соответствующих программах (например, XBLAST и NBLAST). Другой предпочтительный неограничивающий пример математического алгоритма, применяемого для сравнения последовательностей, представляет собой алгоритм, предложенный Myers и Miller (CABIOS 1989). Такой алгоритм включен в программу ALIGN (версия 2.0), которая представляет собой часть пакета программ сравнительного анализа первичной структуры последовательности GCG. При применении программы ALIGN для сравнения аминокислотных последовательностей могут быть применены таблица массы остатков РАМ 120, ограничение на длину пропуска, равное 12, и штраф за пропуск в последовательности, равный 4, для получения аминокислотных последовательностей, гомологичных последовательностям CCSRP настоящего изобретения. При выравнивании с пропусками для сравнения может быть применена программа Gapped BLAST так, как описано в работе Altschul et al. (1997 Nucleic Acids Res. 25:3389-3402). При применении программ BLAST и Gapped BLAST могут быть применены параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST). Другой предпочтительный неограничивающий пример математического алгоритма, применяемого для сравнения последовательностей, представляет собой алгоритм, предложенный Myers и Miller (CABIOS 1989). Такой алгоритм включен в программу ALIGN (версия 2.0), которая представляет собой часть пакета программ GCG сравнительного анализа первичной структуры последовательностей. При применении программы ALIGN для сравнения аминокислотных последовательностей могут быть применены таблица массы остатков РАМ 120, ограничение на длину пропуска, равное 12, и штраф за пропуск в последовательности, равный 4.
Фрагменты предпочтительно имеют длину, равную менее чем 1523 или 1522 аминокислоты, предпочтительно равную менее чем 1491, 900, 500, 400, 300, 200 аминокислот, предпочтительно, по меньшей мере, 20, 50, 100 аминокислот и вплоть до 100, 200, 300, 400, 500 аминокислот. В предпочтительном воплощении фактор, изменяющий направление роста, в соответствии с изобретением включает аминокислотную последовательность, которую выбирают из последовательностей SEQ ID NO:2, 3, 4, 5, 6, 7, 8 и 9, и предпочтительно полипептида, аминокислотная последовательность которого короче, чем зрелый белок SLIT3. Предпочтительно аминокислотная последовательность короче, чем 1523 или 1522, предпочтительно короче, чем 1491 или короче, чем 900 аминокислот в длину, предпочтительно от 200 до 900 аминокислот в длину или более предпочтительно от 220 до 760, от 240 до 520, от 250 до 300 аминокислот в длину. В дополнительном предпочтительном воплощении фактор, изменяющий направление роста, в соответствии с изобретением включает, по меньшей мере, аминокислотную последовательность SEQ ID NO:6, 7, 8 или 9 и аминокислотную последовательность короче, чем зрелый белок SLIT3.
Термин «зрелый белок SLIT3» имеет отношение к белку SLIT3 человека без сигнальной пептидной последовательности. Предпочтительно зрелый белок SLIT3 начинается с позиции 33 или 34 в последовательности SEQ ID NO:1 или начинается с позиции 1 или 2 в последовательности SEQ ID NO:2.
В некоторых воплощениях фактор, изменяющий направление роста, включает аминокислотную последовательность, которую выбирают из последовательностей SEQ ID NO: от 1 до 9 или которая имеет, по меньшей мере, 85% гомологии в аминокислотной последовательности с последовательностями SEQ ID NO: от 1 до 9, в которой аминокислотная последовательность предпочтительно короче, чем зрелый белок SLIT3.
В другом предпочтительном воплощении фактор, изменяющий направление роста, в соответствии с изобретением включает, по меньшей мере, аминокислотную последовательность последовательностей SEQ ID NO:1 от 34 до 917 положения, от 47 до 863 положения, от 66 до 857 положения, от 279 до 863 положения, от 279 до 857 положения, от 279 до 724 положения, от 279 до 504 положения, от 311 до 432 положения, от 335 до 432 положения или от 312 до 437 положения. Более предпочтительно, фактор, изменяющий направление роста, в соответствии с изобретением включает, по меньшей мере, аминокислотную последовательность последовательностей SEQ ID NO:1 от 308 до 413 положения, от 308 до 317 положения, от 331 до 340 положения, от 344 до 352 положения, от 357 до 366 положения, от 380 до 389 положения, от 394 до 402 положения или от 404 до 413 положения или их комбинации.
Дополнительно, факторы, изменяющие направление роста, в которых один или несколько Cys заменены другой аминокислотой, в особенности Ala, представляют собой предпочтительные факторы, изменяющие направление роста. Факторы, изменяющие направление роста, включающие последовательность, которую выбирают из последовательностей SEQ ID NO: от 1 до 9, в особенности из последовательностей SEQ ID NO: от 2 до 9, в которых один или несколько Cys заменены другой аминокислотой, в особенности Ala, представляют собой предпочтительные факторы, изменяющие направление роста. Последовательность SEQ ID NO:21, которая получена из последовательности SEQ ID NO:9 путем замещения Cys в положении 85 на Ala, представляет собой предпочтительный пример такого фактора, изменяющего направление роста.
В предпочтительном воплощении фактор, изменяющий направление роста, негликозилирован, по меньшей мере, во втором обогащенном лейцином повторяющемся домене или в гомологичном обогащенном лейцином повторяющемся домене.
Термин «второй обогащенный лейцином повторяющийся домен» настоящего изобретения имеет отношение к консервативной обогащенной лейцином аминокислотной последовательности, присутствующей в белках SLIT. Обогащенный лейцином повторяющийся (LRR) домен белка SLIT3 состоит из четырех LRR (LRR1-4), фланкированных амино- и карбокси-концевыми консервативны