Рекомбинантная плазмидная днк pmaltev-legumain, кодирующая полипептид, обладающий антигенными свойствами белка легумаин opisthorchis felineus, и штамм e.coli bl 21(de3)plyss-pmaltev-legumain - продуцент рекомбинантного полипептида, обладающего антигенными свойствами белка легумаин opisthorchis felineus
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой рекомбинантную плазмидную ДНК pMALTEV-legumain, молекулярной массой 4,78 мегадальтон и размером 7839 п.н., кодирующую полипептид, обладающий антигенными свойствами белка легумаин Opisthorchis felineus, и содержащую фрагмент векторной плазмиды pMALTEV, включающий Ptac промотор; lac-операторную последовательность; последовательность гена malE, кодирующего мальтоза-связывающий белок; сочетание терминаторов транскрипции rrnB Т1Т2 E.coli; ген β-лактамазы и участок ori (pBR322) инициации репликации; кДНК гена легумаин O.felineus без сигнального пептида, фланкированную сайтами рестрикции BamHI и HindIII; промотор гибридный Ptac; lac-операторную последовательность для усиления связывания lac-репрессора; терминаторы транскрипции гена rrnB E.coli (t1 и t2); в качестве генетического маркера ген β-лактамазы (ampR), детерминирующий устойчивость трансформированных плазмидой pMALTEV-legumain клеток E.coli к ампициллиновым антибиотикам; нуклеотидную последовательность, кодирующую MBP (мальтоза-связывающий белок), являющийся частью гибридной последовательности рекомбинантного белка MBP-legumain и позволяющий выделять рекомбинантный полипептид методами аффинной хроматографии; уникальные сайты эндонуклеаз рестрикции, имеющие следующие координаты: BamHI (2668), EcoRI (2675), StuI (2685), SalI (2691), SpeI (2704), NotI (2711), XbaI (2725), PstI (2737), XhoI (2740), SphI (2750), KpnI (2756), HindIII (2758). Изобретение относится также к штамму E.coli BL21(DE3)pLysS-pMALTEV-legumain, полученному с помощью рекомбинантной плазмидной ДНК pMALTEV-legumain, депонированному в коллекции культур микроорганизмов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером В-1253. Изобретение позволяет получить рекомбинантный гибридный полипептид с антигенными свойствами белка легумаина O.felineus, обеспечивающий высокую специфичность к антителам паразитарной инфекции O.felineus, что позволяет создавать высокочувствительные тест-системы с использованием указанного полипептида. 2 н.п. ф-лы, 6 ил., 5 пр.
Реферат
Изобретение относится к созданию генетической конструкции и получению на ее основе рекомбинантного штамма Escherichia coli - продуцента рекомбинантного полипептида, обладающего антигенными свойствами белка легумаин Opisthorchis felineus, используемых для проведения или совершенствования иммунодиагностики описторхоза, вызываемого трематодой Opisthorchis felineus (O. felineus), а также для получения специфических антител к этому паразиту и рекомбинантных вакцин против описторхоза. Изобретение может быть использовано в биотехнологии, в частности в генетической инженерии, и медицине, а именно в медицинской паразитологии и иммунологии.
Печёночный сосальщик Opisthorchis felineus (O. felineus) относится к представителям класса Trematoda, относимого в супертаксон Lophotrochozoa, объединяющий низших многоклеточных животных, и представляется весьма интересным и перспективным объектом для изучения процессов взаимодействия паразитов с иммунной системой организма хозяина [1]. В то же время десятки миллионов человек в мире страдают от гельминтозов, передающихся через рыбу, ракообразных, моллюсков и продукты их переработки. Гельминтозы, вызываемые трематодами, Opisthorchis felineus, Opisthorchis viverrini, описторхоз, и Clonorchis sinensis, клонорхоз или китайский описторхоз, являются важными эндемичными заболеваниями среди населения Азиатских стран, а описторхоз, вызываемый Opisthorchis felineus, является заболеванием, широко распространенным на территории России, в частности Западной Сибири. Итак, Opisthorchis felineus (как и другие представители семейства описторхид), не только интересная модель для фундаментальных исследований, но и является важным с медицинской точки зрения объектом, поскольку, паразитируя в печени людей, вызывает описторхоз, характеризующийся повреждением гепатобилиарной системы, а также способствующий развитию холангиокарциномы. В странах СНГ очаги описторхоза приурочены к бассейнам таких рек, как Иртыш, Обь, Енисей, Урал, Волга, Кама, Дон, Днепр, Северная Двина и Неман. Максимальный уровень зараженности населения регистрируется в среднем и нижнем течении Оби и Иртыша. Если в Европейской части России описторхисами инвазировано около 0,02-0,1% взрослого населения, то зараженность им населения территорий Обь-Иртышского речного бассейна в отдельных районах достигает 95%. Заражение описторхозом окончательных хозяев - человека и млекопитающих - происходит при употреблении в пищу сырой, малосоленой, вяленой или недостаточно термически обработанной рыбы, содержащей инвазионные личинки (метацеркарии) [2, 3].
В настоящее время накоплены многочисленные экспериментальные и клинические данные о способах диагностики гельминтозов, которые в значительной степени являются несовершенными. Важнейшими критериями при разработке любых иммунодиагностических систем являются их чувствительность и специфичность, повышение которых невозможно без использования более специфичных и стандартных составляющих. Основной недостаток всех иммунодиагностических методов анализа описторхоза заключается в недостаточной специфичности и чувствительности из-за использования мало-специфических фракций антигена (АГ), типа соматических экстрактов для диагностики описторхоза. Неадекватность и нестандартность антигена, используемого для диагностики, не позволяет повысить чувствительность и специфичность иммунохимических тестов.
Иммунодиагностика описторхоза развивается по трем основным направлениям - обнаружение циркулирующих антител (Ig G, Ig M, Ig A, Ig E), циркулирующих иммунных комплексов (ЦИК) и экскретируемых или выделяемых антигенов описторхиса [4, 5]. Однако современные иммуноферментные наборы для определения антител к антигенам описторха обладают существенными недостатками. Это, прежде всего, низкая чувствительность и специфичность анализа при хронических формах глистной инвазии из-за использования малоспецифичных фракций антигена [6]. В результате этот вид диагностики часто дает недостоверные данные и его применение в клинической практике ограничено.
Мировой опыт показывает, что для более успешного и эффективного решения проблем, связанных с описторхозом, необходимо развитие современных методов диагностики, профилактики и лечения этого заболевания. В то же время к настоящему времени практически нет данных об иммунном ответе организма-хозяина на отдельные или индивидуальные белки-антигены O. felineus. Иммуногенные белки как этого, так и близкородственных гельминтов, в основном, не идентифицированы и мало что известно о формировании клеточного и гуморального иммунитета, о молекулярных механизмах защиты человеческого организма. В последние годы, значительные усилия учёных направлены на идентификацию методами масс-спектрометрии белков трематод, проведение их функциональной аннотации, выбор белков-мишеней для совершенствования иммунодиагностики, а также осуществление перехода к генам, ответственным за синтез определённых белков, конструирование плазмид, несущих гены, выбранных белков, наработка целевых рекомбинантных белков в бактериальной или иной системах, а также очистка и изучение их антигенных свойств.
В настоящее время в известных источниках информации описаны способы получения рекомбинантных прокариотических белков на основе генов гельминтов O. viverrini и C. sinensis [7-13]. Наибольший интерес представляют работы, где авторы, используя данные по протеому этих гельминтов и результаты скрининга библиотеки кДНК, выявили гены возможных белков-иммуногенов O. viverrini и C. sinensis и провели конструирование и клонирование плазмид, несущих эти гены. Далее, были получены рекомбинантные аналоги этих белков, и методами иммуноблоттинга и ИФА было проведено тестирование взаимодействия позитивных сывороток от пациентов, больных описторхозом, с этими рекомбинантными белками. В результате полученные оценочные чувствительность и специфичность проведенного анализа для различных рекомбинантных белков находились или определялись в диапазоне 15-85% и 90-100% соответственно, что указывает на возможность использования данных рекомбинантных аналогов белков этих трематод в иммунодиагностических тест-системах.
В этой связи одним из наиболее перспективных путей совершенствования методов иммунодиагностики является использование рекомбинантных аналогов паразитарных белков, синтезированных в различных экспрессирующих системах. Использование в качестве антитело-связывающего субстрата рекомбинантных белков, сохраняющих антигенные детерминанты паразитарных белков, должно привести к увеличению специфичности и чувствительности иммунодиагностических методов [12].
Патентный поиск и анализ источников патентной информации также подтвердил выявленные тенденции. В результате поиска обнаружены патенты и заявки, имеющие отношение к близкородственным трематодам O. viverrini и C. sinensis. Наибольший интерес из зарубежных патентов представляют изобретения китайской компании Сун-Ят-Сен [14-16], касающиеся рекомбинантных аналогов белков O. viverrini и C. sinensis, которые могут быть использованы для совершенствования иммунодиагностики описторхоза и клонорхоза.
Вместе с тем необходимо отметить, что в результате изучения источников научно-технической и патентной информации, не было выявлено какой-либо информации о генах паразита O. felineus, индуцирующих синтез иммуногенных белков в процессе взаимодействия паразит - хозяин. Данные, касающиеся рекомбинантных аналогов белков O. felineus, которые могут быть использованы для совершенствования иммунодиагностики описторхоза, также не были обнаружены.
Легумаин (аспарагенил эндопептидаза) относится к классу цистеиновых протеаз (база данных MEROPS clan CD, family C13), гидролизует пептиды и белки по аспарагину с С-конца белка. Этот белок описан в составе секреторного протеома для многих трематод: Opisthorchis viverrini, Clonorchis sinensis, Schistosoma mansoni, Fasciola spp. [17-18].
Наиболее близким аналогом, по мнению заявителя, является информация о получении рекомбинантного аналога белка Clonorchis sinensis [19]. Ген легумаин Clonorchis sinensis был экспрессирован с использованием системы экспрессии QIAExpress фирмы QIAGEN. При использовании в иммунодиагностике рекомбинантного аналога белка Clonorchis sinensis, полученного в прокариотической системе экспрессии, была показана высокая чувствительность и специфичность - 71,4% и 100% соответственно - взаимодействия человеческих сывороток с указанным белком [19].
Однако вышеуказанные рекомбинантные белки не могут быть использованы в иммунодиагностике O. felineus. Идентификация гена, определяющего или кодирующего синтез белка легумаин O. felineus, получение на основе этого гена рекомбинантных белков, а также использование в иммунодиагностике паразитарных инфекций рекомбинантных аналогов белка легумаин O. felineus в известных источниках научно-технической и патентной информации не обнаружено.
Техническим результатом заявляемого изобретения является получение рекомбинантного гибридного полипептида с антигенными свойствами белка легумаина O. felineus, обеспечивающего высокую специфичность к антителам паразитарной инфекции O. felineus, что позволит создавать высокочувствительные тест-системы с использованием указанного полипептида.
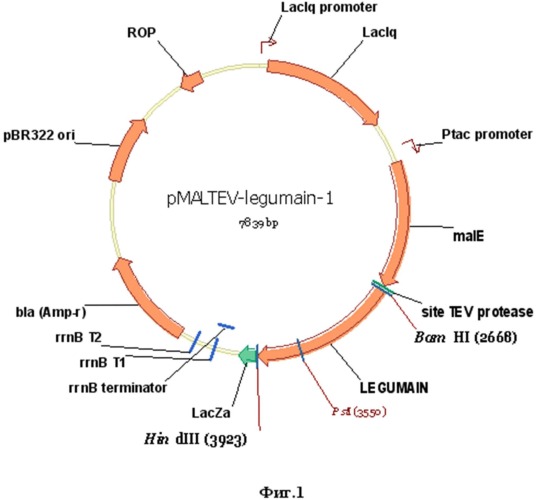
Указанный технический результат достигается созданием рекомбинантной плазмидной ДНК pMALTEV-legumain, кодирующей полипептид c антигенными свойствами белка легумаин Opisthorchis felineus и обладающей молекулярной массой 4,78 мегадальтон и размером 7839 п.н., содержащей в соответствии с физической картой плазмиды, приведенной на фиг.1:
- фрагмент векторной плазмиды pMALTEV, включающий Ptac промотор; lac-операторную последовательность;
- последовательность гена malE, кодирующего мальтоза-связывающий белок;
- сочетание терминаторов транскрипции rrnB Т1Т2 E.coli;
- ген β-лактамазы и участок ori (pBR322) инициации репликации;
- кДНК гена легумаин O. felineus без сигнального пептида фланкированную сайтами рестрикции BamHI и HindIII;
- промотор гибридный Ptac;
- lac-операторную последовательность для усиления связывания lac-репрессора;
- терминаторы транскрипции гена rrnB E. coli (t1 и t2);
- в качестве генетического маркера ген β-лактамазы (ampR), детерминирующий устойчивость трансформированных плазмидой pMALTEV- legumain клеток E. coli к ампициллиновым антибиотикам;
- последовательность, кодирующую MBP (мальтоза-связывающий белок), являющийся частью гибридной последовательности рекомбинантного белка MBP-legumain и позволяющий выделять рекомбинантный полипептид методами аффинной хроматографии;
- уникальные сайты эндонуклеаз рестрикции, имеющие следующие координаты: BamHI (2668), EcoRI (2675), StuI (2685), SalI (2691), SpeI (2704), NotI (2711), XbaI (2725), PstI (2737), XhoI (2740), SphI (2750), KpnI (2756), HindIII (2758).
Указанный технический результат достигается также созданием штамма E.coli BL21(DE3)pLysS-pMALTEV-legumain - продуцента рекомбинантного полипептида, обладающего антигенными свойствами белка легумаин Opisthorchis felineus, полученный с использованием рекомбинантной плазмидной ДНК pMALTEV- legumain по п.1 формулы для применения в иммунодиагностике инфекции Opisthorchis felineus и депонированный в коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор» под номером В-1253.
Штамм Escherichia coli BL21(DE3) pLysS-pMALTEV-legumain обеспечивает при культивировании на жидких питательных средах биосинтез указанного полипептида в растворимой форме с уровнем экспрессии не ниже 40 мг рекомбинантного гибридного белка на литр культуральной жидкости. Растворимость гибридного белка обеспечивается экспрессией легумаина совместно с мальтоза-связывающим белком (MBP). Высокий уровень индукции биосинтеза целевого полипептида обеспечивается наличием в плазмиде pMALTEV-legumain оптимизированной промотор-операторной последовательности, состоящей из гибридного промотора Ptac, узнаваемого РНК-полимеразой E.coli, и lac-операторного участка, способного к высокому уровню связывания lac-репрессора и эффективной репрессии гибридного промотора. Благодаря наличию в плазмиде pMALTEV- legumain нуклеотидной последовательности, кодирующей специфический сайт узнавания TEV протеазы (Glu-Asn-Leu-Tyr-Phe-Gln-Gly), обеспечивается в дальнейшем отщепление целевого белка легумаин от MBP с помощью TEV протеазы.
Изобретение иллюстрируется следующими фигурами графических изображений:
Фиг.1. Физическая карта рекомбинантной плазмиды pMALTEV- legumain.
Условные обозначения:
BamHI, HindIII - уникальные сайты узнавания для соответствующих эндонуклеаз рестрикции, в скобках указаны координаты их сайтов
Ptac promoter - гибридный промотор
malE - мальтоза-связывающий белок
LEGUMAIN - последовательность гена легумаина O.felineus без сигнального пептида
site TEV protease - специфический сайт узнавания для TEV протеазы.
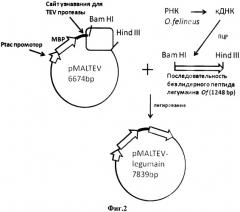
Фиг.2. Схема конструирования плазмиды pMALTEV- legumain.
Условные обозначения:
BamHI, HindIII - уникальные сайты узнавания для соответствующих эндонуклеаз рестрикции, в скобках указаны координаты их сайтов
MBP - мальтоза-связывающий белок
Фиг.3. Нуклеотидная последовательность участка плазмиды pMALTEV- legumain, содержащая ген легумаина O.felineus без сигнального пептида.
Условные обозначения:
Нуклеотиды
(1)-(2391) последовательность гена кодирующего гибридный белок MBP-legumain
(1)-(1059) последовательность рекомбинантной плазмиды pMALTEV-legumain, кодирующая MBP (мальтоза-связывающий белок) - выделена жирным шрифтом
(1)-(3) старт кодон
(1113)-(1134) последовательность, кодирующая специфический сайт узнавания для TEV протеазы - подчеркнута
(1146)-(2391) последовательность рекомбинантной плазмиды pMALTEV-legumain, кодирующая legumain O.felineus - выделена жирным курсивом
Фиг.4. Электрофореграмма. Экспрессия и очистка белка legumain-MBP, синтезирующегося под контролем рекомбинантной плазмиды pMALTEV- legumain в клетках штамма-продуцента Escherichia coli BL21(DE3) pLysS-pMALTEV- legumain.
Фиг.5. Данные по тестированию взаимодействия позитивных антисывороток (АС1 и АС2) от больных описторхозом и отрицательных или нормальных сывороток (НС1 и НС2) с препаратом рекомбинантного белка legumain+MBP в ИФА.
Фиг.6. Выявление методом иммуноблота белка-мишени в препаратах рекомбинантного белка легумаин для антител референс-сыворотки от больного описторхозом.
Условные обозначения:
1-2 - Электрофореграмма. 1 - маркёры молекулярного веса (Fermentas);
2 - очищенный рекомбинантный аналог белка легумаин Opisthorchis felineus;
3-4 - Иммуноблот. 3 - взаимодействие антител позитивной сыворотки от больного описторхозом с очищенным рекомбинантным аналогом белка легумаин O. felineus (Мол. вес ≈ 47-48 кДа); 4 - и отсутствие реагирования с антителами негативной сыворотки здорового пациента.
Характеристика заявляемой рекомбинантной плазмидной ДНК pMALTEV-legumain
Первым этапом в создании штамма-продуцента является конструирование рекомбинантной плазмидной ДНК pMALTEV-legumain.
Плазмида pMALTEV- legumain получена с помощью модификации pMAL-с2 (New England Biolabs), а именно замены сайта протеолиза фактора Xa на специфический сайт протеолиза для TEV протеазы, находящегося после последовательности MBP и встраивания нуклеотидной последовательности кДНК гена легумаин O.felineus без сигнального пептида по сайтами рестрикции BamHI и HindIII.
Полученная в результате плазмида pMALTEV- legumain характеризуется следующими признаками:
• имеет молекулярную массу 4,78 мегадальтон и размер (7839 п.о.);
• содержит последовательность гена легумаин O.felineus;
• состоит из:
- фрагмента векторной плазмиды pMALTEV, сконструированного из плазмиды pMAL-с2 (New England Biolabs) и последовательности специфичного сайта связывания TEV протеазы встроенного после последовательности MBP, который включает Ptac промотор; lac-операторную последовательность; последовательность гена malE, кодирующего мальтоза-связывающий белок, сочетание терминаторов транскрипции rrnB Т1Т2 E.coli; ген β-лактамазы и участок ori (pBR322) инициации репликации;
- кДНК гена легумаин O.felineus без сигнального пептида, фланкированную сайтами рестрикции BamHI и HindIII
• содержит:
- промотор гибридный Ptac;
- lac-операторную последовательность для усиления связывания lac-репрессора;
- терминаторы транскрипции гена rrnB E.coli (t1 и t2);
- в качестве генетического маркера ген β-лактамазы (ampR), детерминирующий устойчивость трансформированных плазмидой pMALTEV- legumain клеток E.coli к ампициллиновым антибиотикам;
- нуклеотидную последовательность, кодирующую MBP (мальтоза-связывающий белок), являющийся частью гибридной последовательности рекомбинантного белка MBP-legumain и позволяющий выделять рекомбинантный полипептид методами аффинной хроматографии;
- уникальные сайты эндонуклеаз рестрикции, имеющие следующие координаты:
BamHI - 2668 EcoRI - 2675 StuI - 2685
SalI - 2691 SpeI - 2704 NotI - 2711
XbaI - 2725 PstI - 2737 XhoI - 2740
SphI - 2750 KpnI - 2756 HindIII - 2758
Способ конструирования плазмиды pMALTEV- legumain заключается во встраивании в плазмиду pMALTEV, линеаризованную по сайтам BamHI и HindIII, фрагмента кДНК, содержащей последовательность легумаина O.felineus без сигнального пептида и фланкированной сайтами рестрикции BamHI и HindIII.
Характеристика заявляемого штамма Escherichia coli BL21(DE3) pLysS-pMALTEV- legumain
Для создания штамма-продуцента рекомбинантного полипептида legumain, компетентные клетки бактерий Escherichia coli BL21(DE3) pLysS трансформируют сконструированной плазмидной ДНК pMALTEV- legumain.
Заявляемый штамм Escherichia coli BL21(DE3) pLysS-pMALTEV- legumain, продуцент рекомбинантного полипептида легумаин, белка-маркёра описторхоза, депонирован в коллекции бактерий, бактериофагов и грибов Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» (ФБУН ГНЦ ВБ «Вектор») под номером В-1253.
Полученный штамм Escherichia coli BL21(DE3) pLysS-pMALTEV- legumain характеризуется следующими признаками:
Исходный штамм E. coli BL21(DE3) pLysS, который является
E. coli B F- ompT hsdS(rB- mB-) gal dcm λ(DE3) [pLysS CamR].
Клетки содержат pLysS плазмиду, которая кодирует Т7 lysozyme - естественный ингибитор T7 RNA pol. Штамм позволяет более строго контролировать экспрессию белков под Т7-pol промотором. При индукции IPTG сильный lacUV5 промотор преодолевает репрессию. CamR- хлорамфеникол устойчивость <40 мкг/мл, но чувствительность >100 мкг/мл.
Морфологические признаки. Клетки мелкие, утолщенной палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. При росте на поверхности агаризованной питательной среды LB колонии круглые, гладкие, блестящие, серо-кремовые, край неровный, консистенция пастообразная. При росте на жидких питательных средах (LB, YT, 2xYT) образуют интенсивную ровную муть.
Физико-биохимические признаки. Клетки растут при температуре от 5 до 37°С при оптимуме pH от 6,5 до 7,0. В качестве источника азота используют органические соединения в виде пептона, триптона, дрожжевого экстракта. В качестве источника углерода используют аминокислоты, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину в концентрации до 300 мкг/мл, обусловленную наличием в плазмидной ДНК гена β -лактамазы.
Штамм Escherichia coli BL21(DE3) pLysS-pMALTEV- legumain обеспечивает индуцируемый ИПТГ (изопропил- β -D-тиогалактозид) синтез рекомбинантного гибридного белка MBP-legumain, с уровнем экспрессии при росте на жидких питательных средах до 40 мг целевого белка на 1 литр культуральной жидкости с выходом целевого белка от 5 до 8 % от суммарного клеточного белка. Цифровая обработка электрофореграмм показала, что чистота белков после аффинной хроматографии достигает 67-88 %.
Сущность изобретения заключается в том, что фрагмент кДНК, содержащей последовательность легумаина O.felineus без сигнального пептида и фланкированной сайтами рестрикции BamHI и HindIII, клонируют в плазмиду pMALTEV по сайтам BamHI и HindIII, в результате получают плазмиду pMALTEV- legumain, кодирующую гибридный белок MBP- legumain, включающий последовательность мальтоза-связывающего белка и легумаина O.felineus без сигнального пептида. Данный гибридный белок экспрессируется в штамме E. coli BL21(DE3)pLysS- pMALTEV- legumain при температуре 30°С и 0,3 mM концентрации IPTG (ИПТГ). После очистки растворимый гибридный белок обрабатывается TEV протеазой, что позволяет в дальнейшем отщепить целевой белок легумаин O.felineus от MBP. Полученный рекомбинантный полипептид legumain имеет антигенные свойства легумаина O.felineus.
Нуклеотидная последовательность участка плазмиды pMALTEV- legumain, содержащая ген легумаина O.felineus без сигнального пептида, приведены на фиг.3.
Таким образом, впервые получены плазмидная ДНК гена legumain Opisthorchis felineus и штамм-продуцент, обеспечивающие экспрессию рекомбинантного белка, включающего аминокислотную последовательность одноименного белка паразита. Этот белок продуцировался в составе гибридного белка-легумаина с мальтоза-связывающим белком (MBP - maltose binding protein), обозначенным как legumain-MBP и пригодным для иммунодиагностики антител к Opisthorchis felineus.
Для лучшего понимания сущности изобретения ниже приведены примеры его осуществления.
Пример 1. Способ конструирования рекомбинантной плазмидной ДНК pMALTEV- legumain.
Процедуры обработки плазмидных ДНК эндонуклеазами рестрикции, ферментами модификации, электрофоретического разделения гидролизатов ДНК, выделения фрагментов ДНК из агарозного геля, проведения лигазных реакций, получения и трансформации компетентных клеток E.coli, получения и анализа рекомбинантных клонов, выделения плазмидных ДНК, рестриктного картирования и секвенирования по методом Сэнгера проводили в соответствии с методическим руководством [20] и инструкциями производителя используемых наборов.
Для выделения суммарной РНК из O.felineus использовали набор для выделения РНК (Aurum™ Total RNA Mini Kit - Bio-Rad Laboratories) и действовали согласно инструкции компании изготовителя. Концентрацию РНК, выделенную вышеуказанными методами, степень ее очистки от белков и компонентов лизирующего буфера и целостность определяли на приборе Agilent 2100 bioanalyzer (RIN>8,7). Образцы РНК, содержащие недеградированные 18S и 28S рибосомальные РНК, использовали в качестве матрицы для синтеза кДНК. Для получения кДНК был использован набор RevertAid™ First Strand cDNA Synthesis Kits (Fermentas) согласно инструкции производителя.
Получение фрагментов ДНК с использованием полимеразной цепной реакции (ПЦР).
Объём стандартной реакции составлял 10-25 мкл; реакционная смесь состояла из 25-50 нг ДНК-матрицы, по 10 пмоль смыслового и антисмыслового праймеров, 0,25 мМ каждого из четырех dNTP, 2 ед. активности ДНК-полимеразы (Phusion® ДНК-полимераза (“Finnzyme”, Finland), Taq ДНК-полимераза (“СибЭнзим”, Новосибирск), в соответствующем фирменном реакционном буфере (1х) и необходимый объем Milli-Q воды. Для проведения реакций использовали амплификатор Master Cycler gradient (Eppendorf). Для наработки ампликонов с кодирующими последовательностями выбранного нами белка легумаин использовалась Phusion® ДНК-полимераза (“Finnzyme”, Finland), отличающаяся высокой точностью и процессивностью, требующая более высокой температуры денатурации и определения температуры отжига праймеров с помощью калькулятора температур на сайте производителя. Программы, используемые для амплификации кодирующей последовательности легумаина: 1 цикл: 2 минуты инкубация при 98°С; 30 циклов: денатурация 20 секунд при 98°С, отжиг праймеров 30 секунд при температуре 65°С, элонгация 1 минута 10 секунд при 72°С; 1цикл: элонгация 5 минут при 72°С. Продукты амплификации хранили при -20°С. Для проведения ПЦР скрининга использовали Taq ДНК-полимеразу (“СибЭнзим”, Новосибирск) и следующую программу амплификации: 1 цикл - 2 минуты инкубация при 95°С; 25 циклов: денатурация 5 секунд при 95°С, отжиг праймеров 20 секунд при температуре 59°С, элонгация 1 минуту 10 секунд при 72°С; элонгация 1 цикл 5 минут 72°С.
Подготовка векторной плазмиды pMALTEV для получения рекомбинантных ДНК pMALTEV- legumain
Для получения конструкци рекомбинантной плазмиды, кодирующей белок легумаин O. felineus, была выбрана коммерчески доступная векторная плазмида pMALTEV, которая была любезно предоставлена лабораторией иммуногенетики (Институт молекулярной и клеточной биологии СО РАН). Она дает возможность получения гибридного белка (мальтоза-связывающий белок - целевой белок) для повышения растворимости и содержащая сайт для TEV протеазы для дальнейшего разделения этих белков. Данные плазмиды переводили в линейную форму гидролизом BamHI, HindIII эндонуклеазами рестрикции. Были получены варианты линейных форм pMALTEV/BamHI/HindIII. Полученные линейные формы очищали с помощью препаративного 1% агарозного гель электрофореза. После визуализации векторные плазмиды элюировали при помощи набора QIAquick Gel Extraction Kit (Qiagen). Трансформацию электрокомпетентных клеток E. coli проводили следующим образом. Оттаивали 40 мкл клеток на льду, добавляли к ним раствор плазмидной ДНК (1-10 мкл) или очищенные продукты реакции лигирования (1-2 мкл). Затем на холоде переносили суспензию клеток с ДНК в кювету для электропорации ёмкостью 100 мкл (ширина щели 1мм), кювету помещали в импульсный генератор Gene Pulser XcellTM (Bio-Rad) и проводили электропорацию ДНК при 1700 В в течение 4-4.8 миллисекунд. После этого суспензию клеток переносили в 1 мл среды LB, предварительно прогретой до +42°С, и инкубировали 1 час при +37°С. По окончании инкубации часть клеточной суспензии высевали на чашку Петри, содержащую 1.5% агар с антибиотиком для скрининга трансформантов и растили около 16 часов при +37°С. Полученные отдельные колонии трансформированных клеток использовали для наращивания бактериальной суспензии и выделения плазмидной ДНК.
Выделение плазмидной ДНК pMALTEV- legumain
Индивидуальную колонию E. coli засевали в 5 мл стерильной жидкой среды LB с добавлением ампициллина натриевой соли в рабочей концентрации и растили 16-18 часов при 37°С. Осаждение клеток проводили при 8000 g 5 минут и выделяли вектор pMALTEV- legumain набором QIAprep Spin Miniprep Kit (Qiagen) по протоколу производителя.
Определение нуклеотидной последовательности ДНК.
При выполнении данной работы последовательности всех фрагментов ДНК, клонированных в составе различных векторов, были проверены с помощью секвенирования. В качестве стандарта использовали открытые рамки трансляции интересующих нас белков, найденные в EST последовательностях O.felineus, представленные в нашей кДНК библиотеке. После очистки образцов ДНК проводили реакцию Сэнгера на амплификаторе Master Cycler gradient (Eppendorf). Реакционная смесь содержала 1мкг ДНК, 2 пмоля праймера (смыслового или антисмыслового), BigDye-буфер и BigDye (Terminator Cycle Sequencing Kit v. 3.1, Applied Biosystems). По окончании реакции смесь подвергали очистке с помощью преосаждения этанолом, 125mM ЭДТА и 3M натрия ацетатом по следующему протоколу: для переосаждения добавляют 1/10 объема 125mM ЭДТА, 1/10 объема 3M натрия ацетата и 2,5 объема 100% этанола, перемешивают, инкубируют 15 минут при комнатной температуре, центрифугируют 13000 x g 20 минут при 40С, аккуратно удаляют супернатант, промывают 3,5 объемами 70% этанола, снова цунтрифугируют и удаляют суператант и образец высушивают на концентраторе Eppendorf 5301.
Образцы ДНК передавали в Центр коллективного пользования СО РАН "Геномика" (Институт химической биологии и фундаментальной медицины Сибирского отделения РАН) для анализа на секвенаторе ABI 3130xl Genetic Analyser, (Applied Biosystems). Компьютерный анализ нуклеотидных последовательностей, полученных после анализа на секвенаторе, проводили с помощью программ и Sequence Scaner v1.0 (Applied Biosystems).
Схема плазмидной ДНК pMALTEV- legumain и способ ее конструирования представлены на Фиг.1 и Фиг.2.
Таким образом, получена плазмидная ДНК pMALTEV- legumain для прокариотической экспрессии полноразмерного гена легумаин Opisthorchis felineus. Плазмида pMALTEV- legumain содержит открытую рамку считывания, кодирующую рекомбинантный полипептид legumain-MBP длиной 797 аминокислотных остатков (расчетный MW=89,4 кДа), включающий аминокислотную последовательность белка легумаин (длина 420 аминокислот, расчетный MW=47,9 кДа). Аминокислотная последовательность рекомбинантного гибридного белка может быть определена на основании нуклеотидной последовательности (фиг. 3) клонированного фрагмента ДНК.
Пример 2. Экспрессия рекомбинантного белка legumain-MBP в прокариотической системе E.coli и анализ его растворимости.
Для получения рекомбинантного белка легумаин использовали штамм E. coli BL21(DE3)pLysS, трансформированный плазмидной ДНК pMALTEV-legumain и обозначенный как Escherichia coli BL21(DE3) pLysS-pMALTEV-legumain, который после добавления IPTG до конечной концентрации 0,3 мМ культивировали при 30°С в 500 мл жидкой среды LB с добавлением ампициллина натриевой соли и перемешивании с частотой 180 об/мин. После индукции IPTG и инкубации культуральную суспензию центрифугировали при 4000 g в течение 20 минут при 4°С и осадок растворяли в буфере (20mM TrisHCl, 200mM NaCl, 1mM ЭДТА). Для дальнейшего выделения и очистки целевого белка из биомассы суспензию подвергали обработке ультразвуком (ультразвуковой дезинтегратор Vibra CellTM (Sonics) на льду (пять раз по 10 секунд при 300W с 30 секундными паузами между обработками). Центрифугировали 15000g 20 минут при 4°С, полученные супернатант и осадок анализировали на наличие целевого белка с помощью ДСН-ПААГ электрофореза.
Сравнительный анализ белкового состава клеточных лизатов показывает, что штамм Escherichia coli BL21(DE3) pLysS-pMALTEV- legumain экспрессирует рекомбинантный полипептид legumain-MBP с молекулярной массой около 100 кДа по электрофоретической подвижности (Фиг.4).
Пример 3. Одностадийная очистка рекомбинантного белка legumain-MBP с помощью аффинной хроматографии.
Очистку гибридного белка MBP-legumain проводили с помощью аффинной хроматографии, используя свойство MBP связывать мальтозу. При прохождении через колонку с амилозой (Amylose resin-New England Biolabs) гибридный белок связывался, затем его элюировали 10 mM мальтозой. Очистку проводили по протоколу производителя (pMAL Protein Fusion & Purification System. Instruction Manual. NEB #E8200S Version 1.2 (New England Biolabs). Обработка очищенного гибридного белка MBP-legumain с помощью TEV протеазы позволяет в дальнейшем отщепить целевой белок легумаин от MBP и в результате дополнительной очистки выделить белок легумаин O.felineus. Полученные клеточные лизаты штамма-продуцента и очищенные рекомбинантные белки анализировали методом белкового электрофореза по методу Лэммли в 10%-12% ДСН-ПААГ и результаты показаны на Фиг.4 и Фиг.6.
Концентрацию общего белка в лизатах клеток штамма-продуцента, а также в очищенном препарате белка legumain-MBP определяют путем измерения оптической плотности по Bio-Rad-protein assay на спектрофотометре с использованием калибровочной кривой, построенной для препаратов очищенного бычьего сывороточного альбумина (BSA) (мол. масса 55 кДа) с известными концентрациями.
Пример 4. Определение антигенных свойств рекомбинантого белка legumain-MBP.
С этой целью выявляли взаимодействие рекомбинантного белка legumain-MBP с набором позитивных антисывороток больных описторхозом и негативных сывороток (ЗАО "Вектор-Бест"). Выявление антител в сыворотках крови проводили с помощью твердофазного иммуноферментного анализа (ИФА) с использованием в качестве антигена белка legumain-MBP. Антиген сорбировали в 100 мкл 0,05 М фосфатного буфера, pH 8, в 96-луночных планшетах (Nunc, Дания) в течение ночи при 4°C. Места неспецифического связывания в лунках полистироловых планшетов блокировали добавлением 0,25% раствора яичного альбумина или казеина (ICN, США) в забуференном физрастворе (ЗФР), содержащем 145 мМ NaCl, 10 мМ Tris-HCl, 0,5%-ный феноловый красный, 0,1%-ный Tween-20, pH 7,4. В лунки вносили сыворотку в различных разведениях в 0,2%-ном растворе яичного альбумина казеина (ICN, США) в ЗФР, и инкубировали 1 ч при 37°C. Планшеты промывали 5 раз в ЗФР. Иммунные комплексы выявляли при помощи антивидового пероксидазного конъюгата. После трехкратного промывания ЗФР в лунки добавляли раствор О-фенилендиамина (1 мг/мл ОФД, 0,03% перекиси водорода) в цитратно-фосфатном буфере (0,2M лимонная кислота и 0,5M Na2HPO4, pH 5,0). Планшеты выдерживали 20 мин в этом растворе, реакцию окрашивания останавливали добавлением 1N соляной кислоты (100 мкл на лунку). Оптическую плотность образцов измеряли на спектрофотометре («Multiscan», Финляндия) при длине волны 492 нм. Положительными считали пробы, значения ОП которых превышали отрицательный контроль в три раза. Результаты анализа представлены на рисунке 5.
Анализ показывает, что рекомбинантный полипептид legumain-MBP связывается с антителами позитивных антисывороток больных описторхозом и не реагирует с антителами негативных сывороток (ЗАО "Вектор-Бест") (Фиг. 5).
Пример 5. Определение взаимодействия антител позитивной сыворотки больного описторхозом с рекомбинантным аналогом белка легумаин Opisthorchis felineus.
Контроль белок-специфичности взаимодействия антител позитивной сыворотки осуществляли методом иммуноблота. Для этого проводили процедуру белкового электрофореза (ЭФ). Постановку ЭФ проводили по методу, описанному в работе [21] в прерывистой буферной системе с использованием 10-15% полиакриламидного геля с 0,1 % додецилсульфата натрия в трис-глициновом буфере. Разделяющий гель содержал 0,0625 М трис-HCl (pH 8,8), 0,1% SDS, 10(15)% акриламид, 1% N,N- метиленбисакриламид. Пробы наносили в буфере, содержащем 0, 0625 М трис-HCl (pH 6,8), 2% SDS, 5% 2-меркаптоэтанол, 10% глицерин, 0,01% бромфеноловый синий. Перед нанесением пробы прогревали 3 мин при 95°С. Электрофорез вели в режиме 10 В/см. Окраску гелей проводили при помощи Кумасси G-250.
Белки, разделенные электрофорезом в полиакриламидном геле, как описано выше, переносили на нитроцеллюлозную мембрану («Millipore», США) по методу Towbin et al., [22] на аппарате Transphor (« LKB», Швеция) в течение 1,5 часов при напряжении 80 В в 0,025М трис-HCl буфере, содержащем 0,192М глицина (рН 8,3) и 20% этанола. Контроль переноса белков на нитроцеллюлозу осуществляли окрашиванием отрезанной от мембраны полоски с белковыми маркерами амидочёрным с последующей отмывкой в растворе, содержащем 8% дистиллированной воды, 90% этанола и 2% ледяной уксусной кислоты. Мембрану целиком или предварительно нарезанные полоски мембраны помещали в ЗФР с твином, содержащий 0,5% казеина на 12 ч при +4°C или на 2 ч при 37°C. Обработанные таким образом полоски инкубировали с препаратами поликлональных сывороток (в течение 1-3 ч при 37°C или 12ч при +4°C). От избытка антител избавлялись 3-кратным промыванием мембраны ЗФР. Далее мембраны обрабатывали антивидовыми антителами, меченными пероксидазой, 2 ч при 37°C. Полоски промывали ЗФР и проявляли в растворе хромогена I (1 мг/мл 4-хлор-1-нафтола в 50 мМ трис-HCl буфере, рН 7,4, содержащем 0,145 М NaCl, 20% этанола и 0,03 % перекиси водорода) или в растворе хромогена II (3,3 диаминобензидин тетрагидрохлорид). Специфическое взаимодействие антител сывороток с рекомбинантными белками проявлялось в виде ярких сине-фиолетовых или коричневых полос, в зависимости от использованного проявляющего раствора.
Анализ показывает, что рекомбинантный аналог белка легумаин Opisthorchis felineus (Мол. вес ≈ 47-48 кДа) связывается с антителами позитивной сыворотки от больного описторхозом и не реагирует с антителами негативной сыворотки (ЗАО "Вектор-Бест") (Фиг. 6).
Таким образом, рекомбинантный аналог белка легумаин Opisthorchis felineus может быть использован для проведения иммунодиагностики специфических антител при описторхозе, а также создания генно-инженерных вакцин или препаратов против O. felineus.
Источники научно-технической и патентной информации
1. Бронштейн A.M., Токмалаев К.М. Паразитарные болезни человека: протозоозы и гельминтозы. - М.: Издательство Российского университета дружбы народов, 2002.
2. World Health Organization Study Group. - Geneva, 2005. - 243 p.
3. Государственный доклад. - М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2009. - с. 349-350.
4. Государственный доклад. - М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2007. - с.360.
5. Лепехин А.В., Мефодьев В.В., Филатов В.Г., Бужак Н.С. Эпидемиология, клиника и профилактика описторхоза. - Издательство Томского университета, 1999.
6. Патент РФ № 2197736, Реагенты для иммуноферментного анализа и метода иммуноферментного тестирования специфических антител описторхоза. Государственный научный центр вирусологии и биотехнологии «Вектор». Заявка №2001112837, 08.05.2001, опубл. 27.01.2003.
7. S.-J. Hong, T. Yun Kim, X.-X. Gan, L.-Y. Shen, K. Sukontason, K. Sukontason, and S.-Y. Kang, Clonorchis sinensis: glutathione S-transferase as a serodiagnostic antigen for detecting IgG and IgE antibodies. // Experimental parasitology - vol. 101 - Aug. 2002 - pp. 231-3.
8. Veerachai Eursitthichoi, Vithoon Viyanant Suksiri Vichasri-Grams, Presert Sobhon, Smarn Tesana, Suchart Edward Upathan, Annemarie Hofman, Gunter Korge,Rudi Grams: Molecular Cloning and Characterisation of a Glutathione S-Transferase En