Биологический синтез дифункциональных алканов из альфа-кетокислот
Иллюстрации
Показать всеИзобретение относится к области биохимии и молекулярной биологии. Предложен способ получения дифункциональных алканов в рекомбинантной клетке-хозяине из исходного материала углеводов в клетках-хозяевах. Изобретение может быть использовано для получения соединений с использованием микроорганизмов для производства химических веществ, производство которых обычными методами является сложным и дорогостоящим. 2 н. и 5 з.п. ф-лы, 5 ил., 5 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Аспекты по изобретению относятся к способам получения дифункциональных алканов в клетках-хозяевах. В частности, аспекты по изобретению описывают компоненты генов, ассоциированных с продукцией дифункционального алкана из исходного материала углеводов в клетках-хозяевах. Более конкретно, аспекты по изобретению описывают метаболические пути для продукции адипиновой кислоты, аминокапроновой кислоты, капролактама, гексаметилендиамина через 2-кетопимелиновую кислоту.
УРОВЕНЬ ТЕХНИКИ
Сырая нефть является основным исходным материалом для синтеза ключевых химических веществ и полимеров. Поскольку нефть становится все более дефицитной и дорогой, биологическая обработка возобновляемого сырья в производстве химических веществ с использованием живых микроорганизмов или их очищенных ферментов вызывает возрастающий интерес. Биологическую обработку, в частности брожение, использовали в течение многих столетий для приготовления напитков. За последние 50 лет микроорганизмы коммерчески использовали для получения соединений, таких как антибиотики, витамины и аминокислоты. Тем не менее использование микроорганизмов для производства промышленных химических веществ было гораздо менее распространено. Только недавно стало понятно, что микроорганизмы могут обладать способностью обеспечивать экономически выгодное получение определенных соединений, которые сложны или дорогостоящи при получении обычными химическими способами.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Аспекты по изобретению относятся к метаболически сконструированной клетке-хозяину для продукции α,ω-дифункциональных Cn-алканов из α-кетокислоты, где концевые функциональные группы α и ω выбраны из группы -OH, -COOH и -NH3 и где n представляет собой целое число в диапазоне от 4 до 8, причем метаболически сконструированная клетка-хозяин генетически модифицирована при помощи нуклеиновой кислоты, содержащей, по меньшей мере, одну нуклеотидную последовательность, кодирующую, по меньшей мере, один фермент биосинтетического пути. В некоторых вариантах осуществления нуклеиновая кислота содержит нуклеотидные последовательности, кодирующие два или более продуктов генов. Метаболически сконструированная клетка-хозяин может представлять собой прокариотическую клетку. Например, в некоторых вариантах осуществления метаболически сконструированная клетка-хозяин является анаэробной прокариотической клеткой. Метаболически сконструированную клетку-хозяина можно выбрать из группы, состоящей из E. Coli, C. glutanicum, B. flavum и B. lactofermentum.
В предпочтительных вариантах осуществления α-кетокислота представляет собой α-кетоглутарат и превращается в α-кетоадипат, α-кетопимелат или α-кетосуберат. В предпочтительных вариантах осуществления клетка-хозяин содержит последовательности нуклеиновой кислоты, кодирующие гомоцитратсинтазу, гомоаконитазу и гомоизоцитратдегидрогеназу. Гомоцитратсинтазу можно выбрать из группы, состоящей из AksA, NifV, hcs и Lys20/21. Гомоаконитазу можно выбрать из группы, состоящей из AksD/E, LysT/U, Lys4, большой/малой субъединиц 3-изопропилмалатдегидратазы и их гомологов. Гомоизоцитратдегидрогеназу можно выбрать из группы, состоящей из AksF, Hicdh, Lysl2, 2-оксосубератсинтазы, 3-изопропилмалатдегидрогеназы и их гомологов.
В предпочтительных вариантах осуществления α,ω-дифункциональный алкан содержит шесть атомов углерода и выбран из группы, состоящей из аминокапроновой кислоты, адипата, гексаметилендиамина, 6-гидроксигексамина, 1,6-гександиола, 6-аминогексанала, 6-аминогексанола и 6-гидроксигексаноата.
Аспекты по изобретению относятся к метаболически сконструированным клеткам-хозяевам для продукции адипиновой кислоты из α-кетопимелата, причем клетка-хозяин дополнительно содержит нуклеиновую кислоту, кодирующую фермент декарбоксилазу и фермент альдегиддегидрогеназу. В некоторых вариантах осуществления фермент декарбоксилаза представляет собой 2-кетодекарбоксилазу и катализирует превращение α-кетопимелата в полуальдегид адипата, и альдегиддегидрогеназа катализирует превращение полуальдегида адипата в адипиновую кислоту. 2-Кетодекарбоксилазу можно выбрать из группы 2-кетоглутаратдекарбоксилазы (kgd), 2-кетоизовалератдекарбоксилазы (kivD), декарбоксилазы трансаминированной аминокислоты (ARO10), бензоилформиатдекарбоксилазы (mdlC), 2-кетоаргининдекарбоксилазы (aruI), фосфонопируватдекарбоксилазы (fom2), изофермента пируватдекарбоксилазы (PDC6, PDC1), изофермента 2 пируватдекарбоксилазы (PDC5, PDC1, PDC6, Aro10, KivD), индолпируватдекарбоксилазы (ipdC) и их гомологов. В некоторых вариантах осуществления декарбоксилаза обладает, по меньшей мере, 30% идентичности при сравнении с 2-кетоглутаратдекарбоксилазой (kgd), 2-кетоизовалератдекарбоксилазой (kivD), декарбоксилазой трансаминированной аминокислоты (ARO10), бензоилформиатдекарбоксилазой (mdlC), 2-кетоаргининдекарбоксилазой (aruI), фосфонопируватдекарбоксилазой (fom2), изоферментом пируватдекарбоксилазы (PDC6, PDC1), изоферментом 2 пируватдекарбоксилазы (PDC5, PDC1, PDC6, Aro10, KivD), индолпируватдекарбоксилазой (ipdC) и их гомологами. В предпочтительных вариантах осуществления альдегиддегидрогеназа представляет собой 6-оксогексаноатдегидрогеназу (ChnE) и ее гомологи. В других вариантах осуществления альдегиддегидрогеназа обладает, по меньшей мере, 30% идентичностью с 6-оксогексаноатдегидрогеназой (ChnE).
Аспекты по изобретению относятся к метаболически сконструированной клетке-хозяину для продукции аминокапроновой кислоты из α-кетопимелата, причем клетка-хозяин дополнительно содержит нуклеиновую кислоту, кодирующую фермент аминотрансферазу и декарбоксилазу. В некоторых вариантах осуществления 2-аминотрансфераза катализирует превращение α-кетопимелата в 2-аминопимелат, и декарбоксилаза катализирует превращение 2-аминопимелата в аминокапроновую кислоту. Аминотрансферазу можно выбрать из группы, состоящей из α-аминоадипатаминотрансферазы-1 (AADAT), аминоадипатаминотрансферазы (LysN), диаминопимелатдегидрогеназы (ddb и dapdh) и их гомологов. В некоторых вариантах осуществления декарбоксилаза представляет собой глутаматдекарбоксилазу. В некоторых вариантах осуществления глутаматдекарбоксилаза кодируется геном или фрагментом гена, выбранным из группы, состоящей из Gad6/7, GadA, GadB и lysA. В некоторых вариантах осуществления декарбоксилаза катализирует превращение α-кетопимелата в полуальдегид адипата, и аминотрансфераза катализирует превращение полуальдегида адипата в аминокапроновую кислоту. Кетодекарбоксилазу можно выбрать из группы 2-кетоглутаратдекарбоксилазы (kgd), 2-кетоизовалератдекарбоксилазы (kivD), декарбоксилазы трансаминированной аминокислоты (ARO10), бензоилформиатдекарбоксилазы (mdlC), 2-кетоаргининдекарбоксилазы (aruI), фосфонопируватдекарбоксилазы (fom2), изофермента пируватдекарбоксилазы (PDC6, PDC1), изофермента 2 пируватдекарбоксилазы (PDC5, PDC1, PDC6, Aro10, KivD), индолпируватдекарбоксилазы (ipdC) и их гомологов. Аминотрансферазу можно выбрать из группы, состоящей из трансаминазы ГАМК, Lys6-дегидрогеназы, трансаминазы орнитиноксокислоты, лизинаминотрансферазы, 4-аминобутиратаминотрансферазы, 4-аминобутиратаминотрансферазы, 4-аминобутиратаминотрансферазы, сахаропиндегидрогеназы (LYS9 и LYS1) или любых гомологичных им белков.
Аспекты по изобретению относятся к продукции гексаметилендиамина из аминокапроновой кислоты, причем клетка-хозяин содержит нуклеиновую кислоту, кодирующую альдегиддегидрогеназу и аминотрансферазу. В некоторых вариантах осуществления альдегиддегидрогеназа катализирует превращение аминокапроновой кислоты в 6-аминогексанал, и аминотрансфераза катализирует превращение 6-аминогексанала в 6-гексаметилендиамин. В предпочтительных вариантах осуществления альдегиддегидрогеназа представляет собой фермент ALDH (EC 1.2.1-). В некоторых вариантах осуществления аминотрансферазу можно выбрать из группы, состоящей из α-аминоадипатаминотрансферазы-1 (AADAT), аминоадипатаминотрансферазы (LysN), диаминопимелатдегидрогеназы (ddb, dapdh) и гомологичных им белков.
Аспекты изобретения относятся к метаболически сконструированной клетке-хозяину для продукции гексаметилендиамина из α-кетопимелата, причем клетка-хозяин содержит нуклеиновую кислоту, кодирующую аминотрансферазу, редуктазу, дегидрогеназу и декарбоксилазу. В некоторых вариантах осуществления аминотрансфераза катализирует превращение α-кетопимелата в 2-аминопимелат, редуктаза катализирует превращение 2-аминопимелата в 2-амино-7-оксогептаноат, дегидрогеназа катализирует превращение 2-амино-7-оксогептаноата в 2,7-диаминогептаноат, и декарбоксилаза катализирует превращение 2,7-диаминогептаноата в гексаметилендиамин. Аминотрансферазу можно выбрать из группы, состоящей из α-аминоадипатаминотрансферазы-1 (AADAT), аминоадипатаминотрансферазы (LysN), диаминопимелатдегидрогеназы (ddb, dapdh) и их вариантов. В некоторых вариантах осуществления редуктаза представляет собой аминоадипатредуктазу или ее гомолог. В некоторых вариантах осуществления аминоадипатредуктаза кодируется Sc-Lys2. В некоторых вариантах осуществления дегидрогеназа представляет собой сахаропиндегидрогеназу или ее гомолог и кодируется Sc-Lys9 или Sc-Lysl или их вариантами. Декарбоксилазу можно выбрать из группы, состоящей из лизиндекарбоксилазы, орнитиндекарбоксилазы и их вариантов.
Некоторые аспекты по изобретению относятся к метаболически сконструированной клетке-хозяину для продукции 6-гидроксигексаноата из α-кетопимелата, причем клетка-хозяин содержит нуклеиновую кислоту, кодирующую алкогольдегидрогеназу. Другие аспекты по изобретению относятся к метаболически сконструированной клетке-хозяину для продукции 1,6-гександиола из 6-гидроксигексаноата, причем клетка-хозяин содержит нуклеиновую кислоту, кодирующую алкогольдегидрогеназу или альдегиддегидрогеназу. Алкогольдегидрогеназу можно выбрать из 6-гидроксигексаноатдегидрогеназы, бутанолдегидрогеназы, ADHIV-дегидрогеназы, пропандиолоксидоредуктазы, ADH6 и их гомологов.
Аспекты по изобретению относятся к способам получения α,ω-дифункциональных Cn-алканов из α-кетоглутарата, где концевые функциональные группы α и ω выбраны из группы -OH, -COOH и -NH3 и где n представляет собой целое число в диапазоне от 4 до 7, включающим культивирование клетки-хозяина в условиях, подходящих для получения α,ω-дифункциональных Cn-алканов; и выделение α,ω-дифункциональных Cn-алканов.
В некоторых аспектах изобретение относится к клетке-хозяину, которая содержит одну или несколько экзогенных последовательностей нуклеиновой кислоты, кодирующих, по меньшей мере, один полипептид, выбранный из гомоцитратсинтазы (EC 2.3.3.-), гомоаконитазы (EC 2.3.3.14), гомоизоцитратдегидрогеназы (EC 1.1.1.-) и их сочетания. В некоторых вариантах осуществления метаболически сконструированные клетки-хозяева продуцируют α-кетоадипат, α-кетопимелат, α-кетосуберат или их сочетание из α-кетоглутарата. В некоторых вариантах осуществления сконструированная клетка-хозяин содержит одну или несколько экзогенных последовательностей нуклеиновой кислоты, кодирующих, по меньшей мере, один полипептид, выбранный из декарбоксилазы α-кетокислоты (EC 4.1.1.-) и дегидрогеназы (EC 1.1.1.-) и их сочетания. В некоторых вариантах осуществления сконструированная клетка-хозяин продуцирует Cn-дикарбоновую кислоту, где n представляет собой целое число в диапазоне от 4 до 7. Например, сконструированная клетка-хозяин продуцирует адипат. В других вариантах осуществления сконструированная клетка-хозяин продуцирует Cn-гидроксикарбоновую кислоту, где n представляет собой целое число в диапазоне от 4 до 7. Например, сконструированные клетки-хозяева продуцируют 6-гидроксигексаноат. Еще в других вариантах осуществления сконструированная клетка-хозяин продуцирует Cn-алкандиол, где n представляет собой целое число в диапазоне от 4 до 7, например, 1,6-гександиол.
В некоторых аспектах по изобретению сконструированная клетка-хозяин, продуцирующая α-кетоадипат, α-кетопимелат, α-кетосуберат или их сочетание из α-кетоглутарата, содержит одну или несколько экзогенных последовательностей нуклеиновых кислот, кодирующих, по меньшей мере, один полипептид, выбранный из декарбоксилазы α-кетокислоты (EC 4.1.1.-), аминотрансферазы (EC 1.4.1.-), аминотрансферазы (EC 2.6.1.-) и их сочетания. В предпочтительных вариантах осуществления сконструированная клетка-хозяин продуцирует аминокапроновую кислоту. В некоторых вариантах осуществления сконструированная клетка-хозяин содержит, кроме того, одну или несколько экзогенных последовательностей нуклеиновой кислоты, кодирующих, по меньшей мере, один полипептид, выбранный из альдегиддегидрогеназы (EC 1.2.1.3), и продуцирует Cn-аминоальдегид или Cn-диаминоалкан, где n представляет собой целое число в диапазоне от 4 до 7. Например, сконструированная клетка-хозяин продуцирует гексаметилендиамин или 6-гидроксигексамин.
В некоторых вариантах осуществления сконструированная клетка-хозяин содержит одну или несколько экзогенных последовательностей нуклеиновой кислоты, кодирующих, по меньшей мере, один полипептид, выбранный из аминоадипаттрансферазы (EC 2.6.1.39), диаминопимелатдегидрогеназы (EC 1.4.1.16), глутаматдекарбоксилазы (EC 4.1.1.-) и их сочетания. В некоторых вариантах осуществления клетка-хозяин продуцирует Cn-аминокарбоновую кислоту, где n представляет собой целое число в диапазоне от 4 до 7. Например, сконструированная клетка-хозяин по пункту продуцирует аминокапроновую кислоту.
Некоторые аспекты по изобретению относятся к сконструированной клетке-хозяину для продукции α,ω-дифункциональных Cn-алканов из α-кетокислоты, содержащей одну или несколько экзогенных последовательностей нуклеиновой кислоты, кодирующих, по меньшей мере, один полипептид, выбранный из α-аминоадипатаминотрансферазы (EC 2.6.1.39), диаминопимелатдегидрогеназы (EC 1.4.1.16), аминоадипатредуктазы (EC 1.2.1.31), сахаропиндегидрогеназы (EC 1.5.1.-), лизиндекарбоксилазы (EC 4.1.1.18), орнитиндекарбоксилазы (EC4.1.1.17) и их сочетания. В некоторых вариантах осуществления сконструированная клетка-хозяин продуцирует Cn-аминоальдегид или Cn-диаминоалкан, где n представляет собой целое число в диапазоне от 4 до 7. Например, сконструированная клетка-хозяин продуцирует гексаметилендиамин. В некоторых аспектах по изобретению сконструированная клетка-хозяин дополнительно содержит одну или несколько экзогенных последовательностей нуклеиновой кислоты, кодирующих, по меньшей мере, один полипептид, выбранный из 3-оксоацил-[ацилпереносящий белок]-редуктазы (EC 1.1.1.100), синтазы жирных кислот (EC 2.3.1.-), дегидратазы (EC 4.2.1.59), 3-гидроксиоктаноил-[ацилпереносящий белок]-дегидратазы (EC 4.2.1.59), еноил-[ацилпереносящий белок]-редуктазы (EC 1.3.1.9) и их сочетания. В некоторых предпочтительных вариантах осуществления сконструированная клетка-хозяин продуцирует Cn-дикарбоновую кислоту, где n представляет собой целое число в диапазоне от 5 до 8. Например, сконструированная клетка-хозяин продуцирует адипат. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит одну или несколько экзогенных последовательностей нуклеиновой кислоты, кодирующих, по меньшей мере, один полипептид, выбранный из альдегиддегидрогеназы (EC 1.2.1.3), и продуцирует Cn-гидроксикарбоновую кислоту, где n представляет собой целое число в диапазоне от 5 до 8, например, 6-гидроксигексаноат. В некоторых вариантах осуществления сконструированная клетка-хозяин продуцирует Cn-алкандиол, где n представляет собой целое число в диапазоне от 5 до 8, например 1,6-гександиол.
Некоторые аспекты по изобретению относятся к сконструированной клетке-хозяину для продукции α,ω-дифункциональных Cn-алканов из α-кетокислоты, содержащей одну или несколько экзогенных последовательностей нуклеиновой кислоты, кодирующих, по меньшей мере, один полипептид, выбранный из α-аминоадипатаминотрансферазы (EC 2.6.1.39), диаминопимелатдегидрогеназы (EC l.4.1.16), аминоадипатредуктазы (EC 1.2.1.31), сахаропиндегидрогеназы (EC 1.5.1.-), лизиндекарбоксилазы (EC 4.1.1.18), орнитиндекарбоксилазы (EC 4.1.1.17) и их сочетания, выбранный из 3-оксоацил-[ацилпереносящий белок]редуктазы (EC 1.1.1.100), синтазы жирных кислот (EC 2.3.1.-), дегидратазы (EC 4.2.1.59), 3-гидроксиоктаноил-[ацилпереносящий белок]дегидратазы (EC 4.2.1.59), еноил-[ацилпереносящий белок]редуктазы (EC 1.3.1.9) и их сочетания, по меньшей мере, один полипептид, выбранный из альдегиддегидрогеназы, и одну или несколько экзогенных последовательностей нуклеиновой кислоты, кодирующих, по меньшей мере, один полипептид, выбранный из аминотрансферазы (EC 1.4.1.-) и аминотрансферазы (EC 2.6.1.-). В некоторых вариантах осуществления клетка-хозяин продуцирует Cn-аминокарбоновую кислоту, где n представляет собой целое число в диапазоне от 5 до 8, например аминокапроновую кислоту. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит одну или несколько экзогенных последовательностей нуклеиновой кислоты, кодирующих, по меньшей мере, один полипептид, выбранный из альдегиддегидрогеназы (EC 1.2.1.3), аминотрансферазы (EC 1.4.1.-) и аминотрансферазы (EC 2.6.1.-) и их сочетания. В некоторых вариантах осуществления сконструированная клетка-хозяин продуцирует 1,n-диаминоалкан, где n представляет собой целое число в диапазоне от 5 до 8, например гексаметилендиамин. В других вариантах осуществления сконструированная клетка-хозяин продуцирует n-аминоспирт, где n представляет собой целое число в диапазоне от 5 до 8, например 6-аминогексанол.
Некоторые аспекты по изобретению относятся к сконструированной клетке-хозяину, содержащей одну или несколько экзогенных последовательностей нуклеиновой кислоты, кодирующих, по меньшей мере, один полипептид, выбранный из аминотрансферазы (EC 2.6.1.7), альдегиддегидрогеназы (EC 1.2.1.3), глутаматполуальдегидальдегидамутазы (EC 5.4.3.8), 3-оксоацил-[ацилпереносящий белок]редуктазы (EC 1.1.1.100), синтазы жирных кислот (EC 2.3.1.-), дегидратазы (EC 4.2.1.59), 3-гидроксиоктаноил-[ацилпереносящий белок]дегидратазы (EC 4.2.1.59), еноил-[ацилпереносящий белок]редуктазы (EC 1.3.1.9) и их сочетания. В некоторых вариантах осуществления сконструированная клетка-хозяин продуцирует n-аминокарбоновую кислоту, где n представляет собой целое число в диапазоне от 5 до 8, например аминокапроновую кислоту.
Некоторые аспекты по изобретению относятся к способу получения α,ω-дифункционального Cn-алкана из α-кетоглутарата, где концевые функциональные группы α и ω выбраны из группы -OH, -COOH и -NH3 и где n представляет собой целое число в диапазоне от 5 до 8, причем способ включает культивирование сконструированной клетки-хозяина в условиях, достаточных для получения α,ω-дифункционального Cn-алкана; и выделение α,ω-дифункционального Cn-алкана.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Изобретение можно более полно понять, исходя из следующего ниже подробного описания и фигур, которые являются частью заявки.
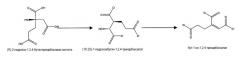
На фигуре 1 показан путь биосинтеза адипиновой кислоты. Стадии от a до 1 описывают путь 2-кетоудлинения из пути биосинтеза кофермента B из Methanococcus jannaschii. Отмеченные стадии a, b, c, d, e, f, g, h, m и n представляют собой превращение субстрата в продукт, описанное ниже.
На фигуре 2 представлена схема последовательности операций для получения с помощью микроорганизмов дифункциональных C(n-1)-алканов, начиная с Cn-α-кетокислоты.
На фигуре 3 представлена схема последовательности операций для получения с помощью микроорганизмов дифункциональных гексанов, начиная с 2-кетопимелата.
На фигуре 4 представлена схема последовательности операций для получения с помощью микроорганизмов дифункциональных Cn-алканов, начиная с Cn-α-кетокислоты.
На фигуре 5 представлена схема последовательности операций для получения с помощью микроорганизмов дифункциональных Cn-гексанов, начиная с 2-кетоадипата.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем документе следующие ниже термины и фразы будут иметь значения, установленные ниже. Если не определено иначе, все технические и научные термины, используемые в настоящем документе, имеют то же самое значение, как обычно понятно специалисту в данной области.
Формы единственного числа включают указание на множественное число, если контекст явным образом не предписывает иначе.
Термины «содержит» и «содержащий» применяют во всеохватывающем общедоступном смысле, означая, что могут быть включены дополнительные элементы.
Термин «включая» применяют в значении «включая в качестве неограничивающих примеров». «Включая» и «включая в качестве неограничивающих примеров» используют взаимозаменяемо.
Все публикации, упомянутые в настоящем документе, включены в настоящий документ в качестве ссылки. Публикации, обсуждаемые в настоящем документе, приведены исключительно для их описания до даты подачи заявки по настоящему изобретению. Ничто в настоящем документе не следует рассматривать в качестве признания, что настоящее изобретение не имеет право противопоставлять факт создания изобретения с более ранним приоритетом такой публикации на основании предшествующего изобретения.
В аспектах по изобретению предлагаются способы и материалы для получения органических алифатических, представляющих интерес соединений быстрым, недорогим и экологически безопасным способом. В связи с этим настоящее изобретение удовлетворяет большому количеству коммерческих и промышленных потребностей. Термин «органическая молекула» относится, например, к любой молекуле, которая преимущественно состоит из углерода и водорода, такой как, например, алканы. Представляющие интерес органические соединения, такие как дифункциональные алканы, диолы, дикарбоновые кислоты и т.д., можно использовать для синтеза пластмассы, нейлона и других продуктов, обычно получаемых из нефти и углеводородов. Аспекты по изобретению относятся к синтезу дифункциональных n-алканов, в которых углеводородные цепи Cn получают из углеводородной цепи Cn или Cn+1, в которой n представляет собой число от приблизительно 1 до приблизительно 8, такое как от приблизительно 2 до приблизительно 5 или от приблизительно 3 до приблизительно 4. В предпочтительном варианте осуществления дифункциональные n-алканы получают из α-(n+1) или n-кетокислоты.
Аспекты по изобретению относятся к получению представляющих интерес дифункциональных алканов в микроорганизмах и предлагают способы получения дифункциональных алканов из источника углеводов в микроорганизме. В настоящем документе «дифункциональные алканы» относится к алканам, содержащим две функциональных группы. Термин «функциональная группа» относится, например, к группе атомов, расположенных некоторым способом, который определяет химические свойства группы и молекулы, к которой она присоединена. Примеры функциональных групп включают атомы галогена, гидроксильные группы (-OH), группы карбоновой кислоты (-COOH) и аминогруппы (-NH2) и т.п. «Спирт» относится, например, к алкильной группе, в которой один или несколько атомов водорода заменено на группу -OH. Термин «первичный спирт» относится, например, к спиртам, в которых группа -OH связана с концевым атомом углерода или атомом углерода на обрыве цепи, таким как в 1-бутаноле, 1-гексаноле и т.п. Термин «вторичный спирт» относится, например, к спиртам, в которых группа -OH связана с атомом углерода, который связан с одним атомом водорода и двумя другими атомами углерода, таким как в 2-бутаноле, 2-гексаноле и т.п. Термин «третичный спирт» относится, например, к спиртам, в которых группа -OH связана с атомом углерода, который связан с тремя другими атомами углерода, таким как в метилпропаноле (трет-бутаноле) и т.п. «Амин» относится, например, к алкильной группе, в которой один или несколько атомов водорода заменены на группу -NH2. «Карбонильное соединение» относится, например, к органическому соединению, содержащему карбонильную группу, C=O, такому как, например, альдегиды, которые имеют общую формулу RCOH; кетоны, которые имеют общую формулу RCOR'; карбоновые кислоты, которые имеют общую формулу RCOOH; и сложные эфиры, которые имеют общую формулу RCOOR'.
Способ предусматривает использование микроорганизмов, способных продуцировать один из следующих ниже, представляющих интерес дифункциональных алканов, в частности, адипиновую кислоту, аминокапроновую кислоту, HMD, 6-гидроксигексаноат. Другие представляющие интерес дифункциональные алканы включают 1,3-пропандиол, глицерин, акриловую кислоту, кадаверин, 3-гидроксипропионовую кислоту, пентаметилендиамин, малеиновую кислоту, янтарную кислоту, адипиновую кислоту, себациновую кислоту, глутаровую кислоту и субериновую кислоту и т.д. Описано несколько способов химического синтеза, например, для адипиновой кислоты и ее промежуточных продуктов, таких как муконовая кислота и полуальдегид адипата; для капролактама и его промежуточных продуктов, таких как 6-аминокапроновая кислота; для гексан-1,6-диаминогексана или гексанметилендиамина; для 3-гидроксипропионовой кислоты и ее промежуточных продуктов, таких как полуальдегид малоната, но только малое количество биологических способов было описано для некоторых из данных органических химических веществ. Поэтому в аспектах по изобретению предлагаются метаболически сконструированные способы, выделенные нуклеиновые кислоты или сконструированные нуклеиновые кислоты, полипептиды или сконструированные полипептиды, клетки-хозяева или генетически сконструированные клетки-хозяева, способы и материалы для получения дифункциональных алканов из неистощимого исходного материала. Источники углерода, подходящие для стартовой точки, включают углеводы и синтетические промежуточные продукты. Примеры углеводов, которые клетки способны метаболизировать, включают сахара, декстрозы, триглицериды и жирные кислоты. Промежуточные продукты из метаболического пути, такие как пируват, оксалоацетат, 2-кетоглутарат, также можно использовать в качестве стартовой точки. Аспекты по изобретению относятся к сконструированным полипептидам и полинуклеотидам, кодирующим ферменты, обладающие активностью или повышенной активностью в отношении природных или неприродных субстратов или обладающие широкой субстратной специфичностью (например, каталитическая разнородность, такая как субстратная разнородность). Термин «полипептид» и термины «белок» и «пептид», которые в настоящем документе используют взаимозаменяемо, относится к полимеру аминокислот, включая, например, продукты генов, встречающиеся в природе белки, гомологи, ортологи, паралоги, фрагменты и другие эквиваленты, варианты и аналоги упомянутого выше. Термин «полипептид, обладающий ферментативной активностью», относится к любому полипептиду, который катализирует химическую реакцию других веществ без собственного разрушения или изменения после завершения реакции. Типично, полипептид, обладающий ферментативной активностью, катализирует образование одного или нескольких продуктов из одного или нескольких субстратов. В некоторых аспектах по изобретению свойства каталитической разнородности некоторых ферментов можно комбинировать с белковым конструированием и можно использовать в новых метаболических путях и биосинтетических применениях. В некоторых вариантах осуществления существующие ферменты модифицируют для применения в органическом биосинтезе. В некоторых предпочтительных вариантах осуществления ферменты, вовлеченные в продукцию представляющих интерес дифункциональных n-алканов, включают в качестве неограничивающих примеров 2-аминодекарбоксилазы, 2-кетодекарбоксилазы, концевые аминотрансферазы, 2-аминотрансферазы, алкогольдегидрогеназы, альдегиддегидрогеназы, аминоальдегиддегидрогеназы, дегидрогеназы и дегидратазы. В некоторых вариантах осуществления механизм реакции фермента можно изменить для катализа новых реакций, для изменения, увеличения или повышения субстратной специфичности. Следует принимать во внимание, что если известна структура фермента (например, кристаллическая структура), свойства ферментов можно модифицировать при помощи рационального реконструирования (см. патентную заявку США US20060160138, US20080064610 и US20080287320, которые в полном объеме включены в качестве ссылки). Модификации или улучшения свойств фермента могут являться результатом встраивания модификаций в полипептидную цепь, которые могут, фактически, исказить структуру-функцию фермента и/или взаимодействие с другой молекулой (например, субстрат в сравнении с неприродным субстратом). В данной области хорошо известно, что некоторые участки полипептида могут являться крайне необходимыми для ферментативной активности. Например, небольшие искажения состава аминокислот, вовлеченных в катализ и/или входящих в состав связывающих субстраты домены, будут оказывать достоверное влияние на функцию фермента. Некоторые аминокислотные остатки могут находиться в важных положениях для сохранения вторичной или третичной структуры фермента, и, таким образом, также приводить к заметным изменениям свойств фермента, если их модифицировать. В некоторых вариантах осуществления возможные компоненты пути являются вариантами любых из упомянутых выше. Такие варианты можно получить случайным мутагенезом или можно получить при рациональном конструировании для появления ферментативной активности, обладающие, например, измененной субстратной специфичностью, повышенной ферментативной активностью, большей устойчивостью и т.д. Таким образом, в некоторых вариантах осуществления количество модификаций упомянутого исходного фермента, которые приводят к появлению фермента, обладающего необходимым свойством, может включать одну или несколько аминокислот, 2 или более аминокислот, 5 или более аминокислот, 10 или более аминокислот или 20 или более аминокислот, вплоть до 10% от общего количества аминокислот, вплоть до 20% от общего количества аминокислот, вплоть до 30% от общего количества аминокислот, вплоть до 40% от общего количества аминокислот, составляющих упомянутый фермент, или вплоть до 50% от общего количества аминокислот, составляющих упомянутый фермент.
Специалистам в данной области будет понятно, что сконструированные пути, представленные в качестве примера в настоящем документе, описаны в отношении, но не ограничены, разновидности определенных генов и охватывают гомологи или ортологи нуклеиновой кислоты или аминокислотных последовательностей. Гомологи и ортологи последовательностей обладают относительно высокой степенью идентичности/схожести последовательности при выравнивании с использованием известных в данной области способов.
Аспекты по изобретению относятся к новым микроорганизмам или «генетически модифицированным» микроорганизмам или клеткам-хозяевам, которые были сконструированы для того, чтобы приобрести новые метаболические возможности или новые метаболические пути. В настоящем документе термин «генетически модифицированные» микроорганизмы относится к микроорганизмам, имеющим, по меньшей мере, одно генетическое изменение, обычно не обнаруживаемое в штамме дикого типа вида сравнения. В некоторых вариантах осуществления генетически сконструированные микроорганизмы создают для экспрессии или повышенной экспрессии, по меньшей мере, одного определенного фермента в важной точке метаболического пути и/или блокируют синтез других ферментов, чтобы преодолеть или обойти метаболические «узкие места». Термин «метаболический путь» относится к серии двух или более ферментативных реакций, в которых продукт одной ферментативной реакции становится субстратом для другой ферментативной реакции. На каждой стадии метаболического пути образуются промежуточные соединения, и они используются в качестве субстратов для последующей стадии. Такие соединения можно назвать «метаболическими промежуточными продуктами». Продукты на каждой стадии также называют «метаболитами».
В аспектах по изобретению предлагаются способы создания и формирования сконструированных метаболических путей. В некоторых аспектах по изобретению альтернативные пути для получения представляющего интерес продукта из одного или нескольких доступных и неистощимых субстратов можно сформировать в одной или нескольких клетках-хозяевах или представляющих интерес микроорганизмах. Следует принимать во внимание, что конструирование пути для получения представляющих интерес дифункциональных алканов может предполагать использование множества ферментов и поэтому продвижение через путь может быть неоптимальным для получения представляющего интерес продукта. Таким образом, в некоторых аспектах по изобретению продвижение оптимально сочетают посредством модуляции уровня активности ферментов пути относительно друг друга. Примеры такой модуляции предлагаются на всем протяжении заявки.
В аспектах по изобретению предлагаются генетически модифицированные клетки-хозяева или микроорганизмы и способы их применения для продукции дифункциональных n-алканов из α-кетокислот. Клетка-хозяин в настоящем документе относится к эукариотической клетке in vivo или in vitro, прокариотической клетке или к клетке из многоклеточного организма (например, клеточной линии), культивируемой в виде одноклеточного организма. Клетка-хозяин может являться прокариотической (например, бактериальной, такой как E. coli или B. subtilis) или эукариотической (например, дрожжевой, клеткой млекопитающих или насекомых). Например, клетки-хозяева могут представлять собой бактериальные клетки (например, Escherichia coli, Bacillus subtilis, Mycobacterium spp., M. tuberculosis или другие подходящие бактериальные клетки), археи (например, Methanococcus Jannaschii или Methanococcus Maripaludis или другие подходящие клетки архей), дрожжевые клетки (например, виды Saccharomyces, такие как S. cerevisiae, S. pombe, виды Picchia, виды Candida, такие как C. albicans, или другие подходящие виды дрожжей). Эукариотические или прокариотические клетки-хозяева могут быть, или были, генетически модифицированы (также обозначаемые как «рекомбинантная клетка-хозяин», «метаболически сконструированные клетки» или «генетически сконструированные клетки») и их используют в качестве реципиентов нуклеиновой кислоты, например, экспрессирующего вектора, который содержит нуклеотидную последовательность, кодирующую один или несколько продуктов генов биосинтетического или сконструированного пути. Эукариотические и прокариотические клетки-хозяева также обозначают потомство исходных клеток, которые были созданы генно-инженерным способом при помощи нуклеиновой кислоты. В некоторых вариантах осуществления клетку-хозяина можно выбрать вследствие ее метаболических свойств. Например, если выбор или скрининг относится к определенному метаболическому пути, возможно, будет полезным применять клетку-хозяина, в которой имеет место соответствующий путь. Такая клетка-хозяин может обладать определенной физиологической адаптацией, которая позволит ей подвергать процессу или импортировать, или экспортировать один или несколько промежуточных продуктов или продуктов пути. Однако в других вариантах осуществления клетку-хозяина, которая не экспрессирует никаких ферментов, ассоциированных с определенным представляющим интерес путем, можно выбрать для того, чтобы иметь возможность идентифицировать все компоненты, необходимые для такого пути, используя соответствующие наборы генетических элементов и не полагаясь на клетку-хозяина, чтобы обеспечить прохождение одной или нескольких отсутствующих стадий.
В некоторых вариантах осуществления анаэробные бактериальные организмы являются метаболически сконструированными. В настоящем документе анаэробный организм представляет собой любой организм, которому для роста не требуется кислород (т.е. анаэробные условия). Преимущественно, бактериальная клетка может представлять собой клетку E. coli, C. glutanicum, B. flavum или B. lactofermentum; данные штаммы в настоящее время применяются в промышленном масштабе для получения аминосоединениий, используя процессы бактериальной ферментации. Например, C. glutanicum широко используют для продукции аминокислоты (например, L-глутамата, L-лизина, см. Eggleging L et al., 2005, Handbook for Corynebacterium glutanicum. Boca Raton, USA: CRC Press).
Метаболически сконструированную клетку по изобретению получают, трансформируя клетку-хозяина при по