Композиции жирных кислот, имеющие новую пропорцию жирных кислот
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой композицию жирных кислот, которая собрана из культивированного продукта, полученного культивированием хозяина, который трансформирован рекомбинантным вектором экспрессии, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая кодирует белок с активностью ацилтрансферазы лизофосфатидиновой кислоты; при этом по меньшей мере один или более из параметров по подпунктам i)-v), показанным далее, выше по пропорции жирных кислот композиции жирных кислот в культивированном продукте, полученном культивированием хозяина, который трансформирован рекомбинантным вектором экспрессии, несущим нуклеиновую кислоту, включающую SEQ ID NO:8: i) содержание олеиновой кислоты; ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты; iii) отношение содержания олеиновой кислоты к содержанию стеариновой кислоты; iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к общему количеству пальмитиновой кислоты и пальмитолеиновой кислоты; и v) содержание n-6 жирной кислоты. Указанная композиция жирных кислот имеет более эффективную пропорцию жирных кислот для использования в пищевых продуктах, косметических изделиях, фармацевтических продуктах и мылах. 4 н. и 6 з.п. ф-лы, 2 ил., 5 табл., 10 пр.
Реферат
Область техники
По настоящей заявке испрашивается приоритет заявки на патент Японии № 2007-190680 (поданной 23 июля 2007 г).
Настоящее изобретение относится к композиции жирных кислот, полученной культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность SEQ ID NO:1, или нуклеотидную последовательность, кодирующую белок, имеющий аминокислотную последовательность, показанную в SEQ ID NO:2, или мутант, функционально эквивалентный нуклеиновой кислоте, где по меньшей мере один или более параметров подпунктов i)-v), показанных далее:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение содержания олеиновой кислоты к содержанию стеариновой кислоты;
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к общему содержанию пальмитиновой кислоты и пальмитолеиновой кислоты; и
v) содержание n-6 жирной кислоты
выше в пропорции жирных кислот композиции жирных кислот, чем в культивированном продукте, полученном культивированием хозяина, который не трансформирован рекомбинантным вектором.
Предшествующий уровень техники
Жирные кислоты представляют важные компоненты липидов, таких как фосфолипиды и триацилглицерины. Сообщалось, что полиненасыщенные жирные кислоты (PUFA), содержащие две или более ненасыщенные связи, включая арахидоновую кислоту, дигомо-γ-линоленовую кислоту, эйкозапентаеноевую кислоту и декозагексаеноевую кислоту, обладают различными видами физиологической активности (не патентный документ 1). Ожидается, что эти полиненасыщенные жирные кислоты найдут применение в различных областях. Для эффективного получения этих жирных кислот, были разработаны микробные методики, которые включают культивирование различных микроорганизмов для получения полиненасыщенных жирных кислот. Предпринимались также другие попытки получения полиненасыщенных жирных кислот в растениях. Известно, что в этих случаях полиненасыщенные жирные кислоты накапливаются, например, в виде компонентов липидов накопления, таких как триацилглицерины внутри клеток микроорганизмов или семян растений.
Этот триацилглицерин получает in vivo, начиная с глицерин-3-фосфата через лизофосфатидиновую кислоту, фосфатидиновую кислоту и диацилглицерин.
Как описано выше, известно, что реакция, при которой лизофосфатидиновая кислота (далее также называемая «LPA» или «1-ацилглицерин-3-фосфат») ацилируется для генерирования фосфатидиновой кислоты (далее также называемой «РА» или «1,2-диацил-sn-глицерин-3-фосфат»), опосредуется ацилтрансферазой лизофосфатидиновой кислоты (далее также называемой «LPAAT»).
Эта LPAAT также известна как ацилтрансфераза 1-ацилглицерин-3-фосфата (E.C. 2.3.1.51). К настоящему времени сообщалось, что гены LPAAT содержатся в нескольких организмах. В качестве гена LPAAT из Escherichia coli, был клонирован ген plsC (не патентный документ 2). В грибах был клонирован ген SLC1 из Saccharomyces cerevisiae (не патентный документ 3). Аналогичным образом, гены LPAAT также были клонированы из животных и растений (патентный документ 1).
Для гена LPAAT из продуцирующего липиды гриба, Mortierella alpina (далее также называемого «M. Alpine»), сообщалось о двух гомологах (патентные документы 2 и 3).
В патентном документе 2 описано клонирование полученного из M. alpine гомолога LPAAT (LPAAT1), который представляет собой ген, являющийся геном, имеющим CDS 1254 нуклеотидов, и состоящий из нуклеотидной последовательности, показанной в SEQ ID NO:16. В этом документе также сообщается, что когда этот LPAAT1 был совместно экспрессирован в дрожжевых клетках с десатуразой Δ6 и элонгазой Δ6 и культивировался в среде с добавлением определенных жирных кислот, такие дрожжевые клетки продуцировали большие количества жирных кислот, длина цепи которых длиннее, и/или чья степень ненасыщения выше, чем степень насыщения добавленных жирных кислот, по сравнению со штаммами, не экспрессирующими LPAAT1 (Патентный документ 2).
Патентный документ 1: Международная патентная публикация №WO2004/076617
Патентный документ 2: Патентная публикация США №2006/174376
Патентный документ 3: Патентная публикация США №2006/0094090
Не патентный документ 1: Lipids, 39, 1147 (2004)
Не патентный документ 2: Mol. Gen. Genet., 232, 295-303, 1992
Не патентный документ 3: J.B.C., 268, 22156-22163, 1993
Не патентный документ 4: Biochemical Society Transactions, 28, 707-709, 2000
Не патентный документ 5: J. Bacteriology, 180, 1425-1430, 1998
Не патентный документ: J. Bacteriology, 173, 2026-2034 1991.
Описание изобретения
Задачи, решаемые изобретением
Однако даже если гены LPAAT, о которых ранее сообщалось, вводятся в клетки-хозяева и экспрессируются в них, композиции жирных кислот, получаемые хозяевами, ограничены вследствие специфичности субстрата экспрессированных ферментов. По этой причине, имеется потребность в идентичности гена, который обеспечивает возможность получения композиции жирных кислот, пропорция жирных кислот которой отличается от ранее отмеченной пропорции.
Средства для решения задач
Целью настоящего изобретения является получение композиции жирных кислот, имеющей пропорцию жирных кислот, полезную для получения жиров и масел или пищевых продуктов и т.д.
Для достижения указанной выше цели авторы настоящего изобретения предприняли большие и интенсивные усилия. Во-первых, был выделен ген LPAAT1-длинный, который получен из продуцирующего липиды гриба Mortierella alpine, и введен в высоко пролиферативные клетки-хозяева (например, дрожжевые клетки) для получения посредством этого композиции жирных кислот. В результате, авторы успешно получили композицию жирных кислот, отличную от композиций, полученных с известными LPAAT. Это привело к осуществлению настоящего изобретения. А именно, настоящее изобретение заключается в следующем.
(1) Композиция жирных кислот, полученная культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в любом из представленных ниже подпунктов (а)-(е):
(а) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:2, и имеющей активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO:1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
(с) нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, имеющей идентичность 90% или более с нуклеотидной последовательностью, состоящей из SEQ ID NO:1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
(d) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
или
(е) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты,
где по меньшей мере один или более из параметров подпунктов i)-v), показанных далее, выше по пропорции жирных кислот композиции жирных кислот в культивированном продукте, полученном культивированием хозяина, который не трансформирован рекомбинантным вектором:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение содержания олеиновой кислоты к содержанию стеариновой кислоты;
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к общему количеству пальмитиновой кислоты и пальмитолеиновой кислоты; и
v) содержание n-6 жирной кислоты.
Альтернативно, композиция жирных кислот по настоящему изобретению может также представлять собой композицию жирных кислот, полученную культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную ниже в любом из подпунктов (а)-(е):
(а) нуклеотидную последовательность, которая кодирует аминокислотную последовательность с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:2;
(b) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO:1;
с) нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, имеющей идентичность 90% или более с нуклеотидной последовательности, состоящей из SEQ ID NO:1;
d) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO:2; или
(е) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:2.
(2) Композиция жирных кислот по указанному выше пункту (1), где нуклеиновая кислота содержит нуклеотидную последовательность, показанную ниже в любом из подпунктов (а)-(с):
(а) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:2, и имеющую активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизироваться в условиях 1 × SSC при 60ºС с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO:1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты; или
(с) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 95% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты.
(3) Композиция жирных кислот по указанному выше пункту (1), где нуклеиновая кислота содержит нуклеотидную последовательность, показанную ниже в подпункте (а) или (b):
(а) нуклеотидную последовательность, показанную в SEQ ID NO: 1; или
(b) нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2.
(4) Композиция жирных кислот по указанному выше пункту (1), где n-6 жирная кислота представляет собой по меньшей мере одну жирную кислоту, выбранную из группы, состоящей из линолевой кислоты, γ-линоленовой кислоты, дигомо-γ-линоленовой кислоты, (DGLA) и арахидоновой кислоты.
(5) Способ получения композиции жирных кислот, который включает составление композиции жирных кислот из культивированного продукта, полученного культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в любом из представленных ниже подпунктов (а)-(е):
(а) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, и имеющей активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
(с) нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, имеющей идентичность 90% или более с нуклеотидной последовательностью, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
(d) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
или
(е) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты,
где композиция жирных кислот имеет более высокую величину по меньшей мере одой или нескольких из i)-v), показанных ниже, по сравнению с культивированным продуктом, полученным культивированием хозяина, который не трансформирован рекомбинантным вектором:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение содержания олеиновой кислоты к содержанию стеариновой кислоты;
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к общему количеству пальмитиновой кислоты и пальмитолеиновой кислоты; и
v) содержание n-6 жирной кислоты.
(6) Способ по представленному выше пункту (5), где n-6 жирная кислота представляет собой по меньшей мере одну жирную кислоту, выбранную из группы, состоящей из линолевой кислоты, γ-линоленовой кислоты, дигомо-γ-линоленовой кислоты, (DGLA) и арахидоновой кислоты.
(7) Способ по представленному выше пункту (5) или пункту (6), где нуклеиновая кислота содержит нуклеотидную последовательность, показанную ниже в любом из подпунктов (а)-(с):
(а) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, и имеющую активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизироваться в условиях 1 × SSC при 60ºС с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты; или
(с) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 95% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты.
(8) Применение нуклеиновой кислоты, содержащей нуклеотидную последовательность, показанную в любом из представленных ниже подпунктов (а)-(е), для получения композиции жирных кислот по любому из представленных выше пп.(1)-(4):
(а) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, и имеющей активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
(с) нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, имеющей идентичность 90% или более с нуклеотидной последовательностью, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
(d) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты;
или
(е) нуклеотидную последовательность, которая может гибридизироваться в очень жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты.
(9) Применение по представленному выше п.(8), где нуклеиновая кислота содержит нуклеотидную последовательность, показанную ниже в любом из подпунктов (а)-(с):
(а) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2, и имеющую активность ацилтрансферазы лизофосфатидиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизироваться в условиях 1 × SSC при 60ºС с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO: 1, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты; или
(с) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 95% или более с аминокислотной последовательностью, состоящей из SEQ ID NO: 2, и которая кодирует белок, имеющий активность ацилтрансферазы лизофосфатидиновой кислоты.
(10) Пищевой продукт, содержащий композицию жирных кислот по любому из представленных выше пп.(1)-(4).
Преимущества изобретения
LPAAT1-длинный по настоящему изобретению имеет субстратную специфичность, отличную от субстратной специфичности известного LPAAT1, и обеспечивает хозяину возможность получения композиции жирных кислот, пропорция жирных кислот которой отличается от пропорции жирных кислот композиции, полученной хозяином, экспрессирующим известный LPAAT1. В результате, LPAAT1-длинный по настоящему изобретению обеспечивает возможность предоставления липидов, имеющих желательные свойства и эффекты, и может использоваться как применимая в пищевых продуктах, косметических изделиях, фармацевтических продуктах, мылах и т.д.
Содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих LPAAT1-длинный по настоящему изобретению, выше, чем содержание арахидоновой кислоты в клетках-хозяевах, не экспрессирующих LPAAT1-длинный по настоящему изобретению. Ожидается, что композиция жирных кислот, полученная из культивированного продукта этих клеток, экспрессирующих LPAAT1-длинный, обеспечит более высокий питательный эффект и, следовательно, является предпочтительной.
Кроме того, LPAAT по настоящему изобретению обеспечивает возможность улучшения способности получения жирных кислот и липидов накопления и, следовательно, предпочтителен в качестве средства для повышения продуктивности полиненасыщенных жирных кислот у микроорганизмов и растений.
Краткое описание чертежей
На фиг.1 показано сравнение LPAAT1-длинного и LPAAT1-короткого в настоящем изобретении с LPAAT1 по их нуклеотидным последовательностям CDS.
На фиг.2 показано сравнение LPAAT1-длинного и LPAAT1-короткого в настоящем изобретении с LPAAT1 по их аминокислотным последовательностям CDS.
Лучший способ осуществления изобретения
Настоящее изобретение относится к новой композиции жирных кислот, способу получения композиции жирных слот и пищевому продукту, содержащему композицию жирных кислот.
Ниже настоящее изобретение будет объяснено более детально.
В настоящем изобретении используется ген ацилтрансферазы лизофосфатидиновой кислоты (LPAAT) из рода Mortierella, который характеризуется обеспечением возможности получения указанной выше новой композиции жирных кислот. Конкретнее, в настоящем изобретении используется нуклеиновая кислота, именуемая LPAAT1-длинной, или ее мутант, который был выделен авторами настоящего изобретения, и показана в SEQ ID NO: 1. Следует отметить, что ацилтрансфераза лизофосфатидиновой кислоты представляет собой фермент, который катализирует реакцию, при которой лизофосфатидиновая кислота ацилируется для генерирования фосфатидиновой кислоты. Термин «LPAAT1-длинный» и LPAAT1-короткий» используется в настоящей заявке для описания штамма, гена, белка или альтернативно, клетки, полученной культивированием трансформанта, который создан вставкой указанного выше гена LPAAT1-длинного или LPAAT1-короткого в вектор экспрессии и трансформацией вектора в соответствующий хозяин.
Гомологи ацилтрансферазы лизофосфатидиновой кислоты (LPAAT)1
Последовательности, относящиеся к LPAAT1-длинному по настоящему изобретению, включают SEQ ID NO: 1 (последовательность, представляющая область ORF LPAAT1-длинного, SEQ ID NO: 2 (аминокислотная последовательность LPAAT1-длинного, SEQ ID NO: 3 (нуклеотидная последовательность кДНК для LPAAT1-длинного и SEQ ID NO: 4 (последовательность, представляющая область CDS LPAAT1-длинного). Среди них, SEQ ID NO: 1 соответствует нуклеотидам 115-1557 SEQ ID NO: 3.
В дополнение к LPAAT1-длинному, авторы настоящего изобретения выделили другой ген LPAAT1 (далее именуемый «LPAAT1-короткий»), который соответствует 86,6% всей нуклеотидной последовательности LPAAT1-длинного и 86,7% всей аминокислотной последовательности LPAAT1-длинного. Последовательности, связанные с LPAAT1-коротким, включают SEQ ID NO: 8 (последовательность, представляющая область ORF LPAAT1-короткого), SEQ ID NO: 10 (аминокислотную последовательность LPAAT1-короткого) и SEQ ID NO: 9 (нуклеотидную последовательность кДНК для LPAAT1-короткого). Нуклеотиды 36-1286 SEQ ID NO: 9 соответствуют ORF, показанной в SEQ ID NO: 8. Связь между LPAAT1-длинным и LPAAT1-коротким показан ниже в таблице 1.
| Таблица 1 | |||
| Связь гомологов LPAAT1 | |||
| LPAAT1-длинный | LPAAT1-короткий | LPAAT1 (патентный документ 2) | |
| Нуклеотидная последовательность | SEQ ID NO: 1 | SEQ ID NO: 8 | SEQ ID NO: 16 (патентный документ 2) |
| Количество нуклеотидов в ORF | 1443 | 1251 | 1251 |
| Соответствующее положениев SEQ ID NO: 1 | *** | 193-1443 | 193-1443 |
| Процентная доля (длина) относительно SEQ ID NO: 1 | *** | 86,8% | 86,8% |
| Аминокислотная последовательность | SEQ ID NO: 2 | SEQ ID NO: 10 | SEQ ID NO: 10 (патентный документ 2) |
| Количество аминокислотных последовательностей | 481 | 417 | 417 |
| Соответствующее положениев SEQ ID NO: 2 | *** | 65-481 | 65-481 |
| Процентная доля (длина) относительно SEQ ID NO: 1 | *** | 86,70% | 86,70% |
А именно, нуклеотидная последовательность с 5'-концевой делецией в нуклеотидной последовательности ORF LPAAT1-длинного по настоящему изобретению соответствует LPAAT1-короткому. В деталях, среди 1443 нуклеотидов в нуклеотидной последовательности ORF (SEQ UID NO: 1) LPAAT1-длинного по настоящему изобретению, нуклеотиды в области между положениями 193 и 1443, которые составляют 86,8% общего количества нуклеотидов, соответствуют нуклеотидной последовательности ORF (SEQ UID NO: 8) LPAAT1-короткого. А именно, LPAAT1-длинный представляет собой последовательность, более длинную, чем LPAAT1-короткий, на 192 нуклеотида в области 5'. Аналогичным образом, среди 481 остатка в аминокислотной последовательности (SEQ UID NO: 2) LPAAT1 -длинного по настоящему изобретению, остатки в области между положениями 65 и 481, которые составляют 86,7% общего количества остатков, соответствуют аминокислотной последовательности (SEQ UID NO: 8) LPAAT1-короткого. А именно, LPAAT1-длинный представляет собой последовательность, которая длиннее, чем LPAAT1-короткий, на 64 аминокислотных остатков (аминокислотные остатки 1-64 в SEQ UID NO: 2) N-конца.
Следует отметить, что известный LPAAT, полученный из M. Alpina (далее именуемой «LPAAT1»), раскрыт в патентном документе 2, перечисленном выше. Количество нуклеотидов в ORF LPAAT1, составляет 1251, что идентично таковому LPAAT1-короткого. Идентичность нуклеотидной последовательности между этими ORF достигает 89%, свидетельствуя о том, что LPAAT1-короткий мог бы представлять собой изоаллель LPAAT1. На фиг.1 и 2 показаны совмещения соответственно нуклеотидной и аминокислотной последовательности для LPAAT1-длинного, LPAAT1-короткого и LPAAT1 (фиг.1 и 2).
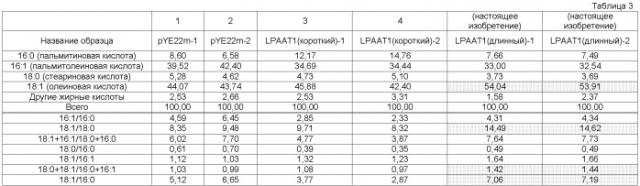
Таким образом, авторы настоящего изобретения использовали LPAAT1-короткий в качестве модели известного LPAAT1 в целях сравнения при исследовании активности LPAAT1-длинного по настоящему изобретению. Конкретнее, LPAAT1-длинный и LPAAT1-короткий были экспрессированы в дрожжевых клетках, и полученные композиции жирных кислот сравнивали по их пропорции жирных кислот. В результате, как детально объясняется ниже, пропорция жирных кислот композиции жирных кислот, полученных хозяином, экспрессирующим LPAAT1-длинный ген по настоящему изобретению, полностью отличалась от пропорции композиции жирных кислот, полученной хозяином, экспрессирующим LPAAT1-короткий. А именно, было обнаружено, что LPAAT1-длинный по настоящему изобретению имеет способность продуцировать композицию жирных кислот, пропорция жирных кислот которой полностью отличается от пропорции композиции жирных кислот, полученных известным LPAAT1.
Конкретнее, одним из отличительных признаков в композиции жирных кислот по настоящему изобретению является высокое содержание арахидоновой кислоты. Арахидоновая кислота, вещество, представленное химической формулой C20H32O2, и имеющее молекулярную массу 304,47, представляет собой карбоновую кислоту, содержащую 20 атомов углерода и 4 двойных связи ([20:4(n-6)]), и классифицируется в качестве члена серии (n-6). Арахидоновая кислота присутствует в качестве важного фосфолипида (в частности, фосфатидилэтаноламина, фосфатидилхолина, фосфатидилинозитола) в мембранах клеток животных, и в большом количестве содержится в мозге. Кроме того, арахидоновая кислота служит в качестве исходного материала для ряда эйкозаноидов (например, простагландина, тромбоксана, лейкотриена), генерируемых каскадом арахидоновой кислоты, и также важна в качестве второго посредника при внутриклеточной передаче сигналов. С другой стороны, арахидоновая кислота синтезируется из линолиновой кислоты в организме животных. Однако, в зависимости от их вида или возраста, некоторые животные не осуществляют эту функцию, достаточную для получения требуемого количества арахидоновой кислоты или для наличия функции получения арахидоновой кислоты. Таким образом, арахидоновую кислоту следует получать из пищевых источников, и ее можно рассматривать в качестве незаменимой жирной кислоты.
Содержание арахидоновой кислоты в композиции жирных кислот по настоящему изобретению может быть измерено следующим образом, в качестве примера. А именно, плазмида для LPAAT1-длинного по настоящему изобретению вставляется в вектор, такой как pDura5MCS, как описано в примерах 8 и 9, и трансформируется в штамм M. alpina. Полученному трансформанту предоставляется возможность экспрессироваться и культивироваться в соответствии с процедурами, описанными в примере 10. Полученные таким образом культивированные клетки используются для измерения пропорции жирных кислот и/или содержания арахидоновой кислоты в клетках и т.д. Для анализа содержания арахидоновой кислоты и т.д., например, жирные кислоты в полученных культивированных клетках дериватизируются в соответствующие сложные метиловые эфиры жирных кислот способом с использованием хлористоводородной кислоты/метанола и затем экстрагируются гексаном. После отгонки гексана, жирные кислоты анализируются газовой хроматографией. В соответствии с этим анализом, было обнаружено, что M. alpina, трансформированная LPAAT1-длинным по настоящему изобретению, проявляет высокое содержание арахидонововй кислоты среди жирных кислот в клетках. Таким образом, предпочтительна композиция жирных кислот по настоящему изобретению, имеющая высокое содержание арахидонововй кислоты, потому что она обеспечивает возможность эффективного поглощения арахидоновой кислоты.
Как показано выше, LPAAT1-длинный по настоящему изобретению имеет активность, которая совершенно отличается от активности известного LPAAT1. Одним из оснований для такой новой активности может быть различие структуры гена/белка между LPAAT1-длинным по настоящему изобретению и известным LPAAT1.
Таким образом, мутанты, имеющие нуклеотидную последовательность/аминокислотную последовательность, крайне близкую к нуклеотидной последовательности LPAAT1-длинного по настоящему изобретению, и являющиеся функционально эквивалентными LPAAT1-длинному, также входят в объем настоящего изобретения. Примеры включают следующие:
i) мутанты, нуклеотидная последовательность/аминокислотная последовательность которых является примерно на 90% идентичной таковой специфического LPAAT1-длинного по настоящему изобретению (примерно 144 нуклеотидов или примерно 48 аминокислотных остатков являются идентичными; также включая мутантов с делецией, заменой или добавлением этих нуклеотидов/остатков); и
ii) мутанты, нуклеотидная последовательность/аминокислотная последовательность которых гидролизуется в очень жестких условиях с последовательностью LPAAT1-длинного по настоящему изобретению.
Детали изложены в описанном ниже разделе «Нуклеиновые кислоты по настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидиновой кислоты».
Нуклеиновые кислоты по настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидиновой кислоты (LPAAT)
Настоящее изобретение относится к композиции жирных кислот, имеющих новую пропорцию жирных кислот, полученную культивированием хозяина, который трансформирован рекомбинантным вектором, несущим нуклеиновую кислоту, содержащую нуклеотидную последовательность SEQ ID NO: 1 (LPAAT1-длинный), или ей подобную, а также к способу ее получения. Во-первых, будет дано объяснение нуклеиновых кислот, используемых для получения указанной выше композиции жирных кислот.
Как описано выше, ацилтрансфераза лизофосфатидиновой кислоты (LPAAT) в настоящем изобретении охватывает LPAAT1-длинный. Последовательности, связанные с LPAAT1-длинным по настоящему изобретению, включают SEQ ID NO: 1 (последовательность, представляющую область ORF LPAAT1-длинного), SEQ ID NO: 2 (аминокислотную последовательность LPAAT1-длинного), SEQ ID NO: 3 (нуклеотидную последовательность для LPAAT1-длинного) и SEQ ID NO: 4 (последовательность, представляющую область CDS LPAAT1-длинного), как объясняется в разделе «Гомологи ацилтрансферазы лизофосфатидиновой кислоты (LPAAT) 1».
Нуклеиновые кислоты по настоящему изобретению охватывают однонитевые и двухнитевые ДНК, а также их комплементарные РНК, которые могут быть или естественно встречающимися или полученными искусственно. ДНК включают без ограничения геномные ДНК, кДНК, соответствующие геномным ДНК, химически синтезированные ДНК, ДНК, амплифицированным PCR, а также их комбинации и гибриды ДНК/РНК.
Предпочтительные варианты осуществления нуклеиновых кислот по настоящему изобретению включают (а) нуклеотидную последовательность, показанную в SEQ ID NO: 1, и (b) нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2.
Для получения этих нуклеотидных последовательностей, данные о нуклеотидной последовательности по анализу EST или геномных ДНК из организмов, имеющих активность LPAAT, могут использоваться для поиска нуклеотидной последовательности, кодирующей белок, имеющий высокую идентичность с известными белками, имеющими активность LPAAT. Предпочтительными организмами, имеющими активность LPAAT, являются продуцирующие липиды грибы, включая без ограничения M. alpine.
Для анализа EST, сначала получают библиотеку кДНК. Что касается методик получения библиотеки кДНК, то можно сослаться на руководство “Molecular Cloning, A Laboratory Manual 3rd ed.” (Cold Spring Harbor Press (2001)). Альтернативно, может использоваться выпускаемый промышленностью набор для получения библиотеки кДНК. В качестве примера, методики для получения библиотеки кДНК, подходящие для настоящего изобретении, следующие. А именно, соответствующий штамм M. alpina, продуцирующий липид гриб, инокулируется в соответствующую среду и предварительно культивируется в течение соответствующего периода. Условия культуры, подходящие для этой предварительной культуры, включают, например, композицию среду из 1,8% глюкозы, 1% дрожжевого экстракта и pH 6,0, периода культуры 3 дня и температуры культуры 28°C. Затем предварительно культивированный продукт подвергается основному культивированию в соответствующих условиях. Композиция среды, подходящая для основной культуры, может составлять, например, 1,8% глюкозы, 1% порошка соевых бобов, 0,1% оливкового масла, 0,01% адеканола, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2·2H2O, 0,05% MgCl2·6H2O и pH 6,0. Условия культивирования, подходящие для основной культуры, могут представлять, например, аэробную центрифужную культуру при 300 об/мин, 1 об.об.м, 26°C в течение 8 дней. Во время культивирования может добавляться соответствующее количество глюкозы. Пробы культивированного продукта берутся в соответствующие точки времени во время основного культивирования, из которых затем собирают клетки для получения общей РНК. Для получения общей РНК, можно использовать любую известную методику, такую как способ гидрохлорида гуанидина/CsCl2. Полученная общая РНК может обрабатываться выпускаемого промышленностью набора для очистки поли(А)+РНК. Далее, библиотека кДНК может быть получена выпускаемым промышленностью набором. Затем определяется нуклеотидная последовательность любого клона из библиотеки кДНК использованием затравок, которые сконструированы на векторе для обеспечения возможности определения нуклеотидной последовательности вставки. В результате, могут быть получены EST. Например, когда для получения библиотеки кДНК используется набор ZAP-cDNA GigapackIII Gold Cloning Kit (STRATAGENE), может выполняться направленное клонирование.
Настоящее изобретение также охватывает нуклеиновые кислоты, функционально эквивалентные нуклеиновой кислоте, содержащей указанную выше нуклеотидную последовательность, показанную в SEQ ID NO: 1 (далее также именуемую как «нуклеотидная последовательность по настоящему изобретению») или нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 (далее также именуемую как «аминокислотная последовательность по настоящему изобретению»). Предполагается, что фраза «функциональный эквивалент» значит, что белок, кодируемый нуклеотидной последовательностью по настоящему изобретению, или белок, состоящий из аминокислотной последовательности по настоящему изобретению, имеет активность LPAAT. В дополнение к этой активности LPAAT, белок, кодируемый нуклеотидной последовательностью по настоящему изобретению, или белок, состоящий из аминокислотной последовательности по настоящему изобретению, могут иметь способность дать пропорцию жирных кислот, обеспечивающую более высокую ценность по меньшей мере для одной или более из следующих величин:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение содержания олеиновой кислоты к содержанию стеариновой кислоты;
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к общему содержанию пальмитиновой кислоты и пальмитолеиновой кислоты; и
v) сод