Фотосенсибилизатор для антимикробной фотодинамической терапии
Иллюстрации
Показать всеИзобретение относится к применению фурацилина в качестве фотосенсибилизатора. Изобретение обеспечивает повышение антимикробной активности фурацилина при воздействии света, спектральный диапазон которого соответствует спектру электронного поглощения фурацилина. 1 табл., 2 ил.
Реферат
Изобретение относится к медицине, а именно к применению лекарственных средств по новому назначению, в частности для использования в качестве фотосенсибилизатора для антимикробной фотодинамической терапии.
Фурацилин (Furacilinum) является противомикробным средством, производным нитрофурана, растворимым в воде и этаноле. Фурацилин предназначен для обработки гнойных инфицированных ран, пролежней, язв, гайморитов; инфицированных ожогов II и III степени; фурункул наружного слухового прохода; для подготовки гранулирующей поверхности к пересадкам кожи и т.п. [1]. Действующее вещество (МНН): нитрофурал; химическое название: 5-нитро-2-фуральдегид семикарбазон; химическая формула препарата следующая:
Фурацилин активен в отношении грамположительных и грамотрицательных бактерий: кишечная, дизентерийная палочки, возбудители паратифа, сальмонеллы, холерный вибрион, лямблии, трихомонады, стафилококки, крупные вирусы, возбудители газовой гангрены (Staphylococcus spp., Streptococcus spp., Shigella dysenteria spp., Shigella flexneri spp., Shigella boydii spp., Shigella sonnei spp., Escherichia coli, Clostridium perfringens, Salmonella spp. и др.). Фурацилин подавляет жизнедеятельность грибковой флоры. Воздействует путем формирования из белков микробной клетки высокоактивных аминопроизводных, в результате чего разрушается или деформируется четвертичная и третичная структура белка, нарушаются обменные процессы, что приводит к гибели патогенной микрофлоры [1].
Способ применения фурацилина: местно, наружно. Наружно, в виде водного 0,02% (1:5000) или спиртового 0,066% (1:1500) растворов - орошают раны и накладывают влажные повязки. При гайморите - промывают водным раствором гайморову полость; остеомиелит после операции - промывание полости с последующим наложением влажной повязки; эмпиема плевры - после удаления гноя проводят промывание плевральной полости и вводят 20-100 мл водного раствора [1].
Недостатком известных методов лечения, основанных на использовании фурацилина, является слабовыраженная терапевтическая активность, что связывают с развитием резистентности (устойчивости) микробных организмов к действию антисептика. В настоящее время в стационарах существуют штаммы бактерий, полностью устойчивые к фурацилину [2-6]. Фурацилин не активен в отношении синегнойной палочки, протея, энтерококков, слабо активен в отношении стафилококков, кишечной палочки, псевдомонад [2]. Авторы [3], исследовавшие устойчивость к фурацилину возбудителей хирургической инфекции у детей, отмечают умеренную устойчивость к нему стафилококков (3,3%) и низкую - энтеробактерий (14,6%). Констатируются также очень высокие показатели частоты выделения биологически устойчивых (для фурацилина) вариантов у штаммов псевдомонад (96,9%). Биологически устойчивые варианты при наличии селективного фактора могут приобрести доминирующее положение и в последующем привести к утрате активности антисептика. По этой причине согласно выводам [3] фурацилин не должен использоваться для лечения хирургической инфекции у детей (либо его использование должно быть ограничено).
Согласно [4] при исследовании частоты и динамики распространения устойчивых к антисептикам этиологически значимых бактерий при различных нозологических формах инфекций, в том числе ожогах, клиническую устойчивость к фурацилину проявляют 80-100% штаммов энтеробактерий и неферментирующие грамотрицательные бактерии, включая синегнойную палочку и 77-88% штаммов золотистого и коагулазоотрицательных стафилококков. По данным ретроспективного анализа 330 историй болезни больных с ожогами, находившихся на стационарном лечении в Белорусском Республиканском ожоговом центре, показано, что все штаммы золотистых и коагулазоотрицательных стафилококков были резистентными к 0,02% раствору фурацилина [5].
Более того, зачастую рабочие растворы фурацилина контаминированны грамотрицательными микроорганизмами; обнаруживаются золотистые, эпидермальные и сапрофитные стафилококки [2, 6]. Так, например, в растворе фурацилина Р. aeruginosa сохраняется в количестве 106 КОЕ/мл. Частота выделения клинически устойчивых к фурацилину Staphylococcus spp., Pseudomonas spp.среди контаминантов антисептических средств составляет 89,6 и 100%, соответственно [6].
Задача настоящего изобретения - повышение антимикробной активности фурацилина за счет использования его способности выступать в качестве фотосенсибилизатора и оказывать антимикробный фотодинамический эффект при воздействии света, спектральный диапазон которого соответствует спектру электронного поглощения фурацилина.
Поставленная задача достигается путем предварительной обработки патологического очага или раны 0,02% водным раствором или 0,066% спиртовым раствором фурацилина и последующим воздействием через 60-90 с оптическим излучением, спектральный диапазон которого соответствует спектру электронного поглощения фурацилина, при плотности мощности 50-200 мВт/см2 в течение 2-3 мин на одно поле. Количество полей определяется площадью патологического очага (раны) и размером светового пятна, обеспечиваемого источником излучения при вышеуказанной плотности мощности.
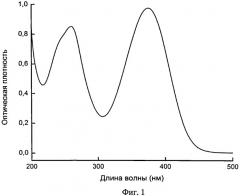
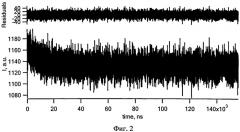
Сущность изобретения поясняется чертежами, представленными фигурой 1 и фигурой 2. На фигуре 1 приведен спектр поглощения 0,0013% раствора. При этом на оси абсцисс отложена длина волны в нанометрах (нм), а по оси ординат - оптическая плотность (безразмерная величина); правая ось ординат - относительная интенсивность излучения. На фигуре 2 приведена кинетика затухания люминесценции синглетного кислорода на длине волны регистрации λрег=1270 нм, генерируемого при возбуждении фурацилина излучением Nd:YAG-лазера с длиной волны λвозб=354 нм. При этом на фигуре 2 по оси абсцисс отложено время в наносекундах (нс), а по оси ординат - относительная интенсивность флуоресценции (нижняя кривая) и взвешенные остатки (верхняя кривая).
Следует отметить, что возможность реализации метода антимикробной фотодинамической терапии хорошо известна в литературе [7-14]. Известны соединения, оказывающие антибактериальное действие при облучении в видимом и УФ диапазоне: метиленовый синий, метиленовый зеленый, толуидиновый синий, аминолевулиновая кислота, фталоцианины, хлорин е6, хлорин p6, бактериохлорофилл, сафранин О, эритрозин В, и др. [7-14]
Так, в качестве фотосенсибилизатора для реализации метода фотодинамического воздействия в отношении грамположительных бактерий, в частности Staphylococcus aureus и грибов рода кандида, в [8] предлагают использовать индотрикарбоцианиновый краситель (длина волны воздействующего излучения λизл=740 нм); для фотодинамического лечения и профилактики послеоперационного панкреатита и гнойного осложнения при резекции поджелудочной железы - нильский синий А (λизл=632,8 нм) [9]; для фотодинамической терапии гнойных ран - фотолон (λизл=660 нм) [10].
Для подавления роста грамотрицательной и грамположительной микрофлоры авторами [11, 12] предлагается использовать сафранин О или эритрозин В при активации их излучением зеленой области спектра (λизл=530 нм). Авторы [13, 14] в качестве фотосенсибилизаторов для проведения антимикробной фотодинамической терапии предлагают использовать катионные фталоцианины (λизл=675 нм) и бактериохлорины (λизл=760-780 нм).
Однако из имеющихся знаний не вытекает, что препарат фурацилин можно использовать в качестве фотосенсибилизатора. Как известно [7], фотосенсибилизированная фотодинамическая деструкция патогенной микрофлоры может быть реализована по двум механизмам: (а) радикальному, основанному на взаимодействии возбужденной молекулы фотосенсибилизатора с биосубстратом; (б) механизму, основанному на участии синглетного кислорода, который образуется в результате фотофизической активации путем переноса энергии с триплетного возбужденного состояния фотосенсибилизатора на молекулярный кислород. Таким образом, для обоснования способности фармпрепарата выступать в качестве фотосенсибилизатора достаточно доказать его способность генерировать синглетный кислород - одну из наиболее химически активных форм молекулярного кислорода.
Спектр поглощения лекарственного препарата «фурацилин, водный раствор» при его концентрации 0,0013%, зарегистрированный с помощью спектрофотометра «Varian» Carry 500, представлен на фигуре 1. Как следует из фигуры 1, спектр поглощения фурацилина характеризуется наличием двух максимумов при λмакс=261 нм и λмакс=375 нм, а также минимумом при λмин=307 нм.
Прямым подтверждением способности фурацилина к фотосенсибилизированной генерации синглетного кислорода является регистрация люминесценции синглетного кислорода с помощью созданного в Институте физики НАН Беларуси высокочувствительного лазерного флуорометра с наносекундным разрешением для ближнего ИК-диапазона [15]. Возбуждение фурацилина осуществляли 3-ей гармоникой излучения Nd:YAG-лазера на длине волны возбуждения λвозб=354 нм; регистрацию сенсибилизированной фурацилином люминесценции синглетного кислорода - на λрег=1270 нм, соответствующей максимуму спектра. Время накопления сигнала люминесценции не превышало 10 мин. Все измерения проводились при комнатной температуре (293±1 К). Оптическая плотность образцов на длине волны возбуждения составляла 0,15. Квантовый выход фотосенсибилизированного фурацилином образования синглетного кислорода (γΔ) определялся относительным методом. В качестве эталона использовался хлорин е6, для которого при рН 7,4 γΔ=60% [16].
Проведенные исследования показали наличие люминесценции синглетного кислорода при возбуждении фурацилина. Кинетика люминесценции синглетного кислорода, генерируемого при возбуждении фурацилина, приведена на фигуре 2. Сравнительные исследования показали, что квантовый выход генерации синглетного кислорода, сенсибилизированной фурацилином составляет γΔ=8±2%. Важно отметить, что хотя измерения уд осуществлялись на длине волны возбуждения λвозб=354 нм, полученное значение квантового выхода сенсибилизированного фурацилином образования синглетного кислорода является характерным для излучения всех длин волн, расположенных в пределах длинноволновой полосы поглощения препарата.
Для сравнения укажем, что квантовый выход генерации синглетного кислорода при сенсибилизации широко использующимся для антимикробной фотодинамической терапии препаратом хлорофиллипт (спиртовая форма) составляет γΔ=1,4%.
Таким образом, представленные данные свидетельствуют о том, что фурацилин способен генерировать синглетный кислород и выступать в качестве фотосенсибилизатора. Предлагаемый фотосенсибилизатор фурацилин значительно превосходит известный фотосенсибилизатор хлорофиллипт по эффективности генерации синглетного кислорода. Другим достоинством фурацилина является его достаточно высокая гидрофильность - растворимость в воде. Это позволяет без болевого синдрома наносить его на раневую поверхность для последующего воздействия света (лазерного излучения или излучения светодиодных источников), соответствующего спектру поглощения фурацилина. Причем нанесение фотосенсибилизатора на очаг поражения может осуществляться как путем его орошения препаратом, так и путем накладывания перевязочного материала, смоченного фурацилином. Вместе с тем при необходимости усиления антисептического действия имеется возможность использования спиртовой формы указанного фотосенсибилизатора.
Важно отметить, что антимикробная фотодинамическая терапия с использованием фурацилина в качестве фотосенсибилизатора может быть реализована с использованием серийно выпускаемой аппаратуры (комплекс многоцветный фототерапевтический «Ромашка», аппарат физиотерапевтический «Экстрасенс», комплекс фототерапевтический «Календула») на основе светодиодного источника с длиной волны излучения λмакс=405±15 нм.
Следует отметить, что время жизни синглетного кислорода в биологических системах составляет 30-180 нс и по этой причине его диффузионный путь не превышает 10-20 нм (расстояние, соизмеримое с размером молекулы белка). Поэтому фотодинамический эффект может проявляться лишь в ближайшем окружении сенсибилизатора и будет касаться, прежде всего, молекул, находящихся с ним в комплексе. В этой связи заслуживает внимания тот факт, что фурацилин проникает внутрь грамположительных и грамотрицательных микробных клеток [1].
Поскольку механизм темнового антимикробного действия фурацилина (в отсутствие света) состоит в модификации четвертичной и третичной структуры белковых молекул бактериальных клеток [1], то есть основания полагать, что при активации фотосенсибилизатора фурацилина светом, скорость инактивации указанных белков будет значительно повышена за счет фотодеструкции аминокислот (триптофана, гистидина, метионина и др.), характеризующихся высокой константой скорости фотолиза при взаимодействии с синглетным кислородом. Таким образом, воздействие на патологический очаг, предварительно обработанный раствором фурацилина, светом, соответствующим спектру поглощения фурацилина, обеспечивает значительное повышение антимикробного действия указанного антисептика.
При этом, по мере увеличения времени использования антимикробных средств в клинической практике патогенная микрофлора постепенно вырабатывает резистентность к ним, то такая резистентность не может быть реализована к антимикробному действию наиболее химически активного интермедиата - синглетного кислорода, генерируемого фурацилином, как фотосенсибилизатором, при его фотовозбуждении.
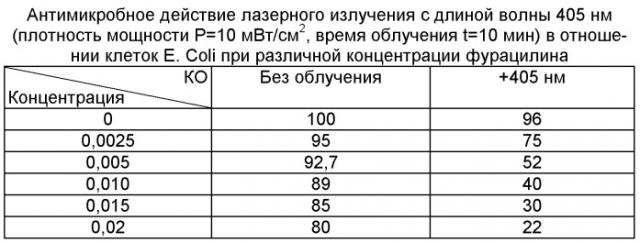
Усиление антмикробного действия за счет фотосенсибилизирующего действия фурацилина продемонстрировано с использованием бактериальной культуры клеток Е. Coli. результаты представлен вы таблице. Фотодинамическую активность фурацилина исследовали путем воздействия лазерным излучением с длинами волн 405 (плотность мощности Р=10 мВт/см2, время облучения t=10 мин) на чашки Петри с указанной бактериальной культурой (желточно-солевой агар). В качестве теста был взят показатель КОЕ (количество колониеобразующих единиц):
где КОЕоп - количество колониеобразующих единиц при воздействии различных факторов.
КОЕк - количество колониеобразующих единиц в контрольных группах.
Как следует из таблицы, в отсутствие фурацилина колониеобразующая активность клеток принята за КОЕ=100%. Облучение клеток без фурацилина слабо сказывается на их активности (КОЕ=96%). По мере увеличения концентрации фурацилина без облучения наблюдается снижение колониеобразующей активности за счет темнового действия антисептика. Однако при облучении клеток в присутствии фурацилина эффект подавления их роста значительно более выражен. Например при концентрации фурацилина 0,02% без облучения эффект составляет КОЕ=80%. При той же концентрации фурацилина, но после облучения клеток КОЕ=22%. Таким образом эффект антимикробного действия фурацилина значительно усиливается за счет фотодинамического действия, сенсибилизированного фурацилином.
Источники информаци
1. Фурацилин 0,02% р-р 500 мл, 1000 мл. http://www.pharmland.by/ru/products/furatsilin-002-r-r-500ml1000ml.
2. Красильников А.П. Справочник по антисептике. - Мн.: Выш. шк., 1995. - 367 с.
3. Абаев Ю.К., Гудкова Е.И., Волков В.И., Слабко И.И., Адарченко А.А. Устойчивость к антибиотикам и антисептикам возбудителей хирургической инфекции у детей. Медицинский журнал: 2005. - №3. С.29-31.
4. Титов Л.П., Адарченко А.А., Гудкова Е.И. Микробиологический мониторинг устойчивости возбудителей внутрибольничных инфекций к антимикробным препаратам // Мед. новости. - 1999. - №8. - с.8-10.
5. Ханенко О.Н., Тонко О-В., Левшина Н.Н., Волохович О.В., Стрежан И.В., Коломиец Н.Д. Резистентность к антисептикам стафилококков, изолированных из ожоговых ран. Профилактика и лечение госпитальных инфекций, резистентность микроорганизмов к химиопрепаратам: Материалы Респ. науч. - практ. конф., - Минск. - 2006. С.208-211.
6. Яфаев Р.Х., Зуева Л.П. Современные проблемы и задачи госпитальной эпидемиологии. В кн.: Госпитальная эпидемиология. Л., 1989; С.4-11.
7. Tianhong D., Huang Y.-Y., Hamblin M. Photodynamic therapy for localized infections - State of the art. Photodiagnosis and Photodynamic Therapy. 2009; Vol.6 №3-4 P.170-188.
8. Титов Л.П., Ермакова Т.С., Самцов М.П., Луговский А.П.; Мельников Д.Г., Луговский А.А., Воропай Е.С., Ляшенко Л.С. Активируемое инфракрасным светом средство подавления стафилококковой и грибковой активности. Патент Республики Беларусь №15152 от 30.12.2011.
9. Стенько А.А., Жук И.Г. Средство для фотодинамического лечения и профилактики послеоперационного панкреатита и гнойного осложнения при резекции поджелудочной железы в эксперименте. Патент Республики Беларусь №11768 от 30.04.2009.
10. Стенько А.А. Средство для фото динамической терапии гнойных ран. Патент Республики Беларусь №9246 от 30.04.2007.
11. Фолькер А., Буркхард Г. Соединение для антимикробной фотодинамической терапии и способ применения. Патент России №2376991.
12. Фолькер А., Буркхард Г. Антимикробное соединение на основе эритрозина для фотодинамической терапии и его применение Патент России №2368375.
13. Ворожцов Г.П., Калия О.Л., Кузнецова Н.А., Кузьмин С.Г., Кучеров А.Г., Лапченко А.С., Лукьянец Е.А., Негримовский В.М., Сливка Л.К., Страховская М.Г., Южакова О.А., Якубовская Р.И. Фотосенсибилизаторы для антимикробной фотодинамической терапии. Патент России №2282647.
14 Шерц А., Брэндис А., Мазор О. Саломон И., Шеер X. Водорастворимые анионсодержащие производные бактериохлорофилла и их применение. Патент России №2353624.
15. Галиевский В.А., Сташевский А.С., Киселев В.В., Шабусов А.И., Бельков М.В.. Джагаров Б.М. Лазерный флуорометр с наносекундным разрешением для ближнего ИК-диапазона // ПТЭ. - 2010. - Т. 107, №4. - С.109-116.
16. Пархоц М.В., Галиевский В.А., Сташевский А.С., Трухачева Т.В., Джагаров Б.М. Динамика и эффективность фотосенсибилизированного образования синглетного кислорода хлорином е6: влияние рН раствора и поливинилпирролидона. Оптика и спектроскопия, 2009, Т.107, №6, С.1026-1032.
Применение фурацилина в качестве фотосенсибилизатора.