Фармацевтическая композиция на основе лигандов паттерн-распознающих рецепторов, способ ее использования в качестве иммуностимулятора для лечения инфекций, вызванных бактериальными и вирусными патогенами, способ ее использования в качестве адъюванта в составе вакцин
Иллюстрации
Показать всеГруппа изобретений относится к области фармакологии и медицины и касается иммуностимулирующей композиции и способов ее применения для усиления иммунного ответа, в частности для лечения инфекций, вызванных бактериальными и вирусными патогенами, к адъювантным композициям и способам усиления иммуногенности антигена при использовании в качестве адъюванта в составе вакцин. Фармацевтическая композиция на основе лигандов паттерн-распознающих рецепторов содержит мурамилпептид структурной формулы N-ацетилмурамил-L-аланил-D-изоглютамин и липополисахарид или липид А при следующем соотношении компонентов, масс.%: мурамилпептид структурной формулы N-ацетилмурамил-L-аланил-D-изоглютамин от 0,00001 до 0,01, липополисахарид или липид А - от 0,00001 до 0,01, растворитель - остальное. Группа изобретений обеспечивает высокую иммуностимулирующую активность и пролонгированность действия композиции. 3 н. и 4 з.п. ф-лы, 6 пр., 1 табл.. 9 ил.
Реферат
Область техники
Изобретение относится к иммуностимулирующим композициям и способам их применения для усиления иммунного ответа, в частности для лечения инфекций, вызванных бактериальными и вирусными патогенами, к адъювантным композициям и способам усиления иммуногенности антигена при использовании в качестве адъюванта в составе вакцин
Предшествующий уровень техники
В настоящее время проводится большое количество исследований, направленных на разработку новых вакцинных препаратов для создания вакцин, которые содержат в своем составе очищенные, содержащих субъединичные или синтетические антигены. Преимуществом использования таких антигенов в составе новых вакцин является значительно более низкий уровень побочных эффектов такого вакцинного препарата по сравнению с другими типами вакцин (аттенуированными, инактивированными и др.). С другой стороны из-за их высокой степени очистки большинство таких антигенов являются низкоиммуногенными, что приводит снижению эффективности вакцин данного типа. Таким образом, в данной области существует потребность в создании эффективных иммуностимулирующих препаратов, которые в виду их выраженной способности инициировать развитие иммунных реакций, могли бы не только сами использоваться для лечения различных инфекций, вызванных бактериальными и вирусными патогенами, но и использоваться в качестве адъювантов в составе вакцин, эффективно усиливающих иммуногенность вакцинных антигенов.
Адъюванты, наряду с вакцинным антигеном, являются одним из неотъемлемых компонентов вакцины. При введении в организм молекулы адъюванта повышают его иммуногенность, дополнительно стимулируя развитие иммунных реакций. Таким образом, иммуностимулирующая способность молекул адъюванта неразрывно связана со способностью повышать иммуногенность вакцинного антигена при использовании их совместно в составе вакцины. На сегодняшний день разработано несколько иммуностимулирующих препаратов, применяемых в качестве адъювантов (гидроксид алюминия, полный и неполный адъювант Фреинда и др.). Однако было показано, что большинство применяемых ранее адъювантов обладало рядом нежелательных побочных действий, ограничивающих их применение в медицинской практике (например, полный и неполный адъювант Фреинда). Длительное время единственным разрешенным к клиническому применению ввиду низких побочных эффектов являлся препарат адъюванта на основе гидроксида алюминия. Однако в ряде исследований было показано, что данный препарат имеет ограниченную эффективность при использовании его с различными вакцинными антигенами. Неспособность к индукции эффективного противоинфекционного иммунитета против ряда бактериальных и вирусных патогенов может быть объяснена развитием при его введении в организм более выраженного Th2 (Т-хелперы второго типа) поляризованного иммунного ответа, тогда как рядом работ было показано, что для некоторых видов инфекций именно Th1 (Т-хелперы первого типа), тип иммунных реакций играет основную роль в иммунной защите организма.
Таким образом, ввиду обозначенных проблем стоит задача разработать адъювантные препараты, обладающие сравнимыми или более высокими уровнями безопасности с солями алюминия, однако обеспечивающие формирование более эффективного противоинфекционного иммунитета, инициирующего развитие как Th1, так и Th2 типа посредством интенсивной индукции широкого спектра иммунных реакций.
Решением данной проблемы может стать использование в качестве адъювантов изолированных молекул-лигандов рецепторов врожденного иммунитета - молекулярных адъювантов. В отличие от используемых в настоящее время адъювантов, молекулярные адъюванты представляют собой высокоочищенные или химически синтезированные молекулы микробного происхождения, обладающие одновременно большей иммуностимулирующей активностью и безопасностью. Кроме того, каждый молекулярный адъювант способен индуцировать свой специфический спектр иммунных реакций, что позволяет модулировать силу и тип индуцируемого иммунного ответа.
Известно решение, в котором описано использование в качестве адъюванта флагеллина или его полипептидов, патент США №8007812. Однако недостатком данного изобретения является то, что его применение сопровождается высокой местной реакцией, появлением антител к флагеллину, которые в дальнейшем при повторном введении препятствуют его эффективному применению.
Известно также решение, заявка на выдачу патента US 2010/0233117. В ней описывается возможность применения липополисахаридов бактерий, а также их производных, а именно монофосфорила липидов А, в качестве адъювантов в составе водно-масляной эмульсии для повышения иммуногенности полипептидных антигенов.
Известно использование фрагментов пептидогликана в качестве адъюванта к вакцинам. Согласно патенту США №6063380 предлагается использование мурамилпептида в качестве адъюванта к вакцине, представляющей антиген, иммобилизированный на поверхности алюминиевых квасцов. Мурамилпептид выбирается из группы соединений, включающей мурабутид, мураметид и мурадиметид.
Изобретение согласно патенту США №7375086 предусматривает использование мурамилдипептида состава MurNAc-L-Ala-D-isoln и MuraNAc-L-Ala-D-Glu для усиления Nod2 активности, ответственной за распознавание муропептидов, в том числе, если соединения описанного состава используются в качестве вакцинного адъюванта.
Известно также решение по заявке на выдачу патента США №20060217319. Описывается возможность использования соединений структуры L-Ala-D-Glu-mesoDAP, активирующей иммунные реакции через взаимодействие с NOD1 рецептором врожденного иммунитета, в качестве адъювантов вакцин, в составе иммуногенных композиций.
В патенте РФ №2383552 описана возможность использования полинуклеотидной адъювантной композиции на основе полирибоинозиновой-полирибоцитидиловой кислоты в качестве средства немедленной защиты, которая является активатором Тоll-подобного рецептора 3, относящегося к семейству паттерн-распознающих рецепторов врожденного иммунитета. Недостатком данной композиции является то, что она приводит преимущественно к индукции противовирусного ответа, что ограничивает ее применение в качестве средства антибактериальной защиты.
Известно также решение по патенту РФ №2412197, где заявлен в качестве иммуностимулятора полимерный фрагмент пептидогликана, повторяющееся звено которого представляет собой тетрасахарид 4-О-{4-O-[4-O-(N-ацетил-β-D-глюкозаминнил)-N-ацетил-β-D-мурамил]-N-ацетил-β-D-глюкозаминнил}-N-ацетил-D-мурамовая кислота, к которому по карбоксильным группам обоих остатков мурамовой кислоты присоединяется тетрапептидный остаток: N-(L-аланил-D-изоглютаминил-мезо-диаминопимелоил-Dаланин).
Данное техническое решение как наиболее близкое к заявляемому по составу действующего вещества и способу его использования выбрано авторами заявляемого изобретения за прототип.
К недостаткам прототипа можно отнести следующее:
1. Относительно низкая иммуностимулирующая активность, которая проявляется лишь при высоких дозах, причем для некоторых антигенов требуется ковалентное присоединение фрагмента пептидогликана к молекуле антигена.
2. Недостаточная длительность эффекта.
3. Индукция узкого спектра иммунных реакций, формируемых за счет активации одного представителя рецепторов врожденного иммунитета - NOD2.
Таким образом, в уровне техники существует острая потребность в разработке эффективного иммуностимулятора, одновременно выполняющего функции молекулярного адъюванта, которое было бы лишено указанных недостатков.
Раскрытие настоящего изобретения
Задачей настоящего изобретения является создание фармацевтической композиции на основе лигандов паттерн-распознающих рецепторов, обладающей высокой
иммуностимулирующей активностью и пролонгированностью действия, с возможностью ее использования в качестве адъюванта в составе вакцин с обеспечением индукции широкого спектра иммунных реакций, формируемых за счет активации представителей двух различных семейств рецепторов врожденного иммунитета - NOD- и TOLL - подобных рецепторов,
Указанная выше задача настоящего изобретения решается за счет того, что, фармацевтическая композиция на основе лигандов паттерн распознающих рецепторов, содержащая фрагменты пептидогликана, дополнительно содержит липополисахарид или его производные, содержащие липид А, а в качестве фрагмента пептидогликана используют фрагмент пептидогликана, содержащий в своей структуре мурамилдипептид структурной формулы N-ацетилмурамил-L-аланил-D-изоглютамин при следующем соотношении компонентов, масс.%:
| фрагмент пептидогликана - | от 0,00001 до 0,01 |
| липополисахарид или его производное - | от 0,00001 до 0,01 |
| растворитель | остальное |
при этом в фармацевтической композиции на основе лигандов паттерн-распознающих рецепторов в качестве фрагментов пептидогликана используют фрагменты пептидогликана, полученные путем химического синтеза. Другим решением является использование в качестве фрагментов пептидогликана фрагменты пептидогликана, полученных из клеточной стенки бактерий. В качестве липополисахарида или его производных используют липополисахарид или его производные, полученные из клеточной стенки бактерий. Другим решением является использование в качестве липополисахарида или его производных липополисахарид или его производные, полученные путем химического синтеза.
Способ использования фармацевтической композиции на основе лигандов паттерн-распознающих рецепторов для лечения инфекции, вызванной бактериальными и вирусными патогенами, заключается в использовании данной фармацевтической композиции в эффективном количестве в качестве иммуностимулятора.
Заявленную фармацевтическую композицию используют в эффективном количестве в качестве адъюванта в составе вакцин.
Перечень фигур
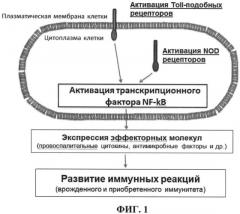
На фиг.1 представлена схема развития иммунных реакций при совместной активации Toll-подобных рецепторов и NOD рецепторов, относящихся к разным семействам паттерн-распознающих рецепторов врожденного иммунитета.
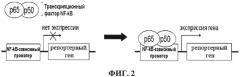
На фиг.2 представлена схема работы репортерной конструкции, которая находится под контролем NF-kB-зависимого промотора.
На фиг.3 представлена гистограмма, показывающая изменение активации транскрипционного фактора NF-kB в клетках THP-1-SEAP при добавлении различных доз лигандов Toll-подобного рецептора 4 (липида А) и NOD2 рецептора (мурамилдипептида)
Ось ординат - оптическая плотность, 405 нм.
Показывает активность фермента щелочной фосфатазы и, следовательно, активацию NF-kB.
Ось абсцисс: 1 - липид А, 2 - мурамилдипетид, 3 - липид А (100 мкг/мл) + мурамилдипетид, 4 - липид А (0,1 мкг/мл) + мурамилдипетид, 5-интактные клетки
- концентрация 100 мкг/мл
- концентрация 10 мкг/мл
- концентрация 1 мкг/мл
- концентрация 0,1 мкг/мл
На фиг.4 представлена гистограмма, показывающая изменение концентрации ИЛ-8 в клетках ТНР-1 при добавлении различных доз лигандов Toll-подобного рецептора 4 и NOD2 рецептора по сравнению с интактными клетками
Ось ординат - концентрация ИЛ8, пг/мл
Ось абсцисс: 1 - липид А, 2 - мурамилдипетид, 3 - липид А (100 мкг/мл) + мурамилдипетид, 4 - липид А (0,1 мкг/мл) + мурамилдипетид, 5- интактные клетки
- концентрация 100 мкг/мл
- концентрация 0,1 мкг/мл
На фиг.5 представлены графики выживаемости мышей после введения отдельных лигандов Toll-подобного рецептора 4, NOD2 рецептора, фармацевтической композиции, на основе лигандов Toll-подобного рецептора 4 и NOD2 рецептора и последующего заражения их вирусом гриппа A/Mallard duck/PA/10218/84(H5N2).
Ось ординат - процент (%) выживших животных
Ось абсцисс - дни
(1) мышам вводили липид А в концентрации 10 мкг/мышь в фосфатном буфере, в объеме 100 мкл на мышь
(2) мышам вводили мурамилдипептид в концентрации 10 мкг/мышь в фосфатном буфере, в объеме 100 мкл на мышь
(3) мышам вводили фармацевтическую композицию на основе лигандов паттерн-распознающих рецепторов: Toll-подобного рецептора 4 (липида А) и NOD2 рецептора (мурамилдипептида) в массовых соотношениях по 0,001% каждого вещества, что составило по 10 мкг/мышь для каждого вещества. Фармацевтическая композиция вводилась в фосфатном буфере, в объеме 100 мкл на мышь. Вместо фосфатного буфера может быть использован любой другой нетоксичный растворитель
(4) мышам вводили фосфатный буфер в качестве отрицательного контроля в объеме 100 мкл на мышь.
На фиг.6 представлены графики выживаемости мышей после введения отдельных лигандов Toll-подобного рецептора 4, NOD2 рецептора, фармацевтической композиции, на основе лигандов Toll-подобного рецептора 4 и NOD2 рецептора и последующего заражения их S.typhimurium.
Ось ординат - процент (%) выживших животных
Ось абсцисс - дни
(1) мышам вводили липид А в концентрации 10 мкг/мышь в фосфатном буфере, в объеме 100 мкл на мышь
(2) мышам вводили мурамилдипептид в концентрации 10 мкг/мышь в фосфатном буфере, в объеме 100 мкл на мышь
(3) мышам вводили фармацевтическую композицию на основе лигандов паттерн-распознающих рецепторов: Toll-подобного рецептора 4 (липида А) и NOD2 рецептора (мурамилдипептида) в массовых соотношениях по 0,001% каждого вещества, что составило по 10 мкг/мышь для каждого вещества. Фармацевтическая композиция вводилась в фосфатном буфере, в объеме 100 мкл на мышь. Вместо фосфатного буфера может быть использован любой другой нетоксичный растворитель
(4) мышам вводили фосфатный буфер в качестве отрицательного контроля в объеме 100 мкл на мышь.
На фиг.7 представлены графики титров антител специфичных к овальбумину, определенных в сыворотке периферической крови мышей после введения им отдельных лигандов Toll-подобного рецептора 4, NOD2 рецептора, фармацевтической композиции, на основе лигандов Toll-подобного рецептора 4 и NOD2 рецептора совместно с модельным антигеном - овальбумином.
Ось ординат - оптическая плотность раствора при длине волны 450 нм
Ось абсцисс - титр разведения
Группа 1 - мышам вводили липид А в концентрации 10 мкг/мышь и овальбумин (10 мкг/мышь) в фосфатном буфере в объеме 100 мкл на мышь
Группа 2 - мышам вводили мурамилдипептид в концентрации 10 мкг/мышь и овальбумин (10 мкг/мышь) в фосфатном буфере в объеме 100 мкл на мышь
Группа 3 - мышам вводили фармацевтическую композицию на основе лигандов паттерн-распознающих рецепторов: Toll-подобного рецептора 4 (липида А) и NOD2 рецептора (мурамилдипептида) в массовых соотношениях по 0,001% каждого вещества, что составило по 10 мкг/мышь для каждого вещества, а также овальбумин (10 мкг/мышь). Фармацевтическая композиция совместно с овальбумином вводилась в фосфатном буфере, в объеме 100 мкл на мышь
Группа 4 - мышам вводили овальбумин (10 мкг/мышь) и фосфатный буфер в качестве контроля
Отрицательный контроль метода
На фиг.8 представлены графики изменения веса животных после введения отдельных лигандов Toll-подобного рецептора 4, NOD2 рецептора, а также фармацевтической композиции, на основе лигандов Toll-подобного рецептора 4 и NOD2 рецептора.
Ось ординат - вес животных, граммы.
Ось абсцисс - дни
Группа 1 - мышам внутримышечно вводили липид А в концентрации 10 мкг/мышь в фосфатном буфере, в объеме 100 мкл
Группа 2 - мышам внутримышечно вводили мурамилдипептид в концентрации 10 мкг/мышь в фосфатном буфере, в объеме 100 мкл
Группа 3 - мышам внутримышечно вводили фармацевтическую композицию на основе лигандов паттерн-распознающих рецепторов: Toll-подобного рецептора 4 (липида А) и NOD2 рецептора (мурамилдипептида) в массовых соотношениях по 0,01% каждого вещества, что составило по 100 мкг/мышь для каждого вещества
Группа 4 - мышам внутримышечно вводили фосфатный буфер в качестве отрицательного контроля.
На фиг.9 представлены графики выживаемости мышей после введения отдельных лигандов Toll-подобного рецептора 4, NOD2 рецептора а также фармацевтической композиции, на основе лигандов Toll-подобного рецептора 4 и NOD2 рецептора.
Ось ординат - процент (%) выживших животных
Ось абсцисс - дни
Группа 1 - мышам внутримышечно вводили липид А в концентрации 10 мкг/мышь в фосфатном буфере, в объеме 100 мкл
Группа 2 - мышам внутримышечно вводили мурамилдипептид в концентрации 10 мкг/мышь в фосфатном буфере, в объеме 100 мкл
Группа 3 - мышам внутримышечно вводили фармацевтическую композицию на основе лигандов паттерн-распознающих рецепторов: Toll-подобного рецептора 4 (липида А) и NOD2 рецептора (мурамилдипептида) в массовых соотношениях по 0,01% каждого вещества, что составило по 100 мкг/мышь для каждого вещества,
Группа 4 - мышам внутримышечно вводили фосфатный буфер в качестве отрицательного контроля.
В заявленном изобретении используется композиция веществ, активирующих разные семейства паттерн-распознающих рецепторов врожденного иммунитета (ПРР), обеспечивающая наибольшее многократное усиление индукции иммунных реакций организма по сравнению с индивидуальными лигандами.
Известно, что первичным событием, определяющим развитие большинства иммунных реакций организма, является взаимодействие паттерн-распознающих рецепторов врожденного иммунитета с собственными лигандами, представляющими собой различные высококонсервативные молекулы микробного происхождения. Связывание собственных лигандов с паттерн-распознающими рецепторами приводит к запуску внутриклеточных сигнальных каскадов, приводящих, в конечном итоге, к активации ряда транскрипционных факторов (АР-1, NF-kB, IRF 3,5,7 и др.), регулирующих развитие тех или иных защитных реакций иммунной системы.
NF-kB является основным провоспалительным транскрипционным фактором, регулирующим экспрессию ряда молекул, которые принимают участие в развитии реакций как врожденного, так и приобретенного иммунитета: секреции провоспалительных цитокинов и хемокинов, синтезе антимикробных пептидов, активации фагоцитоза макрофагами, созревании дендритных клеток и др.
Одними из ПРР, активация которых приводит к индукции NF-kB, являются представители семейства мембраносвязанных Toll-подобных и NOD рецепторов. Таким образом, совместная стимуляция Toll-подобных и NOD рецепторов при добавлении к клеткам соответствующих их лигандов способна привести к суммированию внутриклеточных сигналов вызывающих повышенный уровень активации NF-kB по сравнению с изолированной стимуляцией Toll-подобных или NOD рецепторов. В свою очередь, повышенный уровень активации NF-kB должен вызвать формирование иммунных реакций значительно большей интенсивности.
Таким образом, композиции лигандов различных типов паттерн-распознающих рецепторов врожденного иммунитета, а именно Toll-подобных и NOD рецепторов можно использовать в качестве более эффективных иммуностимуляторов для лечения инфекции, вызванной бактериальными и вирусными патогенами, а также в качестве молекулярных адъювантов, используемых в составе вакцины совместно с вакцинным антигеном.
Использование лигандов, относящихся к разным представителям одного и того же типа паттерн-распознающих рецепторов врожденного иммунитета, например, различных представителей семейства Toll-подобных рецепторов, в составе фармацевтической композиции не обеспечивает повышение развития иммунных реакций по сравнению с использованием индивидуальных лигандов к тем же рецепторам врожденного иммунитета.
Известно, что иммунизация лишь некоторыми антигенами патогенных микроорганизмов способна приводить к формированию эффективного протективного иммунитета, обеспечивающего защиту организма против соответствующего возбудителя заболевания.
Применение в лабораторной и медицинской практике адъювантов совместно с антигенами патогенных микроорганизмов позволило добиться значительного повышения иммуногенности последних, что обеспечило, в свою очередь, возможность повышения эффективности ранее существующих вакцин, а также разработку новых, ранее не существующих вакцин.
Адъюванты, наряду с вакцинным антигеном, являются одним из неотъемлемых компонентов вакцины. При введении в организм молекулы адъюванта способны напрямую повышать его иммуногенность, дополнительно стимулируя развитие иммунных реакций.
Недавние исследования позволили определить механизм действия широко применяемых в практике адъювантов. Было показано, что способность таких адъювантов, как гидроксид алюминия, адъювант Фрейнда и др. стимулировать развитие иммунных реакций, приводящая к повышению эффективности вакцины, в целом реализуется, в том числе посредством взаимодействия с рецепторами врожденного иммунитета. В результате такого взаимодействия происходит активация основного провоспалительного транскрипционного фактора NF-kB, вызывающая, в свою очередь, активацию различных иммунокомпетентных антиген-презентирующих клеток, т.е. повышение экспрессии молекул главного комплекса гистосовместимости, различных костимуляторных молекул. Это играет решающую роль в формировании эффективной иммунной памяти к вакцинному антигену. Таким образом, полученные данные позволяют не использовать ранее востребованный эмпирический способ поиска новых адъювантов, а использовать известные лиганды рецепторов врожденного иммунитета в качестве новых более безопасных и эффективных молекулярных адъювантов. Еще одним положительным свойством применения лигандов рецепторов врожденного иммунитета в качестве адъювантов является способность данных молекул индуцировать свой специфический спектр иммунных реакций, опосредуемых активацией соответствующего рецептора врожденного иммунитета в зависимости от химической природы (липопептид, олигонуклеотид, гликопептид и др.). На основании полученных данных большое количество молекул с различной химической природой было заявлено к использованию в качестве молекулярных адъювантов: флагеллин, липополисахарид, мурамилпептиды и др. Однако молекулярные адъюванты, представляющие собой лиганды рецепторов врожденного иммунитета, помимо низких побочных эффектов способны инициировать развитие иммунных реакций значительно меньшего уровня (по сравнению с адъювантом Фреинда), что бывает недостаточным при использовании их совместно с низкоиммуногенными вакцинными антигенами. Авторы данного изобретения решают данную проблему использованием композиции, состоящей из нескольких молекулярных адъювантов, являющихся лигандами к рецепторам различных типов (Toll-подобного рецептора 4 и NOD рецептора 2). Совместная активация представителей двух различных типов паттерн-распознающих рецепторов врожденного иммунитета позволяет инициировать развитие иммунных реакций значительно большего уровня, по сравнению с применением активацией отдельных типов рецепторов.
Таким образом, представляется возможным создание композиции молекулярных адъювантов, являющихся лигандами различных типов паттерн-распознающих рецепторов врожденного иммунитета, добавление которой к уже существующим вакцинам (вакцинным антигенам) позволит добиться более значительной стимуляции иммунных реакций и, как следствие, повышение эффективности применяемых вакцин и разработке новых вакцин, используя ранее малоэффективные низкоиммуногенные протективные антигены.
Примеры осуществления настоящего изобретения
Пример 1. Выбор действующих веществ фармацевтической композиции на основе лигандов паттерн-распознающих рецепторов, а именно Toll-подобного рецептора 4 и NOD2 рецептора, для использования ее в качестве иммуностимулятора для лечения инфекции, вызванных бактериальными и вирусными патогенами, а также в качестве адъюванта в составе вакцин.
Целью данного примера является определение сочетаний лигандов паттерн-распознающих рецепторов врожденного иммунитета, которые будут вызывать эффект потенциирования развития иммунных реакций (под термином «потенциирование» подразумевается эффект резкого повышения интенсивности иммунных реакций при совместном введении нескольких лигандов, который в несколько раз превышает сумму иммунных реакций, инициируемых каждым лигандом по отдельности).
Для оценки эффективности развития иммунных реакций был использован тест, основанный на определении активности транскрипционного фактора NF-kB. NF-kB является одним из основных провоспалительных транскрипционных факторов, регулирующих экспрессию ряда молекул, которые могут принимать участие в развитии реакций как врожденного, так и приобретенного иммунитета: секреции провоспалительных цитокинов и хемокинов, синтезе антимикробных пептидов, активации фагоцитоза макрофагами, созревания дендритных клеток и др. [Функция и активация NF-kappa В в иммунной системе, Баэрли П., Хэнкель Т., Ежегодный обзор иммунологии, 1994, №12, с.141-79. Function and activation of NF-kappa В in the immune system, Baeuerle P.A., Henkel Т., Annu Rev Immunol. 1994, №12, р:141-79]. Экспериментально доказано, что NF-kB напрямую регулирует транскрипцию более чем 165 генов, принимающих участие в развитие иммунных реакций. Принимая во внимание ключевую роль активации данного транскрипционного фактора в развитии иммунных реакций, он был выбран в качестве молекулярного маркера для определения специфической активности (эффективности индукции иммунных реакций) отдельных лигандов рецепторов врожденного иммунитета, а также их композиций в условиях in vitro.
В цитоплазме клетки транскрипционный фактор NF-kB находится в неактивном состоянии в комплексе с ингибиторным белком IkB. Воздействие внешнего стимула приводит к тому, что IkB фосфорилируется под действием киназы IKK, что приводит к деградации IkB. При этом NF-kB высвобождается от ингибирующего комплекса, транслоцируется в ядро, где взаимодействует с собственной нуклеотидной последовательностью в промотерной части генов, активируя тем самым транскрипцию контролируемых генов.
В настоящее время известно несколько способов оценки уровня активации NF-kB. Одним из наиболее часто используемых прямых методов определения уровня активации NF-kB является функциональная оценка уровня активации NF-kB по определению уровня экспрессии NF-kB-зависимых генов. Для этого в используемую в исследовании клеточную линию вводят генетическую конструкцию, состоящую из репортерного гена, находящегося под контролем промотера, содержащего участок связывания транскрипционного фактора NF-kB (см. фиг.2). В качестве репортерных генов обычно используют гены, уровень экспрессии белковых продуктов которых относительно просто может быть детектирован.
В данном случае была выбрана модель на основе клеточной линии THP-1-SEAP, которая содержит ген щелочной секретируемой фосфатазы (SEAP) под контролем NF-kB-зависимого промотера. Данная клеточная линия позволяет количественно оценивать активацию NF-kB по уровню секреции фермента SEAP.
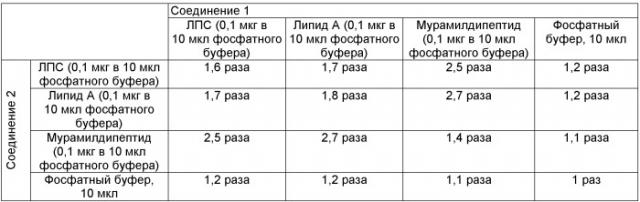
Клетки пассировались на 25 см2 культуральных матрасах в ростовой среде DMEM с 10% эмбриональной сывороткой. Для проведения оценки токсичности клетки были рассеяны на 96 луночный планшет в количестве 104 клеток на лунку. После рассева клеток планшет инкубировали при +37°С и 5% СO2 в течение 18-24 часов.
Через 24 часа к клеткам были добавлены исследуемые образцы, которые представляли собой лиганды паттерн-распознающих рецепторов: Toll-подобного рецептора 4 (ЛПС, Липид A), NOD2 (мурамилдипептид) рецептора, которые добавлялись как отдельно, так и совместно. Образцы были разведены в фосфатном буфере (конечная концентрация указана в таблице) и затем добавлено по 10 мкл соединения 1 и 10 мкл соединения 2. Вместо фосфатного буфера может быть использован любой другой нетоксичный растворитель. Через 12 часов проводили определение активности SEAP. Для этого к аликвоте среды клеток, взятой из каждой лунки (50 мкл), было добавлено по 100 мкл раствора субстрата п-нитрофенил-β-D-глюкопиронозида, после чего оптическая плотность раствора, прямопропорциональная активности фермента, была измерена спектрофотометрически при длине волны 405 нм.
Результаты эксперимента представлены в таблице.
Изменение уровня активации транскрипционного фактора NF-kB по сравнению с интактными клетками (разы)
Результаты эксперимента показали, что только совместное добавление лигандов, активирующих различные семейства паттерн-распознающих рецепторов врожденного иммунитета, приводит к эффекту потенциирования активации NF-kB.
Таким образом, исходя из полученных результатов в качестве действующих веществ для фармацевтической композиции на основе лигандов паттерн-распознающих рецепторов было выбрано сочетание лигандов Toll-подобного рецептора 4 (ЛПС, липид А) и NOD2 рецептора (мурамилдипептид).
Минимальной последовательностью, которую узнает Toll -подобный рецептор 4 является липид А, поэтому данное соединение было выбрано в качестве действующего вещества (лиганда Toll-подобного рецептора 4) для фармацевтической композиции на основе лигандов паттерн-распознающих рецепторов для использования ее в качестве иммуностимулятора для лечения инфекций, вызванных бактериальными и вирусными патогенами, а также в качестве адъюванта в составе вакцин.
Минимальной последовательностью, которую распознает NOD2 рецептор, является мурамилдипептид, поэтому он был выбран в качестве второго компонента для фармацевтической композиции на основе лигандов паттерн-распознающих рецепторов для использования ее в качестве иммуностимулятора для лечения инфекций, вызванных бактериальными и вирусными патогенами, а также в качестве адъюванта в составе вакцин.
При использовании в эксперименте производных липополисахарида, содержащих липид А, например, монофосфорил липида А, дифосфорил липида А, полученных из клеточной стенки бактерий, а также липополисахарида или его производных, содержащих липид А, например монофосфорил липида А, дифосфорил липида А, полученных химическим синтезом, были получены идентичные результаты.
Также при использовании в эксперименте в качестве фрагментов пептидогликана, фрагменты пептидогликана, содержащие в своей структуре мурамилдипептиды структурной формулы N-ацетилмурамил-L-аланил-D-изоглютамин, полученные как путем химического синтеза, так и из клеточной стенки бактерий, были получены идентичные результаты.
Таким образом, химически синтезированные липиды А и мурамилдипептиды, а также они же, но полученные из клеточной стенки бактерий, обладают равной биологической активностью (способностью активировать NF-kB), что позволяет использовать их в равной степени в качестве компонентов для фармацевтической композиции на основе лигандов паттерн-распознающих рецепторов для использования ее в качестве иммуностимулятора для лечения инфекций, вызванных бактериальными и вирусными патогенами, а также в качестве адъюванта в составе вакцин.
Для проведения дальнейших экспериментов были использованы липид А, полученный из клеточной стенки бактерий, а в качестве фрагмента пептидогликана - фрагмент пептидогликана, содержащий в своей структуре мурамилдипептид, полученный из клеточной стенки бактерий, структурной формулы N-ацетилмурамил-L-аланил-D-изоглютамин.
Ввиду того, что и в прототипе, и в заявленном изобретении использованы в качестве NOD 2 рецепторов мурамилдипептиды, в которых содержатся идентичные аминокислоты, которые связываются с NOD 2 рецепторами и обеспечивают биологическую активность вещества, мы можем сопоставить данные исследований, взятых отдельно для NOD 2 рецепторов (как в прототипе), и композиции, на основе лигандов паттерн-распознающих рецепторов: Toll-подобного рецептора 4 и NOD2 рецептора.
Очевидно, что развитие иммунных реакций при активации только NOD 2 рецепторов, относящихся к одному семейству паттерн-распознающих рецепторов врожденного иммунитета (в прототипе), не дает такого эффекта, как использование лигандов Toll -подобного рецептора 4 и NOD2 рецептора, т.е. разных семейств паттерн-распознающих рецепторов врожденного иммунитета, как в заявляемом изобретении, где наблюдается максимальный эффект потенциирования иммунных реакций.
Далее в приведенных примерах также проводится сопоставление с решением по прототипу.
Пример 2. Подбор концентраций действующих веществ фармацевтической композиции на основе лигандов паттерн-распознающих рецепторов: Toll-подобного рецептора 4 и NOD2 рецептора, для использования ее в качестве иммуностимулятора для лечения инфекций, вызванных бактериальными и вирусными патогенами, а также в качестве адъюванта в составе вакцин
Для того чтобы выбрать диапазон концентраций лигандов Toll-подобного рецептора 4 и NOD2 рецептора, в котором наблюдается максимальный эффект потенциирования иммунных реакций, была использована модель на основе клеточной линии THP-1-SEAP, которая подробно описана в примере 1.
Клетки пассировались на 25 см2 культуральных матрасах в ростовой среде DMEM с 10% эмбриональной сывороткой. Для проведения оценки эффективности развития иммунных реакций также был использован тест, основанный на определении активности транскрипционного фактора NF-kB. Для этого клетки были рассеяны на 96 луночный планшет в количестве 104 клеток на лунку. После рассева клеток планшет инкубировали при +37°С и 5% СO2 в течение 18 часов.
Через 18 часов к клеткам были добавлены образцы, представленные лигандом Toll-подобного рецептора 4 (липид А), лигандом NOD2 рецептора (мурамилдипептид), а также фармацевтической композицией, содержащей фрагмент пептидогликана (мурамидипептид) и липид А в различных массовых соотношениях: от 0,00001 до 0,01 мас.% каждого вещества, что составило от 0,1 мкг/мл до 100 мкг/мл соответственно. Растворитель составил остальное. Образцы отдельных лигандов Toll-подобного рецептора 4 (липид А) и лиганда NOD2 рецептора (мурамилдипептид) были разведены в фосфатном буфере также до итоговой концентрации от 0,1 мкг/мл до 100 мкг/мл, соответственно. Вместо фосфатного буфера может быть использован любой другой нетоксичный растворитель.
Результаты эксперимента представлены на фиг.3. Ось ординат - оптическая плотность, 405 нм. Показывает активность фермента щелочной фосфатазы и, следовательно, активацию NF-kB. Ось абсцисс: 1 - липид А, 2 - мурамилдипетид, 3 - липид А (100 мкг/мл) + мурамилдипетид, 4 - липид А (0,1 мкг/мл) + мурамилдипетид, 5 -интактные клетки
- концентрация 100 мкг/мл
- концентрация 10 мкг/мл
- концентрация 1 мкг/мл
- концентрация 0,1 мкг/мл
Как видно из представленных данных, максимальный эффект потенциирования иммунных реакций по сравнению с отдельными лигандами Toll-подобного рецептора 4 (липидом А) и NOD2 рецептора (мурамидипептидом) наблюдался при добавлении фармацевтической композиции на основе лигандов паттерн-распознающих рецепторов: Toll-подобного рецептора 4 (липида А) и NOD2 рецептора (мура