Композиции и способы применения белка са9 для стимуляции иммунного ответа
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к иммунологии, и может быть использована для стимуляции иммунного ответа. Для этого индивидууму вводят композицию, содержащую комплекс изолированного белка угольной ангидразы IX (СА9) и антигена, где изолированный белок СА9 и антиген нековалентно связаны друг с другом. Группа изобретений также относится к композиции, содержащей очищенную популяцию дендритных клеток, которые вступали в контакт с вышеуказанной композицией. Группа изобретений обеспечивает стимуляцию иммунного ответа путем усиления иммуногенности антигена за счет включения в комплекс белка СА9, который может функционировать в качестве шаперона. 3 н. и 15 з.п. ф-лы, 1 табл., 6 ил., 8 пр.
Реферат
По данной заявке испрашивается приоритет по предварительной заявке на патент США №61/001602, поданной 2 ноября 2007 г, описание которой включено в данное описание путем ссылки.
Данная работа была поддержана грантом №1K23CA12007501A1 от Национальных Институтов Здоровья. Правительство США имеет определенные права на данное изобретение.
Область, к которой относится изобретение
Настоящее изобретение относится в целом к стимуляции иммунных ответов и, в частности, к применению угольной ангидразы IX (CA9) для стимуляции иммунного ответа, направленного против антигена.
Предшествующий уровень техники
Экспрессия CA9 связана с опухолевым ростом и коррелировалась с прогнозом при различных видах рака мозга, легких, молочной железы, шейки матки, почек, желудочно-кишечного тракта и головы и шеи (1-6). CA9 экспрессируется в ответ на снижение парциального давления кислорода (7). Считается, что это адаптивный ответ, который приводит к увеличенной доставке кислорода и питательных веществ к опухоли и может содействовать прогрессированию заболевания и, в конечном счете, метастазированию раковых клеток. Экспрессия СА9 увеличивается при многих солидных злокачественных опухолях, причем наибольшая экспрессия имеется в опухолевых клетках, непосредственно прилегающих к областям некроза (1, 7). СА9 также является маркером гипоксии в нормальных клетках и большинстве злокачественных опухолей. При всех злокачественных новообразованиях, где сообщалось о СА9 как о прогностическом маркере, за исключением прозрачно-клеточной почечноклеточной карциномы (RCC), увеличенная экспрессия CA9 прогнозировала худший прогноз (1-4, 6). Экспрессия в другой нормальной ткани ограничивается базальными клетками волосяных фолликулов, эпителием гонад, паутинным сплетением и некоторыми отделами слизистой оболочки желудочно-кишечного тракта (8). Однако при прозрачно-клеточной RCC экспрессия CA9 не регулируется парциальным давлением кислорода. CA9 присутствует более чем в 80% первичных и метастатических RCC, и СА9 присутствует в 95-100% прозрачно-клеточного варианта, наиболее распространенного гистологического типа RCC. CA9 не экспрессирован в нормальной почечной ткани (8, 9). Представляется, что для прозрачно-клеточной RCC СА9 является превосходным маркером, который способствует установлению диагноза, определению прогноза, прогнозированию реакции на лечение и служит в качестве мишени для лечения. В частности, высокая экспрессия CA9 является независимым прогностическим показателем более длительного специфичного для заболевания выживания у пациентов с метастатической RCC (5, 10) и улучшенного выживания у пациентов с локализованной RCC (11, 12). Однако, несмотря на широко распространенный интерес к CA9 и лучшее понимание молекулярного дефекта, ведущего к избыточной экспрессии при прозрачно-клеточной RCC, непонятен механизм, связывающий экспрессию CA9 с улучшенным прогнозом и реакцией на лечение у пациентов с RCC, в то же время в иных отношениях являющийся показателем неблагоприятного прогноза. Поэтому, существует потребность в разработке способов и композиций с использованием CA9 для применения в качестве терапевтического средства.
Сущность изобретения
Настоящее изобретение основано на неожиданно обнаруженной у CA9 функции шаперона, выполняемой подобно белку теплового шока (HSP). В частности, в данном описании раскрывается, что CA9, а также растворимая форма CA9, которая отделяется с поверхности определенных клеток и приблизительно на 4 кДа меньше, чем CA9 полной длины, может ингибировать вызванную нагреванием агрегацию белка и может содействовать сворачиванию белка. Однако авторы показывают, что в отличие от HSP, CA9 может образовывать иммуногенные комплексы с антигенами при комнатной температуре (например, приблизительно 20°C) и при температуре тела человека (например, 37°C). В данном описании также показано, что CA9 интернализуется представляющими антиген клетками и перерабатывается в первую очередь по протеосомальному пути, который считается важным для активации опосредованных клетками иммунных ответов. Кроме того, авторы продемонстрировали на мышиной модели меланомы, что способ по изобретению эффективен для стимуляции антиген-специфического противоопухолевого ответа, который является более выраженным, чем ответ, генерируемый антигеном, в отсутствие белка CA9. Соответственно, изобретение относится к способу стимуляции иммунного ответа на антиген, включающему введение композиции по изобретению индивидууму в количестве, эффективном для стимуляции иммунного ответа на антиген, где иммунный ответ на антиген является более выраженным, чем иммунный ответ, стимулированный антигеном, в отсутствие белка CA9. Композиции по изобретению содержат антиген и изолированный белок CA9. Изолированный белок CA9 и антиген предоставлены в комплексе, причем комплекс может представлять собой нековалентную связь между изолированным CA9 и антигеном или может представлять собой химически конъюгированный белок CA9 с антигеном, или может представлять собой слитый белок CA9/антигена. Иммунный ответ, стимулированный введением композиции, может быть профилактическим или терапевтическим и может включать гуморальный или клеточно-опосредованный иммунный ответ, или их комбинацию. Изобретение может использоваться для стимуляции иммунного ответа против широкого разнообразия пептидных и белковых антигенов, но белки теплового шока не включены в объем антигенов, используемых в композициях и способах по настоящему изобретению. В одном варианте осуществления антиген представляет собой опухолевый антиген.
Краткое описание фигур
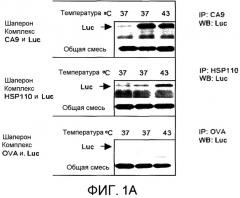
На фиг.1А в виде фотографии представлены результаты прерывистого анализа, использованного для того, чтобы показать, что CA9 способен связывать белки-клиенты. Люцифераза (Luc) служила в качестве белка-клиента, и CA9 образовывал комплекс с Luc при 37°C и 43°C. HSP110 служил в качестве положительного контроля и образовывал комплекс с люциферазой при 43°C, но не при 37°C. Овальбумин (OVA) служил в качестве отрицательного контроля и не обладал способностью выполнять функции шаперона. Полосы без шаперона (1ая полоса) были включены в качестве контролей. Иммунопреципитацию (IP) выполняли, используя антитела против CA9, HSP110 или OVA с последующим вестерн-блоттингом (WB) с антителом против люциферазы. На нижней панели WB выполняли с анти-люциферазой для подтверждения того, что прерывистый анализ OVA был успешным.
На фиг.1B графически представлены данные, демонстрирующие, что рекомбинантный CA9, так же как HSP70, эффективен в предотвращении агрегации люциферазы при 43°C. OVA служил в качестве контрольного белка. Мониторинг агрегации люциферазы в динамике во времени осуществляли измерением оптической плотности при 320 нм.
На фиг.1C в виде фотографии представлены результаты вестерн-блоттинга, демонстрирующие, что CA9 способен предотвращать агрегацию люциферазы и удерживать ее в растворе. Люциферазу нагревали до 43°C в течение 30 мин с белком шаперона (CA9, HSP110, OVA) или без него. Всю реакционную смесь центрифугировали при 16000×g в течение 15 мин для отделения супернатанта и осадка после центрифугирования. В контрольных ответах (полосы 1 и 2) большая часть люциферазы агрегировалась и была обнаружена в осадке после центрифугирования. CA9 и HSP110 были способны удерживать люциферазу в растворе при температуре теплового шока. Вся реакционная смесь служила в качестве контроля загрузки.
На фиг.1D представлено графическое изображение данных, демонстрирующих, что изолированный белок CA9 и классические белки теплового шока представляют собой белки, денатурированные шапероном, и обеспечивают возможность повторного сворачивания. Люциферазу денатурировали при 43°C в течение 30 мин в присутствии CA9, HSP110, HSP70 или OVA (отрицательный контроль). Добавляли лизат кроличьих ретикулоцитов (RRL), и повторное сворачивание оценивали мониторингом ферментной активности люциферазы. Молярное отношение белка шаперона к люциферазе составляло 20:1. Способность повторного сворачивания коррелировалась со способностью предотвращать агрегацию белков-клиентов; CA9 и HSP70 были одинаковы по их способности предотвращения агрегации и повторного сворачивания люциферазы. Для экспериментов, выполненных в трех повторах, представлена средняя величина±SEM (стандартная ошибка среднего).
На фиг.2A представлено графическое изображение данных, показывающих, что CA9 связывает DC (дендритные клетки) насыщаемым образом, что указывает на связывание, опосредованное рецепторами. Полученные из костного мозга DC (1×106/мл) инкубировали при 4°C с CA9, меченным FITC (флюоресцеин-изоцианатом) или BSA, меченным FITC, в течение 30 мин и дважды промывали 1% BSA/PBS (бычий сывороточный альбумин/забуференный фосфатом солевой раствор). Связывание CA9 оценивали измерением средней интенсивности флюоресценции (MFI) с использованием проточной цитометрии.
На фиг.2B представлено графическое изображение данных, показывающих конкурентный анализ связывания CA9 с DC. Связывание CA9 с DC ингибировалось немеченым CA9. DC, полученные из костного мозга (1×106/мл), инкубировали при 4°C с немеченым CA9 или BSA в указанных концентрациях, промывали и затем инкубировали с 200 мкг/мл CA9, меченного FITC.
На фиг.2C представлено графическое изображение данных, показывающих, что связывание CA9 с DC ингибируется лигандом акцепторного рецептора. DC, полученные из костного мозга (1×106/мл), инкубировали при 4°C с фукоиданом или BSA в указанных концентрациях, промывали и затем инкубировали с 200 мкг/мл CA9, меченного FITC.
На фиг.2D представлено графическое изображение данных, показывающих, что связывание CA9 было уменьшено в DC из акцепторного рецептора А (SRA) от нокаутированных мышей (мышей SRA-KO), по сравнению с DC от мышей дикого типа (WT), указывая на то, что связывание CA9 частично опосредуется SRA. DC, полученные из костного мозга (1×106/мл), инкубировали при 4°C с BSA, CA9 или фукоиданом в концентрации 500 мкг/мл перед промыванием и затем инкубировали с 200 мкг/мл CA9, меченного FITC. «Усы» указывают SEM для экспериментов, выполненных в трех повторах.
На фиг.3А представлено графическое изображение данных, показывающих, что опухолевые клетки сбрасывают растворимую форму CA9. Клеточные лизаты из человеческих почечных опухолей зондировали антителом против CA9, демонстрирующим экспрессию CA9 полной длины. Такие же опухоли, выращенные в кратковременных культурах, сбрасывали растворимую Форму CA9 (sCA9), которая имела размер, приблизительно на 4 кДа меньше, чем CA9 полной длины. Прозрачно-клеточные опухоли (опухоли 30-34) экспрессировали и сбрасывали CA9. Здоровые почки (Ki) и 2 папиллярные почечные опухоли (опухоли 28 и 29) не экспрессировали или не сбрасывали CA9.
На фиг.3B представлено графическое изображение данных, показывающих, что сброшенный CA9 обладает свойствами, подобно шаперону. SCA9 был так же эффективен как CA9 полной длины в ингибировании агрегации люциферазы при 43°C. Мониторинг агрегации люциферазы с течением времени проводили измерением оптической плотности при 320 нм.
На фиг.3C представлено графическое изображение данных, показывающих, что растворимый CA9 связывает DC насыщаемым образом. Клетки DC, полученные из костного мозга (1×106/мл), инкубировали при 4°C с sCA9 или BSA, меченым FITC, в течение 30 мин и дважды промывали 1% BSA/PBS (слева). Как и с CA9, связывание sCA9 с DC ингибировалось немеченым CA9 и фукоиданом, свидетельствуя о том, что CA9 и sCA9 связывают акцепторные рецепторы на DC (справа). Клетки DC, полученные из костного мозга (1×106/мл), инкубировали при 4°C с BSA, CA9 или фукоиданом при 500 мкг/мл перед промыванием и инкубировали с 200 мкг/мл меченого FITC CA9. «Усы» указывают SEM для экспериментов, выполненных в трех повторах.
На фиг.3D представлено графическое изображение данных, показывающих, что растворимый CA9 содействует повторному сворачиванию денатурированного белка. Люцифераза денатурировалась при 43°C в течение 30 мин в присутствии CA9, sCA9 и HSP110. Добавляли лизат кроличьих ретикулоцитов, и повторное сворачивание оценивали мониторингом ферментной активности люциферазы. Молярное отношение белка шаперона к люциферазе составляло 20:1. CA9 и sCA9 были одинаковы в их способности повторно сворачивать люциферазу. Средняя величина±SEM представлены для экспериментов, выполненных в трех повторах.
На фиг.4A представлено графическое изображение данных, показывающих, что и CA9, и сброшенный CA9 (sCA9) способны связывать и нести люциферазу к DC. CA9 и sCA9 образовывали комплексы с люциферазой при 37°C в течение 30 мин и инкубировали с DC, полученными из костного мозга при 4°C в течение 2 ч. CA9 и sCA9 без люциферазы и одну люциферазу также инкубировали с DC и служили в качестве контролей. DC дважды промывали для удаления несвязанного CA9, лизировали в буфере RIPA и зондировали вестерн-блоттингом антителами против люциферазы и против CA9.
На фиг.4B представлена фотография, полученная при выполнении анализа с использованием конфокальной микроскопии, демонстрирующая, что CA9 способна связывать DC и быть интернализированным. В частности, конфокальная микроскопия показала CA9, меченный FITC, связанный с поверхностью полученных из костного мозга DC при 4°C. DC промывали для удаления несвязанного CA9 и инкубировали при 37°C в течение 2 часов, что приводило к интернализации CA9, меченного FITC. Проводили контрокрашивание ядра DAPI (диамидин-2-фенилиндолом).
На фиг.4C представлена фотография, полученная при выполнении вестерн-блоттинга, показывающая, что DC способны интернализировать и перерабатывать CA9. CA9 давали возможность связывать DC в течение 2 ч при 4°C. DC дважды промывали и инкубировали в свежей среде при 37°C в течение указанного времени. CA9 клеточной поверхности промывали, и мониторинг внутриклеточного CA9 проводили вестерн-блоттингом для выявления CA9. β-актин служил в качестве контроля загрузки. В необработанной группе (контроль), обработка CA9 приводила к уменьшению внутриклеточного CA9, выявленного вестерн-блоттингом. Предварительная обработка DC MGl32 (ингибитор протеосомы) или NH4Cl (ингибитор лизосомы) в течение 30 мин при 37°C показала, что CA9 обрабатывался обоими путями; однако протеосомальный путь был преобладающим.
На фиг.5А представлено графическое изображение результатов, полученных иммунизацией мышей C57/BL6 (5 на группу) комплексом CA9-gp100 (CA9+gp100), которое демонстрирует стимуляцию противоопухолевого эффекта против опухолевых клеток B16-gp100. Опухолевые клетки B16-gp100 (2×105) инъецировали интрадермально через 7 дней после 3 иммунизаций, проводимых с интервалом 7 дней. Величины P на основании повторных измерений с использованием ANOVA (вариационный анализ), который учитывает вариабельность внутри каждой группы, представлены в таблице, сравнивающей каждую группу с контрольными мышами, которым инъецировали PBS. Скорость роста опухолей значимо отличалась при сравнении мышей, иммунизированных CA9+gp100, и мышей в любой контрольной группе; например, величина p составила 0,0036 при сравнении с группой CA9+gρ100, и мышами, иммунизированными инъекцией CA9 и gp100 в отдельные бока (CA9L-gp100R). Одинаковые результаты были получены в 3 отдельных экспериментах.
На фиг.5B представлено графическое изображение результатов, полученных иммунизацией мышей комплексом CA9+gp100, который стимулировал gp100-специфический ответ IFN-γ (интерферон-гамма) из клеток CD8+, измеренный с использованием анализа иммуноферментного анализа ELISPOT. Средняя величина±SEM представлены для экспериментов, выполненных в трех повторах.
На фиг.5C представлено графическое изображение результатов, полученных иммунизацией мышей комплексом CA9+gp100, который стимулировал специфическую для опухоли Т-клеточный ответ, измеренный с использованием анализа высвобождения 51Cr. Средняя величина±SEM представлены для экспериментов, выполненных в трех повторах.
На фиг.5D представлено графическое изображение результатов, показывающих, что сброшенный CA9 способен стимулировать специфический клеточный иммунный ответ против мышиного пептида gp100 (EGSRNQDWL (SEQ ID NO:2)). Иммунизация DC, обработанными комплексом из CA9 и пептида gp100, вызывала пептид-специфический ответ цитотоксических Т-клеток, измеренный с использованием анализа высвобождения 51Cr. Мышей C57/BL6 (3 на группу) иммунизировали 3 раза с интервалом 7 дней 2×106 DC, полученными из костного мозга, обработанными указанными белок-пептидными комплексами в концентрации 10 мкг/мл и активировали LPS (липополисахаридом). Средняя величина±SEM представлены для экспериментов, выполненных в трех повторах.
На фиг.6A представлена фотография, на которой показаны результаты вестерн-блоттинга, полученные при анализе эффекта цитокинов на отделение и экспрессию CA9. Экспрессия CA9 линией клеток R6 RCC была увеличена в ответ на среды, кондиционированные человеческими WBC, обработанными IL2 (интерлейкин 2) и IFN-α (интерферон-альфа). WBC выделяли из крови человека и обрабатывали IL2, IFN-α, IFN-γ или не обрабатывали ничем (контроль) в течение 24 ч для получения кондиционированных сред (CM). Клетки R6 обрабатывали CM в течение 48 ч перед лизисом и зондированием антителом против CA9. CM использовали, поскольку цитокины обеспечивают терапевтическое благоприятное действие стимуляцией иммунных клеток, а не нацеливаясь непосредственно на опухоли.
На фиг.6B представлена фотография, фотография, на которой показаны результаты вестерн-блоттинга, свидетельствующие о том, что сброс CA9 первичными опухолевыми эксплантатами в кратковременной культуре увеличивается в ответ на действие IL2. Первичные почечные опухоли культивировали с IL2 или без него. Культуральные среды зондировали антителом против CA9. Культуральные среды разделяли электрофорезом и окрашивали кумасси голубым, и они служили в качестве контроля. IL2 наносили непосредственно на хирургические образцы, которые содержат как опухолевые клетки, так и иммунные клетки.
Описание изобретения
Настоящее изобретение относится к композициям и способам стимуляции иммунного ответа на антиген у индивидуума. Композиция содержит комплекс изолированного белка CA9 и антигена. Способ включает введение композиции индивидууму в количестве, эффективном для стимуляции иммунного ответа на антиген, где стимулированный иммунный является более выраженным, чем иммунный ответ, стимулированный одним антигеном. Стимулированный иммунный ответ может оказывать терапевтический или профилактический эффект и может включать клеточно-опосредованный и/или гуморальный ответ или его комбинацию.
Настоящее изобретение основано на неожиданно обнаруженной у CF9 новой функции шаперона, и это считается открытием первого белка клеточной поверхности, который может функционировать в качестве шаперона. «Шаперон» в целом считается в данной области белком, который может связывать белки-клиенты, предотвращать агрегацию белков-клиентов при температурах, вызывающих тепловой шок, таких как температуры приблизительно 42-43°C, и обеспечивать возможность повторного свертывания денатурированных белков. Однако тепловое повреждение белков, необходимое для образования комплексов с белками-шаперонами, может происходить при температурах, достигающих приблизительно 55°C. Белки теплового шока (HSP) являются хорошо известными, вездесущими внутриклеточными шаперонами, экспрессия которых запускается индуцированными тепловым шоком факторами транскрипции, включая HSFl, HSF2, HSF2BP, HSF4, HSF5, HSFXl, HSFX2, HSFYl, HSFY2. Авторы продемонстрировали, что CA9 выполняет много функций, обычно относимых к белкам теплового шока HSP, и что растворимая форма CA9, которая отделяется от поверхности клеток, также обладает свойствами шаперона HSP. В частности, авторы продемонстрировали, что CA9 ингибирует вызванную нагреванием агрегацию белка, обеспечивает возможность повторного сворачивания денатурированного белка и восстанавливает ферментативную функцию белков, с которыми он образует комплексы. Авторы продемонстрировали, что CA9 связывается с дендритными клетками (DC) специфичным для рецептора образом, и показали, что связанный CA9 интернализуется DC и перерабатывается в первую очередь по протеосомальному пути, который, как считают, необходим для представления экзогенных антигенов на MHC I (главном комплексе тканевой совместимости) и активации Т лимфоцитов CD8+. Считается также, что такое представление антигена является важным для стимуляции вакциной иммунного ответа, который может ингибировать рост опухолей. Таким образом, приведенные результаты совместно указывают на то, что CA9, вероятно, играет непосредственную роль в стимуляции адаптивного иммунного ответа. В этом отношении, авторы также продемонстрировали на модели рака в виде мышиной меланомы, что введение композиции, содержащей CA9 и антиген, может стимулировать специфический для антигена противоопухолевый ответ, который является более выраженным, чем ответ, генерируемый одним антигеном.
Несмотря на указанные выше сходства между CA9 и HSP, CA9 имеет несколько необычных и желаемых признаков, по сравнению с HSP, и поэтому не считается одним из HSP. Например, HSP индуцируются нагреванием и, в соответствии с их ролью в обеспечении термической устойчивости, HSP связывают антигены-мишени при температурах, вызывающих тепловой шок, например, 42-43°C. Напротив, CA9 индуцируется не только нагреванием (но и гипоксией), и авторы продемонстрировали, что CA9 эффективно связывает антигены-мишени при 37°C. Кроме того, CA9 может также образовывать иммуногенные комплексы при комнатной температуре. Таким образом, такое свойство CA9 может содействовать более эффективному получению композиций на основе CA9 для применения в способе по изобретению. Кроме того, HSP являются внутриклеточными шаперонами и в целом высвобождаются во внеклеточную среду только после нарушения клеточной целостности. С другой стороны, CA9 представляет собой белок клеточной поверхности и также может сбрасываться во внеклеточную среду жизнеспособными клетками. Кроме того, в клетках с интактной реакцией на гипоксию, CA9 экспрессируется в ответ на уменьшение парциального давления кислорода. Поэтому и без связи с какой-либо конкретной теорией, полагают, что настоящее изобретение выявляет, что экспрессия и сброс CA9 может представлять собой общий механизм вовлечения иммунной системы в нацеливание на внеклеточные антигены в ответ на гипоксический стресс, и может объяснить благоприятный прогноз в случаях RCC, где растворимый CA9 сбрасывается из опухолей. Кроме того, клетки, экспрессирующие CA9 в организме хозяина, могут представлять непрерывный источник для продукции иммунного адъюванта, который мог бы служить содействию иммуностимулирующим эффектам настоящего изобретения.
Белок CA9 полной длины имеет следующую аминокислотную последовательность:
1 maplcpspwl pllipapapg ltvqlllsll llvpvhpgrl prmqedsplg ggssgeddpl
61 geedlpseed spreedppge edlpgeedlp geedlpevkp kseeegslkl edlptveapg
121 dpqepqnnah rdkegddqsh wryggdppwp rvspacagrf qspvdirpql aafcpalrpl
181 ellgfqlppl pelrlrnngh svqltlppgl emalgpgrey ralqlhlhwg aagrpgseht
241 veghrfpaei hvvhlstafa rvdealgrpg glavlaafle egpeensaye qllsrleeia
301 eegsetqvpg ldisallpsd fsryfqyegs lttppcaqgv iwtvfnqtvm lsakqlhtls
361 dtlwgpgdsr lqlnfratqp lngrvieasf pagvdsspra aepvqlnscl aagdilalvf
421 gllfavtsva flvqmrrqhr rgtkggvsyr paevaetga. (SEQ ID NO:1).
кДНК человеческого CA9 известна в данной области и кодирует белок из 459 аминокислот с N-концевой внеклеточной частью из 414 аминокислот, связанной посредством прогнозированной гидрофобной трансмембранной области (ТМ) из 20 аминокислот с прогнозированным С-концевым внутриклеточным хвостом (IC) из 25 аминокислот. Прогнозированная последовательность ТМ представлена в SEQ ID NO:1 в виде аминокислот 415-434. Прогнозированная последовательность IC представлена в SEQ ID NO:1 в виде аминокислот 435-459. Таким образом, прогнозированная последовательность сброшенного белка CA9 представлена в SEQ ID NO:1 в виде аминокислот 1-414.
CA9 полной длины имеет прогнозированную молекулярную массу 49,7 кДа, но он может быть выявлен на вестерн-блотах 54 кДа и 58 кДа. Сброшенная форма CA9 представляет собой растворимую форму CA9, которая высвобождается в культуральную среду и в биологические жидкости, наиболее вероятно, путем протеолитического отщепления внеклеточной части от трансмембранной и внутриклеточной последовательностей. Сброшенный CA9 на 4 кДа меньше чем CA9 полной длины, по данным выявления на вестерн-блотах и, таким образом, мигрирует в виде сдвоенных полос 50/54 кДа (Zavada et al., Br J Cancer. 2003 Sep 15;89(6):1067-71), но имеет прогнозированную молекулярную массу 45,7 кДа.
Композиции по настоящему изобретению содержат изолированный белок CA9. Под термином «изолированный белок CA9» подразумевается, что белок выделен из его естественной среды. Считается, что описанные в настоящем изобретении комплексы CA9/антигена содержат изолированный белок CA9.
Белок CA9 для применения в композициях и способах по изобретению может быть выделен из клеток, которые экспрессируют белок CA9. Некоторые неограничивающие примеры таких клеток включают клетки, которые эндогенно экспрессируют белок CA9 из геномных кодирующих последовательностей, и клетки, которые были подвергнуты манипуляция генной инженерии для экспрессии рекомбинантного белка CA9. Такая рекомбинантная экспрессия белка CA9 может быть достигнута с использованием широкого разнообразия обычных методик и систем рекомбинантной экспрессии белка, известных в данной области. Альтернативно, сброшенный белок CA9 может быть выделен с использованием известных способов из сред для клеточных культур, в которых культивируются клетки, экспрессирующие CA9 посредством эндогенной генной экспрессии или генной инженерии. В случае пептидных антигенов, пептиды могут быть химически синтезированы при помощи любой из разнообразных хорошо известных методик или могут быть получены в результате протеолитического расщепления более крупных белков.
Изолированный белок CA9 необязательно должен представлять собой очищенный белок. Однако изолированный белок CA9 может, тем не менее, быть очищен до любой желаемой степени чистоты. Способы очистки белка хорошо известны в данной области и могут применяться для получения очищенного белка СА9 для использования в настоящем изобретении.
Предусматривается, что настоящее изобретение может применяться для стимуляции иммунного ответа на любой белок, полипептид или пептидный антиген, за исключением того, что используемый в данном описании термины «антиген» и «антигены» не включают HSP. Примеры HSP включают hsp40, калретикулин, hsp60, hsp70, hsp90, HSP110. Таким образом, за исключением иных случаев, описанных в данном описании, антигены, подходящие для использования в настоящем изобретении, включают, но без ограничения, антигены, экспрессируемые раковыми клетками или инфекционными агентами. Антиген может быть хорошо охарактеризован или может быть неизвестен, кроме как известностью его присутствия, например, в лизате из определенного типа клеток, такого как опухоль или бактериальная культура.
В одном варианте осуществления антиген, присутствующий в изолированных комплексах CA9/антиген по изобретению, представляет собой опухолевый антиген. Опухолевые антигены могут быть получены при помощи обычных методик, таких как получение лизатов опухолевых клеток повторным замораживанием и оттаиванием опухолевых клеток/тканей в забуференном фосфатом солевом растворе, содержащем лейпептин и апротинин (полученный из свежей биопсии ткани опухоли или из опухолевых клеток, генерированных in vitro тканевой культурой). Такое замораживание и оттаивание приводит к лизису клеток. Опухолевой лизат может быть получен путем центрифугирования и сбора надосадочной жидкости. Лизаты опухолевых клеток могут применяться сразу или замораживаться и храниться, например, при -70°C до готовности к использованию.
В различных вариантах осуществления антиген может представлять собой антиген, экспрессируемый раковыми клетками, конкретные примеры которых включают, но без ограничения, фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, псевдомиксому брюшины, лимфангиоэндотелиосаркому, синовиому, мезотелиому, опухоль Юинга, лейомиосаркому, рабдомиосаркому, карциному ободочной кишки, рак поджелудочной железы, рак молочной железы, рак яичника, рак предстательной железы, плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярные аденокарциномы, цистаденокарциному, медуллярную карциному, бронхогенную карциному, почечноклеточную карциному, гепатому, карциному желчных протоков, хориокарциному, семиному, эмбриональную карциному, опухоль Вильнса, рак шейки матки, рак семенников, карциному легких, мелкоклеточную карциному легких, карциному мочевого пузыря, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингому, эпендимому, пинеалому, гемангиобластому, нейрому слухового нерва, олигодендроглиому, менингиому, меланому, нейробластому, ретинобластому, лейкоз, лимфому, множественную миелому, макроглобулинемию Вальденстрома и болезнь тяжелых цепей. В одном варианте осуществления антиген представляет собой gp 100.
В других вариантах осуществления, антигены, используемые в изобретении, могут представлять собой такие, которые экспрессируются инфекционными агентами. Примеры таких инфекционных агентов включают, но без ограничения, вирусы, бактерии, грибы и другие паразиты. Примеры вирусов включают, но без ограничения, вирусы гепаптита типа В или типа С, гриппа, ветряной оспы, аденовирус, вирус простого герпеса типа I или типа II, чумы рогатого скота, риновирус, эховирус, тотавирус, респираторный синцитиальный вирус, вирус папилломы, цитомегаловирус, эхиновирус, арбовирус, гантавирус, коксаки вирус, вирус эпидемического паротита, вирус кори, вирус краснухи, вирус полиомиелита, вирус иммунодефицита человека типа I или типа II. Примеры бактерий включают, но без ограничения, M. tuberculosis, микобактерию, микоплазму, Neisseria и Legionella. Примеры других паразитов включают, но без ограничения, рикеттсии и хламидии.
Без намерения быть связанными какой-либо конкретной теорией, считают, что для применения в способе по изобретению, изолированный белок СА9 и антиген должны присутствовать в комплексе и, таким образом, соединены друг с другом химическим связыванием, таким как ковалентные связи, ионные связи, водородные связи и/или связи Ван дер Ваальса или их комбинации. Таким образом, в одном варианте осуществления белок СА9 и антиген могут присутствовать в комплексе, где белок СА9 и антиген ковалентно не связаны друг с другом. Способы образования комплексов белка/антигена без ковалентного связывания известны в данной области и могут использоваться для образования комплексов между изолированным белком СА9 и одним или более антигенами. Комплексы по изобретению могут содержать белок СА9 и антиген или могут состоять по существу из белка СА9 и антигена, или могут состоять из белка СА9 и антигена.
В одном варианте осуществления комплекс, содержащий изолированный СА9 и нековалентно связанный антиген, может быть образован в подходящем буфере при комнатной температуре (например, приблизительно 20°C), или при более высокой температуре, например, 37°C, но ниже более высоких температур, обычно требуемых для того, чтобы HSP образовывали комплекс с белком, например, 43°C. Соответственно комплексы CA9/антигена по настоящему изобретению могут быть образованы, например, при температуре в диапазоне от 20°C до 42°C, включительно, и включая все целые числа от 20°C до 42°C. Комплексы могут также быть образованы при более высоких температурах. В одном варианте осуществления комплекс CA9/антиген образуется при 37°C. Подходящие молярные отношения CA9 к антигену могут быть определены специалистами в данной области, с учетом благоприятного эффекта, раскрытого в данном описании. В одном варианте осуществления используется отношение CA9/антигена 1:1.
В одном варианте осуществления для использования в настоящем способе эндогенный CA9 может быть изолирован из биологического образца, содержащего клетки, такого как биологический образец, полученный из опухоли, и выделенный белок CA9, таким образом, может уже образовывать комплексы с опухолевыми антигенами, против которых надлежит стимулировать иммунный ответ.
В другом варианте осуществления изолированный белок CA9 может быть ковалентно связан с антигеном, например, химическим конъюгированием белка CA9 с антигеном для образования комплекса конъюгата изолированного белка CA9/антигена. Подходящие способы химического конъюгирования белков известны в данной области и могут использоваться для образования конъюгатов изолированного белка CA9/антигена для композиций и способов по изобретению. Кратко, CA9 могут быть ковалентно конъюгированы с антигеном посредством поперечной сшивки аминокислотных остатков CA9 с аминокислотными остатками антигена. Аминокислотные остатки могут быть конъюгированы, например, поперечной сшивкой амино, сульфгидрильных или групп карбоновых кислот с использованием широкого разнообразия хорошо известных реагентов и методик.
В еще одном варианте осуществления комплекс CA9/антигена может быть получен в виде слитого белка CA9/антигена. Кратко, для получения такого слитого белка, последовательности ДНК, кодирующие белок CA9, и антиген могут быть сконструированы с использованием обычных методик и экспрессированы в подходящем типе клеток с использованием любого целесообразного вектора экспрессии. Затем слитый белок может быть экспрессирован в клетках и изолирован с использованием любого способа, известного специалистам в данной области. В одном варианте осуществления слитый белок CA9/антигена может быть отделен линкерной последовательностью.
В еще одном варианте осуществления изолированный белок CA9 может быть смешан с клеточным материалом, таким как опухолевый лизат, для обеспечения возможности связывания CA9 с одним или более опухолевыми антигенами, присутствующими в лизате, образуя, таким образом, гетерогенную смесь изолированных комплексов CA9/антигена, которая может использоваться в способе по изобретению в качестве мультивалентной противораковой вакцины. Таким образом, будет понятно, что могут быть предоставлены изолированные белки CA9 для применения в изобретении с тем, чтобы дискретные изолированные белки CA9 образовывали комплексы с различными антигенами.
В композициях и способах по изобретению могут использоваться любые из различных средств доставки. Подходящие средства доставки включают, но без ограничения, представляющие антиген клетки (APC), такие как дендритные клетки, макрофаги, B клетки, моноциты и другие клетки, которые могут методами генной инженерии сделаны эффективными APC.
В одном варианте осуществления изобретение относится к композиции и способу стимуляции у индивидуума иммунного ответа на антиген, включающему введение индивидууму композиции, содержащей APC, такие как дендритные клетки, которые вступили в контакт с комплексом, содержащим изолированный белок CA9 и антиген. Дендритные клетки могут содержать комплекс белка CA9/антигена во время, когда дендритные клетки вводятся индивидууму. Это может быть достигнуто, например, предварительной загрузкой дендритных клеток комплексом или трансфекцией клеток ДНК, кодирующей белок CA9, и антигеном в виде или различных белков, или в виде слитого белка.
Когда используются APC, то APC, такие как дендритные клетки, могут быть сначала выделены у индивидуума и подготовлены для воздействия комплекса CA9/антиген с использованием обычных методик. Дендритные клетки могут быть выделены у индивидуума, у которого желателен стимулированный иммунный ответ на антиген, или могут быть выделены у другого индивидуума.
В одном варианте осуществления изобретение относится к по существу очищенной популяции дендритных клеток, которые контактировали с комплексом CA9/антиген.
Для применения в композициях и способах по изобретению, может быть использован любой подходящий носитель, известный специалистам в данной области. Тип носителя варьируется в зависимости от пути введения. Композиции по настоящему изобретению могут составляться для любого целесообразного пути введения, включая, например, местное, пероральное, интраназальное, внутривенное, внутричерепное, внутрибрюшинное, подкожное или внутримышечное введение. Для парентерального введения, такого как подкожная инъекция, носитель может содержать воду, солевой раствор, спирт, жир, воск или буфер. Для перорального введения, можно использовать любой из указанных выше носителей или твердый носитель, такой как маннит, лакт