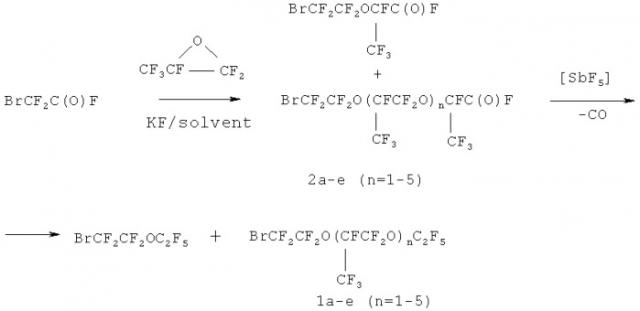Окса- и полиоксаперфторалкилбромиды и способ их получения
Иллюстрации
Показать всеИзобретение относится к новым производным оксаперфторалкилбромидов формулы 1: C2F5O-[CF2CF(CF3)O]n-CF2CF2Br, где n принимает значения от 1 до 5. Указанные соединения характеризуются удельной плотностью 1,79-1,81 г/см3, обладают высокой растворяющей способностью по отношению к кислороду и могут быть использованы в качестве основы для газотранспортных композиций. Изобретение также относится к способу получения указанных соединений. 2 н. и 1 з.п. ф-лы, 7 пр.
Реферат
Изобретение относится к новым соединениям, а именно оксаперфторалкилбромидам общей формулы , где
1а (n=1)
1b (n=2)
1с (n=3)
1d (n=4)
1е (n=5)
Указанные соединения обладают высокой растворяющей способностью по отношению к кислороду, высокой плотностью и химической инертностью, поэтому наиболее эффективно могут быть использованы в медицине, в частности в качестве компонентов газотранспортных композиций, временных интраокулярных имплантов в витреоретинальной хирургии, оксигенирующих добавок к препаратам для наружного применения (терапия раневых поверхностей, трофических язв и т.д.), а также средств визуализации в лучевых исследованиях.
Заявляемые соединения, их свойства и способ получения в литературе не описаны.
Известно, что соединения, используемые в качестве компонентов газотранспортных композиций, временных интраокулярных имплантов в витреоретинальной хирургии отслойки сетчатки глаза, оксигенирующих добавок к препаратам для наружного применения (терапия раневых поверхностей, трофических язв и т.д.), а также в качестве средств визуализации при лучевых исследованиях (рентгенография, магнито-резонансная томография и т.д.) должны быть химически инертны, обладать высокой растворяющей способностью по отношению к кислороду и иметь удельную плотность не менее 1,6 г/см3. Известно, что перфтороктилбромид широко применяется в офтальмологической практике [Биомедицинский журнал, 2004, т.5, ст.46, с.160.; Вестник Военно-медицинской академии, 2007, 3, 77; Патент США №7691051 В2 (2010); Патент США №2004/0092861] в качестве компонента газотранспортных композиций (искусственные кровезаменители) [Biotechnol. Prog., 1992, 8, 454; Crit. Care, 1999, 3(5), R93; EP 2005948 A2 (2008)], а также в качестве средства для визуализации при лучевых исследованиях (рентгенография, магнито-резонансная томография и т.д.) [Biomaterials, v.30, 8, 1462 (2009); Патент США №4640833 (1987); Adv. Funct. Mater., 2008, 18, 1].
Известны следующие способы получения перфтороктилбромида
а) бромированием перфтороктилиодида, который в свою очередь получают теломеризацией тетрафторэтилена под действием перфторэтилиодида [J. Fluor. Chem., 1998, v.88. 2, 153; EP 1380557 A1 (2004); EP 1364934 A1 (2003)], перфторбутилиодида [Заявка на патент США №2011/28768 A1 (2011)] или смеси перфторэтил- и перфторбутилиодидов [Заявка на патент США №2007/249876 A1 (2007)],
б) бромированием перфтороктансульфонилхлорида, образующимся при электрохимическом фторировании октансульфонилхлорида [Патент США №2732398 (1956)],
в) бромированием перфтороктилгидрида [Заявка на патент США №5073651 A1 (1991)], который получают восстановлением перфтороктилиодида [J. Fluor. Chem., 1987, v.36, 49; US Pat 5073651 A1 (1991)] или
г) анодным окислением перфторпеларгоновой кислоты в присутствии брома [Авт. Свид. СССР №1141706 (1984)].
Во всех указанных способах необходимо использовать взрывоопасные либо высокотоксичные вещества, а именно тетрафторэтилен, безводный фтористый водород либо перфторпеларгоновую кислоту, производство и использование которой в настоящее время запрещено из-за ее гепатотоксичного действия.
Все эти факторы делают перфтороктилбромид труднодоступным соединением, что ограничивает масштабы его применения. В этой связи возникает потребность в новых веществах с аналогичными свойствами, способных заменить перфтороктилбромид в вышеуказанных областях.
Задачей изобретения является создание новых соединений, с высокой растворяющей способностью по отношению к кислороду, высокой плотностью и химической инертностью, низкой токсичностью по отношению к живым организмам и другими характеристиками, близкими к характеристикам перфтороктилбромида, что определяет возможность их аналогичного использования в качестве компонентов газопереносящих сред, а также разработка способа их получения без применения высокотоксичных и взрывоопасных веществ.
Указанная задача решается новыми соединениями - оксаперфторалкилбромидами общей формулы , где
1а (n=1)
1b (n=2)
1c (n=3)
1d (n=4)
1e (n=5)
обладающими высокой плотностью и высокой растворяющей способностью по отношению к кислороду, а также химической инертностью и низкой токсичностью по отношению к живым организмам, а также способом их получения, который включает взаимодействие бромдифторацетилфторида с окисью гексафторпропилена в полярном апротонном растворителе (моноглиме, диглиме, ацетонитриле) в присутствии каталитических количеств фторидов калия или цезия или бис(диалкиламино)метанов с образованием смеси ω-бромоксаперфторацилфторидов общей формулы , где
1a (n=1)
1b (n=2)
1c (n=3)
1d (n=4)
1e (n=5),
ее последующее декарбонилирование под действием каталитических количеств SbF5 с образованием смеси целевых продуктов 1а-е и выделение индивидуальных продуктов ректификацией.
Реакцию проводят при 0÷5°С, окись гексафторпропилена (ОГФП) постепенно прибавляют к смеси бромдифторацетилфторида и катализатора (фторид калия или цезия или бис(диалкиламино)метан, (мольное соотношение бромдифторацетилфторид : кат = 10-15:1) в полярном апротонном растворителе (молекулярно-массовое распределение теломер-гомологов регулируется соотношением взятых в реакцию исходных соединений - бромдифторацетилфторида и окиси гексафторпропилена). Образовавшуюся смесь ω-бромоксаперфторацилфторидов 2(а-е) декарбонилируют под действием каталитических количеств SbF5 с образованием смеси целевых бромидов 1(а-е), характеризующихся удельной плотностью 1,79-1,81 г/см3 (20°С) и растворяющей способностью по отношению к кислороду 53-54 об.%, полученную смесь бромидов 1 разделяют ректификацией:
Все соединения, используемые в синтезе заявленных соединений, производятся промышленностью и являются коммерчески доступными.
Пример 1. Получениение смеси фторангидридов 2а-с.
В колбу, снабженную мешалкой, газовводной трубкой и обратным холодильником, охлаждаемым до -78°, помещают смесь 17,7 г (0,1 моль) бромдифторацетилфторида, 0,6 г (0,01 моль) безв. KF и 10 мл диглима, перемешивают 0,5 часа при комнатной температуре., охлаждают до 0-5°С, затем при интенсивном перемешивании постепенно, за 30 мин вводят 33,2 г (0,2 моль) окиси гексафторпропилена (ОГФП), перемешивают 20 мин, реакционную массу переносят в делительную воронку, нижний слой отделяют и получают 45 г смеси, содержащей димер ОГФП (ДОГФП), 2-(2-бромо-1,1,2,2-тетрафторэтокси)-2,3,3,3-тетрафторпропаноил фторид (CF2CF2CF(CF3)С(O)F и соединения 2а-с в соотношении ДОГФП : (CF2CF2CF(CF3)C(O)F : 2a:2b:2c=8:41,4:35:13:2,6 (ГЖХ).
Пример 2. В условиях примера 1 взаимодействием 0,1 моль бромдифторацетилфторида с 0,247 моль ОГФП получают 53 г смеси, содержащей ДОГФП, (CF2CF2CF(CF3)С(O)F и соединения 2a-d в соотношении ДОГФП : (CF2CF2CF(CF3)C(O)F : 2a:2b:2c:2d=10:12,5:33,7:34,8:7:2 (ГЖХ).
Пример 3. В условиях примера 1 взаимодействием 0,1 моль бромдифторацетилфторида с 0,32 моль ОГФП получают 59 г смеси, содержащей ДОГФП, (CF2CF2CF(CF3)C(O)F и соединения 2а-е в соотношении ДОГФП : (CF2CF2CF(CF3)C(O)F : 2a:2b:2c:2d:2e=8:10:12:16:24:22:8 (ГЖХ).
Пример 4. Выделение фторангидридов 2b-е
Смесь фторорганических продуктов реакции, полученная в условиях примера 1 из 177 г (1 моль) CF2CF2CF(CF3)C(O)F и 500 г (3 моль) ОГФП (всего 610 г) подвергают ректификации с использованием колонки Вигре и получают 122 г фракции, выкипающей в интервале 126-142°С и содержащей 90-92% фторангидрида 2а и ~5-6% диглима. Дальнейшей перегонкой выделяют 360 г фракции, выкипающей в интервале 75°С/10 Торр - 130°С/1-2 Торр и содержащей фторанигидриды 2b-е, которую используют для получения целевых оксаалкилбромидов 1b-е без выделения индивидуальных соединений 2b-е.
Пример 5. Получение оксаперфторалкилбромидов 1b-е.
Смесь соединений 2b-е (360 г) очищают от следов диглима, перемешивая с 6-7 г SbF5 в течение 30 мин, выдерживают 15 мин без перемешивания, жидкую часть реакционной массы декантируют с осадка, добавляют 8-10 г SbF5 и перемешивают, постепенно повышая температуру реакции до 90-100°С (5-6 час). После окончания выделения газа смесь охлаждают, промывают разбавленной соляной к-той, водой, сушат P2O5 и перегоняют в вакууме, собирая продукты, кипящие до 110°С/1-2 Торр. Получают 305 г дистиллята, содержащего бромиды 1b-е в соотношении 1b:1c:1d:1e=2:3:3:1. Дальнейшей ректификацией полученного дистиллята выделяют аналитические образцы бромидов 1b-е. получают 237,5 г (92%) бромида 1b, т.кип. 88-92°/75 Торр и 72 г (90%) бромида 1 с, т.кип. 86-90°/11 Торр.
Бромид 1b, т.кип. 88-92°/75 Торр. Найдено %: С 18,64; F 61,71; Br 12,10. C10BrF21O3. Вычислено %: С 18,54; F 61,66; Br 12,36.
Спектр ЯМР 19F бромида 1b:
1 2 3 4 5 6 7 8 9 10
BrCF2CF2OCF(CF3)CF2OCF(CF3)CF2OCF2CF3: -6.6 (c, 2F1), 3,7-4,7 (м, 8F4+5+7), 6,5-8,5 (м, 4F2+8), 11,5 (c, 3F10), 12,8 (c, 2F9), 69,1 (м) и 69,5 (м) (2F3+6).
Бромид 1с, т.кип. 86-90°/11 Торр. Найдено %: С 18,76; F 62,52; Br 9,60. C13BrF27O4. Вычислено %: С 19,19; F 63,10; Br 9,84.
Спектр ЯМР 19F бромида 1с:
1 2 3 4 5 6 7 8 9 10 11 12 13
BrCF2CF2OCF(CF3)CF2OCF(CF3)CF2OCF(CF3)CF2OCF2CF3: -6,6 (c, 2F1), 3,2-4,8 (м, 13F4+5+7+8+10), 6,5-8,6 (м, 4F2+11), 11,6 (c, 3F13), 12,8 (м, 2F12), 68,6-69,5 (м, 3F3+6+9).
Бромид 1d, т.кип. 73-78°С/1-2 Торр. Найдено %: С 19,69; F 64,32; Br 8,13. C16BrF33O5. Вычислено %: С 19,61; F 64,04; Br 8,17.
Спектр ЯМР 19F бромида 1d:
1 2 4, 5, 7, 8, 10, 11 13 14 15 16
BrCF2CF2O[CF(CF)CF2O]3CF(CF3)CF2OCF2CF3:
3, 6, 9 12
CF: 3, 6, 9, 12
CF2O: 2, 5, 8, 11, 14, 15
CF3: 4, 7, 10, 13, 16
-6,75 (c, 2F1); 3,2-4,8 (м, 18F4+5+7+8+10+11), 6,5-8,6 (м, 4F2+14), 11,6 (с, 3F16), 12,8 (м, 2F15), 68,6-69,5 (м, 4F3+6+9+12).
Бромид 1е, т.кип. 106-109°С/1-2 Торр. Найдено %: С 20,11; F 64,81; Br 6,85. C19BrF39O6. Вычислено %: С 19,91; F 64,72; Br 6,99.
Спектр ЯМР 19F бромида Ie:
1 2 4, 5, 7, 8, 10, 11, 13, 14 16 17 18 19
BrCF2CF2O[CF(CF)CF2O]4CF(CF3)CF2OCF2CF3:
3, 6, 9, 12, 15
CF: 3, 6, 9, 12, 15
CF2O: 2, 5, 8, 11, 14, 17, 18
CF3: 4, 7, 10, 13, 16, 19
-6,75 (c, 2F1); 3,2-4,8 (м, 23F4+5+7+8+10+11+13+14+16), 6,5-8,6 (м, 4F2+17), 11,45 (c, 3F19), 12,7 (м, 2F18), 68,5-69,5 (м, 5F3+6+9+12+15).
Пример 6. Получение оксаалкилбромида 1a.
Повышенное содержание диглима во фторангидриде 2а предполагает увеличение расхода дорогостоящей SbF5 на стадии декарбонилирования. В связи с этим предлагается альтернативный способ получения 2а, не содержащего растворителя, приведенный ниже.
а) К 122 г фракции (интервал выкипания 126-142°С) (см. пример 4) при охлаждении ледяной водой постепенно прибавляют 100 мл безв. МеОН, отогревают при перемешивании до 25°С, выливают в воду, органический слой отделяют, последовательно промывают водой, водным раствором NaHCO3, сушат над Na2SO4 и ректификацией выделяют 101 г (90%) метилового эфира 8-бром-3,6-диокса-перфтор-2,5-диметилкаприловой кислоты (3) (смесь диастереомеров), т.кип. 89-91°С/40 Торр. Найдено %: С 20,44; Н 0,58; F 51,02; Br 15,02. C9H3F14BrO4. Вычислено %: С 20,73; Н 0,58; F 51,06; Br 15,36.
б) К смеси 101 г (198 ммоль) эфира 3 и 20 мл воды постепенно при перемешивании прибавляют 50%-ный водный раствор NaOH (~10-12 мл) до появления щелочной реакции реакционной массы (по фенолфталеину), полученный раствор подкисляют 20% водн. H2SO4, нижний слой отделяют и перегонкой над конц. H2SO4 получают 91 г (91%) 8-бром-3,6-диокса-перфтор-2,5-диметилкаприловой кислоты (4), т.кип. 103-104°С/15 Торр. Найдено %: С 18,48; Н 0,30; F 52,58; Br 15,93. C8HF14BrO4. Вычислено %: С 18,95; Н 0,20; F 52,46; Br 15,76.
Спектр ЯМР 19F кислоты 4:
1 2 3 4 5 6 7
BrCF2CF2OCF(CF3)CF2OCF(CF3)CO2H: -6,9 (c, 2F1), 1,2-2,5 и 8,1-9,5 (м, 2F5), 3,9 и 6,3 (с, 6F4+7), 7,5 (м, 2F2), 56,1 и 68,9 (м, 2F3+6).
в) К смеси 25,9 г (56,6 ммоль) и 3 капель хинолина постепенно прибавляют 15 г (126 ммоль) SOCl2, при интенсивном перемешивании реакционную смесь нагревают до кипения, кипятят до прекращения газовыделения, избыток SOCl2 отгоняют, из остатка перегонкой выделяют 24,5 г (91%) хлорангидрида 3,6-диокса-8-бромперфтор-2,5-диметилкаприловой кислоты (5), т.кип. 153-155°С.
Спектр ЯМР 19F хлорангидрида 5:
1 2 3 4 5 6 7
BrCF2CF2OCF(CF3)CF2OCF(CF3)COCl: -6,9 (с, 2F1), 0,5-2,0 и 5,9-7,3 (м, 2F5), 3,8 и 5,0 (с, 6F4+7), 7,5 (м, 2F2), 49,2 и 68,6 (м, 2F3+6).
г) Смесь 17,8 г (34 ммоль) хлорангидрида 5, 3,5 г (56 ммоль) свежепрокаленного KF и 2,8 г тетраметиленсульфона кипятят при интенсивном перемешивании 1,5 часа (температура реакционной смеси падает до 133°С), продукт реакции отгоняют, постепенно понижая давление до 110-100 Торр и получают 15,7 г (91%) фторангидрида 3,6-диокса-8-бромперфтор-2,5-диметилкаприловой кислоты (2b), т.кип. 128-130°С. Найдено %: С 18,79; F 55,98; Br 15.46. C8F15BrO3. Вычислено %: С 18,86; F 55,99; Br 15.72.
Спектр ЯМР 19F фторангидрида 2а:
1 2 3 4 5 6 7 8
BrCF2CF2OCF(CF3)CF2OCF(CF3)COF: -102,4 (с, 1F8), -7,0 (с, 2F1), 0,4-1,8 и 5,7-6,8 (м, 2F5), 3,7 и 4,9 (с, 6F4+7), 7,3 (м, 2F2), 49,0 и 68,5 (м, 2F3+6).
д) Смесь 26,4 г (52 ммоль) фторангидрида 2а и 1,6 г SbF5 перемешивают при 55-100°С до прекращения газовыделения, реакционную массу последовательно промывают 10%-ным раствором соляной кислоты, 5%-ным водн. раствором K2CO3, перегоняют при пониженном давлении над P2O5, последующей перегонкой дистиллята получают 20,6 г (83%) бромида (1а), т.кип. 108-110°С. Найдено %: С 17,71; F 59,23; Br 16,30. C7BrF15O2. Вычислено %: С 17,46; F 59,25; Br 16,63.
Спектр ЯМР 19F бромида 1a:
1 2 3 4 5 6 7
BrCF2CF2OCF(CF3)CF2OCF2CF3: -6,7 (с, 2F1), 4,2 (м, 3F4), 6,2-8,6 (м, 4F2+5), 11,4 (с, 3F7), 12,7 (т, 2F6, 4JFF=13,1 Гц), 69,4 (т, 1F3, 3JFF=21,4 Гц).
Пример 7. Определение растворяющей способности 3,6,9-триоксаперфтор-5,8-диметилундецилбромида 1 с по отношению к кислороду.
Определение проводилось в колбе емкостью 100 мл, снабженной обратным холодильником (-78°), двумя кранами и якорем магнитной мешалки; общий объем прибора - 225 мл. В колбу поместили 118,1 г (66 мл) бромида 1с (d=1,79 г/см3), свободный объем прибора 159 мл. Бромид 1с дегазировали при перемешивании при 8-9 Торр 15 мин, вакуумный насос отсоединили, температуру в обратном холодильника довели до комнатной, в вакуумированный прибор ввели кислород из газовой бюретки при перемешивании бромида 1 с до прекращения поглощения (~15 мин). В прибор вошло 195 мл кислорода, что на 36 мл больше свободного объема прибора. Таким образом, удельная растворяющая способность бромида 1 с по отношению к кислороду составляет 0,54.
1. Оксаперфторалкилбромиды ,где 1a (n=1), 1b (n=2), 1c (n=3), 1d (n=4), 1e (n=5).
2. Соединения по п.1, обладающие высокой растворяющей способностью по отношению к кислороду, в качестве основы для газотранспортных композиций.
3. Способ получения оксаперфторалкилбромидов по п.1, включающий взаимодействие бромдифторацетилфторида с окисью гексафторпропилена в полярном апротонном растворителе (моноглиме, диглиме, ацетонитриле), катализируемое фторидами калия или цезия или бис(диалкиламино)метанами с образованием смеси ω-бромоксаперфторацилфторидов общей формулы ,где 2а (n=1), 2b (n=2), 2c (n=3), 2d (n=4), 2е (n=5),их последующее декарбонилирование под действием каталитических количеств SbF5 с образованием смеси целевых бромидов 1(а-е) и выделение целевых продуктов ректификацией.