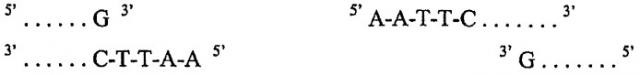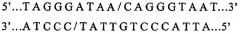Векторные плазмиды для клонирования модулей днк и способы их применения
Иллюстрации
Показать всеИзобретение относится к области генной инженерии и может быть использовано в биотехнологических процессах в качестве средства для объединения фрагментов ДНК и получения сложных ДНК-конструкций. Предложены векторные плазмиды («стыковочные векторы») для синтеза трансгенов (РЕ3), представляющие собой клонирующий вектор, в который включен модуль клонирования, состоящий из четырех генных шарниров (ГШ 1-4) и расположенных между ними трех нуклеотидных последовательностей (НП 1-3), где каждый из ГШ содержит от 2 до 4 невариабельных редких сайтов рестрикции из более чем 6 нуклеотидов, а нуклеотидные последовательности между ГШ включают «вкладыши», которые при клонировании заменяются в НП 1 - модулем промотора; в НП 2 - модулем экспрессии, а в НП 3 - 3'-регуляторным модулем. При этом либо ГШ 1, либо ГШ 2 независимо содержат 3-4 невариабельных редких сайта рестрикции более чем из 6 нуклеотидов. Предлагается также вариация стыковочного вектора РЕ3 по изобретению, предназначенная для множественного клонирования (МС) и отличающаяся тем, что, по меньшей мере, одна из трех НП является модулем множественного клонирования с сайтом множественного клонирования, включающим распространенные сайты рестрикции, которые являются уникальными в стыковочном векторе РЕ3. 2 н. и 4 з.п. ф-лы, 21 ил.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка является частичным продолжением и притязает на приоритет согласно 35 U.S.C 120 заявки № 10/682764, поданной 9 октября 2003 года, по которой испрашивается приоритет согласно 35 U.S.C. 119(e) на основании предварительной заявки 60/417282, поданной 9 октября 2002 года.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области клонирующих векторных плазмид и к применению клонирующих векторных плазмид для создания конструкций ДНК или трансгенов.
УРОВЕНЬ ТЕХНИКИ
Основой молекулярной биологии является технология рекомбинантной ДНК, которую можно в настоящем описании кратко представить как модификацию и репродукцию нуклеиновых кислот в целях исследования структуры и функции нуклеиновых кислот и их белковых продуктов.
Отдельные гены, области регуляции генов, подгруппы генов и, конечно, целые хромосомы, в которых они находятся, состоят из двунитевых антипараллельных последовательностей нуклеотидов аденина, тимина, гуанина и цитозина, обычно обозначаемых буквами A, T, G и C соответственно. Указанные последовательности ДНК, а также последовательности кДНК, которые представляют собой двунитевые копии ДНК, полученные на основе молекул мРНК (матричной РНК), можно расщепить на отдельные фрагменты, выделить и встроить в вектор, такой как бактериальная плазмида, чтобы исследовать генные продукты. Плазмида является внехромосомной частью ДНК, которую исходно получили из бактерий и которая может быть подвергнута обработке и снова введена в бактерию-хозяина в целях исследования или получения генного продукта. ДНК плазмиды сходна со всей хромосомной ДНК тем, что она состоит из таких же нуклеотидов A, T, G и C, кодирующих гены и области регуляции генов, однако ДНК плазмиды представляет собой относительно небольшую молекулу, состоящую менее, чем примерно из 30000 пар оснований или 30 тысяч пар оснований (т.п.о.). Кроме того, пары нуклеотидных оснований двунитевой плазмиды образуют непрерывную кольцевую молекулу, что также отличает плазмидную ДНК от хромосомной ДНК.
Плазмиды усиливают быстрый обмен генетического материала между бактериальными организмами и обеспечивают быструю адаптацию к изменениям окружающей среды, таким как изменения температуры, пищевых ресурсов или другие сигналы. Любая приобретенная плазмида должна экспрессировать ген или гены, которые вносят вклад в жизнеспособность хозяина, или же она будет разрушена или отвергнута организмом, так как сохранение ненужных плазмид было бы неэкономичным использованием ресурсов. Клональная популяция клеток содержит идентичный генетический материал, включая любые плазмиды, которые они могут нести. Применение клонирующей векторной плазмиды со вставкой ДНК в такой клональной популяции клеток-хозяев будет увеличивать количество доступной представляющей интерес ДНК. Клонированную таким образом ДНК затем можно выделить и извлечь для последующей обработки, используя стадии, необходимые для создания конструкции ДНК. Таким образом, понятно, что клонирующие векторные плазмиды являются полезными средствами исследования функции генов, обеспечивающие возможность быстро получать большие количества представляющей интерес вставки ДНК.
В то время как некоторые элементы, выявляемые в плазмидах, являются природными, другие были сконструированы, чтобы расширить применимость плазмид в качестве ДНК-векторов. Такие элементы, наряду с прочим, включают гены резистентности к антибиотикам или химическим веществам и сайт множественного клонирования (MCS). Каждый из таких элементов играет определенную роль согласно настоящему изобретению, а также согласно известному уровню техники. При описании роли каждого элемента на первый план будут выделены ограничения предшествующего уровня техники и показана полезность настоящего изобретения.
Особенно полезным находящимся в плазмиде геном, который может быть приобретен хозяином, является ген, которые может придавать резистентность к антибиотикам. В повседневной практике технологии рекомбинантной ДНК гены резистентности к антибиотикам используют в качестве элементов для позитивной или негативной селекции, чтобы предпочтительно усилить культивирование и амплификацию требуемой плазмиды по сравнению с другими плазмидами.
Чтобы плазмида поддерживалась бактерией-хозяином, она также должна содержать участок последовательностей, который побуждает хозяина к удвоению плазмиды. Последовательности, известные как элемент начала репликации (ORI), заставляют хозяина использовать свои клеточные ферменты для получения копий плазмиды. Когда такая бактерия делится, каждая дочерняя клетка будет иметь копию или копии любой такой плазмиды. Были получены некоторые штаммы бактерий E. coli, которые позволяют максимизировать такую дупликацию, создавая более 300 копий на бактерию. Таким образом, культивирование требуемой плазмиды может быть усилено.
Другим необходимым элементом в любом клонирующем векторе является место для встраивания представляющих интерес генетических материалов. Такой элемент является синтетическим элементом, который был сконструирован в плазмидах «дикого типа», чтобы таким образом сделать их применимыми в качестве клонирующего вектора. Любая обычная коммерчески доступная векторная плазмида для клонирования содержит по меньшей мере одну такую область, известную как сайт множественного клонирования (MCS). MCS обычно содержит нуклеотидные последовательности, которые могут быть расщеплены одним или группой эндонуклеазных ферментов рестрикции (в дальнейшем называемых «ферментами рестрикции»), каждая из которых имеет отдельный сайт рестрикции эндонуклеазой и характерную картину расщепления. Такие сайты для эндонуклеаз или сайты рестрикции эндонуклеазами (в дальнейшем называемые «сайтами рестрикции»), кодируемые в молекуле ДНК, обычно содержат двунитевую палиндромную последовательность. Для некоторых ферментов рестрикции достаточно всего 4-6 нуклеотидов, чтобы обеспечить сайт рестрикции, тогда как некоторые ферменты рестрикции требуют наличия сайта рестрикции из 8 или более нуклеотидов. Например, фермент EcoR1 узнает гексануклеотидную последовательность: 5'G-A-A-T-T-C3', где 5' указывает конец молекулы, по договоренности названный «апстрим» концом, а 3' подобным образом указывает «даунстрим» конец. Комплементарная нить сайта рестрикции должна быть его антипараллельной нитью, 3'G-A-A-T-T-C5'. Таким образом, двунитевой сайт рестрикции может присутствовать в более крупной двунитевой молекуле, в которой он встречается в виде:
Подобно многим другим ферментам рестрикции, EcoR1 не расщепляет точно по оси симметрии двух нитей, а расщепляет в положениях, отстоящих друг от друга на четыре нуклеотида в двух нитях ДНК, между нуклеотидами, указанными «/»:
так что двунитевая молекула ДНК расщепляется и в результате имеет конфигурацию нуклеотидов на новообразованных «концах»:
Такое ступенчатое расщепление дает фрагменты ДНК с выступающими 5'-концами. Поскольку пары A-T и G-C образуются спонтанно, если нуклеотиды находятся рядом друг с другом, то выступающие концы, такие как указанные выше, называют способными к связыванию или «липкими» концами. Любой из таких концов может образовывать водородные связи с любыми другими комплементарными концами, расщепленными таким же ферментом рестрикции. Так как любая ДНК, которая содержит специфичный сайт рестрикции, будет разрезана таким же образом, как и любая другая ДНК, содержащая такую же последовательность, то такие расщепленные концы будут комплементарными. Поэтому концы любых молекул ДНК, разрезанных одним и тем же ферментом рестрикции, «совпадают» друг с другом подобно «совпадению» расположенных рядом кусочков мозаики и могут быть связаны вместе ферментами. Именно такое свойство обеспечивает возможность образования рекомбинантных молекул ДНК и позволяет вводить фрагменты чужеродной ДНК в бактериальные плазмиды или в любую другую молекулу ДНК.
Следующий общий принцип, который учитывается при создании рекомбинантных молекул ДНК, заключается в том, что все сайты рестрикции, встречающиеся в молекуле, будут разрезаться конкретным ферментом рестрикции, но прежде всего представляющий интерес сайт. Чем крупнее молекула ДНК, тем более вероятно, что любой сайт рестрикции будет встречаться повторно. При условии, что любые сайты рестрикции распределены случайным образом вдоль молекулы ДНК, тетрануклеотидный сайт будет встречаться в среднем один раз на каждые 44 (то есть 256) нуклеотидов, тогда как гексануклеотидный сайт будет встречаться один раз на каждые 46 (то есть 4096) нуклеотидов, а октануклеотидные сайты будут встречаться один раз на каждые 48 (то есть 114688) нуклеотидов. Таким образом, легко можно понять, что более короткие сайты рестрикции будут встречаться часто, тогда как более длинные сайты рестрикции будут встречаться редко. При планировании конструкции трансгена или другой молекулы рекомбинантной ДНК, это является важной проблемой, так как такой проект часто требует сборки нескольких фрагментов ДНК разных размеров. Чем крупнее такие фрагменты, тем более вероятно, что сайты, которые собираются использовать, встречаются в нескольких фрагментах компонентов ДНК, что в лучшем случае затрудняет процесс обработки.
Часто встречающиеся сайты рестрикции в настоящем описании названы широко распространенными сайтами рестрикции, и эндонуклеазы, которые расщепляют такие сайты, названы часто щепящими ферментами рестрикции. Ферменты рестрикции, которые узнают последовательности длиной более 6 нуклеотидов, называют редко щепящими ферментами рестрикции, а узнаваемые ими сайты - редкими сайтами рестрикции. Однако существуют некоторые сайты рестрикции из 6 п.н., которые встречаются более редко, чем можно ожидать статистически, и такие сайты и эндонуклеазы, которые их расщепляют, также называют редкими. Таким образом, обозначения «редкий» и «широко распространенный» не относятся к относительной численности или доступности какого-либо конкретного фермента рестрикции, а относятся к частоте встречаемости последовательности нуклеотидов, которая составляет узнаваемый им сайт рестрикции в какой-либо молекуле ДНК или выделенном фрагменте молекулы ДНК или любом гене или в его последовательности ДНК.
Недавно выделен второй класс ферментов рестрикции, называемых ферментами хоминг-эндонуклеазами (HE). Ферменты HE имеют большие асимметричные сайты рестрикции (12-40 пар оснований). Сайты рестрикции HE чрезвычайно редко встречаются. Например, HE, известная как I-SceI, имеет сайт рестрикции длиной 18 п.о. (5'...TAGGGATAACAGGGTAAT...3'), который согласно расчетам встречается только один раз на каждые 7×1010 пар оснований случайной последовательности. Такая частота встречаемости эквивалентна только одному сайту на 20 геномов, имеющих размер генома млекопитающего. Редкая природа сайтов HE в значительной степени увеличивает вероятность того, что генный инженер может вырезать конечный трансгенный продукт, не нарушая целостность трансгена, если сайты HE были введены в соответствующие положения в векторной плазмиде для клонирования.
Так как молекула ДНК из любого выбранного в качестве источника организма будет разрезаться идентичным образом узнающим ее ферментом рестрикции, то чужеродные фрагменты ДНК любого вида могут быть вырезаны ферментом рестрикции, встроены в бактериальный плазмидный вектор, который был расщеплен таким же ферментом рестрикции, и амплифицированы в подходящей клетке-хозяине. Например, ген человека может быть вырезан в 2 местах ферментом рестрикции, известным как EcoR1, и требуемый фрагмент с EcoR1-концами может быть выделен и смешан с плазмидой, которую также разрезали EcoR1, с образованием смеси, обычно известной как реакционная смесь для лигирования или смесь для лигирования. В соответствующих условиях в смеси для лигирования некоторые из выделенных фрагментов гена человека будут соответствовать концам плазмидных молекул. Такие заново соединенные концы могут связываться вместе и посредством ферментов снова образовывать кольцевую плазмиду, теперь содержащую свою новую вставку ДНК. Смесь для лигирования затем вводят в E. coli или другого подходящего хозяина, и заново сконструированные плазмиды будут амплифицироваться по мере деления бактерий. Таким образом, относительно большое количество копий гена человека может быть получено и собрано из бактерий. Такие копии гена затем могут быть подвергнуты дальнейшей обработке в целях исследования, анализа или получения белкового продукта гена.
Технологию рекомбинантной ДНК часто осуществляют при создании так называемых «трансгенов». Трансгены часто содержат разнообразные генетические материалы, которые получены из одного или нескольких донорных организмов и введены в организм хозяина. Обычно трансген конструируют, используя клонирующий вектор в качестве начальной точки или «остова» конструкции, и планируют серию сложных стадий клонирования, чтобы осуществить сборку конечного продукта в таком векторе. Элементы трансгена, содержащие нуклеотидные последовательности, включают без ограничения 1) регуляторные промоторные и/или энхансерные элементы, 2) ген, который будет экспрессироваться в виде молекулы мРНК, 3) ДНК-элементы, которые обеспечивают стабилизацию первичного транскрипта мРНК, 4) нуклеотидные последовательности, имитирующие интронные области генов млекопитающих, и 5) сигналы для процессинга мРНК, такие как поли-A-хвост, добавляемый к концу природных мРНК. В некоторых случаях экспериментальная конструкция может требовать добавления сигнала локализации, чтобы обеспечить транспорт генного продукта в конкретное субклеточное положение. Каждый из таких элементов представляет собой фрагмент более крупной молекулы ДНК, которая вырезается из генома донора или в некоторых случаях синтезируется в лаборатории. Каждый участок подвергается сборке вместе с другими участками в определенном порядке и в 5'-3'-ориентации в векторной плазмиде для клонирования.
Промотор любого гена может быть выделен в виде фрагмента ДНК и помещен в синтетическую молекулу, такую как плазмида, чтобы управлять экспрессией требуемого гена, при условии, что необходимые условия для стимуляции представляющего интерес промотора могут быть обеспечены. Например, последовательности промотора гена инсулина могут быть выделены, помещены в векторную плазмиду для клонирования наряду с репортерный геном и использованы для исследования условий, необходимых для экспрессии гена инсулина в соответствующем типе клеток. Альтернативно промотор гена инсулина может быть связан с кодирующей белок последовательностью любого представляющего интерес гена в клонирующей векторной плазмиде и использован для управления экспрессией представляющего интерес гена в экспрессирующих инсулин клетках, при условии, что все необходимые элементы присутствуют в ДНК-трансгене, сконструированном таким образом.
Репортерный ген является особенно полезным компонентом некоторых типов трансгенов. Репортерный ген содержит нуклеотидные последовательности, кодирующие белок, которые будут экспрессироваться под контролем конкретного представляющего интерес промотора, с которым они связаны в трансгене, обеспечивая измеряемый биохимический ответ активности промотора. Репортерный ген обычно легко выявлять или измерять на фоне эндогенных клеточных белков. Широко используемые репортерные гены включают без ограничения LacZ, белок с зеленой флуоресценцией и люциферазу и другие репортерные гены, многие из которых хорошо известны специалистам в данной области.
Интроны, которые представляют собой некодирующие области генов млекопитающих, не встречаются в бактериальных геномах, но требуются для правильного образования молекул мРНК в клетках млекопитающих. Поэтому любая конструкция ДНК для применения в системах млекопитающих должна иметь по меньшей мере один интрон. Интроны могут быть выделены из любого гена млекопитающих и встроены в конструкцию ДНК наряду с подходящими сигналами сплайсинга, которые позволяют клеткам млекопитающих вырезать интрон и соединять оставшиеся концы мРНК вместе.
Элементом стабилизации мРНК является последовательность ДНК, которую распознают связывающие белки, которые защищают некоторые мРНК от расщепления. Введение элемента стабилизации мРНК часто будет повышать уровень экспрессии гена по сравнению с уровнем мРНК в некоторых типах клеток млекопитающих, и таким образом может быть полезным в некоторых конструкциях ДНК или трансгенах. Элемент стабилизации мРНК может быть выделен из природных ДНК или РНК или получен синтетически для введения в конструкцию ДНК.
Сигналом локализации является последовательность ДНК, которая кодирует белковый сигнал для определения маршрута представляющего интерес белка в клетке. Например, сигнал ядерной локализации будет направлять белок в ядро; сигнал локализации в плазматической мембране будет направлять его к плазматической мембране и т.д. Таким образом, сигнал локализации может быть введен в конструкцию ДНК, чтобы стимулировать перемещение белкового продукта в требуемое место в клетке.
Последовательность метки может быть закодирована в конструкции ДНК для того, чтобы белковый продукт имел уникальную связанную с ним область. Такая уникальная область служит в качестве метки белка, по которой его можно отличить от его эндогенной копии. Альтернативно, такая уникальная область может служить в качестве опознавательного признака, который может быть выявлен различными способами, хорошо известными в данной области, включая без ограничения ОТ-ПЦР, иммуногистохимию или гибридизацию in situ.
В случае сложного трансгена или трансгена, который содержит особенно большие области ДНК, существует повышенная вероятность того, что будут множественные сайты рестрикции в таких участках ДНК. Напомним, что сайты рестрикции, кодирующие любой один гексануклеотидный сайт, встречаются на каждые 4096 п.о. (46). Если последовательность промотора длиной 3000 п.о. и представляющий интерес ген длиной 1500 п.о. собраны в клонирующем векторе длиной 3000 п.о., то статистически очень вероятно, что многие сайты из 6 или меньшего количества нуклеотидов не будут полезными, так как любые пригодные сайты должны встречаться только в двух участках. Кроме того, сайты должны встречаться в подходящих областях соответствующих молекул, которые необходимо собрать вместе. Кроме того, для большинства клонирующих конструкций будет необходимо добавление дополнительных элементов ДНК, что увеличивает сложность растущей молекулы и вероятность ненужного повторения какого-либо конкретного сайта. Так как любой фермент рестрикции будет расщеплять все свои сайты рестрикции в молекуле ДНК, если сайт рестрикции ферментом повторно встречается, то все неподходящие сайты будут расщепляться наряду с нужными сайтами, нарушая целостность молекулы. Таким образом, каждая стадия клонирования должна быть тщательно спланирована так, чтобы не нарушить растущую молекулу расщеплением ферментом рестрикции, который уже был использован для введения предшествующего элемента. И наконец, когда исследователь хочет ввести законченный трансген в организм млекопитающего, полностью собранную трансгенную конструкцию часто необходимо линеаризовать в уникальном сайте рестрикции по меньшей мере с одного конца трансгена, что таким образом требует еще одного уникального сайта, нигде больше не встречающегося в конструкции. Так как большинство конструкций ДНК предназначено для одной цели, мало думают о том, что любые модификации, которые вероятно могут понадобиться в будущем, дополнительно усложнят будущие экспериментальные изменения.
Традиционно на дизайн и конструирование трансгена тратится достаточное количество времени и энергии по нескольким причинам, включая следующие:
1. Существует широкое множество доступных ферментов рестрикции и ферментов HE, которые будут создавать серию концов; однако большинство из них не совместимы друг с другом. Многие ферменты рестрикции, такие как EcoR1, образуют фрагменты ДНК с выступающими липкими 5'-концами или «хвостами»; другие (например, Pst1) образуют фрагменты с выступающими 3'-хвостами, тогда как следующие (например, Bal1) расщепляют по оси симметрии, давая фрагменты с тупыми концами. Некоторые из них будут совместимы с концами, образованными при расщеплении другими ферментами рестрикции и/или ферментами HE, но большинство из них не будут совместимыми. Концы, которые могут быть образованы при каждой процедуре выделения фрагментов ДНК, должны тщательно учитываться при проектировании конструкции ДНК.
2. Фрагменты ДНК, необходимые для сборки конструкции ДНК или трансгена должны сначала быть выделены из геномов, которые являются их источником, помещены в плазмидные клонирующие векторы и амплифицированы, чтобы получить приемлемые количества. Стадию можно осуществлять с использованием ряда коммерчески доступных или индивидуально измененных клонирующих векторов. Каждую из различных коммерчески доступных клонирующих векторных плазмид в основном разрабатывали независимо, и поэтому они содержат разные последовательности и сайты рестрикции для фрагментов ДНК представляющих интерес генов или генетических элементов. Поэтому гены необходимо подгонять индивидуально, чтобы приспособить к каждому из таких векторов, которые необходимы для любой данной серии экспериментов. Одинаковые фрагменты ДНК часто необходимо изменять дополнительно для последующих экспериментов или клонирования в других комбинациях для новых конструкций ДНК или трансгенов. Так как каждую конструкцию ДНК или трансген готовят на заказ для конкретного применения, не думая или не зная, как она будет использована в следующий раз, то ее зачастую необходимо «обратно подгонять» для последующих применений.
3. Кроме того, последовательность ДНК любого данного гена или генетического элемента варьирует и может содержать внутренние сайты рестрикции, которые делают ее несовместимой с доступными в настоящее время векторами, тем самым осложняя обработку. Особенно это верно в случае сборки нескольких фрагментов ДНК в одной конструкции ДНК или трансгене.
Хотя для обработки генетического материала можно использовать ферменты рестрикции, известно, что MCS или другие компоненты трансгена могут быть созданы посредством синтеза de novo, рекомбинацией и/или клонированием с использованием ПЦР с праймерами, имеющими выступающие концы с терминаторами. Один такой способ синтеза составляющих элементов трансгена описан Jarrell et al. в патенте США № 6358712. Хотя Jarrell описывает способ «сварки» элементов трансгена вместе, в известном уровне техники не описан способ или методика, позволяющая «не сваривать» и повторно собирать такие элементы после того, как они были собраны.
Поэтому было бы полезно разработать методику сборки каждого компонента трансгена с другими компонентами в точно установленном порядке и в 5'-3'-ориентации в векторной плазмиде для клонирования. Также существует потребность в системе, которая давала бы возможность пользователю быстро собирать несколько фрагментов ДНК в одну молекулу, несмотря на избыточное количество сайтов рестрикции, встречающихся на концах и в каждом из таких фрагментов ДНК. Также может быть полезной разработка простой методики быстрого изменения концов выбранных фрагментов ДНК, чтобы добавить к ним сайты рестрикции. Введение единичных или противостоящих пар сайтов рестрикции HE может повысить вероятность присутствия уникальных сайтов для клонирования. Система, которая позволила бы также легко заменять или удалять один или несколько фрагментов и могла бы повысить эксплуатационную гибкость, в настоящее время не доступна для пользователей. Поэтому «модульная» система, позволяющая встраивать или удалять фрагменты ДНК из областей «кассеты», фланкированных постоянными редкими сайтами рестрикции, в клонирующем векторе, может быть особенно полезной и долгожданной в области технологии рекомбинантной ДНК.
Соответственно один аспект настоящего изобретения относится к способу быстрой сборки конструкции ДНК или трансгена с использованием векторной плазмиды для клонирования. Другой аспект относится к последовательному введению фрагментов ДНК, также называемых «вставками» или «модулями», таких как промотор, экспрессируемая нуклеотидная последовательность и 3'-регуляторная нуклеотидная последовательность, в клонирующую векторную плазмиду.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к структуре и способам создания модульных клонирующих векторов для синтеза модуля генетического домена, трансгена PE3 и других сложных конструкций ДНК посредством создания остова в модульных клонирующих векторах, имеющего специальные точки стыковки, известные как генные шарниры.
Настоящее изобретение относится к вектору для стыковки доменных модулей, состоящему из клонирующего ДНК-вектора, содержащего модуль множественного клонирования (MC) для субклонирования представляющего интерес генетического материала в модуле MC, при этом модуль MC содержит: a) первый генный шарнир (GP), содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые можно подвергать обработке для определения 5'-части модуля MC; b) последовательность нуклеиновой кислоты, содержащую сайт множественного клонирования (MCS), содержащий множество сайтов рестрикции, выбранных из общепринятых сайтов рестрикции, которые являются уникальными в векторе для стыковки доменных модулей, чтобы обеспечить клонирующие сайты для клонирования представляющего интерес генетического материала в модуле MC; и c) второй генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые можно подвергать обработке для определения 3'-части модуля MC.
Настоящее изобретение также относится к вектору доменного модуля, состоящему из клонирующего ДНК-вектора, содержащего доменный модуль, который содержит: a) первый генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые можно подвергать обработке для определения 5'-части доменного модуля; b) представляющий интерес генетический модуль, состоящий из последовательности нуклеиновой кислоты, содержащей представляющий интерес генетический материал; и c) второй генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые можно подвергать обработке для определения 3'-части доменного модуля.
Настоящее изобретение также относится к стыковочному вектору PE3, состоящему из клонирующего ДНК-вектора, содержащего модуль клонирования PE3, который содержит по меньшей мере один клонирующий модуль, скомпонованный для клонирования по меньшей мере модуля первого домена в модуле клонирования PE3, при этом модуль клонирования PE3 содержит: a) первый генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые при клонировании можно подвергать обработке для определения 5'-части по меньшей мере модуля первого домена; b) модуль вкладыша, состоящий из первой последовательности нуклеиновой кислоты, содержащей вкладыш, который при клонировании заменяется модулем первого домена; и c) второй генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые при клонировании можно подвергать обработке для определения 3'-части по меньшей мере модуля первого домена.
Настоящее изобретение также относится к стыковочному вектору PE3, состоящему из клонирующего ДНК-вектора, содержащего модуль клонирования PE3, который содержит множество клонирующих модулей, скомпонованных для клонирования множества доменных модулей в модуле клонирования PE3, при этом модуль клонирования PE3 содержит: a) первый генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые при клонировании можно подвергать обработке для определения 5'-части модуля первого домена; b) модуль первого вкладыша, состоящий из первой последовательности нуклеиновой кислоты, содержащей вкладыш, который при клонировании заменяется модулем первого домена; c) второй генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые при клонировании можно подвергать обработке для определения области соединения в одно целое между 3'-частью модуля первого домена и 5'-частью модуля второго домена; d) модуль второго вкладыша, состоящий из второй последовательности нуклеиновой кислоты, содержащей вкладыш, который при клонировании заменяется модулем второго домена; e) третий генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые при клонировании можно подвергать обработке для определения области соединения в одно целое между 3'-частью модуля второго домена и 5'-частью модуля третьего домена; f) модуль третьего вкладыша, состоящий из третьей последовательности нуклеиновой кислоты, содержащей вкладыш, который при клонировании заменяется модулем третьего домена; и g) четвертый генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые можно подвергать обработке для определения 3'-части модуля третьего домена.
Настоящее изобретение, кроме того, относится к стыковочному вектору PE3 для множественного клонирования (MC), состоящему из клонирующего ДНК-вектора, содержащего модуль клонирования PE3, скомпонованный для клонирования по меньшей мере трех доменных модулей в модуле клонирования PE3, при этом модуль клонирования PE3 содержит: a) первый генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые при клонировании можно подвергать обработке для определения 5'-части модуля первого домена; b) первую последовательность нуклеиновой кислоты; c) второй генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые при клонировании можно подвергать обработке для определения области соединения в одно целое между 3'-частью модуля первого домена и 5'-частью модуля второго домена; d) вторую последовательность нуклеиновой кислоты; e) третий генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые при клонировании можно подвергать обработке для определения области соединения в одно целое между 3'-частью модуля второго домена и 5'-частью модуля третьего домена; f) третью последовательность нуклеиновой кислоты; и g) четвертый генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые при клонировании можно подвергать обработке для определения области соединения 3'-части модуля третьего домена; при этом по меньшей мере одна первая, вторая и третья последовательность нуклеиновой кислоты является модулем множественного клонирования, содержащим сайт множественного клонирования (MCS), содержащий множество сайтов рестрикции, выбранных из широко распространенных сайтов рестрикции, которые являются уникальными в стыковочном векторе PE3, обеспечивающими клонирующие сайты для клонирования представляющего интерес генетического материала в модуле множественного клонирования, а остальные последовательности нуклеиновой кислоты являются последовательностями вкладышей.
Настоящее изобретение, кроме того, относится к вектору PE3, состоящему из клонирующего ДНК-вектора, содержащего модуль PE3, который содержит модуль промотора, модуль экспрессии и 3'-регуляторный модуль, при этом модуль PE3 содержит: a) первый генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые можно подвергать обработке для определения 5'-части модуля промотора; b) модуль промотора; c) второй генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые можно подвергать обработке для определения области соединения в одно целое между 3'-частью модуля промотора и 5'-частью модуля экспрессии; d) модуль экспрессии; e) третий генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые можно подвергать обработке для определения области соединения в одно целое между 3'-частью модуля экспрессии и 5'-частью 3'-регуляторного модуля; f) 3'-регуляторный модуль; и g) четвертый генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, которые можно подвергать обработке для определения 3'-части 3'-регуляторного модуля.
В настоящем изобретении также предполагается, что любой из векторов: стыковочный вектор PE3, вектор PE3 и стыковочный вектор PE3 для множественного клонирования (MC), может содержать элементы для высвобождения модуля PE3, обычно содержащего модули домена промотора, домена экспрессии и 3'-регуляторного домена, фланкированные генными шарнирами, из вектора PE3 для встраивания в стыковочный вектор нескольких генов. Один элемент для высвобождения и встраивания модуля клонирования PE3 содержит пару сайтов хоминг-эндонуклеаз (HE), расположенных в стыковочном векторе PE3 или стыковочном векторе PE3 MC, которые фланкируют последовательность нуклеиновой кислоты, которая содержит модуль клонирования PE3. После встраивания или клонирования домена промотора, домена экспрессии и 3'-регуляторных доменов в модуле клонирования PE3, пара HE обеспечивает одно из средств вырезания модуля PE3 из вектора PE3 для встраивания в совместимое положение для стыковки в мультигенном векторе, при этом совместимое положение для стыковки обычно определяется такой же парой HE. Хотя можно использовать любые хоминг-эндонуклеазы либо в первом положении (на 5'-конце вырезаемого модуля PE3), либо во втором положении (на 3'-конце вырезаемого модуля PE3), предпочтительная пара HE состоит из I-Ceu I в первом положении и обратного ISce-I во втором положении. В других вариантах стыковочного вектора PE3 или стыковочного вектора PE3 MC можно использовать другие средства для вырезания и встраивания вместо HE. Такие другие средства для вырезания и встраивания могут включать пару одного или нескольких невариабельных редких сайтов рестрикции, включая отдельную пару редких сайтов рестрикции из сайтов рестрикции в генных шарнирах или сами фланкирующие генные шарниры (GP1 и GP4). При таких инсерциях используется рекомбинация, обсуждаемая ниже.
Настоящее изобретение относится к способу конструирования модульного вектора PE3, включающему стадии: a) получения клонирующего вектора PE3, содержащего модуль клонирования PE3, при этом модуль клонирования PE3 содержит последовательно расположенные: первый генный шарнир, содержащий по меньшей мере два невариабельных редких сайта рестрикции, по меньшей мере модуль первого вкладыша, состоящий из последовательности нуклеиновой кислоты, содержащей вкладыш, и второй генный шарнир; b) получения по меньшей мере модульного вектора первого домена, содержащего последовательно расположенные: первый генный шарнир, представляющий интерес генетический модуль, состоящий из последовательности нуклеиновой кислоты, содержащей представляющий интерес генетический материал, и второй генный шарнир; c) получения первого фермента рестрикции, узнающего один из редких сайтов рестрикции первого генного шарнира, и второго фермента рестрикции, узнающего один из редких сайтов рестрикции во втором генном шарнире; d) вырезания и выделения представляющего интерес генетического модуля из модульного вектора первого домена с использованием первого и второго узнающих ферментов рестрикции; e) вырезание модуля первого вкладыша из модуля клонирования PE3 клонирующего вектора PE3 с использованием первого и второго узнающих ферментов рестрикции; и f) лигирование представляющего интерес генетического модуля в модуль клонирования PE3. Способ также обеспечивает встраивание второго представляющего интерес генетического модуля в PE3 с использованием третьего генного шарнира и узнающих ферментов рестрикции для вырезания и лигирования второго представляющего интерес генетическо