Способы выявления сердечных нарушений
Иллюстрации
Показать всеЗаявленная группа изобретений относится к области медицины и предназначена для выявления пациентов с повреждением сердца и оценки эффективности проводимой терапии. У пациентов определяют внутриклеточные уровни кардиального белка тропонина Т (cTnT) или кардиального белка тропонина I (cTnl) в сердечной ткани. Уменьшение этих показателей по меньшей мере на 50% относительно контрольных или нормальных является показателем повреждения сердца у пациента. Способ лечения включает выявление пациентов с повреждением сердца заявленным способом и введение терапевтически эффективного количества GGF2 и ингибитора протеасом. Увеличение внутриклеточных уровней белка cTnT или cTnl в сердечной ткани пациента после введения GGF2 является позитивным индикатором эффективности введения GGF2 для лечения пациента с повреждением сердца. Использование заявленной группы изобретений позволяет быстро и точно диагностировать повреждения сердца у пациента, а также быстро и точно оценить эффективность проводимого лечения. 4 н. и 15 з.п. ф-лы, 26 ил., 1 пр., 1 табл.
Реферат
ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка заявляет приоритет по 35 USC §119(e) предварительной заявки США, серийный номер 60/928541, поданной 10 мая 2007 года, при этом указанная заявка включена в настоящее изобретение путем ссылки во всей полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области медицинской диагностики. Более конкретно, настоящее изобретение направлено на способ выявления повреждения сердца у пациента. Настоящее изобретение также относится к способам лечения пациентов с выявленным повреждением сердца. К области настоящего изобретения также принадлежат способы оценки эффективности проводимой терапевтической программы, разработанной для лечения больных с повреждением сердца.
УРОВЕНЬ ИЗОБРЕТЕНИЯ
В настоящей заявке приведены ссылки на ряд публикаций и патентных документов для более полного описания состояния области техники, к которой относится настоящее изобретение. Раскрытие каждой из этих публикаций и документов включено в настоящее изобретение в качестве ссылки.
Сердечная недостаточность находится в причинной связи со многими состояниями, поражающими сердце, включающими ишемическую болезнь сердца с инфарктом миокарда или без него; гипертонию; заболевания, инфекции или интоксикации, которые воздействуют на сердечную мышцу; и болезни сердечных клапанов. Сердечная недостаточность может возникать быстро, за считанные дни или недели, но чаще развивается медленно в течение нескольких лет, по мере постепенного и прогрессивного ослабевания сердца.
Терапевтические мероприятия, направленные на уменьшение количества раковых клеток у больного, часто, если не всегда, сопровождаются рядом вредных побочных эффектов. В действительности цитостатические препараты, применяемые в качестве химиотерапевтических средств для лечения различных раковых заболеваний, часто проявляют потенциально летальные побочные эффекты, включающие кардиотоксичность. Вещества, обычно применяемые для цитостатической терапии, включают антрациклины даунорубицин и его пролекарства, зорубицин, доксорубицин (адриамицин) и эпирубицин, и синтетический антибиотик митоксантрон. Например, антрациклины, которые относятся к классу химиотерапевтических препаратов на основе даунозамина и тетрагидро-нафтацен-диона. Указанные соединения применяют для лечения множества раковых заболеваний, включающих в себя лейкозы, лимфомы и солидные опухоли груди, матки, яичника и легкого. В дополнение к прогнозируемым побочным эффектам, которые наблюдаются у больных на фоне химиотерапии, таким как потеря волос и тошнота, терапевтические мероприятия, сопровождаемые введением антрациклина, имеют осложнения и ограничения, обусловленные выраженной кардиотоксичностью соединений этого класса. Кардиотоксичность, связанная с применением антрациклина, коррелирует с суммарной введенной дозой и часто является необратимой. Цитостатические эффекты и кардиотоксичность указанных соединений обусловлены, по меньшей мере частично, изменениями текучести и проницаемости мембран, которые вызваны связыванием антрациклина с компонентами клеточной мембраны. Также считается, что образование свободных радикалов в сердце и накопление метаболитов антрациклина способствуют повреждению сердца. Кардиотоксичность часто отражена на электрокардиограмме (ЭКГ) в виде отклонений и аритмий или в виде кардиомиопатии, которые могут в конечном счете приводить к острой сердечной недостаточности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к обеспечению новых способов диагностики для скрининга пациентов с целью идентификации наличия симптомов повреждения сердца. У пациентов с выявленными таким образом симптомами можно применять фармацевтические препараты для лечения повреждения сердца согласно приведенному в настоящем изобретении описанию. В конкретном аспекте настоящего изобретения представлены диагностические методики скрининга пациентов для выявления наличия симптомов повреждения сердца, например, обусловленных кардиотоксичностью, гипертонией, болезнями клапанов, инфарктом миокарда, вирусным миокардитом или склеродермой. В конкретном аспекте целью настоящего изобретения является выявление пациентов с симптомами кардиотоксичности, возникшей в результате химиотерапевтического лечения. Классификация таких пациентов призвана идентифицировать подгруппу пациентов, нуждающихся в терапевтическом воздействии для облегчения кратковременных и продолжительных кардиотоксичных эффектов. Идентифицированную таким образом подгруппу пациентов можно лечить фармацевтическими препаратами для лечения повреждения сердца, которая возникла в связи с применением кардиотоксических доз лекарств или химических агентов. Если ситуация, при которой у пациента выявляют патологию сердца, обусловлена постоянным состоянием, таким как гипертония, болезни клапанов, инфаркт миокарда, вирусный миокардит или склеродерма, также можно создавать подходящие рецептуры фармацевтических препаратов для лечения пациентов с повреждением сердца.
Настоящее изобретение также охватывает способ разделения пациентов на группы согласно степени или типу повреждения сердца, понимание чего для квалифицированного специалиста является руководством для выбора подходящей схемы лечения. Настоящее изобретение также включает в себя способ оценки эффективности схемы лечения.
Основой новых способов настоящего изобретения является открытие возможности использования в качестве индикаторов наличия поражения сердца изменений внутриклеточных уровней содержания кардиального тропонина I (cTnl) и кардиального тропонина T (cTnT) в интактной сердечной ткани. Более конкретно, авторы настоящего изобретения обнаружили, что уменьшение внутриклеточного уровня cTnl и cTnT в интактной сердечной ткани служит диагностическим маркером для выявления пациентов, имеющих риск появления повреждения сердца. Можно проводить биопсию сердечной ткани пациента и тестировать образец in vitro или проводить анализ in vivo, используя протоколы молекулярных исследований, известные в данной области техники.
Применяется подход, при котором внутриклеточные уровни cTnl и cTnT, установленные для сердечной ткани пациента, сравнивают с уровнями в контрольной сердечной ткани, в которой экспрессируется дикий тип или выявлены нормальные уровни внутриклеточного cTnl и cTnT. Уменьшение уровней внутриклеточного cTnl и/или cTnT в сердечной ткани пациента легко определяют путем расчета уровней белка, что можно получить при использовании стандартных способов, и определить с помощью анализа, устанавливающего наличие статистически значимого снижения внутриклеточного уровня cTnl и cTnT в сердечной ткани пациента относительно контрольных уровней. Пациентам с доказанным сниженным внутриклеточным уровнем cTnl и/или cTnT назначается лечение подходящими композициями, которые выбирают для восстановления, по меньшей мере частичного, нормальной работы сердца, подтверждением чего является повышение внутриклеточного уровня cTnl и cTnT или восстановление нормального уровня внутриклеточного cTnl и cTnT.
В одном варианте осуществления настоящего изобретения устанавливают контрольный или нормальный внутриклеточный уровень в сердечной ткани как cTnT, так и cTnl путем определения внутриклеточного уровня и cTnT, и cTnl в сердечной ткани пациента с нормально функционирующим сердцем. В другом варианте осуществления настоящего изобретения устанавливают контрольный или нормальный внутриклеточный уровень в сердечной ткани и cTnT и cTnl путем определения внутриклеточного уровня и cTnT и cTnl в сердечной ткани пациента до начала лечения, которое может стать причиной повреждения сердца.
В одном аспекте настоящего изобретения поражение сердца является результатом кардиотоксичности, гипертонии, болезней клапанов, инфаркта миокарда, вирусного миокардита или склеродермы. В дополнительном аспекте изобретения кардиотоксичность обусловлена применением химиотерапевтического препарата или облучением.
Также в объем настоящего изобретения входит оценка эффективности схемы лечения, разработанной, по меньшей мере, для частичного восстанавления нормальной работы сердца посредством измерения внутриклеточного уровня cTnl и cTnT в сердечной ткани получающего лечение пациента. Согласно настоящему изобретению, повышение внутриклеточного уровня cTnl и cTnT в сердечной ткани получающего лечение пациента относительно уровней, определенных до начала лечения, является положительным индикатором того, что терапевтическое действие направлено на восстановление работы сердца.
Подразумевается, что внутриклеточный уровень как cTnl, так и cTnT в сердечной ткани или оба внутриклеточных уровня и cTnl и cTnT в сердечной ткани можно использовать в качестве индикаторов активности и/или функции сердечной ткани. Это относится ко всем аспектам настоящего изобретения, включая в себя способы, направленные на оценку или диагностику повреждения сердца, способы, направленные на классификацию пациентов в отношении конкретных схем лечения, и способы, направленные на оценку эффективности схем лечения.
Согласно настоящему изобретению показателем повреждения сердца также является снижение уровней cTnl и/или cTnT мРНК в сердечной ткани, что можно использовать для разделения популяции пациентов на группы. В этой связи частичное или полное восстановление нормального уровня cTnl и/или cTnT мРНК также является положительным индикатором терапевтической эффективности, как описано выше, в отношении уровней содержания белка.
Настоящее изобретение, в общем, относится к животным и более конкретно, к млекопитающим, и еще более конкретно, к людям. Соответственно, его субъектом предпочтительно является животное, включая в себя без ограничения таких животных, как коровы, свиньи, лошади, цыплята, кошки, собаки и т.д., и предпочтительно субъектом является млекопитающее, и наиболее предпочтительно, человек. Соответственно, термин "субъект" или "пациент" можно использовать в отношении человека.
В объем настоящего изобретения также входит комбинация схемы лечения, при которой глиальный фактор роста (GGF2) или домен, подобный эпидермальному фактору роста (EGFL), кодируемый геном нейрегулином, вводят в комбинации с ингибитором протеасомы для лечения повреждения сердца. Примером ингибитора протеасомы, применяемым в настоящем изобретении, является Proscript 519, представляющий собой мощный и селективный ингибитор протеасом. Другие ингибиторы протеасом, полезные для настоящего изобретения, включают в себя велкейд (Velcade™) и лактацистин. Дополнительные ингибиторы протеасом известны специалистам в данной области техники. Фактически ингибиторы протеасом уже применяются в качестве терапевтических средств для лечения многих болезней, включающих в себя некоторые раковые и нейродегенеративные заболевания.
В объем настоящего изобретения также входит использование GGF2 или домена, подобного эпидермальному фактору роста (EGFL), кодируемого геном нейрегулином, для изготовления лекарства для введения пациенту, у которого с помощью диагностических способов согласно настоящему изобретению выявлена патология сердца. Настоящее изобретение дополнительно охватывает использование GGF2 или домена, подобного эпидермальному фактору роста (EGFL), кодируемого геном нейрегулином, в комбинации с ингибитором протеасом для изготовления лекарства для введения пациенту, у которого с помощью диагностических способов согласно настоящему изобретению выявлена патология сердца.
Другие признаки и преимущества настоящего изобретения станут очевидными из приведенного ниже описания предпочтительных вариантов его осуществления и из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
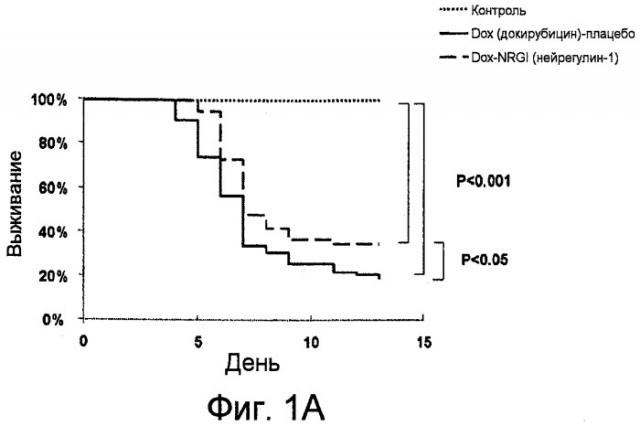
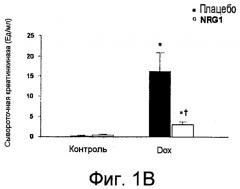
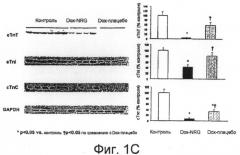
Фиг.1A-1C показывают графики выживания (A), гистограммы (B-C) и иммуноблоты (C). В анализе выживания (A) мышам вводили единственную дозу доксорубицина (20 мг/кг, внутрибрюшинно (в/б)) с сопутствующей инъекцией гена нейрегулина-1 (NRG1) (0,75мг/кг, подкожно (п/к) ежедневно) или без указанной инъекции. Выживание в течение четырнадцати дней анализировали по методике Каплана-Мейера. Относительно определения сывороточного уровня креатинкиназы (КК) (B): сывороточные уровни КК измеряли у контрольных мышей, у мышей, получавших доксорубицин (Dox), и мышей, получавших Dox-NRG1 через четыре дня после инъекции доксорубицина. Фиг.1C показывает, что инъекция NRG1 облегчала индуцированную доксорубицином даун-регуляцию уровней белка cTnl, cTnT и cTnC у мышей. Мышам вводили доксорубицин (20 мг/кг, в/б) с сопутствующей инъекцией гена нейрегулина-1 (NRG1) (0,75мг/кг, подкожно (п/к) ежедневно) или без сопутствующей инъекции. Уровни белков cTnl, cTnT и cTnC измеряли анализом вестерн-блоттинг через пять дней после введения доксорубицина.
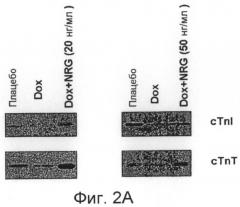
Фиг.2A-D показывают результаты иммуноблот-анализов для обнаружения указанных белков. Фиг.2A показывает, что NRG1 облегчал доксорубицин-индуцированную даун-регуляцию уровней белка cTnl и cTnT в кардиомиоцитах новорожденной крысы (КМНК). Клетки КМНК обрабатывали доксорубицином (1 мкМ) в присутствии или отсутствии NRG1 (20 нг/мл или 50 нг/мл). Уровни содержания белков cTnl и cTnT измеряли анализом вестерн-блоттинг через 48 часов после обработки доксорубицином. Фиг.2B показывает, что ингибирование erbB2 устраняло действие NRG1 на cTnl и cTnT. Клетки КМНК обрабатывали доксорубицином (1 мкМ) и NRG1 (20нг/мл) в присутствии или отсутствии, или AG879 (10 мкМ), или AG1478 (10 мкМ). Уровни содержания белка cTnl и cTnT измеряли в анализе вестерн-блоттинг. Как показано на фиг.2C, клетки КМНК обрабатывали доксорубицином и NRG1 в присутствии LY294002 (10 мкМ), Akti (5 мкМ), PD98059 (50 мкМ) и рапамицина (10 нМ). Уровни содержания белков cTnl и cTnT измеряли в анализе вестерн-блоттинг. Фиг.2D показывает введение в КМНК доксорубицина или доксорубицина + NRG1 в присутствии циклоксемида (5 мкг/мл), Z-VAD (100 мкМ) или MG1 32 (10 мкМ). Уровни содержания белков cTnl и cTnT измеряли анализом вестерн-блоттинг.
Фиг.3A-3D показывают иммуноблоты (A, C, D) и гистограммы (B). Фиг.3A представляет результаты введения в клетки КМНК доксорубицина (1 мкМ) в присутствии ингибиторов разных каспаз (20 мкМ). Уровни содержания белков cTnl и cTnT измеряли c помощью анализа вестерн-блоттинг. Фиг.3B показывает эффекты активации каспазы на клетки КМНК, обработанные доксорубицином. Клетки обрабатывали Dox, Dox+NRG1 или Dox+NRG1+LY. Активацию каспазы анализировали в тесте активации каспазы. Фиг.3C показывает, что NRG1 уменьшает высвобождение цитохрома С, индуцированное доксорубицином. Клетки КМНК обрабатывали Dox или Dox+NRG1. Высвобождение цитохрома С анализировали путем фракционирования клетки и анализом вестерн-блоттинг. Фиг.3D показывает, что NRG1 уменьшает индуцированное доксорубицином убиквитинилирование cTnl. Клетки КМНК обрабатывали Dox или Dox+NRG1. Клеточные лизаты подвергали иммунопреципитации с cTnl-антителом и исследовали с убиквитин-антителом.
Фиг.4A-4B показывают агарозные гели (A) и иммуноблоты (B) с пятнами бромида этидия.
Фиг.4A показывает, что NRG-1 ингибирует доксорубицин-индуцированную даун-регуляцию уровней мРНК cTnl, cTnT и кардиальных специфичных факторов транскрипции. Клетки КМНК обрабатывали Dox или Dox+NRG1. Уровни мРНК cTnl, cTnT, GATA4, MEF2c и NKX2,5 анализировали количественной полимеразной цепной реакцией в реальном времени РВ-ПЦР.
Фиг.4B показывает, что NRG1 ингибирует доксорубицин-индуцированное дефосфорилирование молекул трансляции. Клетки КМНК обрабатывали Dox, Dox+NRG1 или Dox+NRG1+LY. Уровни фосфорилирования mTOR, P70S6K, S6, 4EBP и EIF4G анализировали анализом вестерн-блоттинг.
Фиг.5A-5C показывают график выживания (A), гистограммы (B) и иммуноблот (C).
Фиг.5A показывает анализ выживания мышей с кардиомиоцит-специфической свехэкспрессией доминантного негативного PI3K (dnPDK) после лечения доксорубицином. Мышам вводили единственную дозу доксорубицина (20 мг/кг, в/б) с сопутствующим введением NRG1 (0,75 мг/кг, п/к) или без сопутствующего введения.
Выживание в течение четырнадцати дней анализировали по методике Каплана-Мейера. Фиг.5B показывает измерения гемодинамики у dnPI3K мышей, леченных доксорубицином. Мышам вводили единственную дозу доксорубицина (20 мг/кг, в/б). Измерения гемодинамики проводили через шесть дней после введения доксорубицина. Фиг.5C показывает уровни содержания белка cTnl у мышей dnPDK, которым вводили Dox или Dox+NRG1.
Фиг.6A-D показывают последовательности аминокислот и нуклеиновых кислот GGF2.
Фиг.7 показывает последовательности аминокислот и нуклеиновых кислот EGFL1.
Фиг.8 показывает последовательности аминокислот и нуклеиновых кислот EGFL2.
Фиг.9 показывает последовательности аминокислот и нуклеиновых кислот EGFL3.
Фиг.10 показывает последовательности аминокислот и нуклеиновых кислот EGFL4.
Фиг.11 показывает последовательности аминокислот и нуклеиновых кислот EGFL5.
Фиг.12 показывает последовательности аминокислот и нуклеиновых кислот EGFL6.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Обычно когда пациент приходит в лечебное учреждение с жалобами на боль в груди, проводят следующие этапы диагностики для оценки состояния сердца пациента и определения тяжести всех выявленных нарушений. Для начала проводят опрос пациента для сбора полного перечня симптомов, чтобы медицинский работник мог исключить проблемы, не связанные с сердцем. Во-вторых, проводят электрокардиографическое исследование (ЭКГ), при котором регистрируются электрические волны, возникающие в сердце. ЭКГ является важным инструментом для определения степени тяжести болей в груди, связанных с болезнями сердца и для измерения степени поражения сердца. Данные анализов крови также имеют значение для обнаружения в сыворотке повышения уровней содержания некоторых факторов, таких как тропонины и креатинкиназа (КК), и более кардиоспецифичных изоформ креатинкиназы (КК-MB), которые являются показателями поражения сердца. Повышение в сыворотке уровней КК, КК-MB и тропонинов происходит вследствие высвобождения этих молекул после смерти сердечных мышечных клеток и служит, таким образом, сывороточным маркером некроза. Когда сердечная мышечная клетка умирает, например, в результате длительной ишемии, происходит разрыв клеточной мембраны с выходом содержимого цитозоля во внеклеточное жидкое пространство, откуда оно проникает в лимфатическую систему, и затем в циркулирующую кровь. В контексте диагностики также можно использовать тесты с получением изображений, включающие в себя эхокардиографию и перфузионную сцинтиграфию.
Наиболее специфичными доступными маркерами некроза сердечной мышцы являются сердечные тропонины. Эти белки представляют собой компоненты контрактильного аппарата миокардиальных клеток. Было налажено производство и продажа двух сердечных тропонинов, cTnl и cTnT, и обнаружение этих маркеров считается надежным и специфичным исследованием для обнаружения минимального уровня повреждения миокарда. Сердечные тропонины, такие как КК-MB, высвобождаются из мертвых сердечных мышечных клеток после разрыва клеточной мембраны, и в конечном счете их можно обнаруживать в крови. Некроз может происходить в результате продолжительной ишемии миокарда, но также может быть результатом повреждения миокардиальных клеток вследствие других причин, таких как инфекция, травма или ишемическая болезнь сердца.
Настоящее изобретение в ряде аспектов отличается от методик, ранее описанных в данной области техники. В первую очередь его целью является измерение внутриклеточного уровня cTnl и cTnT в интактной сердечной ткани в отличие от измерения уровня указанных маркеров в сыворотке. Кроме того, авторы настоящего изобретения обнаружили, что уменьшение внутриклеточного уровня cTnl и cTnT в интактной сердечной ткани служат диагностическим маркером для выявления пациентов группы риска по повреждению сердца патологии или с наличием повреждения сердца. Такой подход значительно отличается от измерения уровней содержания указанных маркеров в сыворотке, повышение которых является показателем патологии сердца. Кроме того, повышение уровней содержания этих маркеров в сыворотке представляет собой кратковременный или промежуточный маркер поражения сердца, тогда как измерение внутриклеточных уровней cTnl и cTnT в интактной сердечной ткани служит устойчивым маркером, отражающим состояние сердца. Согласно настоящему изобретению, выявление пациентов со сниженным внутриклеточным уровнем cTnl и cTnT в интактной сердечной ткани также обеспечивает способ скрининга для разделения пациентов на группы с целью последующего лечения. Пациентам с доказанным сниженным внутриклеточным содержанием cTnl и cTnT показано лечение подходящими композициями, выбираемыми для восстановления, по меньшей мере частичного, нормальной работы сердца, проявлением чего является его восстановление.
Примером терапевтического агента, включаемым в такую композицию, является глиальный фактор роста 2 (GGF2). На фиг.6A-6D представлены последовательности аминокислот и нуклеиновых кислот GGF2. Терапевтические композиции могут также включать в себя, например, другие полипептиды, такие как домены, подобные эпидермальному фактору роста (EGFL), кодируемые геном нейрегулином, что показано на фиг.7-12 и описано в патенте США (USPN) 5530109, который включен в настоящее изобретение во всей полноте.
Для более четкой формулировки параметров настоящего изобретения в нем использованы следующие определения:
В настоящем описании и прилагаемой формуле изобретения при использовании существительных в единственном числе эти понятия включают в себя ссылки на множественное число, если в контексте ясно не указано иначе. Таким образом, например, ссылка на термин "способ" включает в себя один или больше способов, и/или этапов того типа, который описан в настоящем изобретении и/или который будет очевиден для специалистов в данной области техники после прочтения настоящего раскрытия.
Композиции, содержащие молекулы или соединения настоящего изобретения, можно вводить в диагностических и/или терапевтических целях. Применение композиций в диагностических целях подразумевает их введение пациенту для определения наличия у пациента повреждения сердца и/или для дифференциации пациентов в отношении предполагаемых схем лечения. Для терапевтического применения композиции вводят пациенту при диагностированном наличии повреждения сердца в количестве, достаточном для лечения пациента, и, таким образом, по меньшей мере частично, устраняются симптомы заболевания и его осложнения. Количество, адекватное для достижения указанной цели, определяют как "терапевтически эффективное количество или доза". Количество, эффективное для такого применения, будет зависеть от степени тяжести заболевания, веса и общего состояния пациента.
Используемое в настоящем изобретении выражение "контрольный образец сердечной ткани" относится к образцу сердечной ткани с внутриклеточным содержанием cTnl и cTnT в пределах нормального диапазона. Нормальный диапазон или диапазон дикого типа внутриклеточных уровней cTnl и cTnT устанавливают на основе экспериментов, например, представленных в настоящем изобретении и известных в данной области техники, в которых используют сердечную ткань субъекта со здоровой работой сердца, что определяет практикующий специалист, в качестве стандарта, с которым сравнивают исследуемые образцы. Стандартные образцы нормальных сердец, например, можно получать при вскрытиях свежих трупов, не имеющих признаков заболевания сердца.
Аналогично, термин "контрольный или нормальный уровень" относится к уровням, которые установлены или определены согласно настоящему описанию и в данной области техники считается, что указанные уровни находятся в пределах диапазона, связанного со здоровым функционированием.
Согласно настоящему изобретению здоровое функционирование относится к здоровой работе сердца, которую может оценить практикующий специалист с использованием стандартных методик, таких как измерение систолического и диастолического артериального давления, измерение сывороточных уровней белков-индикаторов, таких как КК, КК-MB и тропонинов, регистрация ЭКГ и/или проведение теста с физической нагрузкой. Практикующий специалист будет знаком с показателями, которые обычно считаются нормальным уровнем содержания указанных белков в сыворотке.
Был проведен ряд исследований в отношении, например, уровня содержания КК в сыворотке, и установлены общие принципы подхода. В одном из таких исследований выявлено, что, например, у пациентов с подозрением на инфаркт миокарда (ИМ), имевших уровень креатинкиназы в сыворотке 280 МЕ/л или больше, наблюдался высокий риск ИМ; у пациентов с уровнем креатинкиназы в сыворотке от 80 до 279 МЕ/л существовал риск ИМ; пациенты с уровнем креатинкиназы от 40 до 79 МЕ/л имели меньший риск ИМ; и пациенты с уровнем креатинкиназы менее 40 МЕ/л имели гораздо меньший риск ИМ. В отношении считающихся нормой уровней содержания в сыворотке КК или тропонинов нужно подразумевать, что в разных лечебных учреждениях установлены слегка отличающиеся стандарты. Кроме того, практикующий специалист должен знать о принятом в конкретном лечебном учреждении стандарте (например, в конкретной клинике), в котором этот специалист работает.
Тропонин также считается чувствительным и специфичным маркером поражения сердца. В действительности, для диагностики ИМ обнаружение в сыворотке тропонина I (sTnl) считается более точным и представляет более полезную прогностическую информацию, чем показатели концентрации креатинкиназы-MB. Обнаружение sTnl также позволяет на ранних сроках выявить пациентов с острыми коронарными синдромами, имеющих повышенный риск летального исхода. Показатели sTnl более чувствительны, чем концентрации креатинкиназы-MB, для обнаружения незначительного ишемического повреждения миокарда у пациентов с небольшим повышением общей креатинкиназы, и их определение предотвращает большую частоту ложных диагнозов, связанных с использованием креатинкиназы-MB в качестве диагностического маркера в периоперационном периоде ИМ. В одном исследовании, например, пациенты с умеренным повышением уровня сывороточного тропонина I (0,4-2,0 мкг/л) демонстрировали значительно более высокую смертность и большую продолжительность пребывания в стационаре и в отделении интенсивной терапии при сравнении с пациентами без подобного повышения. В диапазоне умеренно повышенной концентрации тропонина более высокие титры были связаны с увеличенным риском смертности, большей продолжительностью пребывания в стационаре и в отделении интенсивной терапии и более высокой частотой возникновения инфаркта миокарда. У пациентов, в сыворотке которых обнаружена максимальная концентрация тропонина, равная или больше 2 мкг/л, лечение β-блокаторами и аспирином улучшало прогноз.
Что касается нормальных уровней внутриклеточного cTnl и cTnT, они были установлены путем изучения нормальной сердечной ткани с использованием стандартных способов определения уровней содержания белка, таких как способы, описанные в настоящем изобретении и известные в данной области техники. Сниженные уровни внутриклеточного cTnl и cTnT, как показатели поврежденного или больного сердца, определяют как снижение уровней указанных белков относительно установленного нормального уровня. В качестве примера, снижение уровня cTnl и/или cTnT в сердечной ткани по меньшей мере на 50% подвергается исследованию на повреждение относительно этих уровней в здоровой сердечной ткани (нормальный контроль) и служит положительным индикатором повреждения исследуемой сердечной ткани, и пациент, у которого удалили поврежденную ткань, получит пользу от терапевтического вмешательства, такого, как описано в настоящем изобретении. В более конкретном примере снижение уровня содержания cTnT по меньшей мере на 75% в сердечной ткани, исследуемой на повреждение, относительно уровня cTnT в здоровой сердечной ткани (контроль нормы), служит положительным индикатором повреждения исследуемой сердечной ткани, и пациент, у которого удалили поврежденную ткань, получит пользу от терапевтического вмешательства, такого, как описано в настоящем изобретении.
Практикующий специалист также будет знаком с большим объемом научной литературы, относящейся к действию и уровню содержания внутриклеточного cTnl и cTnT в сердечной ткани в норме и патологии. Примеры ссылок, которые относятся к внутриклеточному содержанию cTnl и cTnT в сердечной ткани в норме и патологии, включают следующие публикации: Latif et al. (2007, J Heart Lung Transplant 26:230-235); Birks et al. ( 2005, Circulation 112 (9 Suppl):I57-4); Day et al. (2006, Ann NY Acad Sci 1080:437-450); VanBuren et al. (2005, Heart Fail Rev 10:199-209); de Jonge et al. (2005, Int J Cardiol 98:465-470); Wen et al. (2008, J Biol Chem Apr 22, Epub ahead of print); Li et al. (2008, Biochem Biophys Res Commun 369:88-99); Robinson et al. (2007, Circ Res 101:1266-1273); Solzin et al. (2007, Biophys J 93:3917-3931); (Chen et al. (2007, Cardiovasc Toxicol 7:114-121); Solaro et al. (2007, Circ Res 101:114-115); Kubo et al. (2007, J Am Coll Cardio 49:2419-2426); Day et al. (2007, J Mol Med 85:911-921); Milting et al. (2006, Mol Call Cardiol 41:441-450), полное содержание каждой из которых включено в настоящее изобретение путем ссылки.
В другом варианте осуществления изобретения повышение внутриклеточного уровня cTnl и cTnT, определяемое путем анализа содержания белков до начала лечения, во время (или после) применения схемы лечения, показывает терапевтическую эффективность схемы лечения и является доказательством того, что лечение способствует восстановлению нормальной работы сердца. В действительности, повышение внутриклеточного уровня cTnl и cTnT можно использовать для замещения конечного показателя улучшения работы сердца (то есть в качестве биомаркера, предназначенного для замены ожидаемого клинического результата). При этом, если внутриклеточный уровень cTnl и cTnT остается сниженным или дополнительно снижается после терапевтического вмешательства, практикующий специалист будет пересматривать преимущества такой схемы лечения в отношении пациента, которому проводят лечение, и будет менять или, возможно, сокращать схему лечения.
Используемое в настоящем изобретении понятие "проведение профилактики" или "профилактика" относится к уменьшению риска приобретения или развития заболевания или нарушения (т.е. предупреждение развития по меньшей мере одного из клинических симптомов болезни у субъекта, который может подвергаться воздействию агента, вызывающего болезнь, или предрасположен к болезни, перед началом болезни.
Термин "профилактика" связан с "предотвращением" и относится к способу или процедуре, цель которой состоит в предотвращении болезни, в отличие от ее лечения или излечения. Неограничивающие примеры профилактических мероприятий могут включать в себя введение вакцин, введение низкомолекулярного гепарина стационарным больным с риском тромбоза, например обусловленным иммобилизацией, и введение противомалярийного средства, такого как хлорохин, перед посещением географической зоны, где малярия является эндемичной или существует высокий риск заражения малярией.
Понятие "проведение лечения" или "лечение" какой-либо болезни или нарушения в одном варианте осуществления относится к улучшению болезни или нарушения (т.е. прекращение болезни или уменьшение ее проявления, степени распространенности или тяжести по меньшей мере одного из ее клинических симптомов). В другом варианте осуществления "проведение лечения" или "лечение" относится к улучшению по меньшей мере одного физического параметра, который, возможно, является различимым для субъекта. Еще в одном варианте осуществления "проведение лечения" или "лечение" относится к изменению болезни или нарушения, как к физическому (например, стабилизация различимого симптома), к физиологическому (например, стабилизация физического параметра), так и к обоим изменениям.
Инвазивные методики выделения ткани
Биопсия миокарда является общепринятой процедурой, при которой осуществляют забор сердечной ткани из сердца посредством катетера, во время торакотомии или во время операции со вскрытием грудной клетки. Обычно эту процедуру используют для определения этиологии сердечной недостаточности. Проводят и гистологический, и биохимический анализ сердечной ткани. Результаты этих анализов полезны для диагностики причины сердечной недостаточности. Для обзора публикаций по теме биопсии миокарда в клинической практике см. статью Veinot (2002, Can. J. Cardiol. 18 (3):287-96), полное раскрытие которой включено со ссылкой в настоящее изобретение.
Результаты биопсии миокарда могут указывать на то, что возникновение сердечной недостаточности обусловлено такими причинами, как склеродерма, вирусный миокардит, лекарственная интоксикация или рядом других причин. Указанные диагнозы будут определять вид терапевтического вмешательства, если оно предусмотрено, которое может быть полезным и которое необходимо применять.
Биопсия миокарда (или кардиальная биопсия) является инвазивной процедурой, при которой можно использовать, например, биоптом (маленький катетер с захватывающим устройством на конце), чтобы получить небольшой кусочек сердечной мышечной ткани, пригодный для анализа. Биопсию миокарда можно применять для оценки отторжения сердечного трансплантата и диагностики миокардита (воспаления миокарда).
Практикующий специалист будет знаком с основным протоколом биопсии миокарда с использованием катетера, при этом биопсия по существу охватывает следующее: применяется местное анестезирующее средство для потери чувствительности участка шеи или паховой области пациента; в кровеносный сосуд анестезированной области специалист вставляет пластиковую канюлю интродуктора (короткую полую трубку, через которую вводят катетер); через канюлю вставляют биоптом и продвигают его к правому желудочку пациента; затем осуществляют забор образцов сердца, используя захватывающее устройство биоптома. Во время процедуры для правильного размещения биоптома обычно используют рентгеновскую камеру. Образцы имеют размер примерно с булавочную головку. После забора достаточного количества образцов катетер удаляют и останавливают местное кровотечение плотной давящей повязкой. Во время процедуры пациенты могут бодрствовать и находиться в сознании.
Для прогнозирования и диагностики наличия и степени повреждения миокарда после миокардиального события рутинными способами измеряют содержание определенных белков в циркулирующей крови. Эти белки включают в себя без ограничения креатинкиназу и тропонин. Обнаружение определенных подтипов указанных и других белков в циркулирующей крови представляет собой диагностику высвобождения этих белков из миокарда и, таким образом, диагностику повреждения. Обнаружение указанных белков-индикаторов в сыворотке обычно используют в острой ситуации при подозрении на кардиальное событие, что является доказанно полезным для назначения наиболее оптимального лечения пациента. Будучи полезными в острых случаях, показатели уровня кардиальных белков в циркулирующей крови в период позже, чем через несколько дней после кардиального события, не имеют какого-либо значения для диагностики и прогноза сердечной недостаточности и при этом не имеют какого-либо значения для определения этиологии заболевания сердца или надлежащего курса лечения. Поскольку уровень кардиальных белков в крови не повышается, за исключением острого периода сразу после кардиального события, измерение указанных белков в циркулирующей крови является малоинформативным в отношении состояния миокарда.
С другой стороны, настоящее изобретение описывает применение биопсии миокарда для предварительного выявления пациентов, которые могут реагировать на кардиопротективную, кардиовосстановительную и другую терапию сердечной недостаточности. Составление прогноза в отношении пациента, восприимчивого к указанным способам лечения, будет улучшать лечение, способствуя гарантии того, что конкретные виды лечения назначаются правильной группе пациентов и, что важно, ограничит число пациентов, получающих малозначимое лечение, и поэтому только подвергающее их риску потенциально серьезных побочных эффектов. Дополнительно, биопсия миокарда и определение содержания некоторых белков могут показывать, какие пациенты восприимчивы к конкретным видам лечения и кому из них необходимо продолжать лечение.
Данные, представленные в настоящем изобретении, показывают, что, как и предполагалось, некоторые белки, включающие в себя креатинкиназу и тро