Способы лечения неалкогольного стеатогепатита (nash) с применением цистеаминовых продуктов
Иллюстрации
Показать всеГруппа изобретений относится к лечению жирового перерождения печени. Способ лечения пациента, страдающего жировым перерождением печени, включает введение терапевтически эффективного количества цистеамина или цистамина, или их фармацевтически приемлемой соли в составе композиции. Способ лечения пациента, страдающего заболеванием неалкогольное жировое перерождение печени (NAFLD) или неалкогольным стеатогепатитом (NASH), включает введение терапевтически эффективного количества композиции, содержащей цистеамин или цистамин или его фармацевтически приемлемую соль. В обоих способах композицией может быть лекарственная форма, содержащая энтеросолюбильное покрытие с задерживаемым или регулируемым высвобождением, которая обеспечивает повышенную доставку цистеамина или цистамина или их фармацевтически приемлемой соли в тонкую кишку. 2 н. и 22 з.п. ф-лы, 3 пр., 7 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к веществам и способам для лечения жирового перерождения печени с применением цистеаминовых продуктов.
Уровень техники
Жировое перерождение (инфильтрация) печени (или стеатогепатит) часто связано с чрезмерным потреблением алкоголя или ожирением, но имеются также другие причины, такие как метаболические недостаточности, включающие в себя инсулинорезистентность и диабет. Жировое перерождение печени является результатом аккумуляции триглицеридного жира в вакуолях клеток печени, приводящей к пониженной функции печени и возможно приводящей к циррозу или раку печени.
Неалкогольное жировое перерождение печени (NAFLD) представляет собой спектр заболевания, имеющего место в отсутствие злоупотребления алкоголем. Удовлетворительное лечение жирового перерождения печени, такого как NAFLD и NASH, в настоящее время является недоступным.
Раскрытие изобретения
Изобретение относится к способу лечения субъекта, страдающего жировым перерождением печени, включающему введение терапевтически эффективного количества композиции цистеамина. В одном варианте осуществления жировое перерождение печени выбрано из группы, состоящей из неалкогольного жирового перерождения печени (NAFLD), неалкогольного стеатогепатита (NASH), жирового перерождения печени, являющегося результатом гепатита, жирового перерождения печени, являющегося результатом ожирения, жирового перерождения печени, являющегося результатом диабета, жирового перерождения печени, являющегося результатом инсулинорезистентности, жирового перерождения печени, являющегося результатом гипертриглицеридемии, абеталипопротеинемии, гликогеноза, болезни Вебера-Крисчена, болезни Вольмана, острого жирового перерождения печени при беременности и липо дистрофии. В другом варианте осуществления общая суточная доза композиции цистеамина составляет приблизительно 0,5-1,0 г/м2. Еще в одном варианте осуществления цистеаминовую композицию вводят при частоте 4 или меньше раз в день (например, один, два или три раза в день). В одном варианте осуществления композицией является лекарственная форма с продолженным или регулируемым высвобождением, которая обеспечивает повышенную доставку цистеамина или производного цистеамина в тонкую кишку. Лекарственная форма с продолженным или регулируемым высвобождением может обеспечить Cmax цистеамина или производного цистеамина, или его биологически активного метаболита, которое, по меньшей мере, приблизительно на 35%, 50%, 75% или более выше, чем Cmax, обеспечиваемое лекарственной формой с немедленным высвобождением, содержащей такое же количество цистеамина или производного цистеамина. Еще в одном варианте осуществления лекарственная форма с продолженным или регулируемым высвобождением содержит энтеросолюбильное покрытие, которое высвобождает композицию цистеамина, когда композиция достигает тонкую кишку или участок желудочно-кишечного тракта субъекта, в котором рН больше, чем приблизительно 4,5. Например, покрытие может быть выбрано из группы, состоящей из полимеризованного желатина, шеллака, сополимера метакриловой кислоты типа С NF, бутират-фталата целлюлозы, гидрофталата целлюлозы, пропионат-фталата целлюлозы, поливинилацетатфталата (PVAP), ацетат-фталата целлюлозы (CAP), ацетат-тримеллитата целлюлозы (CAT), фталата гидроксипропилметилцеллюлозы, ацетата гидроксипропилметилцеллюлозы, сукцината диоксипропилметилцеллюлозы, карбоксиметилэтилцеллюлозы (СМЕС), ацетат-сукцината гидроксипропилметилцеллюлозы (HPMCAS) и полимеров и сополимеров акриловой кислоты, обычно образованных из метилакрилата, этилакрилата, метилметакрилата и/или этилметакрилата с сополимерами эфиров акриловой и метакриловой кислоты. Композицию можно вводить перорально или парентерально. В другом варианте осуществления способ приводит к улучшению состояния при фиброзе печени по сравнению с состояниями перед введением композиции цистеамина. Еще в одном варианте осуществления способ приводит к снижению содержания жира печени, снижению заболеваемостью циррозом или прогрессирующего развития цирроза или снижению заболеваемостью гепатоклеточной карциномой. В одном варианте осуществления способ приводит к уменьшению уровней печеночной аминотрансферазы по сравнению с уровнями перед введением композиции цистеамина. В следующем варианте осуществления введение приводит к уменьшению уровней печеночной аминотрансферазы приблизительно на 10%-40% по сравнению с уровнями перед лечением. Еще в одном варианте осуществления введение приводит к уменьшению уровней аланин- или аспартатаминотрансферазы у подвергнутого лечению пациента приблизительно до 30%, 20% или 10% выше нормальных уровней ALT или до нормальных уровней ALT. Еще в одном варианте осуществления введение приводит к уменьшению уровней ферритина сыворотки по сравнению с уровнями перед лечением композицией цистеамина. Способы и композиции по изобретению могут включать в себя также введение второго агента в комбинации с композицией цистеамина для лечения жирового перерождения печени. Субъектом может быть взрослый человек, подросток или ребенок.
В одном аспекте описание относится к способу лечения пациента, страдающего жировой инфильтрацией печени, в том числе NAFLD или NASH, включающему введение терапевтически эффективного количества композиции, содержащей цистеаминовый продукт. Способы включают в себя также применение цистеаминового продукта при получении лекарственного средства для лечения жирового перерождения печени и применение цистеаминового продукта при получении лекарственного средства для введения в комбинации со вторым агентом для лечения жирового перерождения печени. Включено также применение второго агента для лечения жирового перерождения печени при получении лекарственного средства для введения в комбинации с цистеаминовым продуктом. Далее описание относится к наборам, содержащим цистеаминовый продукт для лечения жирового перерождения печени, необязательно со вторым агентом для лечения жирового перерождения печени, и инструкции для применения при лечении жирового перерождения печени. Термин "жировое перерождение печени" может включать в себя или исключать NASH.
Краткое описание фигур
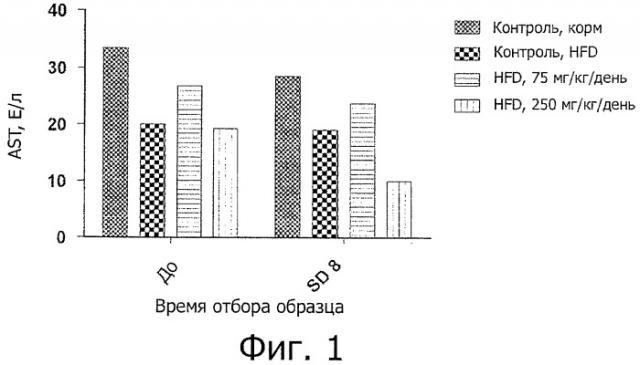
На фигуре 1 показано влияние лечения цистеамином в дозе 0, 75 и 250 мг/кг/день, доставленного внутрибрюшинным путем, на уровни аспартатаминотрансферазы (AST) у животных, которым давали корм с высоким содержанием жира (HFD) в течение 8 дней. Показаны также уровни AST для контрольных животных, которых не кормили HFD. На графике показаны средние величины AST для образцов крови, отобранных при анализе в день -1 ("перед") и при анализе в день 8 (SD8).
На фигуре 2 показано влияние лечения цистеамином в дозе 0, 75 и 250 мг/кг/день, доставленного внутрибрюшинным путем, на уровни холестерина у животных, которых кормили HFD в течение 8 дней. Показаны также уровни холестерина для контрольных животных, которых не кормили HFD. На графике показаны средние величины холестерина для образцов крови, отобранных при анализе в день -1 ("перед") и при анализе в день 8 (SD8).
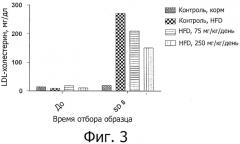
На фигуре 3 показано влияние лечения цистеамином в дозе 0, 75 и 250 мг/кг/день доставленного внутрибрюшинным путем, на уровни липопротеид низкой плотности-холестерина (LDL-холестерин) у животных, которых кормили HFD в течение 8 дней. Показаны также уровни LDL-холестерина для контрольных животных, которых не кормили HFD. На графике показаны средние величины LDL-холестерина для образцов крови, отобранных при анализе в день -1 ("перед") и при анализе в день 8 (SD8).
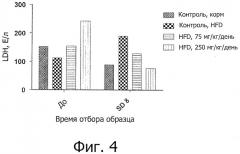
На фигуре 4 показано влияние лечения цистеамином в дозах 0, 75 и 250 мг/кг/день, доставленного внутрибрюшинным путем, на уровни лактатдегидрогеназы (LDH) у животных, которых кормили HFD в течение 8 дней. Показаны также уровни LDH для контрольных животных, которых не кормили HFD. На графике показаны средние величины LDH для образцов крови, отобранных при анализе в день -1 ("перед") и при анализе в день 8 (SD8).
На фигуре 5 показано влияние лечения цистеамином в дозах 0, 25, 75 и 250 мг/кг/день, доставленного посредством питьевой воды, на уровни AST у животных, которых кормили HFD в течение 8 недель. Показаны также уровни AST для контрольных животных, которых не кормили HFD. На графике показаны средние величины AST ± CKO (SEM) для образцов крови, отобранных при анализе в день -1 ("неделя 0") и в последний день указанной недели (недели 2, 4, 6 или 8).
На фигуре 6 показано влияние лечения цистеамином в дозах 0, 25, 75 и 250 мг/кг/день, доставленного посредством питьевой воды, на уровни LDH у животных, которых кормили HFD в течение 8 недель. Показаны также уровни LDH для контрольных животных, которых не кормили HFD. На графике показаны средние величины LDH ± CKO (SEM) для образцов крови, отобранных при анализе в день -1 ("неделя 0") и в последний день указанной недели (недели 2, 4, 6 или 8).
На фигуре 7 показано влияние лечения цистеамином в дозах 0, 25, 75 и 250 мг/кг/день, доставленного посредством питьевой воды, на уровни липопротеид высокой плотности-холестерина (HDL-холестерина) у животных, которых кормили HFD в течение 8 недель. Показаны также уровни HDL-холестерина для контрольных животных, которых не кормили HFD. На графике показаны средние величины HDL-холестерина ± CKO (SEM) для образцов крови, отобранных при анализе в день -1 ("неделя 0") и в последний день указанной недели (недели 2, 4, 6 или 8).
Осуществление изобретения
Применяемые в контексте и в прилагаемой формуле изобретения термины в единственном числе включают в себя и множественное число, если не подразумевается другое. Так, например, указание на "производное" включает в себя множество таких производных и указание на "субъект" включает в себя указание на один или нескольких субъектов и так далее.
Кроме того, применение слова "или" означает "и/или", если не указано иначе. Аналогично этому, термины "содержат", "содержит", "содержащий", "включают в себя", "включает в себя" и "включающий в себя" являются взаимозаменяемыми и не предполагается, что они являются ограничивающими.
Должно быть далее понятно, что когда в описаниях различных вариантов осуществления применяют термин "содержащий", специалисту в данной области должно быть понятно, что в некоторых конкретных случаях вариант осуществления может быть альтернативно описан с применением термина "состоящий по существу из" или "состоящий из".
Если не указано иначе, все технические и научные термины, применяемые в контексте, имеют такое же значение, какое обычно знает специалист в области, к которой относится данное изобретение. Хотя способы и вещества, подобные или эквивалентные способам и веществам, описанным в контексте, можно применять на практике описанных способов и композиций, в контексте описаны примерные способы, устройства и материалы.
Публикации, обсуждаемые выше и на всем протяжении текста, предложены только для описания публикаций до даты подачи настоящей заявки. Ничто в контексте не должно быть истолковано, как допущение, что авторы изобретения не имеют право датировать такое описание задним числом благодаря предыдущему описанию.
Изобретение относится к новым терапиям, которые могут ослаблять симптомы, связанные с заболеванием жировое перерождение печени, у пациентов, страдающих таким заболеванием. Изобретение относится к композициям цистеамина, которые обеспечивают эффективную терапию для пациентов, нуждающихся в лечении.
Следующие ссылки обеспечивают специалиста в данной области общим определением многих терминов, применяемых в данном описании: Singleton, et al., DICTIONARY OF MICROBIOLOGY AND MOLEKULAR BIOLOGY (2d ed. 1994); THE CAMBRIDGE DICTIONARY OF SCIENCE AND TECHNOLOGY (Walker ed., 1988); THE GLOSSARY OF GENETICS, 5TH ED., R. Rieger, et al. (eds.), Springer Verlag (1991); and Hale and Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGE (1991).
Цистеамин является предшественником глутатионового (GSH) предшественника белка и в настоящее время разрешен Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств США (FDA) для применения при лечении цистиноза, внутрилизосомного цистиноза. При цистинозе цистеамин действует посредством превращения цистина в цистеин и смешанный дисульфид цистеин-цистеамина, оба из которых затем способны покидать лизосому посредством транспортеров цистеина и лизина соответственно (Gahl et al., N Engl J Med 2002; 347(2): 111-21). В цитозоле смешанный дисульфид может восстанавливаться реакцией его с глутатионом и высвобожденный цистеин может применяться для дальнейшего синтеза GSH. Синтез GSH из цистеина катализируется двумя ферментами, гамма-глутаминцистеинсинтетазой и GSH-синтетазой. Этот метаболический путь имеет место почти во всех типах клеток, причем печень является основным производителем и экспортером GSH. Восстановленный смешанный дисульфид цистеин-цистеамина может также высвобождать цистеамин, который теоретически затем способен повторно входить в лизосому, связывать дополнительный цистин и повторять данный процесс (Dohil et al., J Pediatr 2006; 148 (6): 764-9). В последнем исследовании тонкокишечное введение цистеамина детям с цистинозом приводило к повышенным уровням цистеамина в плазме, что затем вызывало пролонгированную эффективность в снижении уровней цистина лейкоцитов (Dohil et al., J Pediatr 2006; 148 (6): 764-9). Это может быть обусловлено "рециркуляцией" цистеамина, когда адекватные количества лекарственного средства достигали лизосомы. Если цистеамин действует этим способом, то продуцирование GSH может быть также значительно увеличено.
Цистеамин является сильнодействующим средством, усиливающим секрецию желудочной кислоты, которое применяли для индуцирования язвы двенадцатиперстной кишки у лабораторных животных; исследования на людях и животных показали, что индуцированная цистеамином гиперсекреция желудочной кислоты весьма вероятно опосредуется посредством гипергастринемии. В предыдущих исследованиях, проведенных на детях с цистинозом, которые страдали регулярными симптомами нарушения функции нижней части желудочно-кишечного тракта, было показано, что одна пероральная доза цистеамина (11-23 мг/кг) вызывает гипергастринемию и в 2-3 раза повышает гиперсекрецию желудочной кислоты и на 50% повышает уровни гастрина в сыворотке. Симптомами, которые наблюдаются у этих индивидуумов, включают в себя абдоминальную боль, изжогу, тошноту, рвоту и анорексию. В заявке на патент США №11/990869 и в WO 2007/089670, причем обе испрашивают приоритет предварительной заявки на патент США №60/762715, зарегистрированной 26 января 2006 (все из которых включены в контекст в качестве ссылки во всей их полноте) показано, что индуцированная цистеамином гипергастринемия возникает, частично, как локальное действие на желудочные, преимущественно антральные G-клетки у восприимчивых индивидуумов. Эти данные позволяют также предположить, что это является также системным действием высвобождения гастрина цистеамином. В зависимости от пути введения, уровни гастрина плазмы обычно достигают максимума после внутрижелудочной доставки за 30 минут, тогда как уровни цистеамина достигают максимума позже.
Субъектам с цистинозом требуется принимать перорально цистеамин (цистагон®) каждые 6 часов днем и ночью. При приеме регулярно цистеамин может истощать содержание внутриклеточного цистина вплоть до 90% (измеряемой в циркулирующих лейкоцитах), и было показано, что это снижает скорость прогрессирующего развития до почечной недостаточности/трансплантации и также устраняет необходимость тироидной заместительной терапии. Вследствие трудности приема цистагона® снижение требуемой дозировки ослабляет привязанность к лечебной схеме. В WO 2007/089670 показано, что доставка цистеамина к тонкой кишке уменьшает желудочный дистресс и образование язвы, увеличивает Cmax и увеличивает AUC. Доставка цистеамина в тонкую кишку является полезной вследствие повышенных скоростей абсорбции из тонкой кишки и/или меньшего выведения цистеамина, подвергающегося печеночному первому проходу, при абсорбции на протяжении тонкой кишки. Снижение уровня цистина в лейкоцитах наблюдали в пределах часа лечения.
Изобретение относится к цистеаминовым продуктам, применимым при лечении заболеваний и нарушений жирового перерождения печени. Термин цистеаминовый продукт относится обычно к цистеамину, цистамину или его биологически активному метаболиту или комбинации цистеамина или цистамина и включает в себя соли, сложные эфиры, амиды, алкилированные производные, пролекарства, аналоги, фосфорилированные производные, сульфатированные производные цистеамина или цистамина или их другие формы, химически модифицированные такими способами, как введение метки (например, радионуклидами или различными ферментами) или ковалентное присоединение к полимеру, такое как пэгилирование (получение производного с полиэтиленгликолем).
Цистеаминовый продукт включает в себя цистеамин, цистамин, биологически активные метаболиты, формы соединения, химически модифицированные такими способами, как этерификация, алкилирование (например, C1, C2 или С3), введение метки (например, радионуклидами или различными ферментами), ковалентное присоединение к полимеру, такое как пэгилирование (получение производного с полиэтиленгликолем), или их смеси. В некоторых вариантах осуществления цистеаминовые продукты включают в себя, но не ограничиваются перечисленным, гидрохлоридные соли, битартратные соли, фосфорилированные производные и сульфатированные производные.
Примеры других цистеаминовых продуктов включают в себя 2-аминопропантиол-1,1-аминопропантиол-2,N- и S-замещенный цистеамин, АЕТ, аминоалкилпроизводные, фосфоротиоат, амифостин (патент США 4816482). В одном варианте осуществления цистеаминовый продукт в частности включает в себя N-ацетилцистеин. В одном варианте осуществления цистеаминовые продукты включают в себя, но не ограничиваются перечисленным, описанные ниже структуры:
где n равно 2 или 3, каждый из R1 и R2 представляет собой атом водорода или алкильную группу, необязательно замещенную гидрокси-, амино-, алкиламино- или диалкиламиногруппой, или представляет собой циклоалкильную или арильную группу и X1 представляет собой группу, выбранную из группы, состоящей из =N-CN, =N-NO2, =N-COR3, =N-NR-COOR3, =N-NR-CONH2, =N-SO2R3, -CH-NO2, -CH-SO2R3, =C(CN)2, =С(CN)COOR3 и =C(CN)CONH2, где R3 представляет собой алкильную или арильную группу. В другом аспекте цистеаминовый продукт может содержать цистеаминовый радикал, связанный с любым числом нетоксичных групп, указываемых ниже
где R1 представляет собой атом водорода или алкильную группу с неразветвленной или разветвленной цепью, имеющую 1-10 атомов углерода.
Фармацевтически приемлемые соли цистеаминовых продуктов также включены в описание и содержат фармацевтически приемлемые анионы и/или катионы. Фармацевтически приемлемые катионы включают в себя, среди других катионов, катионы щелочных металлов (например, Li+, Na+, K+), катионы щелочноземельных металлов (например, Са2+, Mg2+), нетоксичные катионы металлов и аммония (NH4+) и замещенного аммония (N(R')4+, где R' представляет собой водород, алкил или замещенный алкил, т.е. включающий в себя метил, этил или гидроксиэтил, конкретно, катионы триметиламмония, триэтиламмония и триэтаноламмония). Фармацевтически приемлемые анионы включают в себя, среди других анионов, галогениды (например, Cl-, Br-), сульфат, ацетаты (например, ацетат, трифторацетат), аскорбаты, аспартаты, бензоаты, цитраты и лактат.
Цистеаминовые продукты можно покрыть энтеросолюбильной оболочкой. Покрытое энтеросолюбильной оболочкой лекарственное средство или таблетка относится обычно к лекарственному средству или таблетке, которая покрыта веществом ("энтеросолюбильным покрытием"), которое остается интактным или по существу интактным, так что лекарственное средство или таблетка проходит через желудок, но растворяется и высвобождает лекарственное средство в тонкой кишке.
Энтеросолюбильным покрытием может быть полимерный материал или материалы, которые помещают в оболочку сердцевину лекарственного средства (например, цистамин, цистеамин, цистагон®) или другой цистеаминовый продукт). Обычно значительное или все количество образующего энтеросолюбильное покрытие материала растворяется до того, как лекарственное средство или терапевтически активный агент высвобождается из лекарственной формы, так чтобы достигалось задержанное растворение или доставка сердцевины лекарственного средства. Подходящим рН-чувствительным полимером является полимер, который может растворяться в кишечной окружающей среде при более высоком значении рН (рН больше, чем 4,5), таком как в тонкой кишке, и поэтому позволяет фармакологически активному веществу высвобождаться в областях тонкой кишки, но не в верхней части желудочно-кишечного (GI) тракта, такой как желудок.
Цистеаминовый продукт может включать в себя также дополнительные фармацевтически приемлемые носители или наполнители. Фармацевтически приемлемый носитель или наполнитель относится обычно к материалам (веществам), которые являются подходящими для введения субъекту, где носитель или наполнитель не является биологически вредным, или иначе, не вызывает нежелательные действия. Такие носители или наполнители обычно являются инертными ингредиентами лекарственного средства. Носитель или наполнитель обычно вводят субъекту вместе с активным ингредиентом без индуцирования любых нежелательных биологических действий или взаимодействия вредным образом с любым из других компонентов фармацевтической композиции, в которой он содержится.
Цистеаминовый продукт или другой активный ингредиент может содержать фармацевтически приемлемую соль, сложный эфир или другое производное. Например, соли, сложные эфиры или другие производные содержат биологически активные формы, имеющие аналогичное биологическое действие, сравнимое с "родительским" соединением. Примерные соли включают в себя гидрохлоридную соль и бистартратные соли.
Активный ингредиент, фармацевтическая или другая композиция описания может содержать стабилизирующий агент. Стабилизирующие агенты обычно относятся к соединениям, которые снижают скорость, с которой фармацевтический агент разрушается, особенно пероральный фармацевтический препарат, в условиях окружающей среды при хранении.
Применяемый в контексте термин "фармацевтически эффективное количество" или "эффективное количество" относится к количеству соединения, достаточного для того, чтобы привести к уменьшения интенсивности симптомов, например, лечению, излечиванию, профилактике или улучшению соответствующего медицинского состояния, или повышению скорости лечения, излечивания, профилактики или улучшения таких состояний, обычно обеспечивающему статистически значимое улучшение у подвергнутой лечению популяции пациентов. Что касается отдельного активного ингредиента, вводимого отдельно, термин терапевтически эффективная доза относится к дозе данного отдельного ингредиента. Что касается комбинации, терапевтически эффективная доза относится к общим количествам активных ингредиентов, которые приводят к терапевтическому действию, независимо от того, вводят ли их в комбинации, в том числе последовательно, или одновременно. В одном варианте осуществления терапевтически эффективное количество цистеаминового продукта уменьшает интенсивность симптомов заболеваний, включающих в себя, но не ограничивающихся перечисленным, фиброз печени, избыточное содержание жира в печени, заболеваемость циррозом или прогрессирующее развитие цирроза, заболеваемость гепатоклеточной карциномой, повышенные уровни печеночной аминотрансферазы, такой как ALT и AST, повышенные уровни ферритина сыворотки, повышенные уровни гамма-глутамилтрансферазы (гамма-GT) и повышенные уровни инсулина, холестерина и триглицерида плазмы.
Неалкогольное жировое перерождение печени (NAFLD) представляет собой спектр заболевания, имеющего место в отсутствие злоупотребления алкоголем. Оно характеризуется наличием стеатоза (жир в печени) и может представлять собой печеночное проявление метаболического синдрома (включающего в себя ожирение, диабет и гипертриглицеридемию). NAFLD связано с инсунорезистентностью, оно вызывает заболевание печени у взрослых людей и детей и может в конце концов привести к циррозу (Skelly et al., J Hepatol 2001; 35: 195-9; Chitturi et al., Hepatology 2002; 35(2); 373-9). Тяжесть NAFLD простирается от относительно доброкачественного обособленного преимущественно макровезикулярного стеатоза (т.е. неалкогольного жирового перерождения печени или NAFL) до неалкогольного стеатогепатита (NASH) (Angulo et al., J Gastroenterol Hepatol 2002; 17 Suppi: S 186-90). NASH характеризуется гистологическим присутствием стеатоза, цитологическим вздутием, диффузным воспалением и периклеточным фиброзом (Contos et al., Adv Anat Pathol 2002; 37-51). Фиброз печени, являющийся результатом NASH, может прогрессировать до цирроза печени или печеночной недостаточности и в некоторых случаях может привести к гепатоклеточной карциноме.
Степень инсулинорезистентности (и гиперинсулинемии) коррелирует с тяжестью NAFLD, причем является более выраженной у пациентов с NASH, чем с простым жировым перерождением печени (Sanyal et al, Gastroenterology 2001; 120(5); 1183-92). В результате этого имеет место опосредуемое инсулином подавление липолиза и уровни циркулирующих жирных кислот увеличиваются. Два фактора, связанные с NASH, включают в себя инсулинорезистентность и увеличенную доставку свободных жирных кислот к печени. Инсулин блокирует митохондриальное окисление жирных кислот. Повышенное образование свободных жирных кислот для печеночной переэтерификации и окисления приводит к аккумуляции внутрипеченочного жира и повышает восприимчивость печени ко вторичным повреждениям.
Глутатион (гамма-глутамилцистеинилглицин; GSH) является основным эндогенным антиоксидантом и снижение его содержания оказывает влияние на развитие гепатоклеточного повреждения (Wu et al., J Nutr 2004; 134(3): 489-92). Одним таким повреждением является отравление ацетаминофеном, когда уровни восстановленного GSH становятся истощенными при попытке конъюгировать и инактивировать гепатотоксический метаболит лекарственного средства. После появления токсичной дозы ацетаминофена избыточный метаболит (N-ацетилбензохинонимин) ковалентно связывается с печеночными белками и ферментами, что приводит к повреждению печени. (Wu et al., J Nutr 2004; 134(3); 489-92; Prescott et al., Annu Rev Pharmacol Toxicol 1983; 23: 87-101). Оказывается, что повышенные уровни глутатиона поэтому оказывают некоторые защитные действия посредством уменьшения ROS. Сам глутатион не может легко входить в клетки, даже когда его дают в больших количеств. Однако, предшественники глутатиона действительно входят в клетки, и обнаружено, что некоторые предшественники GSH, такие как N-ацетилцистеин, является эффективным при лечении таких состояний, как вызванных токсичностью ацетаминофена, замедлением или предотвращением истощения уровня GSH (Prescott et al., Annu Rev Pharmacol Toxicol 1983; 23: 87-101). Примеры предшественников GSH включают в себя цистеин, N-ацетилцистеин, метионин и другие серасодержащие соединения, такие как цистеамин (Prescott et al., J hit Med Res 1976; 4 (4 Suppi): 112-7).
Цистеин является основным лимитирующим фактором для синтеза GSH, и такие факторы (например, инсулин и факторы роста), которые стимулируют поглощение цистеина клетками, что обычно приводит к повышенным уровням внутриклеточного GSH (Lyons et al., Proc Nati Acad Sci USA 2000; 97(10): 5071-6; Lu SC. Curr Top Cell Regul 2000; 36: 95-11).
N-Ацетилцистеин вводили пациентам с NASH. В сообщениях из Турции показано, что страдающие ожирением индивидуумы с NASH, подвергнутые лечению N-ацетилцистеином в течение 4-12 недель, обнаруживали улучшение в уровнях аминотрансферазы и гамма-GT, даже если не было указанного изменения в показателе массы тела субъекта (Pamuk et al., J Gastroenterol Hepatol 2003; 18(10): 1220-1).
Цистеамин (HS-CH2-CH2-NH2) способен легко пересечь мембраны клеток вследствие его малого размера. В настоящее время цистеамин является разрешенным PDA (Food and Drug Administration) только для лечения цистиноза, нарушения интрализосомный цистиноз. При цистинозе цистеамин действует посредством превращения цистина в цистеин и смешанный дисульфид цистеин-цистеамина, оба из которых затем способны покидать лизосому посредством транспортеров цистеина и лизина, соответственно (Gahl et al., N Engi J Med 2002; 347(2): 111-21). Было показано, что лечение цистеамином приводит к снижению уровней внутриклеточного цистина в циркулирующих лейкоцитах (Dohil et al., J Pediatr 2006; 148(6): 764-9).
Исследования на мышах и с участием людей показали, что цистеамин является эффективным при предотвращении индуцированного ацетаминофеном гепатоклеточного повреждения (Prescott et al.. Lancet 1972; 2(7778): 652; Prescott et al., Br Med J 1978; 1(6116): 856-7; Mitchell et al., din Pharmacol Ther 1974; 16(4): 676-84). Описано, что цистамин и цистеин уменьшает некроз клеток печени, индуцированный несколькими гепатотоксинами (Toxicol Appi Pharmacol. 1979 Apr; 48(2): 221-8). Обнаружено, что цистамин уменьшает интенсивность симптомов фиброза печени, индуцированной тетрахлоридом углерода посредством ингибирования тканевой трансглутаминазы (Qiu et al., World J Gastroenterol. 13: 4328-32, 2007).
Распространенность NAFLD у детей неизвестна, поскольку для подтверждения диагноза требуется гистологический анализ печени (Schwimmer et al., Pediatrics 2006; 118(4): 1388-93). Однако, оценки распространенности можно получить из данных детского ожирения с применением печеночной ультразвуковой эхографии и повышенных уровней трансаминазы сыворотки и сведений, что 85% детей с NAFLD страдают ожирением. Данные обзора национального обследования здоровья и питания показали трехкратное повышение в преобладании ожирения в детском и юношеском возрасте на протяжении последних 35 лет; данные 2000 года позволяют предположить, что 14-16% детей возраста 6-19 лет страдают ожирением с BMI>95% (Fishbein et al., J Pediatr Gastroenterol Nutr 2003; 36(1): 54-61), а также тот факт, что 85% детей с NAFLD страдают ожирением.
У пациентов с гистологически доказанным NAFLD уровни печеночных аминотрансфераз, особенно аланинаминотрансферазы (ALT), являются повышенными от верхнего предела нормального до 10-кратного такого уровня (Schwimmer et al., J. Pediatr 2003; 143(4): 500-5; Rashid et al., J. Pediatr Gastroenterol Nutr 2000; 30(1): 48-53). Отношение ALT/AST (аспартатаминотрансфераза), которое >1 (диапазон 1,5-1,7), отличается от такого отношения алкогольного стеатогепатита, которое обычно <1. Другие аномальные серологические тесты, которые могут быть аномально увеличенными при NASH, включают в себя уровень гамма-глутамилтрансферазы (гамма-GT) и уровни инсулина, холестерина и триглицерида в плазме при голодании.
Точный механизм, которым происходит развитие NAFLD в NASH остается неясным. Поскольку инсулинорезистентность связана как с NAFLD, так и NASH, постулируется, что для появления NASH требуются также другие дополнительные факторы. Этот постулат называют гипотезой "двух толчков" (Day СР. Best Pract Res Clin Gastroenterol 2002; 16(5): 663-78) и он включает в себя, во-первых, аккумуляцию жира в печени и, во-вторых, присутствие больших количеств свободных радикалов с повышенным окислительным стрессом. Макровезикулярный стеатоз представляет собой печеночную аккумуляцию триглицеридов и это, в свою очередь, является результатом дисбаланса между доставкой свободных жирных кислот к печени и утилизацией их печенью. Во время периодов поглощения пищи с повышенной калорийностью триглицериды будут аккумулироваться и действовать в качестве резервного источника энергии. Когда калории в пище являются недостаточными, сохраняемые триглицериды (в жире) подвергаются липолизу и жирные кислоты высвобождаются в кровоток и потребляются печенью. Окисление жирных кислот будет производить энергию для утилизации. Лечение NASH в настоящее время вращается вокруг уменьшения двух основных патогенетических факторов, а именно, аккумуляции жира в печени и избыточной аккумуляции свободных радикалов, вызывающих окислительный стресс. Аккумуляцию жира уменьшают снижением потребления жира, а также повышением расхода калорий. Одним терапевтическим подходом является стойко поддерживаемая и равномерная потеря массы. Хотя это точно не доказано, показано, что >10% потеря массы тела в некоторых случаях уменьшает аккумуляцию печеночного жира, нормализует уровни трансаминаз печени и улучшает состояние при печеночном воспалении и фиброзе (Ueno et al, J. Hepatol 1997; 27(1): 103-7; Vajro et al., J Pediatr 1994; 125(2): 239-41; Franzese et al., Dig Dis Sci 1997; 42(7): 1428-32).
В некоторых исследованиях показано также, что уменьшение окислительного стресса посредством лечения антиоксидантами является эффективным. Например, страдающих ожирением детей, у которых был стеатоз, лечили витамином Е (400-1000 МЕ/день) в течение 4-10 месяцев (Lavine J Pediatr 2000; 136(6): 734-8). Несмотря на любое значительное изменение в BMI, средние уровни ALT уменьшались от 175±106 МЕ/л до 40±26 МЕ/л (Р<0,01) и средние уровни AST уменьшались от 104±61 МЕ/л до 33±11 МЕ/л (Р 0,002). Уровни печеночных трансаминаз увеличивались у тех пациентов, которых выбрали для продолжения терапии витамином Е. Изучение с участием взрослых людей и с применением витамина Е в течение одного года показало аналогичное уменьшение уровней печеночных трансаминаз, а также уровней маркеров фиброза TGFβ (Hasegawa et al., Aliment Pharmacol Ther 2001; 15(10): 1667-72).
Стеатоз может также развиваться в стеатогепатит посредством окислительного стресса посредством реакционноспособного кислородного соединения (ROS) и пониженной антиокислительной защиты (Sanyal et al., Gastroenterology 2001; 120(5): 1183-92). ROS может образовываться в печени посредством нескольких метаболических путей, включающих в себя митохондрии, пероксисомы, цитохром Р450, NADPH-оксидазу и липооксигеназу (Sanyal et al., Nat Clin Pract Gastroenterol Hepatol 2005; 2(1): 46-53). Было показано, что инсулинорезистентность и гиперинсулинизм повышали печеночный окислительный стресс и липидное перокисление посредством повышенной активности печеночной CYP2EI (Robertson et al.. Am J Physiol Gastrointest Liver Physiol 2001; 281(5): Gl 135-9; Leclercq et al., J Clin Invest 2000; 105(8): 1067-75).
В настоящее время большая часть того, что известно о патогенезе NAFLD, появляется из исследований животных. Существует ряд мышиных моделей, которые проявляют стеатоз/стеатогепатит и включают в себя генетически измененную модель с дефицитом лептина (ob/ob) или с лептинорезистентостью (db/db) и модель с кормовым дефицитом метионина/холина MCD). Проводили исследования, сравнивающие самцов и самок крыс различных штаммов (Wistar, Sprague-Dawley, Long-Evans) со штаммом мыши (C57BL/6) в качестве моделей для NASH. Этих животных кормили в течение 4 недель кормом MCD; хотя увеличение уровня ALT и стеатоз были более заметны у крысы Wistar, общие гистологические изменения в печени мышей были более постоянными с изменениями вследствие NASH. Позднее применение суперпитательных кормов для животных приводило к модели NAFLD, которая физиологически более походила на фенотип человека. Медицинскими состояниями, чаще всего связанными с NAFLD, являются ожирение, диабет типа II и дислипидемия. Эти состояния можно индуцировать кормлением мышей и крыс кормами с высоким содержанием жира или сахарозы. У крыс, которых кормили кормом, обогащенным >70% жира, в течение 3 недель, развивался пандольковый стеатоз, очаговое воспаление, повышенный окислительный стресс и повышенные концентрации инсулина плазмы, предполагающие инсулинорезистентность. NASH у мышей индуцировали посредством внутрижелудочного перекармливания. Мышей кормили избытком до 85% их обычного потребления корма в течение 9 недель. Мыши стали страдать ожирением с 71% увеличением конечной массы тела; они проявляли увеличение белой жировой ткани, гипергликемию, гиперинсулинемию, гиперлептинемию, непереносимость глюкозы и инсулинорезистентность. У 46% этих мышей появлялись повышенные уровни ALT (121=/-27 по сравнению с 13+/-1 Е/л), а также гистологические признаки, указывающие на NASH. Печени перекормленных мышей были приблизительно в два раза больше предполагаемых, имели бежевый цвет с микроскопическим доказательством присутствия липидных капелек, цитоплазмических вакуолей и кластеров воспаления.
Мышиные модели NASH создавали посредством специальных кормов (с дефицитом метионинхолина, MCD) или внутрижелудочным перекармливанием. У этих мышей развивались серологические и гистологиче