Иммуномодуляторные соединения и лечение заболеваний, связанных со сверхпродукцией воспалительных цитокинов
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к применению, по меньшей мере одного иммуномодулирующего соединения общей формулы (I) или его фармацевтически приемлемой соли, сольвата или изомера для изготовления фармацевтической композиции для лечения заболевания или расстройства, выбранного из астмы, атопического дерматита, аллергического ринита, воспалительного заболевания кишечника, диабета или ревматоидного артрита у теплокровных животных, включая человека. Также предложено применение (5S,11R)-1-амино-5-[(R)-3-додеканоилокситетрадеканоиламино]-6-оксо-7-аза-11-[(R)-3-гидрокситетрадеканоиламино]додекан-12-ол-12-дигидрофосфат (ОМ-294-ВА-МР(S,R)) или его фармацевтически приемлемой соли, сольвата или изомера для изготовления фармацевтической композиции. Группа изобретений обеспечивает лечение указанных заболеваний за счет модулирования баланса TH1/TH2 цитокинов путем снижения высвобождения ТН2-цитокинов и усиления продукции TH1-цитокинов. 2 н. и 9 з.п. ф-лы, 16 ил, 14 пр.
Реферат
Изобретение относится к применению соединений, обладающих иммуномодуляторной активностью для лечения заболеваний, связанных со сверхпродукцией воспалительных цитокинов, таких как заболевания, выбранные из группы, состоящей из астмы, атопического дерматита, аллергического ринита, простатита, воспалительного заболевания кишечника, диабета и ревматоидного артрита.
Недавно достигнут значительный прогресс в понимании механизма активации врожденной иммунной системы микробными сигналами. Также стало очевидно, что такая активация врожденной иммунной системы существенна для вызывания адаптивных иммунных ответов и для определения типа полученных адаптивных ответов. Вместе эти наблюдения вызвали значительное возрождение интереса к рациональным подходам в разработке иммунотерапии.
Два главных открытия оказались существенными для возросшего понимания активации врожденного иммунитета:
1) роль дендритных клеток (DC) в качестве антигенпрезентирующих клеток, отвечающих за индукцию первичных иммунных ответов;
2) открытие Toll-подобных рецепторов (TLR) и других «образраспознающих» рецепторов, которые определяют присутствие микробных структур, что приводит к стимуляции врожденной иммунной системы.
Sallusto и Lanzavecchia впервые сообщили о том, что незрелые DC можно получать из моноцитов человека в среде с добавлением GM-CSF и IL-4 (Sallusto F, Lanzavecchia A. J Exp Med 1994, 179:1109-18). Однако скоро стало понятно, что, кроме GM-CSF и IL-4, дополнительный фактор созревания необходим для получения зрелых DC, которые полностью функциональны в качестве антигенпрезентирующих клеток (APC). Зрелые DC способны управлять и инициировать адаптивный иммунный ответ.
Такие сигналы созревания можно получить при помощи микробных продуктов. Показано, что эти продукты действуют через TLR. Идентифицировано одиннадцать TLR, способных к распознаванию разных микробных продуктов или распознающих их. TLR4 представляет собой рецептор, который специфически распознает бактериальный липополисахарид (LPS), один из наиболее мощных известных стимуляторов врожденной иммунной системы.
В публикации международной заявки WO 2005007699 описано применение специфических участников связывания, в частности, молекул антител анти-IL-13 человека и, в особенности, молекул антител, которые нейтрализуют активность IL-13, в диагностике или лечении расстройств, связанных с IL-13, включая астму, атопический дерматит, аллергический ринит, фиброз, воспалительное заболевание кишечника и лимфому Ходжкина.
Однако по-прежнему необходимы исследования, чтобы узнать конкретную роль IL-13 в иммуномодуляции, и интерпретация результатов, связанных с исследованием пути IL-13/IL-4, все еще находится на стадии гипотез, как показано в следующих двух недавних публикациях.
В публикации «IL-4/IL-13 pathway genetics strongly influence serum IgE levels and childhood asthma», Michael Kabesch et al. (J. Allergy Clin. Immunol. Volume 117, Number 2), утверждается, что продукция IgE, отличительного признака астмы и атопического заболевания, может находиться под генетическим контролем, в который вовлечены гены пути IL-4 и IL-13. Вследствие того, что переключение IgE является фундаментальным для иммунитета и продолжительности жизни человека, существует тонкая регуляция IgE. Хотя путь IL-4/IL-13 может влиять на развитие астмы преимущественно посредством влияния на регуляцию IgE, данные результаты указывают на то, что, возможно, имеет место не только это.
В публикации «Control of allergic airway inflammation through immunomodulation», David B Corry and Farrah Kheradmand (J. Allergy Clin. Immunol. Volume 117, Number 2), описаны те основные открытия, связанные с клиническими испытаниями, которые изменили лечение астмы, и те, которые не изменили, и которые требуют дальнейшего изучения. Получены данные, что IL-4, цитокин, который необходим для IgE-ответов B-клеток, является существенным для ответов гиперчувствительности I типа, и что IL-4, таким образом, является одним из первых цитокинов, которые служат мишенью в клинических испытаниях для лечения астмы с использованием растворимой формы α-цепи (sIL-4Rα) рецептора IL-4, которая связывается с IL-4 и инактивирует его. IL-13 представляет собой другой цитокин, который обладает многими из эффектов, свойственных IL-4, но который не ингибируется посредством sIL-4α. Вывод состоит в том, что в будущих исследованиях для лечения астмы можно, таким образом, попытаться ингибировать одновременно как IL-4, так и IL-13.
Настоящее изобретение основано на демонстрации авторами настоящего изобретения того, что описанные далее молекулы являются эффективными агонистами TLR4 с надлежащим профилем безопасности, где молекулы способны индуцировать полное созревание функциональных DC моноцитарного происхождения, а также активировать другие типы клеток, экспрессирующих TLR4. DC, обработанные соединениями согласно изобретению, способны индуцировать первичной активации T-клеток и способствовать Th1-клеточным иммунным ответам.
Авторы настоящего изобретения также показали, что соединения согласно изобретению, способны заметно снижать секрецию IL-13 T-клетками CD4+, активированными поликлональными антителами анти-CD3 и анти-CD28.
Более того, при введении одного из соединений путем i.p. или i.n. в модели астмы на мышах, авторы настоящего изобретения показали предотвращение аллергических ответов, вызванных антигенной сенсибилизацией и последующей обработкой антигеном в форме аэрозоля. Измеренные иммунологические параметры позволяют предположить относительное снижение уровней Th2-ответов, которое может объяснить механизм, посредством которого соединения согласно изобретению действуют в этой модели астмы. Кроме того, авторы показали, что соединение по изобретению способно снижать частоту возникновения диабета у нетучных диабетических мышей.
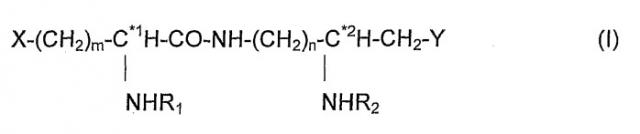
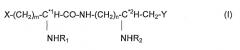
Настоящее изобретение относится к способу лечения теплокровных животных, включая человека, страдающих заболеванием или расстройством, связанным со сверхпродукцией воспалительных цитокинов, где способ включает введение пациенту, нуждающемуся в нем, соответствующего количества фармацевтической композиции, содержащей, по меньшей мере, одно иммуномодуляторное соединение следующей общей формулы (I):
где
- m и n независимо друг от друга представляют собой целое число от 1 до 4,
- X и Y каждый обозначает группу или в нейтральном или заряженном состоянии, выбранную из следующих групп:
* карбоксил -COOH,
* дигидроксифосфорилокси -O-P(O)(OH)2,
* гидроксисульфонилокси -O-SO2(OH),
* амино -NH2,
* гидроксил -OH,
* [амино(C1-C10)алкил]аминокарбонил -CONH(CH2)n1-NH2, где n1 представляет собой целое число от 1 до 10,
* [дикарбокси(C1-C5)алкил]аминокарбонил -CO-NH-CH(COOH)-(CH2)n1-COOH, где n1 представляет собой целое число от 1 до 5,
* {карбокси[амино(C1-C5)алкил]}аминокарбонил -CO-NH-CH(COOH)-(CH2)n1-NH2, где n1 представляет собой целое число от 1 до 5,
* амино(C1-C15)алканоилокси -O-CO-(CH2)n1-NH2, где n1 представляет собой целое число от 1 до 15,
* дигидрокси(C1-C10)алканоилокси -O-CO-(CH2)n1-CHOH-CH2OH, где n1 представляет собой целое число от 1 до 10,
* гидрокси(C1-C10)алканоилокси -O-CO-(CH2)n1-OH, где n1 представляет собой целое число от 1 до 10,
* карбокси(C1-C10)алканоилокси -O-CO-(CH2)n1-COOH, где n1 представляет собой целое число от 1 до 10,
* оксо(C1-C5)алканоилокси -O-CO-(CH2)n1-CHO, где n1 представляет собой целое число от 1 до 5,
* [карбокси(C1-C10)алканоил]амино(C1-C15)алканоилокси -O-CO-(CH2)n1-NH-CO-(CH2)n2-COOH, где n1 представляет собой целое число от 1 до 10, и n2 представляет собой целое число от 1 до 15,
- R1 и R2 каждый обозначает ацильную группу, полученную из насыщенной или ненасыщенной карбоновой кислоты с прямой или разветвленной цепью, содержащей от 2 до 18 атомов углерода, которая является незамещенной или имеет от одного до трех заместителей, выбранных из гидроксила, дигидроксифосфорилокси, алкила из 2-18 атомов углерода, алкокси из 2-18 атомов углерода, ацилокси из 2-18 атомов углерода в ацильной группе, амино, ациламино,
- C*1 и C*2 независимо друг от друга являются асимметрическими атомами углерода в конфигурации R, S, или в рацемической форме RS,
или его фармацевтически приемлемая соль, сольват или изомер, не обязательно, в конъюгации или смеси с инертным нетоксичным фармацевтически приемлемым разбавителем или носителем.
Изобретение более конкретно относится к способу, как определено выше, где:
* X выбран из следующих групп:
* карбоксил -COOH,
* дигидроксифосфорилокси -O-P(O)(OH)2,
* гидроксисульфонилокси -O-SO2(OH),
* амино -NH2,
* [амино(C1-C5)алкил]аминокарбонил -CONH(CH2)n1-NH2, где n1 представляет собой целое число от 1 до 10,
* [дикарбокси(C1-C5)алкил]аминокарбонил -CO-NH-CH(COOH)-(CH2)n1-COOH, где n1 представляет собой целое число от 1 до 5,
* {карбокси[амино(C1-C5)алкил]}аминокарбонил -CO-NH-CH(COOH)- (CH2)n1-NH2, где n1 представляет собой целое число от 1 до 5,
* амино(C1-C15)алканоилокси -O-CO-(CH2)n1-NH2, где n1 представляет собой целое число от 1 до 15,
* и Y выбран из следующих групп:
* дигидроксифосфорилокси -O-P(O)(OH)2,
* гидроксисульфонилокси -O-SO2(OH),
* амино -NH2,
* гидроксил -OH,
* амино(C1-C15)алканоилокси -O-CO-(CH2)n1-NH2, где n1 представляет собой целое число от 1 до 15,
* дигидрокси(C1-C10)алканоилокси -O-CO-(CH2)n1-CHOH-CH2OH, где n1 представляет собой целое число от 1 до 10,
* гидрокси(C1-C10)алканоилокси -O-CO-(CH2)n1-OH, где n1 представляет собой целое число от 1 до 10,
* карбокси(C1-C10)алканоилокси -O-CO-(CH2)n1-COOH, где n1 представляет собой целое число от 1 до 10,
* оксо(C1-C5)алканоилокси -O-CO-(CH2)n1-CHO, где n1 представляет собой целое число от 1 до 5,
* [карбокси(C1-C10)алканоил]амино(C1-C15)алканоилокси -O-CO-(CH2)n1-NH-CO-(CH2)n2-COOH, где n1 представляет собой целое число от 1 до 10, и n2 представляет собой целое число от 1 до 15.
Изобретение более конкретно относится к способу, как определено выше, где:
* X выбран из следующих групп:
* карбоксил -COOH,
* дигидроксифосфорилокси -O-P(O)(OH)2,
* гидроксисульфонилокси -O-SO2(OH),
* амино -NH2,
* [амино(C1-C6)алкил]аминокарбонил -CONH(CH2)n1-NH2, где n1 представляет собой целое число от 1 до 6,
* [дикарбокси(C1-C5)алкил]аминокарбонил -CO-NH-CH(COOH)-(CH2)n1-COOH, где n1 представляет собой целое число от 1 до 5,
* {карбокси[амино(C1-C5)алкил]}аминокарбонил -CO-NH-CH(COOH)-(CH2)n1-NH2, где n1 представляет собой целое число от 1 до 5,
* амино(C2-C12)алканоилокси -O-CO-(CH2)n1-NH2, где n1 представляет собой целое число от 2 до 12,
* и Y выбран из следующих групп:
* дигидроксифосфорилокси -O-P(O)(OH)2,
* гидроксисульфонилокси -O-SO2(OH),
* амино -NH2,
* гидроксил -OH,
* амино(C2-C12)алканоилокси -O-CO-(CH2)n1-NH2, где n1 представляет собой целое число от 2 до 12,
* дигидрокси(C3-C7)алканоилокси -O-CO-(CH2)n1-CHOH-CH2OH, где n1 представляет собой целое число от 3 до 7,
* гидрокси(C2-C6)алканоилокси -O-CO-(CH2)n1-OH, где n1 представляет собой целое число от 2 до 6,
* карбокси(C3-C6)алканоилокси -O-CO-(CH2)n1-COOH, где n1 представляет собой целое число от 3 до 6,
* оксо(C2-C5)алканоилокси -O-CO-(CH2)n1-CHO, где n1 представляет собой целое число от 2 до 5,
* [карбокси(C3-C6)алканоил]амино(C2-C12)алканоилокси -O-CO-(CH2)n1-NH-CO-(CH2)n2-COOH, где n1 представляет собой целое число от 3 до 6, и n2 представляет собой целое число от 2 до 12.
Изобретение более конкретно относится к способу, как определено выше, где:
* X выбран из следующих групп:
* -СООН,
* -O-P(O)(OH)2,
* -O-SO2(OH)
* -NH2,
* -CO-NH-(CH2)3-NH2 или -CONH-(CH2)6-NH2,
* -CO-NH-CH(COOH)-CH2-COOH,
* -CO-NH-CH(COOH)-(CH2)4-NH2,
* -O-CO-(CH2)5-NH2,
* и Y выбран из следующих групп:
* -O-P(O)(OH)2,
* -O-SO2(OH)
* -NH2,
* -OH,
* -O-CO-CH2-NH2 (2-аминоэтаноилокси), -O-CO-(CH2)2-NH2 (3-аминопропаноилокси), -O-CO-(CH2)5-NH2 (6-аминогексаноилокси) или -O-CO-(CH2)11-NH2 (12-аминододеканоилокси),
* -O-CO-(CH2)4-CHOH-CH2OH (6,7-дигидроксигептаноилокси),
* -O-CO-(CH2)5-OH (6-гидроксигексаноилокси),
* -O-CO-(CH2)2-COOH (3-карбоксипропаноилокси)
* -O-CO-(CH2)4-CHO (6-оксогексаноилокси),
* -O-CO-(CH2)5-NH-CO-(CH2)2-COOH (3-карбоксипропаноиламиногексаноилокси).
Изобретение более конкретно относится к способу, как определено выше, где R1 и R2 выбраны из:
-СО-СН2-С*Н[О-СО-(СН2)10-СН3]-(СН2)10-СН3, (3(C12O)C14),
-СО-СН2-С*НОН-(СН2)10-СН3, (3(НО)С14),
-СО-СН3, (С2),
-СО-СН2-NH-СО-С*Н[O-СО-(СН2)8-СН3]-(СН2)5-СН3, [2(C10O)C8]NC2),
-CO-C*H[О-CO-(CH2)4-CH3]-(CH2)5-CH3, (2(C6O)C8),
-CO-(CH2)16-CH3, (C18),
-СО-СН2-С*Н[О-СН2-С6Н5]-(СН2)10-СН3, (3(BnO)C14),
-СО-СН2-С*Н[O-Р(O)(ОН)2]-(СН2)10-СН3, (3[(ОН)2-Р(O)О]С14),
C* в упомянутых выше формулах соответствует асимметрическому атому углерода в конфигурации R, S, или в рацемической форме RS.
Изобретение более конкретно относится к способу, как определено выше, где:
- R1 выбран из:
-СО-СН2-С**1Н[O-СО-(СН2)10-СН3]-(СН2)10-СН3, (3(C12O)C14),
-CO-CH2-C**1HOH-(CH2)10-CH3, (3(HO)C14),
-СО-СН3, (С2),
-CO-CH2-NH-CO-C**1H[O-CO-(CH2)8-CH3]-(CH2)5-CH3, ([2(C10O)C8]NC2),
-CO-C**1H[О-CO-(CH2)4-CH3]-(CH2)5-CH3, (2(C6O)C8),
-CO-(CH2)16-CH3, (C18),
- R2 выбран из:
-СО-СН2-С**2Н[O-СО-(СН2)10-СН3]-СН2)10-СН3, (3(C12O)С14),
-CO-CH2-C**2HOH-(CH2)10-CH3, (3(HO)C14),
-СО-СН2-С**2Н[O-СН2-С6Н5]-(СН2)10-СН3, (3(BnO)C14),
-CO-CH2-C**2H[O-P(O)(OH)2]-(CH2)10-CH3, (3[(OH)2-P(O)O]C14).
C**1 и C**2 в упомянутых выше формулах соответствуют асимметрическим атомам углерода в конфигурации R, S, или в рацемической форме RS.
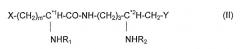
Изобретение также относится к способу, как определено выше, где вводимое соединение обладает общей формулой (II):
где X, Y, R1, R2 и m являются такими, как определено выше, C*1 находится в конфигурации R, S, или представляет собой рацемат RS, и C*2 находится в конфигурации R.
Изобретение более конкретно относится к способу, как определено выше, где вводимое соединение выбрано из таких формул (II), где:
- X=-O-P(O)(OH)2, Y=-O-P(O)(OH)2, R1=-CO-CH2-C**1H[O-CO-(CH2)10-CH3]-(CH2)10-CH3, R2=-CO-CH2-C**2HOH-(CH2)10-CH3, m=2, C*1 находится в конфигурации S, C*2 находится в конфигурации R, C**1 и C**2 находятся в конфигурации R, т.е. (3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-гидрокситетрадеканоиламино]декан-1,10-диол-1,10-бис-дигидрофосфат (OM-294-DP (S,R)),
- X = -O-P(O)(OH)2, Y = -O-CO-(CH2)4-CHOH-CH2OH, R1 = -CO-CH2-C**1H[O-CO-(CH2)10-CH3]-(CH2)10-CH3, R2 = -CO-CH2-C**2HOH-(CH2)10-CH3, m = 2, C*1 находится в конфигурации S, и C*2 находится в конфигурации R, C**1 и C**2 находятся в конфигурации R, т.е. (3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-гидрокситетрадеканоиламино]декан-1,10-диол-1-дигидрофосфат-10-(6,7-дигидроксигептаноат) (OM-197-MP-HD (S,R)),
- X = -COOH, Y = -O-CO-(CH2)4-CHOH-CH2OH, R1 = -CO-CH2-C**1H[O-CO-(CH2)10-CH3]-(CH2)10-CH3, R2 = -CO-CH2-C**2HOH-(CH2)10-CH3, m = 1, C*1 находится в конфигурации S, и C*2 находится в конфигурации R, C**1 и C**2 находятся в конфигурации R, т.е. N-[(R)-3-додеканоилокситетрадеканоил]-L-аспарагиновая кислота, α-N-{(4R)-5-гидрокси-4-[(R)-3-гидрокситетрадеканоиламино]пентил}амид-5-O-(6,7-дигидроксигептаноат) (OM-197-MC-HD (S,R)),
- X = -O-P(O)(OH)2, Y = -O-CO-(CH2)5-NH2, R1 = -CO-CH2-C**1H[O-CO-(CH2)10-CH3]-(CH2)10-CH3, R2 = -CO-CH2-C**2HOH-(CH2)10-CH3, m = 2, C*1 находится в конфигурации S, и C*2 находится в конфигурации R, C**1 и C**2 находятся в конфигурации R, т.е. (3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-гидрокситетрадеканоиламино]декан-1,10-диол-1-дигидрофосфат-10-(6-аминогексаноат) (OM-197-MP-AC (S,R)),
- X = -NH2, Y = -O-P(O)(OH)2, R1 = -CO-CH2-C**1H[O-CO-(CH2)10-CH3]-(CH2)10-CH3, R2 = -CO-CH2-C**2HOH-(CH2)10-CH3, m = 4, C*1 находится в конфигурации S, и C*2 находится в конфигурации R, C**1 и C**2 находятся в конфигурации R, т.е. (5S,11R)-1-амино-5-[(R)-3-додеканоилокситетрадеканоиламино]-6-оксо-7-аза-11-[(R)-3-гидрокситетрадеканоиламино]додекан-12-ол-12-дигидрофосфат (OM-294-BA-MP (S,R)).
Изобретение также относится к способу, как определено выше, лечения теплокровных животных, включая человека, страдающих заболеванием или расстройством, связанным со сверхпродукцией воспалительных цитокинов или маркеров воспалительного заболевания активированными T-лимфоцитами, моноцитами или антигенпрезентирующими клетками организма, где воспалительные цитокины или маркеры воспалительного заболевания относятся к группе, состоящей из IL-1β, IL-4, IL-5, IL-6, IL-8, IL-9, IL-13, IFN-γ, TNF-α и MCP-1.
Изобретение более конкретно относится к способу, как определено выше, где заболевание выбрано из группы, состоящей из астмы, диабета, атопического дерматита, аллергического ринита, простатита, воспалительного заболевания кишечника и ревматоидного артрита.
Изобретение также более конкретно относится к способу, как определено выше, который заключается во введении терапевтически эффективного количества любого соединения формулы (I) по изобретению, как определено выше, в фармацевтически приемлемом носителе, эксципиенте или композиции, посредством мукозального или парентерального способа введения.
Изобретение также более конкретно относится к способу, как определено выше, который заключается во введении терапевтически эффективного количества соединения формулы (I) по изобретению, как определено выше, предпочтительно посредством перитонеального, подкожного, перорального, интраназального, подъязычного или аэрозольного способов введения.
Изобретение более конкретно относится к устойчивым к действию желудочного сока фармацевтическим композициям, содержащим терапевтически эффективное количество соединения формулы (I), как определено выше, в сочетании с устойчивым к действию желудочного сока носителем, таким как поверхностно-активные вещества из гидрофильных полоксамеров, таких как полоксамер 407 (лутрол F-127). Коллоидные носители, такие как полимерные наночастицы или микрочастицы, также подходят в качестве композиций для пероральной доставки соединения формулы (I), в которых применяют кишечнорастворимые полимеры, такие как полимеры метакрилата.
В более общепринятом способе применение устойчивых к действию желудочного сока таблеток или капсул, полученных с использованием кишечнорастворимого покрытия, может также являться альтернативой при пероральном способе введения.
Изобретение также более конкретно относится к способу, как определено выше, где необходимые дозировки для человека иммуномодуляторных молекул формулы (I) по изобретению, как определено выше, варьируют от 0,01 до 50 мг/м2.
Изобретение также относится к применению, по меньшей мере, одного соединения формулы (I), как определено выше, для получения лекарственного средства для профилактики или лечения заболевания или расстройства, такого как астма, диабет, атопический дерматит, аллергический ринит, простатит, воспалительное заболевание кишечника и ревматоидный артрит, связанного со сверхпродукцией воспалительных цитокинов или маркеров воспалительного заболевания.
Изобретение также относится к соединениям формулы (I), как определено выше, и лекарственному средству, содержащему указанные соединения в сочетании с физиологически приемлемым носителем.
Соединения формулы (I) по настоящему изобретению, как определено выше, можно получать согласно способу, описанному в WO 00/00462 и WO 01/46127 в связи с получением и применением соединений формулы (I) при лечении форм рака или в качестве иммуноадъювантов.
Изобретение далее подробно описано в следующем описании синтеза соединений OM-294-DP (S,R), OM-197-MP-HD (S,R), OM-197-MC-HD (S,R), OM-197-MP-AC (S,R) и OM-294-BA-MP (S,R), и их биологических свойств.
ПРИМЕРЫ
ПРИМЕР 1
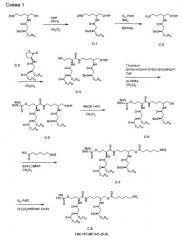
(3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-гидрокситетрадеканоиламино]декан-1,10-диол-1-дигидрофосфат-10-(6-аминогексаноат) (= OM-197-MP-AC (S,R)) (схема 1)
1. (2R)-5-(бензилоксикарбониламино)-2-[(R)-3-бензилокситетрадеканоиламино]-1-(2-тетрагидропиранилокси)пентан (C-1)
К раствору (2R)-5-(бензилоксикарбониламино)-2-[(R)-3-бензилокситетрадеканоиламино]пентан-1-ола (PCT WO 00146127A1) (2,5 г; 4,39 ммоль) в безводном CH2Cl2 (83 мл) при комнатной температуре и в атмосфере аргона добавляли последовательно 3,4-дигидро-2H-пиран (DHP) (1,4 мл, 15,38 ммоль), затем пиридиний-p-толуолсульфонат (PPTS) (441 мг, 1,75 ммоль). Раствор перемешивали в течение 18 час при комнатной температуре, затем разводили при помощи CH2Cl2 (100 мл), промывали 5% водным NaHCO3, затем H2O. Органическую фазу сушили над MgSO4, фильтровали и концентрировали. Очисткой флэш-хроматографией на силикагеле (AcOEt/петролейный эфир 4/1) получали соединение C-1 (2,86 г; 100%) в виде белого кристаллического твердого вещества. (Rf = 0,66 в AcOEt/петролейный эфир 4/1; УФ и фосфомолибдат.)
C39H60N2O6. IS/MS: m/z 653,5 ([M+H]+), 675,5 ([M+Na]+). Температура плавления = 84-86°C
2. (2R)-5-амино-2-[(R)-3-бензилокситетрадеканоиламино]-1-(2-тетрагидропиранилокси)пентан (C-2)
Раствор соединения C-1 (2,5 г; 4,4 ммоль) в EtOH (150 мл), содержащий триэтиламин (4 мл), гидрогенизировали в присутствии 10% Pd на C при комнатной температуре и при атмосферном давлении водорода в течение 3,5 час. Катализатор затем удаляли фильтрованием, промывали этанолом, и фильтрат концентрировали и сушили в условиях высокого вакуума с получением чистого амина C-2 (2,15 г; 96%) в виде аморфного белого твердого вещества. C31H54N2O4. IS/MS: m/z 519,5 ([M+H]+).
3. (S)-α-[(R)-3-додеканоилокситетрадеканоиламино]-γ-бутиролактон (C-3)
К раствору (R)-3-додеканоилокситетрадекановой кислоты [Bull. Chem. Soc. Jpn 60 (1987), 2205-2214] (2,16 г; 5,1 ммоль) в безводном THF (28 мл) при -15°C и в атмосфере аргона добавляли последовательно N-метилморфолин (0,56 мл; 5,1 ммоль; 1 экв.) и изобутилхлорформиат (657 мкл; 5,1 ммоль; 1 экв.). После 1 час при перемешивании при -15°C добавляли L-гомосеринлактонгидробромид (916 мг; 5,1 ммоль; 1 экв.) в виде раствора в 0,72 М водного NaHCO3 (14 мл, 2 экв.). Реакционную смесь перемешивали в течение 20 час при комнатной температуре. Смесь разводили Et2O (130 мл), органическую фазу отделяли и промывали H2O, затем сушили над MgSO4, фильтровали и концентрировали. Очисткой путем кристаллизации (минимальный объем CH2Cl2 и избыток пентана при 0°C) получали соединение C-3 (2,17 г; 85%) в виде белого твердого вещества. C30H55NO5. IS/MS: m/z 510,5 ([M+H]+), 532,5 ([M+Na]+). Температура плавления = 79-80°C.
4. (3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-бензилокситетрадеканоиламино]-10-(2-тетрагидропиранил)оксидекан-1-ол (C-4)
К раствору соединения C-2 (638 мг, 1,23 ммоль, 1,3 экв.) в безводном CH2Cl2 (1,5 мл) при 20-21°C добавляли соединение C-3 (483 мг, 0,95 ммоль). Раствор перемешивали в течение 3 суток при 20-21°C; растворитель выпаривали при пониженном давлении. Очисткой флэш-хроматографией на силикагеле (CH2Cl2/ацетон от 5/1 до 1/1) получали спирт C-4 (829 мг, 85%) в виде белого твердого вещества. C61H109N3O9. IS/MS: m/z 1029,0 ([M+H]+), 1051,0 ([M+Na]+). Температура плавления = 81-82°C.
5. (3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-бензилокситетрадеканоиламино]-10-(2-тетрагидропиранил)оксидекан-1-ол-дибензилфосфат (C-5)
К раствору спирта C-4 (120 мг; 0,12 ммоль) и 1H-тетразола (25 мг; 0,35 ммоль; 3 экв.) в безводном THF (5 мл) при комнатной температуре и в атмосфере аргона добавляли N,N-дибензилдиэтилфосфорамидит (85%, 95 мкл; 0,27 ммоль; 2,3 экв.). После 45 мин при перемешивании реакционную смесь охлаждали до -40°C, затем добавляли раствор mCPBA (57-86%; 75 мг; 0,43 ммоль; 3,7 экв.) в CH2Cl2 (3 мл). После 45 мин при -40°C смесь нагревали, и добавляли насыщенный раствор Na2S2O3 (3 мл), и смесь перемешивали в течение 10 мин. Раствор разводили эфиром, органическую фазу отделяли и промывали насыщенным Na2S2O3 (5x), затем насыщенным NaHCO3 (2x). Органическую фазу сушили над MgSO4, фильтровали и концентрировали. Очисткой флэш-хроматографией на силикагеле (CH2Cl2/ацетон 4/1, затем 2/1) получали дибензилфосфат C-5 (126 мг; 84%) в виде аморфного твердого вещества.
6. (3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-бензилокситетрадеканоиламино]декан-1,10-диол-1-дибензилфосфат (C-6)
К 1% раствору HCl в метаноле (25 мл) при 0°C добавляли раствор соединения C-5 (700 мг, 0,54 ммоль) в CH2Cl2 (2,5 мл). После 45 мин при перемешивании при 0°C реакционную смесь нейтрализовали 5% водным NaHCO3, разводили при помощи CH2Cl2, затем отделяли органическую фазу. Водную фазу экстрагировали при помощи CH2Cl2 (3x), затем органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали с получением спирта C-6 (640 мг; 98%).
7. (3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-бензилокситетрадеканоиламино]декан-1,10-диол-1-дибензилфосфат-10-6-бензилоксикарбониламиногексаноат (C-7)
К полученному выше раствору соединения C-6 (640 мг, 0,53 ммоль) и 6-(бензилоксикарбониламино)гексановой кислоты (423 мг, 1,60 ммоль) в безводном CH2Cl2 (25 мл) при 0°C и в атмосфере аргона добавляли последовательно коммерчески доступный 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (306 мг, 1,60 ммоль) и 4-диметиламинопиридин (20 мг, 160 мкмоль). Реакционную смесь затем перемешивали в течение 30 минут при 0°C и затем в течение ночи при комнатной температуре. Реакционную среду затем промывали водой и раствором 1 Н HCl с последующим разделением слоев. Органический слой сушили над MgSO4, фильтровали и выпаривали. Проведением очистки флэш-хроматографией на силикагеле (элюент CH2Cl2/ацетон 4/1, затем 2/1), получали продукт реакции сочетания C-7 (537 мг; 71%). 13C-ЯМР (62,89 МГц, CDCl3), δ м.д.: 173,18, 171,16, 170,38, 169,60, 156,30, 138,23, 136,50, 135,38, 135,28, 128,42, 128,26, 128,17, 127,79, 127,74, 127,44, 76,48, 71,15, 70,84, 69,47, 69,39, 69,31, 66,25, 65,62, 64,37, 49,78, 47,76, 41,41, 41,34, 40,57, 38,97, 34,22, 34,16, 33,96, 33,57, 32,95, 31,70, 29,15, 28,95, 28,32, 25,87, 25,46, 25,02, 28,80, 24,18, 22,49, 13,94.
8. (3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-гидрокситетрадеканоиламино]декан-1,10-диол-1-дигидрофосфат-10-(6-аминогексаноат) (C-8) (= OM-197-MP-AC (S,R))
Раствор соединения C-7 (500 мг, 0,35 ммоль) в смеси CH2Cl2/этанол 5/2 (70 мл), содержащей уксусную кислоту (10 мл), гидрогенизировали в присутствии Pd на углероде, содержащем 10% Pd, при комнатной температуре и при атмосферном давлении водорода в течение 12-24 часов. Катализатор удаляли фильтрованием. Фильтрат выпаривали до сухого состояния и осадок затем сушили отсасыванием вакуумным насосом с получением C-8 (368 мг, количественный выход). ES/MS: отношение m/z 1047,9 [M+H]+; 1069,8.
ПРИМЕР 2
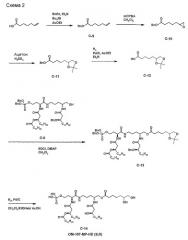
(3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-гидрокситетрадеканоиламино]декан-1,10-диол-1-дигидрофосфат-10-(6,7-дигидроксигептаноат) (= OM-197-MP-HD (S,R)) (схема 2)
1. Бензил-6-гептеноат (C-9)
К раствору 6-гептеновой кислоты (4,71 г, 36,75 ммоль) в AcOEt (80 мл) при 0°C последовательно добавляли триэтиламин (15,3 мл, 110,24 ммоль), бензилбромид (13,1 мл, 110,24 ммоль) и Bu4NI (6,79 г, 18,37 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 час и концентрировали в вакууме. Осадок отбирали в AcOEt, органическую фазу промывали насыщенным водным NaHCO3 и H2O. Органическую фазу сушили над MgSO4 и растворитель удаляли в вакууме. Флэш-хроматографией осадка на силикагеле (н-гептан/EtOAc, 9:1) получили соединение C-9 (6,00 г; 75%) в виде бесцветного масла. 13C-ЯМР (62,89 МГц, CDCl3): 24,42, 28,34, 33,37, 34,13, 66,08, 114,73, 128,19, 128,55, 136,16, 138,37, 173,43.
2. Бензил-6,7-эпоксигептаноат (C-10)
К раствору m-CPBA (2,76 г, 12,29 ммоль) в CH2Cl2 (50 мл) при 0°C медленно добавляли раствор C-9 (1,79 г, 8,19 ммоль) в CH2Cl2 (20 мл). Раствор перемешивали при 0°C в течение 2 час, затем при комнатной температуре в течение 18 час. Раствор разводили с помощью CH2Cl2, и органическую фазу промывали насыщенным водным раствором Na2S2O3 (5x). Органическую фазу сушили над MgSO4 и растворитель удаляли в вакууме. Флэш-хроматографией осадка на силикагеле (н-гептан/EtOAc, 5:1) получили соединение C-10 (1,54 г; 80%) в виде бесцветного масла. 13C-ЯМР (62,89 МГц, CDCl3): 24,60, 25,39, 32,00, 34,02, 46,86, 51,91, 66,04, 128,11, 128,46, 136,01, 173,17.
3. Бензил-6,7-изопропилиденгептаноат (C-11)
К раствору C-10 (1,54 г, 6,59 ммоль) в ацетоне (50 мл) при комнатной температуре добавляли серную кислоту (0,42 мл, 7,9 ммоль). Раствор перемешивали в течение 3 час, разводили диэтиловым эфиром, и органическую фазу промывали насыщенным водным раствором NaHCO3, органическую фазу сушили над MgSO4 и растворитель удаляли в вакууме с получением C-11 (1,73 г) в виде бледно-желтого масла, которое использовали на следующей стадии без дополнительной очистки.
4. 6,7-изопропилиденгептановая кислота (C-12)
Раствор соединения C-11 (1,53 г) в EtOAc (20 мл), содержащий Et3N (3,65 мл, 26,16 ммоль), гидрогенизировали в присутствии Pd на углероде, содержащем 10% Pd, при комнатной температуре и при атмосферном давлении водорода в течение 3 час. Катализатор удаляли фильтрованием и фильтрат выпаривали до сухого состояния. Флэш-хроматографией осадка на силикагеле (CH2Cl2/MeOH, 5:1) получили соединение C-12 (0,63 г; 54% с 2 стадий) в виде бесцветного масла.
5. (3S, 9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-бензилокситетрадеканоиламино]декан-1,10-диол-1-дибензилфосфат-10-(6,7-изопропилиденгептаноат) (C-13)
К раствору полученного выше соединения C-6 (248 мг, 0,21 ммоль) и соединения 6,7-изопропилиденгептановой кислоты (C-12) (92 мг, 0,45 ммоль) в безводном CH2Cl2 (5 мл) при 0°C и в атмосфере аргона добавляли последовательно коммерчески доступные 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (91 мг, 0,47 ммоль) и 4-диметиламинопиридин (каталитический). Реакционную смесь затем перемешивали в течение 30 минут при 0°C и затем в течение ночи при комнатной температуре. Реакционную среду затем промывали водой и раствором 1 Н HCl с последующим разделением слоев. Органический слой сушили над MgSO4, фильтровали и выпаривали. Проведением очистки флэш-хроматографией на силикагеле (CH2Cl2/MeOH, 99:1) получали продукт реакции сочетания C-13 (240 мг; 83%). ES/MS: m/z 1390 [M+H]+; 1411 [M+Na]+.
6. (3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-гидрокситетрадеканоиламино]декан-1,10-диол-1-дигидрофосфат-10-(6,7-дигидроксигептаноат) (C-14) (= OM-197-MP-HD (S,R))
Раствор соединения C-13 (180 мг, 0,13 ммоль) в смеси CH2Cl2/этанол 5/2 (21 мл), содержащей уксусную кислоту (3 мл), гидрогенизировали в присутствии Pd на углероде, содержащем 10% Pd, при комнатной температуре и при атмосферном давлении водорода в течение 12-36 часов. Катализатор удаляли фильтрованием. Фильтрат выпаривали до сухого состояния и осадок затем сушили отсасыванием вакуумным насосом с получением C-14 (139 мг, количественный выход). ES/MS: m/z 1079 [M+H]+; 1101 [M+Na]+.
ПРИМЕР 3
(3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-гидрокситетрадеканоиламино]декан-1,10-диол-1,10-бис-дигидрофосфат (= OM-294-DP (S,R)) (схема 3)
1. (3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-бензилокситетрадеканоиламино]декан-1,10-диол (C-15)
К раствору (2R)-5-амино-2-[(R)-3-бензилокситетрадеканоиламино]пентан-1-ола (PCT WO 00146127A1) (8 г, 18,4 ммоль) в безводном CH2Cl2 (60 мл) при 25°C добавляли соединение C-3 (9 г, 17,5 ммоль) в безводном CH2Cl2 (28 мл). Раствор перемешивали в течение 3 суток при 20-21°C. Суспензию разводили при помощи CH2Cl2 (66 мл) и нагревали до 30°C с получением прозрачного раствора. Ацетонитрил (320 мл) медленно добавляли к раствору. Раствор охлаждали до 20°C и перемешивали в течение 2 час. Осадок фильтровали, промывали ацетонитрилом и сушили под действием вакуума, получая C-15 (13,7 г, 83%) в виде белого твердого вещества. Температура плавления = 103°C.
2. (3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-бензилокситетрадеканоиламино]декан-1,10-диол-1,10-бис-дибензилфосфат (C-16)
К раствору C-15 (1,02 г; 1,08 ммоль) и 1H-тетразола (454 мг; 6,48 ммоль; 6 экв.) в безводном THF (46 мл) при комнатной температуре и в атмосфере аргона добавляли N,N-дибензилдиэтилфосфорамидит (85%, 1,50 мл; 4,97 ммоль; 4,6 экв.). После 30 мин при перемешивании реакционную смесь охлаждали до -20°C, затем добавляли раствор mCPBA (57-86%; 1,32 г; 7,67 ммоль; 7,4 экв.) в CH2Cl2 (30 мл). После 45 мин при -20°C раствор нагревали до 0°C и добавляли насыщенный раствор Na2S2O3 (25 мл), и смесь перемешивали в течение 10 мин. Раствор разводили эфиром, органическую фазу отделяли и промывали насыщенным Na2S2O3 (5x), затем насыщенным NaHCO3 (2x). Органическую фазу сушили над MgSO4, фильтровали и концентрировали. Очисткой флэш-хроматографией на силикагеле (CH2Cl2/ацетон 4/1, затем 3/1) получали C-16 (1,38 г; 87%) в виде бесцветного масла.
3. (3S,9R)-3-[(R)-3-додеканоилокситетрадеканоиламино]-4-оксо-5-аза-9-[(R)-3-гидрокситетрадеканоиламино]декан-1,10-диол-1,10-бис-дигидрофосфат (C-17) (= OM-294-DP (S,R))
Раствор соединения C-16 (2,7 г, 1,84 ммоль) в изопропаноле (150 мл) гидрогенизировали над 10% Pd на C (320 мг) при комнатной температуре и при атмосферном давлении водорода в течение 3 часов. Катализатор удаляли фильтрованием через миллипоровую мембрану. Фильтрат концентрировали и сушили в условиях высокого вакуума с получением C-17 (1,8 г; 98%) в виде аморфного твердого вещества.
ПРИМЕР 4
N-[(R)-3-додеканоилокситетрадеканоиламино]-L-аспарагиновая кислота, α-N-{(4R)-5-гидрокси-4-[(R)-3-гидрокситетрадеканоиламино]пентил}амид-5-O-(6,7-дигидроксигептаноат) (=OM-197-MC-HD (S,R)) (схема 4)
1. N-[(R)-3-додеканоилокситетрадеканоиламино]-L-аспарагиновая кислота, α-N-{(4R)-5-гидрокси-4-[(R)-3-гидрокситетрадеканоиламино]пентил}амид-β-бензиловый эфир, 5-O-(6,7-изопропилиденгептаноат) (C-18)
К раствору соединения N-[(R)-3-додеканоилокситетрадеканоиламино]-L-аспарагиновой кислоты, α-N-{(4R)-5-гидрокси-4-[(R)-3-бензилокситетрадеканоиламино]пентил}амид-β-бензилового эфира (PCT WO 00146127A1) (1,14 г, 1,09 ммоль) и соединения 6,7-изопропилиденгептановой кислоты (C-12) (487 мг, 2,48 ммоль) в безводном CH2Cl2 (30 мл) при 0°C и в атмосфере аргона добавляли последовательно коммерчески доступные 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (485 мг, 2,53 ммоль) и 4-диметиламинопиридин (43 мг, 0,35 ммоль). Реакционную смесь затем перемешивали в течение 30 минут при 0°C и затем в течение ночи при комнатной температуре. Реакционную среду затем промывали водой и раствором 1 Н HCl с последующим разделением слоев. Органический слой сушили над MgSO4, фильтровали и выпаривали. Проведением очистки флэш-хроматографией на силикагеле (CH2Cl2/ацетон, 9:1) получали продукт реакции сочетания C-18 (1,20 г; 76%) в виде белого твердого вещества. ES/MS: m/z 1255 [M+Na]+.
2. N-[(R)-3-додеканоилокситетрадеканоиламино]-L-аспарагиновая кислота, α-N-{(4R)-5-гидрокси-4-[(R)-3-гидрокситетрадеканоиламино]пентил}амид-5-O-(6,7-дигидроксигептаноат) (C-19) (= OM-197-MC-HD (S,R))
Раствор соединения C-18 (1,20 г, 0,97 ммоль) в смеси CH2Cl2/этанол 2/1 (50 мл), содержащей уксусную кислоту (5 мл), гидрогенизировали в присутствии Pd на углероде, содержащем 10% Pd, при комнатной темп