Пептиды тем8 и содержащие их вакцины
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложены пептиды, представляющие собой Т-клеточные эпитопы эндотелиального маркера опухоли (ТЕМ8), которые способны индуцировать цитотоксические Т-лимфоциты (CTL) в присутствии антиген-презентирующих клеток или экзосом, несущих или содержащих HLA-A*0201. Предложена фармацевтическая композиция для уничтожения клеток, экспрессирующих ТЕМ8, выделенные экзосома и антиген-презентирующая клетка, несущие комплекс, содержащий пептид по изобретению с молекулой HLA-A*0201. Рассмотрены способы индукции антиген-презентирующей клетки, которые могут индуцировать CTL, которые уничтожают клетки, экспрессирующие ТЕМ8, и индукции цитотоксических клеток. Предложенное изобретение может найти дальнейшее применение в лечении рака. 8 н. и 2 з.п. ф-лы, 5 ил., 3 табл.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки США № 60/911194, поданной 11 апреля 2007 года, полное описание которой, таким образом, приведено в настоящем документе в качестве ссылки для всех целей.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к биологии, более конкретно, к области злокачественных новообразований. В частности, настоящее изобретение относится к пептидам TEM8, которые невероятно эффективны в качестве противораковых вакцин, а также к лекарственным средствам для лечения и профилактики опухолевых заболеваний.
Предшествующий уровень техники
Было показано, что CD8-позитивные цитотоксические Т-лимфоциты (CTL) распознают эпитопы пептидов опухоле-ассоциированных антигенов (ОАА), представленные на молекуле главного комплекса гистосовместимости (MHC) класса I, после чего уничтожают опухолевые клетки. С момента открытия семейства меланомных антигенов (MAGE) в качестве первого примера ОАА, при помощи различных иммунологических подходов было идентифицировано большое число других ОАА (Boon T, Int J Cancer 1993 May 8, 54(2): 177-80; Boon T & van der Bruggen P, J Exp Med 1996 Mar 1, 183(3): 725-9), и некоторые из этих ОАА в настоящее время проходят клинические исследования в качестве мишеней для иммунотерапевтических препаратов.
Идентификация новых ОАА, индуцирующих мощный специфический противоопухолевый иммунный ответ, обеспечивает возможность дальнейшего клинического использования различных стратегий пептидной вакцинации в различных типах злокачественных новообразований (Harris CC, J Natl Cancer Inst 1996 Oct 16, 88(20): 1442-55; Butterfield LH et al., Cancer Res 1999 Jul 1, 59(13): 3134-42; Vissers JL et al., Cancer Res 1999 Nov 1, 59(21): 5554-9; van der Burg SH et al., J Immunol 1996 May 1, 156(9): 3308-14; Tanaka F et al., Cancer Res 1997 Oct 15, 57(20): 4465-8; Fujie T et al., Int J Cancer 1999 Jan 18, 80(2): 169-72; Kikuchi M et al., Int J Cancer 1999 May 5, 81(3): 459-66; Oiso M et al., Int J Cancer 1999 May 5, 81(3): 387-94). На сегодняшний день было опубликовано несколько клинических исследований с использованием этих пептидов опухоле-ассоциированных антигенов. К сожалению, до настоящего момента, наблюдаемый в исследованиях этих противораковых вакцин уровень объективных клинических ответов был низким (Belli F et al., J Clin Oncol 2002 Oct 15, 20(20): 4169-80; Coulie PG et al., Immunol Rev 2002 Oct, 188: 33-42; Rosenberg SA et al., Nat Med 2004 Sep, 10(9): 909-15).
Одной из возможных причин подобного отсутствия эффективности может быть потеря или ингибирование уровня экспрессии антигена лейкоцитов человека (HLA) класса I опухолевыми клетками, что часто происходит в солидных опухолях и значительно снижает эффективность Т-клеточного противоопухолевого ответа (Cormier JN et al., Int J Cancer 1998 Feb 9, 75(4): 517-24; Hicklin DJ et al., Mol Med Today 1999 Apr, 5(4): 178-86; Paschen A et al., Int J Cancer 2003 Mar 1, 103(6): 759-67). Даже в том случае, если противораковая вакцина на основе опухоле-ассоциированных антигенов индуцирует эффективные цитотоксические Т-лимфоциты (CTL), то такие CTL неспособны распознать клетки-мишени, поскольку последние не экспрессируют молекулы HLA класса I на достаточном уровне.
Опухолевый ангиогенез является важным фактором, связанным с прогрессией опухолей. Ранее уже была показана возможность разработки эффективной вакцины, направленной на опухолевый ангиогенез, при помощи подхода, основанного на использовании эндотелиальных клеток, при котором в качестве мишеней используются рецепторы васкулярно-эндотелиального фактора роста (VEGFR) 1 и 2, как молекулы HLA класса I, которые не ингибируются на эндотелиальных клетках (Wada S et al., Cancer Res 2005 Jun 1, 65(11): 4939-46; Ishizaki H et al., Clin Cancer Res 2006 Oct 1, 12(19): 5841-9). Более того, так как эти терапевтические мишени являются независимыми от опухоли, то уничтожение эндотелиальных клеток сосудов микроокружения опухоли может оказаться эффективным для широкого спектра злокачественных новообразований. Более того, эндотелиальные клетки опухоли являются легкодоступными для лимфоцитов, находящихся в кровотоке, и CTL могут непосредственно повреждать эндотелиальные клетки, не проникая в ткани каких-либо других типов. Помимо этого, лизис даже небольшого количества эндотелиальных клеток сосудистой сети опухоли приводит к нарушению целостности сосудов, что в свою очередь ведет к ингибированию роста большого числа опухолевых клеток (Folkman J, Nat Med 1995 Jan, 1(1): 27-31). Таким образом, эндотелиальные клетки опухоли представляют собой отличную мишень для противораковой иммунотерапии. Для подавления опухолевого ангиогенеза при помощи специфического и эффективного CTL-ответа, среди молекул, вовлеченных в процесс ангиогенеза, следует выбрать подходящую мишень.
Было обнаружено, что экспрессия эндотелиальных маркеров опухоли (TEM), в том числе TEM8, специфически повышена в опухоле-ассоциированном эндотелии по сравнению с нормальной тканью (St Croix B et al., Science 2000 Aug 18, 289(5482): 1197-202). Транскрипт TEM8 экспрессируется в опухолях легких и головного мозга, а также в метастатических опухолях печени. Терапия, направленная на TEM, может использоваться в отношении широкого спектра опухолей. Например, в патентной заявке WO2005/048943 предлагается использовать вакцины, содержащие вектор, кодирующий внеклеточный домен TEM8, в сочетании с вектором, кодирующим опухоле-ассоциированный антиген. Однако в вышеупомянутом документе не приводится никаких доказательств того, что введение в состав вакцины вектора, экспрессирующего TEM8, приводит к индукции CTL против опухоле-ассоциированного эндотелия и никакой информации о локализации эпитопов в пределах TEM8.
Раскрытие изобретения
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Улучшение показателей клинической эффективности противораковой терапии, направленной на разрушение опухолевого микроокружения, и в частности, терапии, направленной на подавление опухолевого ангиогенеза, является важной задачей. В фокусе настоящего изобретения находятся кровеносные сосуды опухоли в качестве мишени для противоопухолевой иммунотерапии. В частности, настоящее изобретение относится к использованию маркера опухолевого эндотелия 8 (TEM8) (№ NP_115584 по базе данных GenBank (SEQ ID NO:76), кодируемого геном № NM_032208 по базе данных GenBank (SEQ ID NO:75)), поскольку считается, что TEM8 экспрессируется сосудами широкого спектра опухолей. Настоящее изобретение относится к белковым продуктам гена TEM8, содержащим эпитопы пептидов, вызывающие специфический CTL-ответ на соответствующие молекулы. Периферические мононуклеарные клетки (PBMC), полученные из крови здорового донора, были простимулированы кандидатными в отношении связывания с молекулами HLA-A*2402 или HLA-A*0201 пептидами, полученными из TEM8. Настоящее изобретении, кроме того, относится к стабильным линиям CTL, специфически распознающим HLA-A24 или HLA-A02 - позитивные клетки-мишени, нагруженные соответствующими кандидатными пептидами, а также HLA-A24 или HLA-A02 - рестрицированным эпитопам пептидов, способным индуцировать мощный и специфический иммунный ответ на экспрессируемый в кровеносных сосудах опухоли TEM8. Приведенные результаты демонстрируют высокую иммуногенность TEM8, и соответствующие эпитопы представляют собой эффективные мишени для противоопухолевой иммунотерапии.
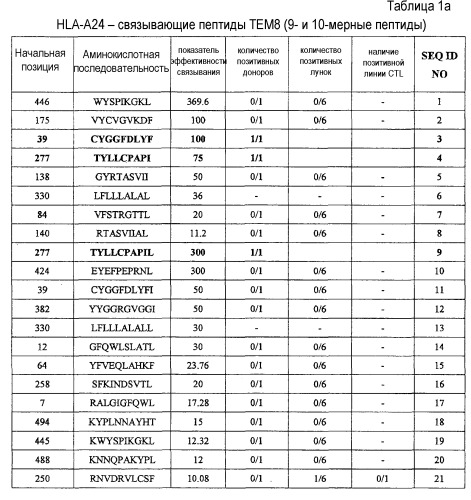
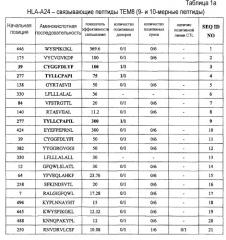
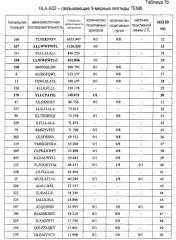
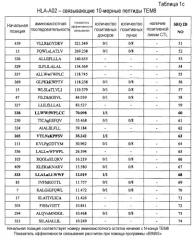
Таким образом, настоящее изобретение относится к выделенному нона- или декапептиду, способному к индукции цитотоксических Т-клеток, где указанный нонапептид или декапептид, содержит аминокислотную последовательность, выбранную из аминокислотной последовательности SEQ ID NO:76. В частности, настоящее изобретение относится к пептидам, содержащим аминокислотную последовательность, выбранную из группы SEQ ID NO: 3, 4, 9, 23, 25, 30, 60, 63 и 68, способным к индукции CTL. Пептиды по настоящему изобретению включают пептиды, в которых замещены или добавлены одна, две или более аминокислот, при условии, что эти модифицированные пептиды сохраняют изначальную способность исходного пептида индуцировать CTL.
При введении индивиду, пептиды по настоящему изобретению презентируются на поверхности антиген-экспрессирующих клеток, после чего индуцируют CTL, специфически распознающие соответствующие пептиды. Таким образом, настоящее изобретение, в соответствии с одним из его аспектов, также относится к антиген-презентирующим клеткам и экзосомам, презентирующим любой из пептидов по настоящему изобретению, а также к способам индукции антиген-презентирующих клеток.
Противоопухолевый иммунный ответ индуцируется путем введения полипептидов ТЕМ8 по настоящему изобретению или кодирующих эти полипептиды полинуклеотидов, а также экзосом и антиген-презентирующих клеток, презентирующих полипептиды TEM8. Таким образом, настоящее изобретение относится к фармацевтическим средствам, содержащим в качестве активных ингредиентов полипептиды по настоящему изобретению или кодирующие их полинуклеотиды, а также экзосомы и антиген-презентирующие клетки. Фармацевтические средства по настоящему изобретению могут использоваться в качестве вакцин.
Далее, настоящее изобретение относится к способам лечения и/или профилактики (т.е. предотвращения) злокачественных новообразований (опухолей) и/или профилактики послеоперационного рецидивирования этих опухолей, а также к способам индукции CTL, способам индукции иммунного ответа против опухоле-ассоциированного эндотелия и противоопухолевого иммунитета, включающим введение полипептидов TEM8, полинуклеотидов, кодирующих полипептиды TEM8, экзосом или антиген-презентирующих клеток, презентирующих полипептиды ТЕМ8 или фармацевтических средств по настоящему изобретению.
Помимо этого, CTL, специфически распознающие полипептиды TEM по настоящему изобретению, усиливают иммунный ответ против опухоле-ассоциированного эндотелия. В связи с этим, настоящее изобретение также относится к CTL, специфически распознающим полипептиды TEM по настоящему изобретению. CTL по настоящему изобретению также могут использоваться в качестве противораковых вакцин.
Нижеследующее краткое описание и подробное описания изобретения приведены лишь на примерах отдельных вариантов осуществления и не ограничивают объем изобретения и не исключают наличия альтернативных вариантов.
Краткое описание графического материала
На фигуре 1 изображены фотографии, демонстрирующие результаты IFN-γ ELISPOT-анализа CTL, индуцированных пептидами TEM8. CTL в лунках #5 и #6 на панели «а», стимулированные TEM8-A24-9-39 (SEQ ID NO:3); в лунке #6 на панели «b», стимулированные TEM8-A24-9-277 (SEQ ID NO:4); в лунке #3 на панели «с», стимулированные TEM8-A24- 10-277 (SEQ ID NO:9); в лунке #3 на панели «d», стимулированные TEM8-A02-9-337 (SEQ ID NO:23); в лунке #6 на панели «е», стимулированные TEM8-A02-9-338 (SEQ ID NO:25); в лунке #3 на панели «f», стимулированные TEM8-A02-9-278 (SEQ ID NO:30); в лунке #2 на панели «g», стимулированные TEM8-A02-10-338 (SEQ ID NO:60); в лунке #5 на панели «h», стимулированные TEM8-A02-10-265 (SEQ ID NO:63); и в лунке #4 на панели «i», стимулированные TEM8-A02-10-333 (SEQ ID NO:68), демонстрировали высокую продукцию IFN-γ по сравнению с контролем. Напротив, специфической продукции IFN-γ не было обнаружено в типичном случае отсутствия индукции CTL при стимуляции последних клетками-мишенями, нагруженными пептидом TEM8-A02-9-207 (SEQ ID NO:46) (j). Большая часть прогнозированных пептидов не демонстрировала индукции CTL, поэтому в фокусе настоящего изобретения находятся лишь положительные результаты (наличие индукции CTL). Рамки на вышеописанных рисунках указывают на лунки, содержавшие клетки, в дальнейшем выведенные в стабильные линии CTL. Знак «+» относится к продукции IFN-γ, стимулированными клетками-мишенями, нагруженными подходящим пептидом, знак «-» - к продукции IFN-γ, стимулированными клетками-мишенями, не нагруженными никакими пептидами.
На фигуре 2 приведены линейные диаграммы, демонстрирующие результаты выведения линий CTL, стимулированных пептидами TEM8-A24-9-39 (SEQ ID NO:3) (a), TEM8-A24-9-277 (SEQ ID NO:4) (b), TEM8-A24-10-277 (SEQ ID NO:9) (c), TEM8-A02-9-337 (SEQ ID NO:23) (d), TEM8-A02-9-338 (SEQ ID NO:25) (e), TEM8-A02-9-278 (SEQ ID NO:30) (f), TEM8-A02-10-338 (SEQ ID NO:60) (g), TEM8-A02-10-265 (SEQ ID NO:63) (h) и TEM8-A02-10-333 (SEQ ID NO:68) (i) (данные IFN-γ ELISA-анализа). Данный анализ продемонстрировал, что клеточные линии CTL, выведенные путем стимуляции CTL каждым из вышеуказанных пептидов, демонстрируют высокую продукцию IFN-γ по сравнению с контролем. Напротив, специфической продукции IFN-γ не было обнаружено в типичном случае «негативной» клеточной линии, выведенной путем стимуляции CTL клетками-мишенями, нагруженными пептидом TEM8-A02-9-207 (SEQ ID NO:46) (j). Знак «+» относится к продукции IFN-γ CTL, стимулированными клетками-мишенями, нагруженными подходящим пептидом, знак «-» - к продукции IFN-γ CTL, стимулированными клетками-мишенями, не нагруженными никакими пептидами.
На фигуре 3 приведены линейные диаграммы, демонстрирующие результаты выведения клонов CTL, стимулированных пептидами TEM8-A24-9-277 (SEQ ID NO:4) (a) TEM8-A24-10-277 (SEQ ID NO:9) (b), TEM8-A02-9-337 (SEQ ID NO:23) (c), TEM8-A02-9-338 (SEQ ID NO:25) (d) и TEM8-A02-10-265 (SEQ ID NO:63) (e). Клоны CTL, выведенные путем стимуляции CTL каждым из вышеуказанных пептидов, демонстрируют высокую продукцию IFN-γ при стимуляции клетками-мишенями, нагруженными соответствующими пептидами. Напротив, в случае стимуляции CTL клетками-мишенями, не нагруженными никакими пептидами, продукции IFN-γ не наблюдалось. Знак «+» относится к продукции IFN-γ CTL, стимулированными клетками-мишенями, нагруженными подходящим пептидом, знак «-» - к продукции IFN-γ CTL, стимулированными клетками-мишенями, не нагруженными никакими пептидами.
На фигуре 4 приведены линейные диаграммы, демонстрирующие специфическую CTL-активность против клеток-мишеней, эндогенно экспрессирующих TEM8 и HLA-A*2402 или HLA-A*0201. В качестве контролей использовались клетки COS7, трансфецированные полноразмерным геном TEM8, либо трансфецированные соответствующим геном HLA и нагруженные нерелевантным пепидом TEM8. (a) Клон CTL, полученный путем стимуляции пептидом TEM8-A24-9-277 (SEQ ID NO:4) демонстрирует высокую и специфичную CTL-активность в отношении клеток COS7, трансфецированных TEM8 и HLA-A24 (закрашенные ромбами). Напротив, в отношении клеток-мишеней, экспрессирующих HLA-A*2402 (незакрашенные треугольники) или TEM8 (незакрашенные круги) по отдельности, не было обнаружено сколь-нибудь значимой CTL-активности. (b) Клон CTL, полученный путем стимуляции пептидом TEM8-A02-10-265 (SEQ ID NO:63) демонстрирует высокую и специфичную CTL-активность в отношении клеток COS7, трансфецированных TEM8 и HLA-A24 (закрашенные ромбами). Напротив, в отношении клеток-мишеней, экспрессирующих HLA-A*0201 (незакрашенные треугольники) или TEM8 (незакрашенные круги) по отдельности, не было обнаружено сколь-нибудь значимой CTL-активности
На фигуре 5 приведены данные по in vivo иммуногенности и противоопухолевым эффектам вакцинации с использованием пептида TEM8-A24-9-277. (a) In vivo иммуногенность эпитопа пептида TEM8 была исследована по протоколу, описанному в разделе «Материалы и методы». Мышам линии BALB/c путем инъекции вводили пептид TEM8-A24-9-277 (SEQ ID NO:4) (M1-M5) в неполном адъюванте Фрейнда (IFA), либо только IFA (N1 и N2). Знак «+» относится к продукции IFN-γ CTL, стимулированными клетками-мишенями, нагруженными подходящим пептидом (черные столбцы), знак «-» - к продукции IFN-γ CTL, стимулированными клетками-мишенями, не нагруженными никакими пептидами (белые столбцы). Спленоциты вакцинированных мышей продуцировали IFN-γ при стимуляции клетками RLmale1, нагруженными пептидами TEM8-A24-9-277 (SEQ ID NO:4) и не продуцировали IFN-γ при стимуляции клетками-мишенями, не нагруженными никакими пептидами. Аббревиатура SFC относится к числу спот-образующих клеток. (b) Противоопухолевые эффекты вакцинации эпитопом пептидов TEM8 были исследованы в режиме профилактики. TEM8-A24-9-277 (SEQ ID NO:4) (закрашенные треугольники) в IFA либо не содержащую пептидов композицию (незакрашенные ромбы) вводили путем инъекции в дни -7 и 0 мышам линии BALB/c. В день 0 мышам подкожно вводили клетки линии CT26 (мышиный колоректальный рак) в количестве 5×104 клеток/мышь. Приведенные значения размеров опухолей представляют собой среднее в выборке из 5 мышей. В группе мышей, вакцинированных эпитопом пептидов, наблюдали статистически значимое подавление роста опухоли (*; p<0,05).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
Используемые в настоящей заявке взаимозаменяемые термины «полипептид», «пептид» и «белок» относятся к полимеру, состоящему из аминокислотных остатков. Эти термины также относятся к полимерам, в которых один или несколько аминокислотных остатков представляют собой модифицированный или неприродный остаток, такой как искусственный химический миметик соответствующей природной аминокислоты, а также к природным полимерам аминокислот.
Используемый в настоящей заявке термин «аминокислота» относится к природным и синтетическим аминокислотам, а также к аминокислотным аналогам и миметикам, являющихся функционально близкими к природным аминокислотам. Природными являются аминокислоты, кодируемые генетическим кодом, а также аминокислоты, подвергающиеся после трансляции внутриклеточным модификациям (например, гидроксипролин, γ-карбоксиглутаминовая кислота и O-фосфосерин). Фраза «аминокислотный аналог» относится к соединениям, имеющим такую же общую химическую структуру (α-атом углерода, связанный с атомом водорода, карбокси-группу, аминогруппу и R-группу), как и природная аминокислота, но содержащим модифицированную R-группу или полипептидный остов (например, гомосерин, норлейцин, метионин, сульфоксид, метионин-метилсульфоний). Фраза «аминокислотный миметик» относится к химическим соединениям, имеющим отличные от природных аминокислот химические структуры, однако функционально с ними сходные.
Аминокислоты могут быть обозначены в соответствии с общепринятыми трехбуквенным или однобуквенным кодами, рекомендованными номенклатурной комиссией по биохимии IUPAC-IUB.
Использование взаимозаменяемых терминов «ген», «полинуклеотиды», «нуклеотиды» и «нуклеиновые кислоты», если не указано иного, аналогично таковому для аминокислот в соответствии с общепринятым однобуквенным кодом.
Если не указано иного, все используемые в настоящей заявке технические и научные термины имеют свои обычные значения, общепринятые в кругу специалистов в той области техники, к которой относится настоящее изобретение.
II. Пептиды
Для того, чтобы показать, что пептиды TEM8 действуют как антигены, распознаваемые цитотоксическими Т-лимфоцитами (CTL), было исследовано, являются ли пептиды TEM8 (№ NP_115584 по базе данных GenBank (SEQ ID NO: 76)) антигенными эпитопами, рестрицированными часто встречающимися HLA-аллелями HLA-A24 или HLA-A02 (Date Y et al., Tissue Antigens 47: 93-101, 1996; Kondo A et al., J Immunol 155: 4307-12, 1995; Kubo RT et al., J Immunol 152: 3913-24, 1994). Идентификация кандидатных в отношении связывания с HLA-A24 и HLA-A02 пептидов проводили на основании информации об аффинности их связывания с HLA-A24 и HLA-A02. Стабильные линии CTL были получены в результате in vitro стимуляции Т-клеток дендритными клетками (ДК), нагруженных каждым из нижеследующих пептидов:
TEM8-A24-9-39 (SEQ ID NO:3),
TEM8-A24-9-277 (SEQ ID NO:4),
TEM8-A24-10-277 (SEQ ID NO:9),
TEM8-A02-9-337 (SEQ ID NO:23),
TEM8-A02-9-338 (SEQ ID NO:25),
TEM8-A02-9-278 (SEQ ID NO:30),
TEM8-A02-10-338 (SEQ ID NO:60),
TEM8-A02-10-265 (SEQ ID NO:63) и
TEM8-A02-10-333 (SEQ ID NO:68).
Эти стабильные линии CTL демонстрировали мощную специфическую CTL-активность по отношению к клеткам-мишеням, нагруженным соответствующими пептидами. Эти результаты демонстрируют, что TEM8 представляет собой антиген, распознаваемый CTL, а нижеследующие пептиды являются эпитопами пептидов ТЕМ8, рестрицированными HLA-A24 или HLA-A02:
TEM8-A24-9-39 (SEQ ID NO:3),
TEM8-A24-9-277 (SEQ ID NO:4),
TEM8-A24-10-277 (SEQ ID NO:9),
TEM8-A02-9-337 (SEQ ID NO:23),
TEM8-A02-9-338 (SEQ ID NO:25),
TEM8-A02-9-278 (SEQ ID NO:30),
TEM8-A02-10-338 (SEQ ID NO:60),
TEM8-A02-10-265 (SEQ ID NO:63) и
TEM8-A02-10-333 (SEQ ID NO:68).
Поскольку у большинства больных злокачественными опухолями ген TEM8 сверхэкспрессирован, то он представляет хорошую мишень для иммунотерапии с повышенной клинической эффективностью. Таким образом, настоящее изобретение относится к нонапептидам (пептиды, состоящие из девяти аминокислотных остатков) и декапептидам (пептиды, состоящие из десяти аминокислотных остатков) эпитопов ТЕМ8, распознаваемых CTL. Согласно настоящему изобретению, аминокислотные последовательности нонапептидов или декапептидов могут быть выбраны из последовательности SEQ ID NO:76. Таким образом, настоящее изобретение относится к выделенным пептидам, способным индуцировать цитотоксические Т-клетки, состоящим из девяти или десяти аминокислот, непрерывная последовательность которых может быть выбрана из аминокислотной последовательности SEQ ID NO:76. В частности, в некоторых вариантах осуществления, настоящее изобретение относится к пептидам, которые содержат аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, 4, 9, 23, 25, 30, 60, 63 и 68.
В настоящее время доступное в сети Интернет программное обеспечение, такое как, например, описанное в работе Parker KC et al., J Immunol 1994 Jan 1, 152(1): 163-75, может быть использовано для расчета аффинности связывания различных пептидов с антигенами HLA in silico. Аффинность связывания с антигенами HLA может быть определена согласно описанному, например, в работах Parker KC et al., J Immunol 1994 Jan 1, 152(1): 163-75; и Kuzushima K et al., Blood 2001, 98(6): 1872-81. Способы определения аффинности связывания приведены, например, в Journal of Immunological Methods, 1995, 185: 181-190.; Protein Science, 2000, 9: 1838-1846. Таким образом, настоящее изобретение включает в себя пептиды TEM8, в отношении которых связывание с антигенами HLA прогнозировано при помощи известных программ.
Кроме того, эти пептиды по настоящему изобретению могут быть фланкированы дополнительными аминокислотными остатками, при условии что полученный пептид сохраняет способность индуцировать CTL. Длина подобных пептидов, способных к индукции CTL, составляет, например, менее 40 аминокислот, часто менее 20 аминокислот, обычно менее 15 аминокислот. Аминокислотные последовательности, фланкирующие пептиды, которые содержат аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, 4, 9, 23, 25, 30, 60, 63 и 68, не ограничены и могут состоять из аминокислот любого типа при условии, что добавление этих последовательностей не снижает способности исходных пептидов индуцировать CTL. Таким образом, настоящее изобретение относится к пептидам, способным индуцировать CTL, которые содержат аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, 4, 9, 23, 25, 30, 60, 63 и 68.
В общем случае известно, что модификации одной или более аминокислот в белке не оказывают влияния на его функцию, а в некоторых случаях даже повышают желаемую функцию исходного белка. Действительно, известно, что модифицированные пептиды (т.е. пептиды, аминокислотная последовательность которых модифицирована путем введения одного, двух или нескольких аминокислотных остатков в исходную аминокислотную последовательность), могут сохранять биологическую активность исходного пептида (Mark et al., Proc Natl Acad Sci USA 1984, 81: 5662-6; Zoller and Smith, Nucleic Acids Res 1982, 10: 6487-500; Dalbadie-McFarland et al., Proc Natl Acad Sci USA 1982, 79: 6409-13). Таким образом, в соответствии с одним из вариантов осуществления настоящего изобретения, аминокислотная последовательность пептида по настоящему изобретению, способного индуцировать CTL, может представлять собой последовательность SEQ ID NO: 3, 4, 9, 23, 25, 30, 60, 63 или 68, в которой одна, две или более аминокислот добавлены и/или замещены на другие.
Специалистам в данной области техники будет понятно, что индивидуальные добавления или замещения одной или небольшой части аминокислот в аминокислотной последовательности сохраняют свойства боковых цепей исходных аминокислот; подобный тип модификаций, при которых полученный модифицированный белок обладает свойствами, близкими к исходному, называется «консервативной заменой» или «консервативной модификацией». Таблицы консервативных замен функционально сходных аминокислот хорошо известны в данной области техники. Примеры аминокислот, сгруппированных по свойствам их боковых цепей, включают в себя гидрофобные аминокислоты (A, I, L, M, F, P, W, Y, V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S, T), а также аминокислоты с нижеследующими боковыми цепями, содержащими общие функциональные группы или характеристики: алифатические боковые цепи (G, A, V, L, I, P); боковые цепи, содержащие гидроксильную группу (S, T, Y); боковые цепи, содержащие атом серы (C, M); боковые цепи, содержащие карбокси- или амидные группы (D, N, E, Q); основные боковые цепи (R, K, H); и боковые цепи, содержащие ароматические кольца (H, F, Y, W). Помимо этого, консервативными являются замены одной аминокислоты на другую в пределах каждой из нижеследующих восьми групп:
(1) аланин (A), глицин (G);
(2) аспарагиновая кислота (D), глутаминовая кислота (E);
(3) аспарагин (N), глутамин (Q);
(4) аргинин (R), лизин (K);
(5) изолейцин (I), лейцин (L), метионин (M), валин (V);
(6) фенилаланин (F), тирозин (Y), триптофан (W);
(7) серин (S), треонин (T); и
(8) цистеин (C), метионин (M) (см., например, Creighton, Proteins 1984).
Подобные консервативно модифицированные пептиды также рассматриваются как пептиды по настоящему изобретению. Однако пептиды по настоящему изобретению не ограничиваются подобными модификациями и также включают в себя пептиды с неконсервативными модификациями при условии, что полученный пептид сохраняет способность к индукции CTL. Помимо этого, модифицированные пептиды по настоящему изобретению не исключают из своего множества способные к индукции CTL пептиды, являющиеся продуктами полиморфных и аллельных вариантов, а также межвидовых гомологов TEM8.
Для сохранения требуемой способности индуцировать CTL можно модифицировать (добавить или заменить) небольшое число (например, 1, 2 или несколько) или небольшой процент аминокислот. В данном контексте термин «несколько» означает 5 или менее аминокислот, например, 3 или менее. Процент аминокислот, подлежащих замене, может составлять 20% или менее, например, 15% или менее, например, 10% или от 1 до 5%.
Анализ гомологии представленного пептида TEM8-A24-9-39 (SEQ ID NO:3), TEM8-A24-9-277 (SEQ ID NO:4), TEM8-A24-10-277 (SEQ ID NO:9), TEM8-A02-9-337 (SEQ ID NO:23), TEM8-A02-9-338 (SEQ ID NO:25), TEM8-A02-9-278 (SEQ ID NO:30), TEM8-A02-10-338 (SEQ ID NO:60), TEM8-A02-10-265 (SEQ ID NO:63) и TEM8-A02-10-333 (SEQ ID NO:68) продемонстрировал отсутствие значимой гомологии с любыми другими пептидами каких бы то ни было белковых продуктов других человеческих генов. Этот факт снижает вероятность развития неизвестных или нежелательных иммунных реакций при использовании этих пептидов в иммунотерапии. Таким образом, в контексте данного аспекта, эти пептиды могут быть использованы для индукции иммунного ответа против TEM8 в опухоле-ассоциированном эндотелии у пациентов с опухолями.
При использовании в иммунотерапии, пептиды по настоящему изобретению презентируются на поверхности клетки или экзосомы в виде комплекса с антигеном HLA. Таким образом, можно выбрать пептиды, которые в дополнение к способности индуцировать CTL обладают высокой аффинностью связывания с антигеном HLA. Более того, подобные пептиды могут быть модифицированы путем замены, добавления и т.д. аминокислотных остатков для повышения аффинности связывания. Поскольку закономерности пептидных последовательностей, представляемых в ходе связывания с антигенами HLA, в настоящее время известны (J Immunol 1994, 152: 3913; Immunogenetics 1995, 41: 178; J Immunol 1994, 155: 4307), на основании этих закономерностей и в дополнение к естественно представляемым пептидам, в иммуногенные пептиды по настоящему изобретению могут быть введены определенные модификации. Например, пептиды, в которых вторая с N-конца аминокислота замещена на фенилаланин, тирозин, метионин или триптофан, демонстрируют высокую аффинность связывания с HLA-A24; пептиды, в которых С-концевая аминокислота замещена на фенилаланин, лейцин, изолейцин, триптофан или метионин, также могут быть успешно использованы. Таким образом, пептиды с аминокислотными последовательностями SEQ ID NO: 3, 4 или 9, в которых вторая с N-конца аминокислота замещена на фенилаланин, тирозин, метионин или триптофан, и/или в которых С-концевая аминокислота замещена на фенилаланин, лейцин, изолейцин, триптофан или метионин, также включены в объем настоящего изобретения.
С другой стороны, пептиды, в которых вторая с N-конца аминокислота замещена на лейцин или метионин, а С-концевая аминокислота замещена на валин или лейцин, могут быть использованы как пептиды с высокой аффинностью связывания с HLA-02. Таким образом, пептиды, соответствующие любой из аминокислотных последовательностей SEQ ID NO: 23, 25, 30, 60, 63 и 68, в которых вторая с N-конца аминокислота замещена на лейцин или метионин, и/или в которых С-концевая аминокислота замещена на валин или лейцин, также включены в объем настоящего изобретения. Замены могут быть введены не только в концевых позициях, но также в положениях, соответствующих месту потенциального распознавания Т-клеточным рецептором (ТКР). В нескольких исследованиях было продемонстрировано, что аминокислотные замены в пептиде могут быть нейтральными или улучшать исходный пептид, как в случаях, например, CAP1, p53(264-272), Her-2/neu(369-377) или gp100 (209-217) (Zaremba et al. Cancer Res. 57, 4570-4577, 1997, T. K. Hoffmann et al. J Immunol. (2002) Feb 1; 168(3): 1338-47., S. O. Dionne et al. Cancer Immunol Immunother. (2003) 52: 199-206 and S. O. Dionne et al. Cancer Immunology, Immunotherapy (2004) 53, 307-314).
Кроме того, с N- или C-конца пептида могут быть добавлены одна или две аминокислоты. Подобные модифицированные пептиды с высокой аффинностью связывания с антигенами HLA и сохранением способности к индукции CTL, также включены в объем настоящего изобретения.
Однако в том случае, если последовательность пептида идентична фрагменту аминокислотной последовательности эндогенного или экзогенного белка с функцией, отличной от исходного белка, из которого получен пептид, могут проявиться побочные эффекты, такие как аутоиммунные расстройства или аллергические реакции против определенных веществ. Поэтому можно провести поиск гомологов по доступным базам данных для исключения ситуаций, в которых пептид будет соответствовать аминокислотной последовательности другого белка. В том случае, если из подобного поиска становится ясно, что не существует ни одного пептида, отличающегося от исходного на 1 или 2 аминокислоты, исходный пептид может быть далее модифицирован для повышения аффинности связывания с антигенами HLA и/или повышения способности пептида к индукции CTL без какой-либо опасности возникновения побочных эффектов.
Хотя ожидается, что пептиды с высокой аффинностью связывания с антигенами HLA (предсказанной согласно вышеописанному) будут высокоэффективными, кандидатные пептиды, выбранные на основании высокой аффинности связывания как индикаторного свойства, далее тестируются на способность к индукции CTL. В данном контексте, фраза «способность к индукции CTL» относится к способности презентированного на антиген-презентирующих клетках пептида индуцировать CTL. Также, фраза «способность к индукции CTL» относится к способности пептида индуцировать активацию CTL, пролиферацию CTL, а также активировать CTL к лизису клеток-мишеней и повышению продукции IFN-γ.
Подтверждение способности к индукции CTL проводится при помощи индукции антиген-презентирующих клеток, несущих антигены MHC человека (например, B-лимфоциты, макрофаги и дендритные клетки (ДК)), в частности - ДК, полученных из мононуклеарных лейкоцитов периферической крови, и дальнейшей стимуляции пептидами с последующим смешиванием с CD8-позитивными клетками и измерением уровня продукции IFN-γ, секретируемого CTL в ответ на стимуляцию клетками-мишенями. В качестве экспериментальной системы также могут быть использованы трансгенные животные, экспрессирующие антиген HLA человека (описанные, например, в работе BenMohamed L, Krishnan R, Longmate J, Auge C, Low L, Primus J, Diamond DJ, Hum Immunol 2000 Aug, 61(8): 764-79, Related Articles, Books, Linkout Induction of CTL response by a minimal epitope vaccine in HLA A*0201/DRl transgenic mice: dependence on HLA class II restricted T(H) response). Например, клетки-мишени могут быть помечены радиоактивным изотопом 51Cr и т.д., и цитотоксическая активность может быть вычислена по количеству высвобожденной радиоактивной метки из клетки-мишени. Помимо этого, цитотоксическая активность может быть определена по количеству IFN-γ, продуцируемого и высвобождаемого CTL в присутствии несущих иммобилизованный пептид антиген-презентирующих клеток, с последующей визуализацией зон ингибирования при помощи моноклональных анти-IFN-γ антител.
По результатам вышеописанного анализа на способность пептидов к индукции CTL, пептиды с высокой аффинностью связывания с антигеном HLA не обязательно демонстрируют высокую способность к индукции CTL. Нонапептиды или декапептиды, выбранные из группы пептидов, аминокислотные последовательности которых соответствуют последовательностям SEQ ID NO: 3, 4, 9, 23, 25, 30, 60, 63 и 68, демонстрировали особо высокую способность к индукции CTL, равно как и высокие показатели аффинности связывания с антигеном HLA. Таким образом, эти пептиды представляют собой примеры вариантов настоящего изобретения.
Помимо вышеописанных модификаций пептидов, пептиды по настоящему изобретению могут быть далее дополнительно связаны с другими веществами, при условии, что полученный продукт сохраняет способность к индукции CTL. Примеры подобных веществ включают в себя: пептиды, липиды, сахара и сахаридные цепи, ацетильные группы, природные и синтетические полимеры и т.д. Эти пептиды могут быть подвергнуты различным модификациям, таким как гликозилирование, окисление боковых цепей или фосфорилирование, при условии что подобные модификации не снижают вышеописанной биологической активности исходных пептидов. Подобные типы модификаций могут быть применены для придания полипептиду дополнительных функций (например, способности к таргеттированию или доставке) либо для его стабилизации. Например, известным в данной области техники способом повышения стабильности полипептида in vivo является введение в его состав D-аминокислот, аминокислотных миметиков либо искусственных аминокислот; данный подход также может быть адаптирован для целей настоящего изобретения. Стабильность полипептида может быть проанализирована множеством способов. Например, для анализа стабильности могут быть использованы пептидазы и различные биологические среды, такие как человеческая плазма и сыворотка (см., например, Verhoef et al., Eur J Drug Metab Pharmacokin 1986, 11: 291-302).
В данном тексте, пептиды по настоящему изобретению также могут быть названы как «пептид(ы) TEM8» или «полипептид(ы) TEM8».
III. Получение пептидов TEM8
Пептиды по настоящему изобретению могут быть получены при помощи широко известных методов. Например, данные пептиды могут быть получены синтетически, при помощи технологии рекомбинантной ДНК или путем химического синтеза. Пептиды по настоящему изобретению могут быть получены в индивидуальном виде или в виде более длинного полипептида, состоящего из двух или более пептидов. Данные пептиды могут быть выделены, т.е. очищены или выделены в виде препаратов, практически свободных от других белков клеток-хозяев и их фрагментов, а также от любых других химических соединений.
Пептиды по настоящему изобретению могут быть получены путем химического синтеза на основании выбранной аминокислотной последовательности. Например, общепринятые способы пептидного синтеза, которые могут быть адаптированы для целей настоящего изобретения, включают в себя способы, изложенные в следующих руководствах и работах:
(i) Peptide Synthesis, Interscience, New York, 1966;
(ii) The Proteins, Vol. 2, Academic Press, New York, 1976;
(iii) Peptide Synthesis (in Japanese), Maruzen Co., 1975;
(iv) Basics and Experiment of Peptide Synthesis (in Japanese), Maruzen Co., 1985;
(v) Development of Pharmaceuticals (second volume) (in Japanese), Vol. 14 (peptide synthesis), Hirokawa, 1991;
(vi) WO99/67288; и
(vii) Barany G. & Merrifield R.B., Peptides Vol. 2, "Solid Phase Peptide Synthesis", Academic Press, New York, 1980, 100-118.
Помимо этого, пептиды по настоящему изобретению могут быть получены при помощи адапатации любых известных генноинженерных способов получения пептидов (см., например, Morrison J, J Bacteriology 1977, 132: 349-51; Clark-Curtiss & Curtiss, Methods in Enzymology (eds. Wu et al.) 1983, 101: 347-62). Например, на первой стадии получают подходящий вектор, несущий кодирующий целевой пептид полинуклеотид в экспрессируемой форме (например, расположенный с 3'-конца от регуляторной последовательности, соответствующей последовательности промотора), которым далее трансформируют подходящие клетки-хозяева. Полученные клетки-хозяева далее культивируются для продукции целевого пептида. Пептид также может быть получен in vitro при помощи адаптации систем in vitro трансляции.
IV. Полинуклеотиды
Настоящее изобретение относится к полинуклеотидам, кодирующим любой из вышеупомянутых пептидов по настоящему изобретению. Эти полинуклеотиды включают в себя полинуклеотиды, полученные из природного гена TEM8 (№ NM_032208 по базе данных GenBank (SEQ ID NO:75)), а также нуклеотидные последовательности, представляющие собой их консервативно модифицированные аналоги. Термин «консервативно модифицированные аналоги» относится к последовательностям, кодирующим идентичные либо почти идентичные аминокислотные последовательности. В силу вырожденности генетического кода, один