Варианты альфа-амилазы с измененными свойствами
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии и может быть использовано в производстве композиций, предназначенных для удаления крахмалсодержащих загрязнений. Предложены композиции, содержащие активные варианты альфа-амилазы, которые проявляют повышенную термостабильность относительно родительской формы AmyS-подобной альфа-амилазы, из которой они получены путем замены S/Q в положении, соответствующем положению 242 альфа-амилазы с SEQ ID NO: 1. Помимо нового варианта альфа-амилазы композиции по изобретению обычно содержат, по меньшей мере, один дополнительный фермент, детергент, одно поверхностно-активное вещество, один комплексообразователь, окислитель, подкислитель, подщелачивающий агент, источник пероксида, источник жесткости, соль, детергентный комплексообразующий агент, полимер, стабилизирующий агент или кондиционер. Описаны также способы применения этих композиций для расшлихтовки тканого материала, для мойки или очистки изделий, таких как посуда или белье, загрязненных крахмалсодержащими веществами. 5 н. и 5 з.п. ф-лы, 13 табл., 24 ил., 14 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ПУБЛИКАЦИИ
Эта заявка заявляет приоритет Предварительных заявок на патент США 60/985619, поданной 5 ноября 2007 года, 61/026579, поданной 6 февраля 2008 года, 61/041075, поданной 31 марта 2008 года, и 61/059411, поданной 6 июня 2008 года, описания каждой из которых включены здесь в качестве ссылки в их полном объеме, для всех целей.
К описанию прилагается список последовательностей, содержащий SEQ ID NO:1-30, каждая из которых включена здесь в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Это описание относится к новым альфа-амилазам. В частности, оно относится к способам применения некоторых вариантных альфа-амилазных активностей и их смесей для удаления пятен и в качестве компонента детергентных композиций для стирки.
УРОВЕНЬ ТЕХНИКИ
Альфа-амилазы (альфа-1,4-глюкан-4-глюканогидролазы, E.C. 3.2.1.1) составляют группу ферментов, которые катализируют гидролиз крахмала и родственных линейных или разветвленных 1,4-глюкозидных олиго- и полисахаридов.
Амилазы могут быть использованы для различных целей. Например, амилазы используют коммерчески в начальных стадиях обработки крахмала (например, разжижения); в процессах мокрого способа помола и в получении спирта из углеводных источников. Они используются также в качестве очищающих средств или вспомогательных агентов в детергентных матриксах; в текстильной промышленности для расшлихтовки крахмала; в хлебопекарных применениях; в производстве напитков; в нефтяных промыслах для процессов бурения; в процессах рециркуляции, например, для очищения от краски бумаги, и в корме для животных.
Предпринимались попытки конструирования вариантов альфа-амилазы с улучшенными свойствами для конкретных применений, таких как разжижение крахмала и расшлихтовка текстиля.
Существует потребность в создании и улучшении амилаз, которые обеспечивают, например, преимущества изготовления и/или эффективности в сравнении со стандартными промышленными ферментами (например, из Bacillus licheniformis), для различных применений, включающих в себя коммерческую расшлихтовку, а также процессы чистки/мойки и удаления краски или крахмала. Имеется также потребность в детергентах и чистящих добавках или препаратах, содержащих улучшенные амилазы и дополнительные компоненты, такие как поверхностно-активное вещество, комплексообразователи и т.п.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте данное изобретение относится, inter alia, к новым вариантам α-амилолитических ферментов исходной α-амилазы, такой как AmyS-подобная α-амилаза, в частности, вариантов, проявляющих измененные свойства, которые являются выгодными в связи с процессами очищения или мойки, или удалением крахмала, например, в расшлихтовке тканого материала.
Например, этот вариант изменен, в сравнении с исходной AmyS-подобной альфа-амилазой или референсной амилазой, в одном или нескольких свойствах, таких как общий заряд, субстратная специфичность, расщепление субстрата, связывание субстрата, термостабильность, активность при одном или нескольких pH, стабильность при одном или нескольких pH, стабильность в условиях окисления, потребности в Ca2+, удельная активность, каталитическая скорость, каталитическая эффективность, активность в присутствии комплексообразователя (хелатообразователя), термо- или pH-стабильность в присутствии комплексообразователя, применимость для расшлихтовки или применимость для процесса очистки или величина экспрессии в системе экспрессии белков, и других представляющих интерес свойствах. Например, одно или несколько изменений могут приводить к варианту, который имеет уменьшенную Ca2+-зависимость и/или измененный профиль pH/активности и/или измененную термостабильность, в сравнении с исходной α-амилазой, такой как AmyS-подобная амилаза.
В одном аспекте здесь обеспечен вариант исходной α-амилазы Geobacillus stearothermophilus, причем этот вариант имеет аминокислотную последовательность, которая имеет по меньшей мере приблизительно 95% гомологию относительно исходной α-амилазы Geobacillus stearothermophilus и содержит замену аминокислоты 242, где положения аминокислот в этой пептидной последовательности пронумерованы относительно референсной амилазы (например, SEQ ID NO:1 или 2) и где этот вариант имеет α-амилазную активность.
В другом аспекте обеспечены композиции, содержащие: a) по меньшей мере один вариант альфа-амилазы, содержащий аминокислотную последовательность, по меньшей мере на приблизительно 95% идентичную аминокислотной последовательности исходной AmyS-подобной альфа-амилазе и имеющую замену в положении аминокислоты, соответствующем положению 242 референсной альфа-амилазы, причем указанный вариант имеет детектируемую альфа-амилазную активность, и b) по меньшей мере один дополнительный фермент, детергент, по меньшей мере одно поверхностно-активное вещество, по меньшей мере один комплексообразователь, окислитель, подкислитель, подщелачивающий агент, источник пероксида, источник жесткости, соль, детергентный комплексообразующий агент, полимер, стабилизирующий агент или кондиционер. В предпочтительных вариантах осуществления референсной амилазой является SEQ ID NO:1 или 2, и эта композиция является компонентом продукта для применения в стирке, очистке посуды и твердой поверхности, расшлихтовке или обработке тканей или пятен.
В одном варианте осуществления эта композиция содержит дополнительный фермент, который является протеазой, липазой, амилазой, целлюлазой, пероксидазой, оксидазой, пектиназой, лиазой, кутиназой, лакказой или их комбинацией.
В различных вариантах осуществления поверхностно-активное вещество является неионогенным, анионогенным, катионогенным или цвиттерионным. Этой вариантной альфа-амилазой является предпочтительно вариант S242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q или S242T. В некоторых вариантах осуществления этот вариант имеет измененную устойчивость к окислению и эта вариантная альфа-амилаза дополнительно включает в себя делецию или замену одного или нескольких остатков метионина, в том числе остатков, расположенных в положениях аминокислот 8, 9, 96, 200, 206, 284, 307, 311, 316 и 438 исходной AmyS-подобной альфа-амилазы, где эта референсная альфа-амилаза имеет SEQ ID NO:2.
В других вариантах осуществления эта вариантная альфа-амилаза дополнительно содержит модификацию последовательности в одном или нескольких положениях аминокислот, соответствующих положениям аминокислот 97, 179, 180, 193, 319, 349, 358, 416, 428 или 443 референсной альфа-амилазы. В дополнительных других вариантах осуществления этот вариант содержит одну или несколько замен в следующих положениях: цистеин в положении 349, цистеин в положении 428, глутаминовую кислоту в положении 97, аргинин в положении 97, глутаминовую кислоту в положении 319, аргинин в положении 319, глутаминовую кислоту в положении 358, аргинин в положении 358, глутаминовую кислоту в положении 443 или аргинин в положении 443.
Здесь применимы также вариантные альфа-амилазы, содержащие замену N193 или V416 или обе эти замены, например, замену N193F или V416G или обе. В некоторых вариантах осуществления эти варианты обнаруживают делецию одной или нескольких аминокислот, например, в положениях F178, R179, G180, I181, G182 и K183.
Предпочтительно, эта вариантная альфа-амилаза имеет измененную зависимость от ионов металлов или измененную стабильность или активность в отсутствие добавленного кальция или в присутствии комплексообразователя в некоторых вариантах.
Эта вариантная альфа-амилаза предпочтительно имеет по меньшей мере 95%, 98% или даже 99% или большую гомологию относительно SEQ ID NO:2 и содержит замену аминокислоты 242 относительно нумерации в референсной альфа-амилазе, содержащей SEQ ID NO:1, причем эта вариантная альфа-амилаза имеет альфа-амилазную активность.
Исходная AmyS-подобная альфа-амилаза является SEQ ID NO:1, 2, 6, 7, 8, 9, 10, 11, 12, 15 или 16, а референсная альфа-амилаза является SEQ ID NO:1 или 2 в одном варианте.
Предпочтительно, эта вариантная альфа-амилаза имеет улучшенную эффективность (эксплуатационные качества) в процессе мойки при pH ≥ приблизительно 8, относительно исходной AmyS-подобной альфа-амилазы.
Эта вариантная альфа-амилаза может обнаруживать, в различных вариантах, ряд замен a) Q97E, Q319E, Q358E, Q443E; b) Q97E, Q319R, Q358E, Q443R; c) Q97E, Q319R, Q358E; d) Q97E, Q319R, Q443E; e) Q97E, Q319R, Q443R; f) Q97E, Q358R; g) Q97E, Q443E; h) Q319R, Q358E, Q443E или i) Q319R, Q358R, Q443E.
В другом из его нескольких аспектов это изобретение обеспечивает композиции, которые являются детергентными или чистящими препаратами, содержащими по меньшей мере одну вариантную амилазу, содержащую аминокислотную последовательность, по меньшей мере на приблизительно 95% идентичную аминокислотной последовательности исходной AmyS-подобной альфа-амилазы и имеющую замену в положении аминокислоты, соответствующем положению 242 референсной альфа-амилазы, причем этот вариант имеет детектируемую альфа-амилазную активность; где этой референсной амилазой является SEQ ID NO:1 или 2. В некоторых вариантах осуществления этот вариант является вариантом S242, содержащим по меньшей мере замену S242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q или S242T.
В другом из его нескольких аспектов это изобретение обеспечивает способы расшлихтовки тканого материала после процесса ткачества, предусматривающие контактирование тканого материала с вариантной альфа-амилаза, содержащей аминокислотную последовательность, по меньшей мере на приблизительно 95% идентичную аминокислотной последовательности исходной AmyS-подобной альфа-амилазы, и имеющую замену в положении аминокислоты, соответствующем положению 242 референсной альфа-амилазы. Предпочтительно, этот вариант имеет детектируемую альфа-амилазную активность. Это контактирование выполняют при условиях и в течение времени, которые являются эффективными по меньшей мере для частичного удаления шлихты из тканого материала.
В различных вариантах осуществления эта альфа-амилаза является измененной, в сравнении с исходной AmyS-подобной альфа-амилазой или референсной альфа-амилазой, в одном или нескольких из таких свойств, как (a) общий заряд, (b) субстратная специфичность, (c) расщепление субстрата, (d) связывание субстрата, (e) термостабильность, (f) активность при одном или нескольких pH, (g) стабильность при одном или нескольких pH, (h) стабильность в условиях окисления, (i) потребности Ca2+, (j) удельная активность, (k) каталитическая скорость, (l) каталитическая эффективность, (m) активность в присутствии комплексообразователя, (n) термо- или pH-стабильность в присутствии комплексообразователя, (o) эффективность в отношении расшлихтовки или (p) величина экспрессии в системе экспрессии белков.
Исходная AmyS-подобная альфа-амилаза является SEQ ID NO:1, 2, 6, 7, 8, 9, 10, 11, 12, 15 или 16, а референсная альфа-амилаза является SEQ ID NO:1 или 2 в различных вариантах осуществления. Предпочтительно, эта вариантная альфа-амилаза является вариантом S242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q или S242T.
В некоторых вариантах осуществления эта вариантная альфа-амилаза дополнительно содержит одну или несколько замен в следующих положениях: цистеин в положении 349, цистеин в положении 428, глутаминовую кислоту в положении 97, аргинин в положении 97, глутаминовую кислоту в положении 319, аргинин в положении 319, глутаминовую кислоту в положении 358, аргинин в положении 358, глутаминовую кислоту в положении 443 или аргинин в положении 443, где референсной альфа-амилазой является SEQ ID NO:1 или 2.
Обеспечены также способы мойки или очистки. Эти способы предусматривают контактирование одного или нескольких изделий, подлежащих мойке или очистке, с композицией, содержащей вариантную альфа-амилазу, содержащую аминокислотную последовательность, по меньшей мере на приблизительно 95% идентичную аминокислотной последовательности исходной AmyS-подобной альфа-амилазы и имеющую замену в положении аминокислоты, соответствующем положению 242 референсной альфа-амилазы. Это контактирование выполняют при условиях и в течение времени, которые являются эффективными по меньшей мере для частичной мойки или очистки этих одного или нескольких изделий. Этот вариант имеет детектируемую альфа-амилазную активность. В примерах способов по меньшей мере одно изделие загрязнено по меньшей мере одним крахмалсодержащим веществом, удаление которого улучшается этой вариантной альфа-амилазой. В различных вариантах осуществления этих способов, эта композиция дополнительно содержит один или несколько из дополнительных компонентов, таких как фермент, детергент, поверхностно-активное вещество, окислитель, подкислитель, подщелачивающий агент, источник пероксида, источник жесткости, соль, детергентный комплексообразующий агент, полимер, стабилизирующий агент или кондиционер.
В одном варианте этих способов исходная AmyS-подобная альфа-амилаза является SEQ ID NO:1, 2, 6, 7, 8, 9, 10, 11, 12, 15 или 16, а референсная альфа-амилаза является SEQ ID NO:1 или 2. Предпочтительно, эта вариантная альфа-амилаза является вариантом S242A, S242D, S242E, S242F, S242G, S242H, S242L, S242M, S242N, S242Q или S242T.
В различных вариантах осуществления эта вариантная альфа-амилаза имеет улучшенную эффективность (эксплуатационные качества) в процессе мойки при pH ≥ приблизительно 8, относительно исходной AmyS-подобной альфа-амилазы.
В одном варианте осуществления эта вариантная альфа-амилаза содержит одну или несколько замен в следующих положениях: цистеин в положении 349, цистеин в положении 428, глутаминовую кислоту в положении 97, аргинин в положении 97, глутаминовую кислоту в положении 319, аргинин в положении 319, глутаминовую кислоту в положении 358, аргинин в положении 358, глутаминовую кислоту в положении 443 или аргинин в положении 443. В других вариантах осуществления эта вариантная альфа-амилаза содержит набор замен a) Q97E, Q319E, Q358E, Q443E; b) Q97E, Q319R, Q358E, Q443R; c) Q97E, Q319R, Q358E; d) Q97E, Q319R, Q443E; e) Q97E, Q319R, Q443R; f) Q97E, Q358R; g) Q97E, Q443E; h) Q319R, Q358E, Q443E или i) Q319R, Q358R, Q443E.
Этот способ может также предусматривать применение вариантных альфа-амилаз, содержащих делецию одной или нескольких аминокислот в положениях F178, R179, G180, I181, G182 или K183.
В некоторых вариантах осуществления вариантная альфа-амилаза имеет измененную зависимость от ионов металлов или измененную стабильность или активность в отсутствие добавленного кальция или в присутствии комплексообразователя.
Здесь обеспечены также наборы, содержащие а) одну или несколько вариантных альфа-амилаз, содержащих аминокислотную последовательность, по меньшей мере на приблизительно 95% идентичную аминокислотной последовательности исходной AmyS-подобной альфа-амилазы и имеющую замену в положении аминокислоты, соответствующем положению 242 референсной альфа-амилазы, и b) по меньшей мере один дополнительный фермент, детергент, поверхностно-активное вещество, комплексообразователь, окислитель, подкислитель, подщелачивающий агент, источник пероксида, источник жесткости, соль, детергентный комплексообразующий агент, полимер, стабилизирующий агент или кондиционер.
В одном варианте осуществления этот набор дополнительно содержит инструкции для применения, например, для применения компонентов этого набора в процессе расшлихтовки тканого материала или для мойки или очистки одного или нескольких изделий, загрязненных крахмалсодержащим веществом.
Эти и другие признаки этого изобретения будут описаны более подробно ниже.
КРАТКОЕ ОПИСАНИЕ ФИГУР
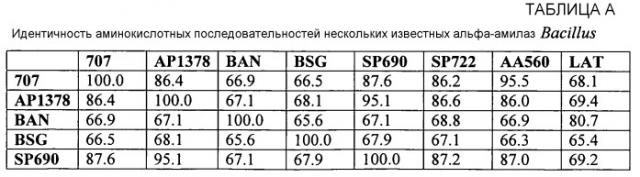
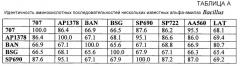
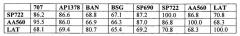
Фигура 1 показывает выравнивание аминокислотных последовательностей среди нескольких кандидатных исходных альфа-амилаз (AmyS-подобных амилаз) для применения здесь. Положения, соответствующие положению любой аминокислоты (например, 1-520) амилазы из Geobacillus stearothermophilus (SEQ ID NO:1) могут быть легко определены. SEQ ID NO:1, альфа-амилаза из G. stearothermophilus "BSG"; SEQ ID NO:2, укороченная амилаза из G. stearothermophilus (AmyS, SPEZYME XTRA); SEQ ID NO:3, G. stearothermophilus (S242A, вариантная амилаза); SEQ ID NO:4, G. stearothermophilus (S242Q, вариантная амилаза); SEQ ID NO:5, G. stearothermophilus (S242E, вариантная амилаза); SEQ ID NO:6, амилаза Yamane 707; SEQ ID NO:7, зрелая амилаза LAT; SEQ ID NO:8, амилаза Bacillus licheniformis дикого типа [TERMAMYL (NOVOZYMES)=SEQ ID NO:8 в WO 02/10355A2]; SEQ ID NO:9, амилаза B. amyloliquefaciens, BAN; SEQ ID NO:10, STAINZYME=AA560, которая является SEQ ID NO:2 в WO 0060060 или SEQ ID NO:24 в US 6528298; SEQ ID NO:11, амилаза B. halmapalus (NATALASE); SEQ ID NO:12, KSM-1378 (KAO CORP., SEQ ID NO:3 в EP1199356); SEQ ID NO:13, Bacillus spp. KSM-K38 (KAO CORP., SEQ ID NO:4 в US 6403355 B1); SEQ ID NO:14, Bacillus spp. KSM-K36 (KAO CORP., SEQ ID NO:2 в US 6403355 B1); SEQ ID NO:15, LIQUOZYME SC (NOVOZYMES); и SEQ ID NO:16, Консенсусная последовательность №1 исходной альфа-амилазы.
Фигура 2 показывает плазмиду pHPLT-AmyS.
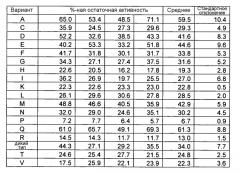
Фигура 3 показывает процентную остаточную активность вариантов S242 после теплового стресса при 95°C в течение 30 минут. Вариантные положения P, S, W и Y отсутствовали и заменялись AmyS дикого типа (Spezyme® Xtra (помеченная "Z")). Показан также положительный контроль, G. stearothermophilus с Δ179-180 с С-концом, укороченным на 29 аминокислот (т.е. SEQ ID NO:2). Линии показывают в 2 и 3 раза более высокое стандартное отклонение процентной остаточной активности фермента дикого типа. S242A и S242Q ясно показывают более высокие остаточные активности, чем эти активности дикого типа.
Фигура 4: Панели A, B, C, D, E, F, G, H и I показывают парные сопоставления и консенсусные последовательности для нескольких последовательностей из фигуры 1 и изображают, соответственно, консенсусные последовательности 2, 3, 4, 5, 6, 7, 8, 9 и 10 или SEQ ID NO:22, 23, 24, 25, 26, 27, 28, 29 и 30, соответственно.
Фигура 5 показывает кривые теплового плавления и точек плавления для амилазы дикого типа и вариантов амилазы без добавленного кальция.
Фигура 6 показывает кривые теплового плавления и точек плавления в присутствии 2 мМ добавленного кальция как для амилазы дикого типа, так и для вариантов амилазы.
Фигура 7 показывает профиль активности при 4, 10 и 20 минутах для Spezyme Xtra и двух вариантов, относительно Liquozyme SC.
Фигура 8 показывает профиль активности четырех вариантов относительно варианта S242Q для трех временных точек.
Фигура 9 является диаграммой, изображающей эффективность S242Q (черные кружки) и его вариантов (белые кружки), как функцию заряда, в анализе маленьких образцов тканей (микролоскутков) с рисовым крахмалом при условиях североамериканской стирки с использованием комбинаторной библиотеки зарядов, причем чистку микролоскутков с рисовым крахмалом выполняли в Tide 2x, при 20°C. Делается ссылка на пример 10.
Фигура 10 является диаграммой, изображающей эффективность укороченной амилазы TS-23 Bacillus sp. (черные кружки) со следующими мутациями: Q98R, M201L, S243Q R309A, Q320R, Q359E и K444E и ее вариантами зарядов (белые кружки) (см. находящуюся в процессе одновременного рассмотрения заявку на патент США № PCT/US2008/007103, поданную 6 июня 2008 года) в анализе маленьких образцов тканей (микролоскутков) с рисовым крахмалом как функцию заряда при условиях западноамериканской стирки с использованием комбинаторной библиотеки зарядов TS23t, причем чистку микролоскутков с рисовым крахмалом выполняли в Persil при 40°C. Делается ссылка на пример 10.
Фигура 11 является диаграммой, изображающей эффективность S242Q (черные кружки) и ее вариантов (белые кружки) в анализе с BODIPY-крахмалом как функцию заряда. Комбинаторная библиотека зарядов S242Q (CCL), удельная активность на BODIPY-крахмале, стандартные условия анализа. Делается ссылка на пример 10.
Фигура 12: Панель А является диаграммой, изображающей относительный гидролиз BODIPY-крахмала как функцию относительной экспрессии во встряхиваемой пробирке (т.е. относительный гидролиз BODIPY-крахмала в зависимости от относительной экспрессии во встряхиваемой пробирке); Панель В является диаграммой, изображающей относительный гидролиз крахмала на микролоскутках как функцию относительной экспрессии во встряхиваемой пробирке (т.е. относительный гидролиз крахмала на микролоскутках в зависимости от относительной экспрессии во встряхиваемой пробирке). Делается ссылка на пример 13.
Фигура 13: Панель А является диаграммой, изображающей относительную экспрессию во встряхиваемой пробирке как функцию заряда; Панель В является диаграммой, изображающей относительный гидролиз BODIPY-крахмала как функцию заряда. Делается ссылка на пример 13.
Фигура 14: Панель А является диаграммой, изображающей относительную экспрессию во встряхиваемой пробирке как функцию заряда; Панель В является диаграммой, изображающей относительную активность очистки микролоскутков как функцию заряда. Делается ссылка на пример 13.
Фигура 15 показывает действия добавленного Ca2+ на эффективность расшлихтовки варианта S242Q в сравнении с эффективностью расшлихтовки Ethyl и Xtra в лаундерометре при условиях 85°C, в течение 30 минут при 0,01 м.д. активного белка. Расшлихтовку выполняли в присутствии 0 или 5 м.д. CaCl2. См. пример 14.
Фигура 16 показывает действия добавленного Ca2+ на эффективность расшлихтовки варианта S242Q в сравнении с эффективностью расшлихтовки Ethyl и Xtra в лаундерометре при условиях 97°C, в течение 30 минут при 0,01 м.д. активного белка. Расшлихтовку выполняли в присутствии 0 или 5 м.д. CaCl2. См. пример 14.
ПОДРОБНОЕ ОПИСАНИЕ
1. Определения и аббревиатуры
В соответствии с этим описанием, используются следующие аббревиатуры и определения. Следует отметить, что в данном контексте единственные формы существительных включают в себя множественные формы, если контекст не диктует ясно противоположное. Так, например, ссылка на "полипептид" включает в себя множество таких полипептидов, а ссылка на "готовую форму" включает в себя ссылку на одну или несколько готовых форм и их эквивалентов, известных квалифицированным в данной области специалистам, и т.д.
Если нет другого указания, все технические и научные термины, используемые здесь, имеют такое же значение, какое понимается квалифицированным в данной области специалистом. Ниже обеспечены следующие термины.
1.1. Аббревиатуры
Следующие аббревиатуры применяются, если не указаны другие значения:
AATCC Американская Ассоциация химиков и колористов текстильной промышленности;
ADWавтоматическая мойка посуды;
AEэтоксилат спирта;
AEOэтоксилат спирта;
AEOSэтоксисульфат спирта;
AESэтоксисульфат спирта;
AFAUкислотные единицы грибной α-амилазы;
AGUединицы глюкоамилазной активности;
AOSα-олефинсульфонат;
ASсульфат спирта;
BAAбактериальная α-амилаза;
°Cградусы Цельсия;
CCLкомбинаторная библиотека зарядов;
кДНКкомплементарная ДНК;
CMCкарбоксиметилцеллюлоза;
dEобщее различие окраски, определенное по цветовому пространству CIE-LAB;
dH2Oдеионизованная вода;
dIH2Oдеионизованная вода, Milli-Q фильтрация;
DEдекстрозный эквивалент;
DNAдезоксирибонуклеиновая кислота;
dNTPдезоксирибонуклеотидтрифосфаты;
DOрастворенный кислород;
DP3степень полимеризации с тремя субъединицами;
DPnстепень полимеризации с n субъединицами;
DS (или ds)содержание сухих веществ;
DSCдифференциальная сканирующая калориметрия;
DTMPAдиэтилтриаминпентауксусная кислота;
ECкомиссия по ферментам для классификации ферментов;
EDTAэтилендиаминтетрауксусная кислота;
EDTMPAэтилендиаминтетраметиленфосфоновая кислота;
EOэтиленоксид;
Eqэквиваленты;
ETOHэтанол;
F&HCуход за тканями и бытовой техникой;
ФТЕ"фитазные единицы", фитат-гидролизующая единица;
г (или гм) граммы;
ГАЕглюкоамилазные единицы;
gpgграны на галлон;
г/лграммы на литр;
GenencorDanisco US Inc, Genencor Division, Palo Alto, CA;
H2Oвода;
HDGгранулированный детергент интенсивного режима;
HDLжидкий детергент интенсивного режима;
HFCSфруктозный кукурузный сироп;
HFSSфруктозный сироп на основе крахмала;
HPAEC-PADанионообменная хроматография высокого разрешения с импульсным амперометрическим детектированием;
ч (часы) ч (часы);
IKAIKA Works Inc. 2635 North Chase Parkway SE, Wilmington, NC;
IPTGизопропил-β-D-тиогалактозид;
JPNЯпония;
кгкилограммы;
LAагар Луриа;
LASлинейный алкилбензолсульфонат;
LBбульон Луриа;
LUлипазные единицы;
Mмолярный;
MBD-средасреда на основе MOPS определенного состава;
MES2-(N-морфолино)этансульфоновая кислота;
мгмиллиграммы;
минминута/минуты;
млмиллилитр (или миллилитры);
мммиллиметры;
мМмиллимолярный;
MOPS3-(N-морфолино)пропансульфоновая кислота;
MWмолекулярная масса;
NAСеверная Америка;
нсмньютон-сантиметр;
NEOнеомицин;
нгнанограмм;
нмнанометр;
NOBSнонаноилоксибензолсульфонат;
ннормальный;
NTAнитрилотрехуксусная кислота;
PAHBAHгидразид п-гидроксибензойной кислоты;
ПЦРполимеразная цепная реакция;
ПЭГполиэтиленгликоль;
pIизоэлектрическая точка;
м.д. миллионная доля;
PVAполи(виниловый спирт);
PVPполи(винилпирролидон);
RAUединицы референсной амилазы;
RMSсреднеквадратичное значение;
РНКрибонуклеиновая кислота;
об/минобороты в минуту;
SAPUспектрофотометрическая единица кислой протеазы;
SASвторичные алкансульфонаты;
1X SSC0,15 M NaCl, 0,015 M цитрат натрия, pH 7,0;
сексекунды;
%SRIпроцентный показатель удаления краски;
SSFодновременные осахаривание и ферментация;
TAEDтетраацетилэтилендиамин;
Tm температурная средняя точка для DSC-кривой, или температура плавления белка;
TNBSтринитробензолсульфоновая кислота;
мкгмикрограммы;
мклмикролитры;
мкНммикроньютон-метры;
мкммикрометр;
мкМмикромолярный;
Еединицы;
О/Ообъем/объем;
WEЗападная Европа;
масс.% массовый процент;
м/о (или М/О)масса/объем;
м/м (или М/М)масса/масса;
wtдикий тип.
1.2. Определения
В некоторых аспектах данное описание основывается на рутинных способах и методах, используемых в области генной инженерии и молекулярной биологии. Следующие источники включают в себя описания общей методологии, применимой в соответствии с тем, что описано здесь: Sambrook et al., MOLECULAR CLONING: A LABORATORY MANUAL (2nd Ed., 1989); Kreigler, GENE TRANSFER AND EXPRESSION; A LABORATORY MANUAL (1990) и Ausubel et al., Eds. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (1994).
Эти общие ссылки обеспечивают определения и способы, известные квалифицированным в данной области специалистам. Если нет других указаний, все технические и научные термины, используемые здесь, имеют такие же значения, какие обычно понимаются специалистом с обычной квалификацией в области, к которой относится это описание. Singleton, et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 2D ED., John Wiley and Sons, New York (1994) и Hale & Markham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, NY (1991) обеспечивают одно из руководств с общими словарями многих терминов, используемых в этом описании.
"Выделенные" означает, что выделенное вещество, например, соединение или последовательность, модифицировано рукой человека относительно этого соединения или этой последовательности, обнаруживаемых в природе. Например, выделенная последовательность является по меньшей мере частично свободной, или по существу свободной, по меньшей мере от одного другого компонента, с которым эта последовательность природно ассоциирована при обнаружении в природе.
"Очищенные", при описании материала или вещества, означает, что этот материал или это вещество находится в относительно чистом состоянии, например, является по меньшей мере приблизительно на 90% чистым, по меньшей мере приблизительно на 95% чистым, по меньшей мере приблизительно на 98% чистым или по меньшей мере приблизительно на 99% чистым.
В данном контексте "крахмал" обозначает любую углеводную композицию, содержащую комплексные полисахариды, содержащие амилозу и/или амилопектин формулы (C6H10O5)х, где "X" может быть любым числом. Предпочтительно, крахмалом называют любой такой углевод, который природно присутствует в растениях, в том числе, но не только, в зернах, травах, клубнях и корнях и, более конкретно, происходит из пшеницы, ячменя, кукурузы, ржи, риса, сорго, кассавы, проса, картофеля, сладкого картофеля и тапиоки. Крахмалом называют также синтетические крахмалы или модифицированные крахмалы, такие как химически модифицированный крахмал, для применения в качестве детектируемого субстрата для ферментных анализов, или крахмалы, химически или ферментативно модифицированные для улучшения одного или нескольких свойств, для применения.
В данном контексте "фитиновая кислота" (или инозитгексафосфат (IP6)), является важной запасной формой фосфора во многих тканях растений, таких как отруби, семена и т.п. Фитиновую кислоту называют здесь также "фитатом", в частности, когда она имеет форму соли. Различные другие инозитфосфаты, такие как инозитпента- (IP5), тетра- (IP4) и трифосфат (IP3), также называют здесь фитатами. Фитаты являются обычно трудноперевариваемыми человеком и большинством животных с моногастрическим (однокамерным) желудком.
Ферменты, которые деградируют фитаты, называют здесь "фитазами", и "фитазы" обычно являются миоинозитгексафосфатфосфогидролазами. Фитазную активность определяют в виде фитазных единиц (ФТЕ или Е), где одна ФТЕ определяется как количество фермента, которое высвобождает 1 микромоль неорганического фосфора (Р) в минуту из 0,0015 моль/л фитата натрия при pH 5,5 и 37°C. Это определение обеспечивает применимую меру количества фитазной активности и представляет простое эталонное измерение. Деградирующие фитат ферменты дрожжей (например, Schwanniomyces occidentalis, Pichia anomala, Arxula adeninivorans), грамотрицательных бактерий (например, Escherichia coli, Pseudomonas spp., Klebsiella spp.) и грамположительных бактерий (например, Bacillus spp.) были идентифицированы и охарактеризованы. Известны также фитазы из многих растений и из мицелиальных грибов, таких как Penicillium spp., Aspergillus spp., Trichoderma spp., Mucor piriformis и Cladosporium spp. 3-фитазы (EC 3.1.3.8) и 6-фитазы (EC 3.1.3.26) были охарактеризованы в зависимости от сайта инициации гидролиза. Фитазы были также охарактеризованы на основе их pH-"оптимума" либо как кислые (pH-оптимум около 5), либо как щелочные (pH-оптимум около 9). Доступны различные коммерческие фитазы, в том числе ROVABIO (Genencor International).
"Амилазой" называют фермент, который способен катализировать расщепление крахмального субстрата, приводящее к деградации или частичной деградации крахмала. Амилазы являются обычно гидролазами, которые расщепляют гликозидные связи в крахмале. В данном контексте амилаза включает в себя любую глюкоамилазу, альфа-амилазу, β-амилазу, например, альфа-амилазы дикого типа Bacillus spp., в частности, B. licheniformis. Обычно альфа-амилазы (EC 3.2.1.1; α-D-(1→4)-глюканогидролаза) являются эндо-действующими ферментами, определяемыми как ферменты, расщепляющие α-D-(l→4)-O-гликозидные связи в молекуле крахмала случайным образом. В противоположность этому, экзо-действующие амилолитические ферменты, такие как β-амилазы (EC 3.2.1.2; α-D-(l→4)-глюканмальтогидролаза) и некоторые продукт-специфические амилазы, такие как мальтогенная альфа-амилаза (EC 3.2.1.133), расщепляют субстратную молекулу крахмала от нередуцирующего конца. β-амилазы, α-глюкозидазы (EC 3.2.1.20; α-D-глюкозидглюкогидролаза), глюкоамилаза (EC 3.2.1.3; α-D-(1→4)-глюканглюкогидролаза) и продукт-специфические амилазы могут продуцировать мальтоолигосахариды конкретной длины из крахмала. Альфа-амилазу дикого типа из Bacillus stearothermophilus, или "AmyS"-амилазу, называют здесь иногда XTRA или SPEZYME XTRA, которые являются коммерческими продуктами AmyS из Genencor International.
В данном контексте "AmyS-подобные альфа-амилазы" применимы здесь в качестве исходных