Способ получения наноразмерной системы доставки фрагментов нуклеиновых кислот и их аналогов в клетки млекопитающих
Иллюстрации
Показать всеИзобретение относится к области биохимии, молекулярной биологии и медицины. Предложен способ получения наноразмерной системы доставки фрагментов нуклеиновых кислот (ФНК) и их аналогов в клетки млекопитающих. Получают суспензию наночастиц TiO2 с концентрацией 1-2 мг/мл в 0,1-0,5 M растворе NaCl. При этом частицы TiO2 имеют размер 3-20 нм, преимущественно 3-5 нм, и находятся в аморфной или в кристаллической форме анатаз или брукит. Полученную суспензию TiO2 смешивают с водным раствором полилизина с концентрацией 20 мг/мл в соотношении TiO2:полилизин равном 1:(0,05-0,8). Смесь инкубируют при комнатной температуре в течение не менее 30 мин. Далее к полученной суспензии полилизинсодержащих наночастиц добавляют 5-70 мкл раствора ФНК с концентрацией 10-4-10-7 М и инкубируют в 0,1-0,5 М растворе NaCl при комнатной температуре в течение 20-30 мин. Получают нанокомпозит TiO2-PL·ФНК с емкостью по ФНК 0,2-60 нмоль/мг. Изобретение позволяет упростить способ получения системы доставки ФНК и сократить его длительность. 3 з.п. ф-лы, 3 ил., 14 пр.
Реферат
Изобретение относится к области молекулярной биологии, биоорганической химии и медицины и может быть использовано для создания наноразмерных систем доставки лекарственных средств (в частности, олигонуклеотидов) в клетки.
Использование фрагментов нуклеиновых кислот и их аналогов (ФНК) для селективного воздействия на внутриклеточный генетический материал является одной из важнейших задач современной биологии и фундаментальной медицины. В случае решения этой проблемы открывается возможность широкого использования этого подхода в практической медицине. Однако до конца не решенной проблемой является отсутствие эффективного способа доставки фрагментов нуклеиновых кислот и их аналогов внутрь клетки, поскольку известно, что сами по себе они проникают в клетки в очень малой степени, в первую очередь, из-за гидрофобного характера клеточной мембраны.
Известны способы доставки ФНК в клетки с помощью вирусных векторов [Bouard D. еt al., British Journal of Pharmacology, 2009, v.157, 153-165], путем включения в липосомы [Deshpande, D. et al., Pharm. Res., 1998, v.15, p.1340-1347] путем конъюгирования с катионными полимерами различной природы [Smedt S.C. et al., Pharm. Res., 2000, v.17, 113-126], с помощью электропорации [Baum С. et al., Biotechniques. 1994, v.17, 1058-1062] и др. Однако проблема доставки пока не нашла окончательного решения и продолжает оставаться актуальной задачей.
Известно использование наночастиц различной природы, в частности неорганических наночастиц, в качестве агентов доставки реакционноспособных олигонуклеотидов, обеспечивая тем самым высокоэффективное взаимодействие с внутриклеточными нуклеиновыми кислотами. Описано использование наночастиц фосфата кальция для доставки плазмидной ДНК в стволовые клетки [Сао X. et al., Int. J. Nanomedicine, 2011; 6, 3335-3349]; наночастиц фосфатов магния и марганца для доставки олигонуклеотидов в клетки HeLa [Bhakta G. et al., Biomaterials. 2005, v.26, 2157-2163], наночастиц карбонат-апатита для доставки ДНК в клетки млекопитающих [Hossain S. et al. Anal. Biochem., 2010, v.397, 156-161]; наночастиц благородных металлов для детекции ДНК и их доставки в клетки [Chen XJ et al., Wiley Interdiscip. Rev. Nanomed. NanobiotechnoL, 2012, doi: 10.1002/wnan.ll59].
Известен способ получения наноразмерной системы доставки ДНК-фрагментов в клетки млекопитающих, состоящий в иммобилизации допаминсодержащего олигонуклеотида на TiO2-наночастицы размером ~5 нм [Paunesku Т. et al., NatMater. 2003, v.2, 343-346; Thum K.T. et al. Small 2009, v.5, 1318-1325; Kurepa J. et al., Nano Lett. 2010, v.10, 2296-2302].
Наиболее близким к заявляемому способу - прототипом - является способ получения наноразмерной системы доставки олигонуклеотидов для инактивации внутриклеточного генетического материала, включающий синтез наночастиц диоксида титана, синтез конъюгатов олигонуклеотида с соответствующим линкером (PL-oligo), иммобилизацию конъюгатов на наночастицы диоксида титана (TiO2), при этом иммобилизацию конъюгатов олигонуклеотида с полиаминным линкером проводят в водном растворе при комнатной температуре, а не связавшийся с частицами конъюгат отмывают последовательно растворами KH2PO4 и NaCl. В качестве линкера используют полиамины, содержащие от 3 до 1000 аминогрупп в молекуле, преимущественно полилизин, полиэтиленимин или спермин (заявка RU 2008121609 А, опубл. 10.12.2009).
Синтез конъюгата PL-oligo проводят по известному способу (Патент RU 2236467 C1, oпубл. 20.09.04), основанному на активации 5-- или 3--концевой фосфатной группы незащищенного олигонуклеотида. Предварительно получают цетавлоновую соль олигонуклеотида для придания растворимости в абсолютном органическом растворителе, для чего олигонуклеотид осаждают 8% раствором цетилтриметиламмоний бромида (цетавлона) и осадок сушат в вакууме в течение 16-20 ч. Затем олигонуклеотид в виде цетавлоновой соли активируют с помощью пары трифенилфосфин-ипиридилдисульфид в присутствии нуклеофильного катализатора в абсолютном органическом растворителе (диметилформамиде или диметилсульфоксиде) и образующееся активное производное инкубируют с полиамином (в частности, полилизином, содержащим в среднем 100 аминогрупп в молекуле). В качестве нуклеофильного катализатора используют, преимущественно, метилимидазол, диметиламинопиридин или N-окись диметиламинопиридина. Иммобилизацию полученных конъюгатов PL-oligo на наночастицы диоксида титана проводят следующим образом. Конъюгаты PL-oligo в концентрации 10-5 М (по олигонуклеотиду) смешивают с наночастицами TiO2 в соотношении 1-50 нмол PL-oligo на 1 мг наночастиц и выдерживают смесь при перемешивании в течение 1 (или более) часа при 20-50°С. Несвязавшийся конъюгат PL-oligo отмывают последовательно буферными растворами. Наночастицы диоксида титана используют как в аморфной, так и в кристаллической форме. Описанный способ позволяет получать конъюгаты олигонуклеотидов с полиаминами с выходом 90-100%. Процесс получения конъюгата PL-oligo занимает 1-1.5 суток (не менее 24 ч). В целом процесс получения наноразмерной системы доставки олигонуклеотидов (нанокомпозит) занимает 1.5-2 суток (не менее 36 ч).
Полученные нанокомпозиты TiO2-PL-oligo с емкостью по oligo, составляющей 0.1-40 нмоль на 1 мг TiO2, способны проникать в клетки и ингибировать размножение вируса гриппа А путем расщепления мишенной цепи вирусной РНК.
Недостатками известного способа являются сложность и длительность из-за необходимости предварительного получения полилизинового производного олигонуклеотида, а также ограниченные функциональные возможности вследствие того, что в качестве фрагментов нуклеиновых кислот используются только олигодезоксирибонуклеотиды длиной 10-40 звеньев.
Задачей изобретения является создание более простого и менее длительного способа с более широкими функциональными возможностями.
Поставленная задача достигается заявляемым способом, заключающимся в следующем.
Наночастицы диоксида титана (TiO2) получают известным способом (заявка RU 2008121609 А, опубл. 10.12.2009). Суспензию, содержащую наночастицы TiO2 в аморфной или кристаллической (анатаз, брукит) форме размером 3-20 нм, преимущественно 3-5 нм с концентрацией 1-2 мг/мл, смешивают с водным раствором полилизина с концентрацией 20 мг/мл (что соответствует 0,1 М концентрации по аминогруппам) в соотношении TiO2:полилизин равном 1:(0.05-0.8) и инкубируют в 0.1-0.5 М растворе NaCl при комнатной температуре в течение не менее 30 мин. К полученной суспензии полилизинсодержащих наночастиц (TiO2-PL) добавляют рассчитанное количество 10-4-10-7 М раствора соответствующего ФНК длиной 10-1500 звеньев и инкубируют в 0.1-0.5 М растворе NaCl, при комнатной температуре в течение 20-30 мин. ФНК связываются с TiO2-PL за счет электростатического взаимодействия положительно заряженных аминогрупп полилизина (NH2) и отрицательно заряженных межнуклеотидных фосфатных групп олигонуклеотида (р). Выход целевого продукта составляет 80-90%. Получают наноразмерную систему доставки ФНК в клетки, представляющую собой нанокомпозит TiO2-PL·ФНК с емкостью по ФНК, составляющей 0.2-60 нмоль/мг в зависимости от длины ФНК и от емкости наночастиц по аминогруппам. Длительность способа составляет 1.5-2 часа.
Получаемая заявляемым способом наноразмерная система доставки ФНК в клетки состоит из наночастиц диоксида титана, покрытых полилизином, на которых иммобилизованы ФНК, способные проникать в эукариотические клетки путем обычного эндоцитоза без использования дополнительных внешних методов трансфекции, и направленно воздействовать на внутриклеточный генетический материал и подавлять его дальнейшее функционирование.
Определяющими отличительными признаками предлагаемого способа от прототипа является следующее.
1. Для получения основы для иммобилизации ФНК наночастицы TiO2 в виде суспензии с концентрацией 1-2 мг/мл в 0.1-0.5 М растворе NaCl смешивают с водным раствором полилизина с концентрацией 20 мг/мл в соотношении TiO2:полилизин равном 1:(0.05-0.8) и инкубируют при комнатной температуре в течение не менее 30 минут, что позволяет получать нанокомпозит TiO2-PL высокого качества, а также упростить способ и сократить его длительность за счет исключения предварительного получения полилизинового производного олигонуклеотида.
2. Последующую иммобилизацию ФНК на TiO2-PL осуществляют путем добавления к суспензии полилизинсодержащих наночастиц 5-70 мкл 10-4-10-7М раствора соответствующего ФНК и инкубации в растворе NaCl при комнатной температуре в течение 20-30 минут, что позволяет получать достаточно прочный нанокомпозит TiO2-PL·ФНК за счет электростатического связывания отрицательно заряженных фосфатных групп ФНК с положительно заряженными аминогруппами полилизина на поверхности наночастиц, а также упростить способ и сократить общее время получения нанокомпозита более чем в 10 раз, при сохранении высокого выхода и качества целевого продукта.
3. В качестве ФНК используют ДНК- и РНК-фрагменты и их аналоги длиной 10-1500 звеньев, в частности, олигодезоксирибонуклеотиды, олигорибонуклеотиды, тиофосфатные аналоги олигодезоксирибонуклеотидов, ДНК-фрагменты длиной до 1500 звеньев, что позволяет расширить функциональные возможности способа (в прототипе в качестве ФНК используют только олигодезоксирибонуклеотиды длиной 10-40 звеньев).
Заявляемый способ обеспечивает практически такую же емкость нанокомпозита по ФНК, как и известный способ (прототип), и высокую прочность связывания ФНК с частицами: промывка 1 М NaCl, горячей водой и буфером 1×PBS приводила к потере не более 10-20% иммобилизованного ФНК. Кроме этого, предлагаемый способ обеспечивает возможность иммобилизовывать на наночастицы любые ФНК и их аналоги, содержащие отрицательные заряды на межнуклеотидных фосфатных группах, а не только природные олигодезоксирибонуклеотиды.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1. Получение TiO2-PL.
К 1 мл суспензии наночастиц TiO2 размером 3-5 нм в кристаллической форме анатаз с концентрацией 1 мг/мл в 0.1 М NaCl добавили 10 мкл водного раствора поли-L-лизина гидробромида (PL, фракция с молекулярным весом 15000-30000, Sigma-Aldrich, США) с концентрацией 20 мг/мл (0.1 М по аминогруппам) в соотношении TiO2:PL равном 1:0.2 и инкубировали при комнатной температуре при интенсивном перемешивании в течение 30 мин. После центрифугирования реакционной смеси супернатант заменяли на новую порцию 0.1 М NaCl (1 мл) и получали композит TiO2-PL с концентрацией частиц в суспензии - 1 мг/мл и с емкостью по аминогруппам 1 мкмоль/мг.
Для элементного анализа наночастицы отделяли от супернатанта, сушили в вакууме. Элементный анализ для TiO2-PL (TiO2 в форме анатаз): (Ti - 42.2%, N - 2.09%, С - 6.8%), что соответствует отношению NH2/TiO2=1 мкмоль/мг, т.е. выход присоединения полилизина к наночастицам практически количественный.
Пример 2.
Способ осуществляли аналогично примеру 1, за исключением того, что вместо анатаза использовали наночастицы размером 5-20 нм в аморфной форме.
Пример 3.
Способ осуществляли аналогично примеру 1, за исключением того, что вместо анатаза использовали наночастицы в кристаллической форме брукит.
Пример 4.
Способ осуществляли аналогично примеру 1, за исключением того, что к 0.5 мл суспензии наночастиц с концентрацией 2 мг/мл добавляли 2.5 мкл раствора полилизина с концентрацией 20 мг/мл в соотношением TiO2:PL=1:0.05. В результате получали композит TiO2-PL с концентрацией частиц в суспензии -1 мг/мл и с емкостью по аминогруппам 0.25 мкмоль/мг.
Пример 5.
Способ осуществляли аналогично примеру 1, за исключением того, что к наночастицам в 0.5 М NaCl добавляли 40 мкл раствора полилизина с концентрацией 20 мг/мл в соотношением TiO2:PL=1:0.8. В результате получали композит TiO2-PL с концентрацией частиц в суспензии -1 мг/мл, и с емкостью по аминогруппам 4 мкмоль/мг.
Пример 6. Получение нанокомпозитов TiO2-PL·ФНК
Нанокомпозиты TiO2-PL·oligol и TiO2-PL·oligo2 получали, добавляя 10 мкл 10-4 М раствора 21-звенных олигодезоксирибонуклеотидов d(5'GCAAAAGCAGGGTAGATAATCp) (oligo1) или d(5'GATCAACTCCATATGCCATGTp) (oligo2) к 0.1 мл суспензии композита TiO2-PL, полученного, как описано в примере 1, и инкубировали в 0.1 растворе NaCl при комнатной температуре в течение 30 минут. Через 30 мин интенсивного встряхивания суспензии промывали 0,1 М NaCl (2×100 мкл) и буфером 1×PBS (1×100 мкл). Частицы отделяли от супернатанта центрифугированием. Выход иммобилизации, т.е. образования нанокомпозита TiO2-PL×oligo, определяли по отношению (А0-Ac)/А0, где A0 и Ac - оптическое поглощение олигонуклеотида в исходном растворе и в супернатанте соответственно. Выход нанокомпозитов составил ~90%; емкость по олигонуклеотиду ~9 нмоль/мг.
Пример 7.
Способ осуществляли аналогично примеру 6, за исключением того, что к 0.1 мл суспензии TiO2-PL, полученной как описано в примере 5, добавляли 70 мкл 10-4 М раствора 10-звенного олигодезоксирибонуклеотида d(5'CATCCAGGATp) (oligo3) и получали нанокомпозит TiO2-PL·oligo3 с выходом ~90% и емкостью по олигонуклеотиду ~60 нмоль/мг.
Пример 8.
Способ осуществляли аналогично примеру 6, за исключением того, что к TiO2-PL добавляли 5 мкл 10-4 М раствора 30-звенного олигорибонуклеотида 5'CUGCUGUACAUGGCACAUGGAAUUGAUUA (oligo4) или 10 мкл 10-4 М раствора 16-звенного аналога олигодезоксирибонуклеотида dps(CCGTCGGTACCGGCCG) (oligo5), содержащего межнуклеотидные тиофосфатные группы (ps) и получали нанокомпозиты TiO2-PL·oligo4 и TiO2-PL·oligo5 с выходом ~90% и емкостью по олигонуклеотиду ~4.5 нмоль/мг и ~9 нмоль/мг соответственно.
Пример 9.
Способ осуществляли аналогично примеру 6, за исключением того, что к 5 мкл композита TiO2-PL (5 мкг TiO2), полученному по примеру 4, добавляли 5 мкл 1500-звенного фрагмента ДНК (oligo6) с концентрацией 100 мкг/мл, или 2·10-7 М (0.5 мкг или 1·10-3 нмоль) и получали нанокомпозит TiO2-PL·oligo6 с выходом ~95% и емкостью по олигонуклеотиду ~0.2 нмоль/мг.
Пример 10.
К 0.1 мл суспензии композита TiO2-PL, полученного как описано в примере 4 и содержащего 0.25 мкмоль/мг аминогрупп, добавляли 20 мкл 10-5 М раствора олигонуклеотида 5'GCAAAAGCAGGGTAGATAATCp (oligo1). Далее все операции проводили, как описано в примере 6, и получали нанокомпозиты TiO2-PL·oligol с выходом ~80% и емкостью по олигонуклеотиду ~1.6 нмоль/мг.
Пример 11.
Способ осуществляли аналогично примеру 6, за исключением того, что к TiO2-PL добавляли 10 мкл 10-4 М флуоресцентно-меченного олигонуклеотида oligol-Flu, и получали нанокомпозит TiO2-PL·oligo1(Flu) с емкостью по олигонуклеотиду ~9 нмоль/мг.
Пример 12. Оценка способности нанокомпозитов TiO2-PL·ФНК проникать в клетки.
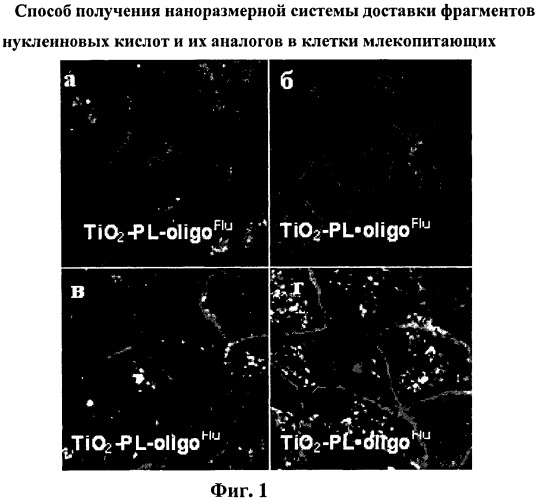
В эксперименте использовали клетки линий КСТ, HeLa и MDCK (полученные из коллекции культур клеток ФБУН ГНЦ ВБ «Вектор», п.Кольцове, Новосибирская обл.), красители для окрашивания клеточных ядер и мембран (DAPI и Cell Mask Plasma Membrane Stain) и питательную среду для клеток DMEM, эмбриональную телячью сыворотку (ЭТС), антибиотики, буфер PBS (Invitrogen, США). Для приготовления образцов для конфокальной микроскопии клетки культивировали в полной среде DMEM в 8-луночных камерах до достижения 70% монослоя, после этого полную среду заменяли на среду без сыворотки, стрептомицина и пенициллина (160 мкл). Затем добавляли исследуемый нанокомпозит TiO2-PL·oligol(Flu), полученный, как описано в примере 11, и для сравнения - TiO2-PL·oligo1(Flu), полученный известным способом (прототип) (по 40 мкл в лунку) до конечной концентрации 0.01 мг/мл по TiO2 и 1 мкмоль/мл по олигонуклеотиду. После 24-часовой инкубации клетки отмывали буфером PBS, фиксировали и окрашивали красителями (DAPI для ядер, голубой цвет и Cell Mask Plasma Membrane Stain для клеточных мембран, красный цвет) в течение 10 мин. Препараты анализировали с помощью конфокального лазерного сканирующего микроскопа LSM 510 UV MetaMicroscope (Carl Zeiss, Inc.).
На фиг.1 представлены изображения клеток HeLa (a, б) и MDCK (в, г). Флуоресцеин-меченые нанокомпозиты проявляются в виде белых точек. Видно, что способность проникновения в клетки нанокомпозитов TiO2-PL·oligo, полученных заявляемым способом (фиг.1б, г) и нанокомпозитов TiO2-PL·oligo, полученных способом-прототипом (фиг.1а, в) практически не отличается.
Пример 13. Оценка цитотоксичности нанокомпозитов.
Для оценки цитотоксичности нанокомпозитов использовали метод окраски мертвых клеток с помощью красителя трипанового синего [Altaian S. et al., Biotechnol. Prog. 1993, v.3, 671-674]. В экспериментах использовали клетки линии MDCK. Клетки высевали с посадочной концентрацией 100000 кл/мл в питательной среде RPMI-1640, содержащей 10% сыворотки крови плодов коровы, L-глутамин и антибиотики, по 100 мкл/лунку 96-луночного планшета. Через 2 суток после образования сплошного монослоя клетки использовали в экспериментах, для чего их предварительно трижды промывали питательной средой, не содержащей сыворотку, в объеме 200 мкл/лунку.
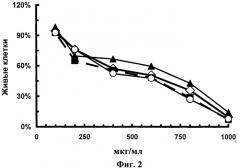
Затем клетки инкубировали с нанокомпозитом TiO2-PL·oligo1, полученным, как описано в примере 6, и нанокомпозитом TiO2-PL·oligo1, полученным известным способом (прототип), а также образцом TiO2-PL, полученным, как описано в примере 1, и с исходными TiO2-наночастицами в концентрации от 100 до 1000 мкг/мл при 37°С, 5% CO2 и 100% влажности в течение 48 ч. Контролем служили необработанные клетки. После инкубации клетки промывали свежей культуральной средой и затем удаляли с планшетов смесью, содержащей 0,25% трипсина и 0,2% ЕДТА (1; 1) и окрашивали 0,025% трипановым синим. Число живых и мертвых клеток считали под микроскопом Leica DM 2500. Все эксперименты повторены 3 раза. Результаты представлены на фиг.2, где белые ромбы - TiO2, черные квадраты - TiO2-PL, черные треугольники - TiO2-PL·oligo1, белые круги - TiO2-PL·oligo1. Из фиг.2 видно, что выживаемость клеток примерно одинакова для всех исследуемых образцов.
Пример 14. Исследование противовирусной активности нанокомпозитов.
В экспериментах использовали вирус гриппа A/Aichi/2/68 (H3N2) с исходным титром 108,5 ТЦД50/мл. Исследовали противовирусные свойства нанокомпозитов TiO2-PL·oligo1 и TiO2-PL·oligo2, полученных как описано в примере 6, и TiO2-PL·oligo1 и TiO2-PL·oligo2, полученных известным способом (прототип), а также контрольных образцов TiO2 и TiO2-PL. В качестве наночастиц использовали TiO2 в форме анатаз, а в качестве адресующей части нанокомпозитов олигонуклеотиды: oligo1, комплементарный 3'-концу вирусной (-)РНК и имеющий выраженные противовирусные свойства по отношению к вирусу гриппа A H5N1, и oligo2, имеющий случайную последовательность той же длины.
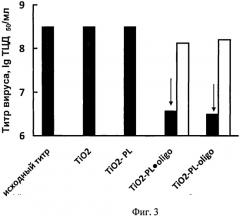
Противовирусные свойства нанокомпозитов были исследованы на культуре клеток MDCK. Использовали среду DMEM с добавлением 2% FBS, глютамина и антибиотиков. Клетки культивировали, как описано в примере 13. Препараты разводили средой RPMI-1640, содержащей 2 мкг/мл трипсина, и вносили на монослой отмытых от сыворотки клеток MDCK в объеме 50 мкл на лунку 96-луночного планшета из расчета 100 мкг/мл по отношению к наночастицам или 10 мкМ по отношению к олигонуклеотиду в конечной реакционной смеси. Реакционные смеси инкубировали при 37°С и 100% влажности в СО2-инкубаторе в течение 1 ч. Затем вносили вирус A/Aichi/2/68 (H3N2) в разведениях на среде RPMI-1640, содержащей 2 мкг/мл трипсина, от -1 до -8 с десятикратным шагом в объеме 50 мкл/лунку. Инкубировали в течение 2 суток в CO2-термостате при 37°С и 100% влажности; определяли наличие вируса визуально под микроскопом по ЦПД и в РГА с 1% эритроцитами петуха. Значения титра вируса в логарифмической шкале приведены на фиг.3.
В качестве дополнительных контролей использовали:
а) контроль клеток MDCK (вносили по 100 мкл/лунку питательной среды RPMI-1640, содержащей 2 мкг/мл трипсина);
б) контроль вируса A/Aichi/2/68 (H3N2) (вносили 50 мкл/лунку среды и через 1 ч инкубации вносили вирус по 50 мкл/лунку в разведениях на среде RPMI-1640, содержащей 2 мкг/мл трипсина, от -1 до -8 с десятикратным шагом).
Все препараты были проверены на противовирусную активность при n=6.
Из фиг.3 следует, что нанокомпозиты TiO2-PL·oligo1 и TiO2-PL-oligol. проявляют практически одинаковую противовирусную активность (98.8% и 99% соответственно; отмечено стрелками). В обоих случаях нанокомпозиты оказывают специфическое действие, поскольку нанокомпозиты, содержащие случайную последовательность oligo2 (белые столбцы на фиг.3), подавляют размножение вируса в гораздо меньшей степени. Контрольные образцы - TiO2-наночастицы и конъюгаты TiO2-PL - практически не оказывают никакого действия.
Предлагаемый способ позволяет существенно упростить и сократить длительность, а также расширить функциональные возможности известного способа (прототипа) и обеспечить получение нанокомпозитов, представляющих собой наноразмерные системы доставки фрагментов нуклеиновых кислот и их аналогов в клетки млекопитающих. При этом получаемые заявляемым способом нанокомпозиты обладают свойствами, подобными нанокомпозитам, получаемым известным способом, а именно: такой же емкостью по ФНК, в частности, олигодезоксирибонуклеотиду, высокой прочностью связывания олигонуклеотида с частицами, способностью проникать через клеточную мембрану, аналогичной цитотоксичностью и специфической противовирусной активностью по отношению к вирусу гриппа А.
1. Способ получения наноразмерной системы доставки фрагментов нуклеиновых кислот (ФНК) и их аналогов в клетки млекопитающих, включающий синтез наночастиц диоксида титана (TiO2) и иммобилизацию ФНК на поверхность наночастиц, отличающийся тем, что предварительно наночастицы в виде суспензии с концентрацией 1-2 мг/мл в 0,1-0,5 M растворе NaCl смешивают с водным раствором полилизина с концентрацией 20 мг/мл в соотношении TiO2:полилизин равном 1:(0,05-0,8) и инкубируют при комнатной температуре в течение не менее 30 мин, далее к полученной суспензии полилизинсодержащих наночастиц (TiO2-PL) добавляют 5-70 мкл 10-4-10-7 М раствора соответствующего ФНК и инкубируют в растворе NaCl при комнатной температуре в течение 20-30 мин.
2. Способ по п.1, отличающийся тем, что используют наночастицы диоксида титана, имеющие размер 3-20 нм, преимущественно 3-5 нм, и находящиеся в аморфном состоянии или в кристаллической модификации анатаз или брукит.
3. Способ по п.1, отличающийся тем, что в качестве полилизина используют препарат поли-L-лизина гидробромида с молекулярным весом 15000-30000.
4. Способ по п.1, отличающийся тем, что в качестве ФНК используют ДНК- и РНК-фрагменты и их аналоги длиной 10-1500 звеньев.