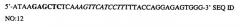Способ синтеза белка с модифицированным профилем n-гликозилирования в растениях
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу синтеза целевого белка с пониженным ксилозилированием, пониженным фукозилированием или их комбинацией. Способ включает в себя введение в растение, часть растения или растительную клетку нуклеотидной последовательности на 80-100 % идентичной нуклеотидной последовательности, определенной в SEQ ID NO: 17, и кодирующей составной белок, содержащий цитоплазматический концевой сегмент, трансмембранный домен, стволовую область (CTS домен) N-ацетилглюкозаминилтрансферазы (GNT1), слитую с каталитическим доменом бета-1,4-галактозилтрансферазы (GalT), причем указанная первая нуклеотидная последовательность функционально связана с первой регуляторной областью, являющейся активной в растении; и второй нуклеотидной последовательностью для кодирования целевого белка, причем указанная вторая нуклеотидная последовательность функционально связана со второй регуляторной областью, являющейся активной в растении, а также транзиентную коэкспрессию первой и второй нуклеотидных последовательностей с синтезом целевого белка, содержащего гликаны, с пониженным ксилозилированием, пониженным фукозилированием или их комбинацией при сравнении с таким же целевым белком, полученным из дикого растения. Раскрыты нуклеиновая кислота, кодирующая белок, модифицирующий гликозилирование целевого белка, составной белок для модификации гликозилирования целевого белка, нуклеиновая кислота, его кодирующая, а также растение, растительная клетка и семя, содержащие указанную нуклеиновую кислоту или указанный составной белок. Изобретение позволяет эффективно получать целевой белок с пониженным ксилозилированием, пониженным фукозилированием или их комбинацией. 7 н. и 13 з.п. ф-лы, 7 ил., 9 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение имеет отношение к способам модифицированного продуцирования гликопротеинов в растениях. Настоящее изобретение также предполагает использование растений с модифицированным продуцированием гликопротеинов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Иммуноглобулины (ИгГ) - это сложные гетеромиллиметровые белки с характерной аффинностью для конкретных антигенных аналогов различной природы. В настоящее время регулярное изолирование клеточных линий, образующих ИгГ, и появление технологий для ориентированной на ИгГ эволюции, а также молекулярной инженерии серьезно повлияло на их развитие в качестве биотерапии и на общий рынок продукции медико-биологических исследований. Терапевтические моноклональные ИГГ (моноклональные антитела (МКА)) доминируют на существующем рынке новых противовоспалительных и противораковых средств терапии. А в настоящее время сотни новых потенциальных лечебных препаратов находятся на стадии исследований и клинических испытаний с целью улучшения их свойств или определения новых направлений их применения. Годовая потребность рынка МКА колеблется в пределах от нескольких грамм (диагностика), нескольких килограмм (антитоксины) до одной или нескольких сотен килограммов (биозащита, противораковые, противоинфекционные, противовоспалительные препараты).
Несмотря на то, что культивирование клеток СНО продолжает оставаться предпочтительным основным производством промышленного масштаба, общепризнано, что для того чтобы МКА достигли своего полного влияния на рынок продукции медико-биологических исследований, необходимо создать резервные производственные мощности. Поскольку мощности, необходимые для производства этих культур, не могут быть легко реконструированы по масштабу, расходы на их возведение и содержание являются слишком высокими и постоянно увеличиваются, а их легализация в соответствии с правилами организации производства и контроля качества лекарственных средств (GMP) пока занимает в среднем три года после их создания. Даже на ранних стадиях развития выбор клеточных линий СНО с приемлемым результатом на выходе и эффективностью производства остается дорогостоящим и длительным процессом. Новые производственные мощности, которые снизят растущие расходы (более высокий выход продукции, более простые технологии и инфраструктуры), имеют более короткое время ввода в эксплуатацию, являются легко перераспределяемыми, в то время как соблюдение действующих на данный момент свойств воспроизводимости, качества и безопасности находящихся в обращении систем клеточных культур, вероятно, будет значительно влиять на разработку МКА и вакцин для рынка продукции медико-биологических исследований на каждый стадии развития.
Растения являются удобными «хозяевами» для получения МКА и ряда других белков, применяемых в настоящее время в биологических научных исследованиях (см. Ко и Koprovski, 2005; Ма с соавт., 2005; Yusibov с соавт., 2006 для обзоров последних результатов). Получение МКА происходило в стабильных линиях трансгенных растений с выходом до 200 мг/кг сырой массы (СМ) и путем переходной экспрессии в объемах до 20 мг/кг CM (Kathuria, 2002). В отчете Giritch с соавт. (2006) упоминаются уровни экспрессии величиной 200-300 мг/кг листовой массы для ИГГ, один из упомянутых уровней составляет максимум 500 мг/кг, достигнут путем использования системы переходной экспрессии.
Процесс N-гликолизации у растений и млекопитающих различен. Последние шаги N-гликолизации в клетке млекопитающих присоединяют β1,4 галактозу, α1,6 фукозу (бета-1,4 галактозу, альфа1,6 фукозу) и конечные остатки сиаловой кислоты к сложным гликанам. Однако в растениях добавляются остатки β1,3 галактозы, α1,3 фукозы (бета-1,3 галактозы, альфа1,3 фукоза), α1,4 фукозы и β1,2 ксилозы (альфа1,4 фукоза и бета1,2 ксилоза). Альфа1,3 фукоза и бета1,2 ксилоза, являются компонентами глико-эпитопов ряда растительных аллергенов. Эти остатки считаются потенциально иммуногенными (аллергенными), и их появление в лечебных белках, включая антитела, считается нежелательным.
Присоединение последовательности KDEL к С-концу пептида обычно используется для обеспечения извлечения пептида из клетки Гольджи с его возвращением в ЭР (эндоплазматический ретикулом). Такой подход был применен для получения нефукозилированного и нексилозилированного антитела при использовании агроинфильтрации листьев табака (Sriraman с соавт., 2004). Однако присоединенный KDEL-пептид является потенциальным аллергеном, поэтому данный подход имеет ограниченное применение в продуцировании лечебных белков.
Контроль присоединения α1,3 фукозы (альфа1,3 фукозы) и β1,2 ксилозы (бета1,2 ксилозы) был также достигнут путем модифицирования экспрессии фукозилтрансферазы и ксилозилтрансферазы. Мутанты, неспособные присоединять α1,3 фукозу и β1,2 ксилозу к сложным гликанам, были получены из мха (Physcomitrella patens; Koprivova с соавт., 2004) и Arabidopsis thaUana (Strasser с соавт., 2004). Частичное ингибирование экспрессии фукозилтрансферазы и ксилозилтрансферазы растения было также достигнуто путем экспрессии РНК-ингибирования (РНК/нацеленное на гены α1,3 фукозилтрансферазы и β1,2 ксилозилтрансферазы в Lemna minor Кокс с соавт., 2006 г.). Однако полное ингибирование этой ферментативной активности оказывает вредное воздействие на некоторые виды растений, поскольку они мешают нормальному течению ключевых, связанных с развитием событий, например формирование пыльцы или завязывание семян. Вызванная РНК-ингибированием специфичная деградация иРНК (информационной РНК) не может оставаться стабильной длительное время, и она не может быть применена к широкому спектру базирующихся на растениях платформ, используемых для получения лечебных препаратов, поскольку, как сообщалось в отчетах, она чувствительна к воздействию факторов окружающей среды.
Патент WO 03/078637 содержит описание применения галактозилтрансферазы человека для ускорения присоединения конечной β1,4 галактозы (GalT) к гликанам растения. Экспрессия галактозы и направление ее действия на цис Гольджи путем использования синтеза с трансмембранным доменом ксилозилтрансферазы привела к присоединению конечной галактозы и уменьшению специфических остатков в растении, несущем N-гликаны (см. также Bakker с соавт., 2006). Разведение таких растений, содержащих рекомбинантный ИГГ, привело к значительному, но переменному снижению гликанов, включающих в себя фукозу и ксилозу.
Прикрепление остатка бета-1,4-связанного N-ацетилглюкозамина (GlnANc) к бета-связанной маннозе для получения деленной пополам GlcNac ускоряется N-ацетилглюкозаминилтрансферазой III (GnT-III; EC 2.4..1.144). Введение данного энзима было описано Rouwendal с соавт. в 2007 г., а растения, экспрессирующие белки, содержали GnT-III со сложными N-гликанами, были поделены пополам и несли два остатка GlnAc.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение имеет отношение к способам модифицирования продуцирования гликопротеина в растениях. Настоящее изобретение также предлагает растения с модифицированным продуцированием гликопротеина.
Целью настоящего изобретения является предложение усовершенствованного способа модифицирования образования гликопротеина в растениях.
Предлагается нуклеиновая кислота, имеющая нуклеотидную последовательность (А), содержащую нуклеотиды 1-1077 последовательности SEQ ID NO. 17 (GNT1-GalT; фиг.5d) или содержащую нуклеотидную последовательность, демонстрирующую от 80 до 100% идентичность с нуклеотидами 1-1077 последовательности SEQ ID NO. 17, что подтверждается путем использования следующих параметров: Программа: blastn; База данных: номер; Expect 10; фильтр: малой сложности; Расположение: парами; Размер слова: 11, где нуклеотидная последовательность кодирует белок, который модифицирует гликозилирование целевого белка.
Также предлагается нуклеиновая кислота, имеющая нуклеотидную последовательность (В), содержащую первую последовательность нуклеиновой кислоты, имеющей нуклеотиды 5-1198 последовательности SEQ ID NO. 14 (GalT), или содержащую нуклеотидную последовательность, демонстрирующую от 80 до 100% идентичность с нуклеотидами 5-1198 последовательности SEQ ID NO. 14, что подтверждается путем использования следующих параметров: Программа: blastn; База данных: номер; Expect 10; фильтр: малой сложности; Расположение: парами; Размер слова: 11, где первая последовательность нуклеиновой кислоты кодирует белок, который модифицирует гликозилирование целевого белка, а первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, содержащей 35S, или пластоцианин, промотер.
Настоящее изобретение описывает нуклеиновую кислоту, имеющую нуклеотидную последовательность, содержащую нуклеотиды 1-1641 последовательности SEQ ID NO. 26 (GNT1-GnT-III) или содержащую нуклеотидную последовательность, демонстрирующую от 80 до 100% идентичность с нуклеотидами 1-1641 последовательности SEQ ID NO. 26, что подтверждается путем использования следующих параметров: Программа: blastn; База данных: номер; Expect 10; фильтр: малой сложности; Расположение: парами; Размер слова: 11, где нуклеотидная последовательность кодирует белок, который модифицирует гликозилирование целевого белка.
Также приводится описание нуклеиновой кислоты, имеющей нуклеотидную последовательность, содержащую первую последовательность нуклеиновой кислоты, имеющей нуклеотиды 1-1460 последовательности SEQ ID NO. 16 (GnT-III) или содержащую нуклеотидную последовательность, демонстрирующую от 80 до 100% идентичность с нуклеотидами 1-1460 последовательности SEQ ID NO. 16, что подтверждается путем использования следующих параметров: Программа: blastn; База данных: номер; Expect 10; фильтр: малой сложности; Расположение: парами; Размер слова: 11, где первая последовательность нуклеиновой кислоты кодирует белок, который модифицирует гликозилирование целевого белка, а первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, содержащей 35S, или промотер пластоцианина.
Кроме того, предлагается растение, растительная клетка и семя, содержащие нуклеотидные последовательности (А), (В), (С) или (D), рассмотренные выше.
Настоящее изобретение также имеет отношение к составному (гибридному) белку GNT1-GalT, содержащему CTS домен N-ацетилглюкозаминилтрансферазы, слитый с каталитическим доменом бета 1,4 галактозилтрансферазы, а также содержащий последовательность SEQ ID NO. 18. Аминокислотная последовательность последовательности SEQ ID NO. 18 может быть закодирована нуклеотидной последовательностью SEQ ID NO. 17.
Также предлагается растение, растительная клетка или семя, содержащее только что упомянутый составной белок. Кроме того, предлагается растение, растительная клетка или семя, содержащее нуклеиновую кислоту, имеющую последовательность SEQ ID NO. 17.
Настоящее изобретение включает в себя составной (гибридный) белок GNT1- GnT-III, содержащий CTS домен N-ацетилглюкозаминилтрансферазы, слитый с каталитическим доменом N-ацетилглюкозаминилтрансферазы III, а также содержащий аминокислотную последовательность SEQ ID NO. 20, Аминокислотная последовательность последовательности SEQ ID NO. 21 может быть закодирована нуклеотидной последовательностью SEQ ID NO. 26.
Также предлагается растение, растительная клетка или семя, содержащее только что упомянутый составной белок. Кроме того, предлагается растение, растительная клетка или семя, содержащее нуклеиновую кислоту, имеющую нуклеотидную последовательность SEQ ID NO. 26.
В соответствии с настоящим изобретением предлагается способ (1) синтезирования целевого белка, содержащего экспрессию в пределах растения или части растения, нуклеотидную последовательность, кодирующую первую нуклеотидную последовательность, кодирующую составной белок GNT1-GalT, содержащий CTS домен N-ацетилглюкозаминилтрансферазы (GNT1), слитый с каталитическим доменом бета 1,4 галактозилтрансферазы (GalT), первую нуклеотидную последовательность, функционально связанную с первой регуляторной областью, являющейся активной в растении, а также вторую нуклеотидную последовательность для кодирования целевого белка. Вторая нуклеотидная последовательность функционально связана со второй регуляторной областью, являющейся активной в растении, и экспрессию первой и второй нуклеотидных последовательностей на синтезирование целевого белка, содержащего гликаны с модифицированным N-гликозилированием.
Как изложено выше, первая нуклеотидная последовательность и вторая нуклеотидная последовательность могут быть экспрессированы в растении неустойчиво, или они могут быть экспрессированы стабильно. Далее, первая регуляторная область может быть первым тканеспецифичным промотором, а вторая регуляторная область является вторым тканеспецифичным промотором. Как первый, так и второй промоторы могут быть промоторами пластоцианина.
В настоящем изобретении также предлагается способ (2) синтезирования целевого белка. Данный способ аналогичен по описанию способу 1, при этом целевой белок может быть антителом. Если целевой белок является антителом, то вторая нуклеотидная последовательность, кодирующая целевой белок, содержит нуклеотидную последовательность 2А, функционально связанную с регуляторной областью 2А, которая является активной в пределах растения, а также вторая нуклеотидная последовательность 2В, функционально связанная с регуляторной областью 2В, которая является активной в растении, а также продукт, кодируемый каждой из последовательностей 2А и 2В, объединяются для получения белка. Регуляторная область 2А может быть промотором пластоцианина, а регуляторная область 2В может быть также промотором пластоцианина.
В настоящем изобретении также предлагается рассмотренный выше способ (1) или способ (2), где третья нуклеотидная последовательность экспрессируется в растении. Третья нуклеотидная последовательность, кодирующая суппрессора сайленсинга (подавителя механизма «выключения» генов), функционально связана с третьей регуляторной областью, являющейся активной в растении. Третьей нуклеотидной последовательностью, кодирующей суппрессора сайленсинга, может быть, например, HcPro, TEV-p1/HC-Pro? BYV-p21, TBSV-p19, TCV-CP, CMV-2b, PVX-p25, PVM-p11, PVS-p11, BScV-p16, CTV-p23, GLRaV-2 p24, GBV-p14, HLV-p10, GCLV-p16 или GVA-p10. Третий тканевый промотер может быть промотором пластоцианина.
В настоящем изобретении предлагается система экспрессии растения для сушки экспрессии целевого белка в растении, где целевой белок содержит модифицированный паттерн гликозилирования. Например, целевой белок содержит редуцированные фукозилированные, ксилозилированные или одновременно фукозилированные и ксилозилированные N-гликаны. В качестве варианта, целевой белок может содержать модифицированный паттерн гликозилирования, при котором в протеине отсутствуют фукозилированные, ксилозилированные или одновременно фукозилированные и ксилозилированные остатки, а сам белок демонстрирует увеличенное галатолизирование. Кроме того, может произойти присоединение терминальной галактозы, что приведет к снижению или исчезновению фукозилирования и ксилозилирования целевого белка при сравнении с таким же целевым белком, полученным в диком растении.
В настоящем изобретении предлагается способ (3) синтезирования целевого белка с модифицированным профилем N-гликозилирования, содержащим коэкспрессирующую в пределах растения, части растения или растительной клетке нуклеотидной последовательности, кодирующей первую нуклеотидную последовательность, кодирующую составной белок, GNT1-GnT-III, содержащую CTS домен N-ацетилглюкозаминилтрансферазы (GNT1), слитый с каталитическим доменом N-ацетилглюкозаминилтрансферазы III (GnT-III), первую нуклеотидную последовательность, функционально связанную с первой регуляторной областью, являющейся активной в растении, а также вторую нуклеотидную последовательность для кодирования целевого белка. Вторая нуклеотидная последовательность функционально связана со второй регуляторной областью, являющейся активной в растении, и коэкспрессию первой и второй нуклеотидных последовательностей на синтезирование целевого белка, содержащего гликаны с модифицированным профилем N-гликозилирования.
Первая нуклеотидная последовательность и вторая нуклеотидная последовательность, рассмотренные выше (способ 3), могут находиться в растении временно или они могут быть экспрессированы стабильно. Более того, первая регуляторная область является, возможно, первым тканеспецифичным промотором, а вторая регуляторная область является вторым тканеспецифичным промотором. Любой из первого и второго тканеспецифичных промоторов может быть промотором пластоцианина.
Также представлен способ (4) синтезирования целевого белка с модифицированным профилем N-гликозилирования, содержащий коэкспрессирующую в пределах растения, части растения или растительной клетке нуклеотидную последовательность, кодирующую первую нуклеотидную последовательность, кодирующую составной белок, GNTI-GalT, содержащий CTS домен N-ацетилглюкозаминилтрансферазы (GNT1), слитый с каталитическим доменом бета 1,4 галактозилтрансферазы (GalT), первую нуклеотидную последовательность, функционально связанную с первой регуляторной областью, являющейся активной в растении, вторую нуклеотидную последовательность, кодирующую бета 1,4 галактозилтрансферазы, вторая нуклеотидная последовательность функционально связана со второй регуляторной областью, являющейся активной в растении, третью нуклеотидную последовательность, кодирующую целевой белок, третья нуклеотидная последовательность функционально связана с третьей регуляторной областью, являющейся активной в растении, и коэкспрессию первой, второй и третьей последовательностей на синтезирование целевого белка, содержащего гликаны с модифицированным профилем N-гликозилирования.
Первая нуклеотидная последовательность и вторая нуклеотидная последовательность, рассмотренные выше (4), могут находиться в растении временно или они могут быть экспрессированы стабильно. Более того, первая регуляторная область может быть первым тканеспецифичным промотором, а вторая регуляторная область является вторым тканеспецифичным промотором. Любой из первого и второго тканевых промоторов может быть промотором пластоцианина.
В настоящем изобретении предлагается способ (5) синтезирования целевого белка с модифицированным профилем N-гликозилирования, содержащий коэкспрессирующую в пределах растения, части растения или растительной клетке нуклеотидной последовательности, кодирующей первую нуклеотидную последовательность, кодирующую составной белок, GNTI-GnT-III, содержащий CTS домен N-ацетилглюкозаминилтрансферазы (GNT1), слитый с каталитическим доменом N-ацетилглюкозаминилтрансферазы III (GnT-III), указанная первая нуклеотидная последовательность, функционально связана с первой регуляторной областью, являющейся активной в растении; вторую нуклеотидную последовательность N-ацетил глюкозаминил трансферазы III, указанная вторая нуклеотидная последовательность функционально связана со второй регуляторной областью, являющейся активной в растении; и третью нуклеотидную последовательность, кодирующую целевой белок, указанная третья нуклеотидная последовательность функционально связана с третьей регуляторной областью, являющейся активной в растении; а также коэкспрессию первой, второй и третьей последовательностей на синтезирование целевого белка, содержащего гликаны с модифицированным профилем N-гликозилирования.
Первая нуклеотидная последовательность, вторая нуклеотидная последовательность и третья нуклеотидная последовательность, рассмотренные выше (5), могут находиться в растении временно или они могут быть экспрессированы стабильно. Более того, первая, вторая и третья регуляторные области являются, возможными тканевыми промоторами. Например, любой из тканевых промоторов может быть промотором пластоцианина.
[0030] В соответствии с рассмотренными в описании способами белок может быть получен таким образом в больших количествах. В нем отсутствуют гликаны, которые, как известно, участвуют в реакциях гиперчувствительности или, другими словами, в аллергических реакциях. Это достигается коэкспрессией гликоинженерных энзимов вместе с целевым белком, в результате получается белок, который является менее иммуногенным, чем белок, полученный в диком растении.
Как рассматривается в настоящем описании, возможно использование упрощенных систем экспрессии для получения целевого белка, применяющих систему транзиентной экспрессии. Однако указанные способы могут использоваться с применением стабильных систем преобразования. По этой причине настоящее изобретение не ограничено использованием только систем транзиентной экспрессии.
Используя транзиентную коэкспрессию, рассматриваемая в настоящем описании система избегает длительных периодов продуцирования, а также процесса отбора элитных мутантов и гликоинженерных трансгенных линий и их последующего использования в качестве родительских клеточных линий (например, как это описано Bakker с соавт., 2005). Система также позволяет предотвратить побочные проблемы, зачастую связанные с мутантами и гликоинженерными растениями относительно продуктивности, пыльцевой продуктивности, завязывания семян (Bakker с соавт., 2005), а также относительно жизнеспособности (Boisson с соавт., 2005). Как поясняется в настоящем описании, коэкспрессия целевого белка с модифицированной химерной человеческой галактозилтрансферазой не влияла на кинетику производства и количества получаемого продукта
Система транзиентной экспрессии, рассматриваемая в настоящем описании, обеспечивает уровни экспрессии, достигающие 1,5 г высококачественного антитела на килограмм массы сырой ткани листьев, что превышает известный по отчетам уровень аккумулирования любого антитела в растениях при помощи других систем экспрессии, включая системы, базирующиеся на многих вирусах и трансгенных растениях.
Изложенная в настоящем описании методика, например, включающая в себя экспрессию Galt или Galt-GNT1, может быть также применена к устойчиво трансформированным растениям. Наряду с демонстрацией многих преимуществ настоящее изобретение не ограничивается только системами транзиентной экспрессии,
Данное краткое изложение сущности изобретения не излагает в обязательном порядке все отличительные признаки настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Указанные и прочие признаки настоящего изобретения станут более очевидными из последующего описания, в котором приведены ссылки на прилагаемые чертежи.
На фиг.1А показан базирующийся на пластоцианине кластер, собранный для экспрессии С5-1. R610 содержит нуклеотидную последовательность, кодирующую С5-1 LC, С5-1 HC-KDTL; R612 содержит нуклеотидную последовательность, кодирующую С5-1 LC и С5-1 НС, где С5-1 LC: последовательность кодирования легкой цепи С5-1; С5-1 НС: последовательность кодирования тяжелой цепи С5-1. На фиг.1В показана нуклеотидная последовательность для промотора пластоцианина и 5'-НТО (нетранслируемой области) (SEQ ID NO:23), сайт инициирования транскрипции показан полужирным шрифтом, а кодон инициирования трансляции подчеркнут. На фиг.1C показана нуклеотидная последовательность для пластоцианина 3'-НТО и терминатора (SEQ ID NO:24), терминатор подчеркнут.
На фиг.2 показано накопление антитела С5-1 в листьях Nicotiana benthamiana, пропитанных R610 и R612 (полигенные экспрессирующие кластеры, базирующиеся на пластоцианине) с и без коэкспрессии суппрессора сайленсинга HcPro. Представленные величины соответствуют среднему уровню аккумулирования и стандартному отклонению, полученным в результате 6 измерений на трех растениях (с инфильтрацией при помощи шприца) или 6 измерений на отдельных партиях приблизительно 12 инфильтрованных растений (250 г).
На фиг.3 показан блот-анализ белка накопления С5-1 антитела в экстрактах, инфильтрованных при помощи шприца растений и растений с вакуумной инфильтрацией. На фиг.3А показан иммуноблотинг конъюгированных с пероксидазой антител козы против иммуноглобулинов мыши (IgG (H+L)) на экстрактах из растений, инфильтрованных с применением R612 (для секреции, дорожки 1) или R610 (для удержания ЭР (эндоплазматического ретикулома), дорожки 2). C1: 100 нг коммерческого иммуноглобулина мыши IgG1 (Sigma M9269), загруженного для контроля электрофоретической подвижности; С2: 12 мкг общих белков, извлеченных из биомассы, инфильтрованной мыльнянкой лекарственной (пустой вектор). С3: 100 нг коммерческого иммуноглобулина мыши IgG1 (Sigma M9269), добавленного в 12 мкг общих белков, извлеченных из биомассы, инфильтрованной мыльнянкой лекарственной (пустой вектор). На фиг.3В показан иммуноблотинг активности с применением конъюгированных с пероксидазой иммуноглобулинов человека IgG1 на экстрактах из растений, инфильтрованных с применением R612 (для секреции, дорожки 1) или R610 (для удержания ЭР (эндоплазматического ретикулома), дорожки 2). C1: 2 мкг контрольного антитела С5-1, рафинированного из гибридомы (Хауди с соавт., 1997 г.); С2: 75 мкг общего белка, извлеченного из биомассы, инфильтрованной мыльнянкой лекарственной (пустой вектор).
На фиг.4 показан анализ антител, рафинированных из растений, инфильтрованных с применением R612 (для секреции, дорожки 1) или R610 (для удержания ЭР, дорожки 2). На фиг.4А показан анализ методом электрофореза в полиакриламидном геле (SDS-PAGE) суммарных экстрактов и рафинированных белков, выполняемый в невосстановительных условиях. На фиг.4В показан анализ SDS-PAGE рафинированных антител, выполняемый в восстановительных условиях. На фиг.4С показан иммуноблотинг активности рафинированных антител, выполняемый с применением конъюгированных с пероксидазой ИгГ1 человека. На фиг.4D показано сравнение загрязнителей в 6 партиях рафинированных антител С5-1 из различных инфильтрованных культур. С: 2,5 мкг коммерческого иммуноглобулина мыши ИгГ1 (Sigma M9269), загруженного для контроля электрофоретической подвижности.
На фиг.5 представлены примеры полигенных кластеров, собранных для экспрессии нативной (R622) и гибридной (R621) версий галактозилтрансферазы. GNT1-CTS: CTS домен N-ацетилглюкозаминилтрансферазы I; GalT-Cat: каталитический домен человеческой β1,4 галактозилтрансферазы; GalT (R622): человеческая (31,4 галактозилтрансфераза. На фиг.5В показана нуклеотидная последовательность (SEQ ID NO: 14) для GalT (UDP-GakbetaGlcNac бета 1,4 галактозилтрансферазы полипептид 1, бета 1,4 галактозилтрансферазы I), сайт инициирования АТГ подчеркнут; трансмембранный домен подчеркнут и выделен курсивом; последовательность, выделенная полужирным шрифтом, соответствует каталитическому домену человеческой бета 1,4 галактозилтрансферазы (human beta 1,4GalT); FLAG-эпитоп выделен курсивом. На фиг.5С показана аминокислотная последовательность (SEQ ID NO: 15) для GalT (UDP-Gal:betaGlcNac бета 1,4 галактозилтрансферазы полипептид 1, бета 1,4 галактозилтрансферазы I). Трансмембранный домен подчеркнут и выделен курсивом; последовательность, выделенная полужирным шрифтом, соответствует каталитическому домену человеческой бета 1,4 галактозилтрансферазы; FLAG эпитоп выделен курсивом. На фиг.5D показана нуклеотидная последовательность (SEQ ID NO: 17) GNTIGalT, сайт инициирования АТГ подчеркнут; трансмембранный домен (CTS) подчеркнут и выделен курсивом; последовательность, выделенная полужирным шрифтом, соответствует каталитическому домену человеческой бета 1,4 галактозилтрансферазы (human beta 1,4GalT); FLAG эпитоп выделен курсивом. На фиг.5Е показана аминокислотная последовательность (SEQ ID NO: 18) GNTIGalT, трансмембранный домен (CTS) подчеркнут и выделен курсивом; последовательность, выделенная полужирным шрифтом, соответствует каталитическому домену человеческой бета 1,4 галактозилтрансферазы (human beta 1,4GalT); FLAG эпитоп выделен курсивом. На фиг.5F показана нуклеотидная последовательность домена CTS (внутриклеточный концевой элемент, трансмембранный домен, межзональная область) N-ацетилглюкозаминтрансферазы (GNT1; SEQ ID NO: 21). На фиг.5G аминокислота последовательности, нацеленной на капсиду (CTS) (SEQ ID NO: 22). На фиг.5Н показана последовательность нуклеиновой кислоты Gntl-Gnt III (SEQ ID NO: 26). На фиг.5I показана аминокислотная последовательность Gntl-Gnt III (SEQ ID NO: 20). На фиг.5J показана последовательность нуклеиновой кислоты Gnt III (SEQ ID NO: 16). На фиг.5K показана аминокислотная последовательность Gnt III (SEQ ID NO: 19).
На фиг.6 показан профиль экстрактов, полученных из экспрессирующих антитела С5-1 растений и либо окрашенных для выделения белка, либо для проведения иммуноблотинга. На верхней панели показан окрашенный по классу «Кумасси» полиакридамидный гель (ПААГ). Вторая сверху панель показывает определение аффинности агглютинина Erythrina cristagali (ECA), который связывает конкретно β1,4 галактозу. Третья сверху панель показывает иммуноблотинг с использованием антител против α1,3 фукозы. Нижняя панель показывает иммуноблотинг с использованием антител против β1,2 ксилозы. R612: С5-1 экспрессирует в одиночку; R612+R622: С5-1 коэкспрессирует (коинфильтрирует) с GalT; R612+R621: С5-1 коэкспрессирует с GNT1-GalT.
На фиг.7 показана MALDI-TOF масс-спектрометрия для определения N-гликозилирования типичного гликопептида EEQFNSTFR (SEQ ID NO: 13) С5-1 антитела, изолированного от растений, инфильтрованных Nicotina benthamiana при помощи шприца, с применением ряда моделей. N-гликозирование гликопептида было определено после сепарации на препаративном высокоэффективном жидкостном хроматографе (ВЭЖХ). Аналогичные результаты были получены после проведения вакуумной инфильтрации. На фиг.7А показана MALDI-TOF масс-спектрометрия типичного гликопептида вслед за экспрессией R612: (С5-1; см. фиг.1). На фиг.7В показана MALDI-TOF масс-спектрометрия типичного гликопептида вслед за экспрессией С5-1 (R612; см. фиг.1) совместно с естественным GalT (R622; см. фиг.5). На фиг.7С показана MALDI-TOF масс-спектрометрия типичного гликопептида вслед за экспрессией С5-1 (R612; см. фиг.1) вместе с GNTIGalT (R621, см. фиг.5). На фиг.7С - вкладыш, соответствующий увеличенному виду m/z 2650-2800 спектра, показано (стрелкой) отсутствие основного комплексного иона J, обнаруженного в растении R612. A: GlcNAcMan3GlcNac2; В: Man5GlcNac2; С: GalGlcNAcMan3GlcNAc2; D: GlcNAc2Man3GlcNac2; E: Man6GlcNac2;:F: GalGlcNAcMan3(Xyl)GlcNAc2; G: GlcNAcMan5GlcNac2; H: GlcNAc2Man5(Fuc)GlcNAc2; I: Man7GlcNac2; J: GlcNAc2Man3(Xyl)(Fuc)GlcNAc2; K: GalGlcNAcMan5GlcNAc2; L: Man8GlcNac2; M: Man9GlcNac2.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение имеет отношение к способам модифицирования продуцирования гликопротеинов в растениях. Настоящее изобретение также предлагает растения с модифицированным продуцированием гликопротеинов.
В настоящем изобретении содержится описание системы экспрессии в растениях для управления экспрессией целевого белка в растении. При использовании описанной системы экспрессии целевой белок, имеющий модифицированный паттерн гликозилирования, например, с редуцированным фукозилированием, ксилозилированием или одновременно фукозилированием и ксилозилированием, могут быть получены N-гликаны. В альтернативном варианте может быть получен целевой белок, имеющий модифицированный паттерн гликозилирования, где белок не имеет фукозилирования, ксилозилирования или того и другого одновременно, а также содержит повышенное галатолизирование. Кроме этого, как указывается в описании, модуляция посттрансляционных модификаций, например присоединение концевой галактозы, приводит к уменьшению фукозилирования и ксилозилирования экспрессированного белка, целевого. Например, целевой белок может содержать менее 10% продуктов фукозилирования и ксилозилирования (т.е. менее 10% остатков N-гликанов фукозилированы и ксилозилированы), или менее 5% продуктов фукозилирования и ксилозилирования (т.е. менее 5% остатков N-гликанов фукозилированы и ксилозилированы), или менее 1% продуктов фукозилирования и ксилозилирования (т.е. менее 1% остатков N-гликанов фукозилированы и ксилозилированы) от примерно 0,1 до примерно 2% остатков N-гликанов фукозилированы и ксилозилированы, от примерно 0,5 до примерно 1,5% остатков N-гликанов фукозилированы и ксилозилированы, или от примерно 0,7 до примерно 1% остатков N-гликанов фукозилированы и ксилозилированы, при сравнении с аналогичным целевым белком, полученным в диком растении. Таким образом, целевой белок может быть произведен в больших количествах и не содержать гликаны, которые могут вызвать реакции повышенной чувствительности или могут каким-либо образом участвовать в аллергических реакциях.
[0046] Неограничительный пример целевого белка, подлежащего экспрессированию, включает сложный белок, например антитело. Экспрессия такого сложного белка внутри агроинфильтрованного растения, например Nicotina benthamiana, достигала уровня продуцирования белка в 1,5 г/кг массы сырой ткани (около 25% TSP (transferred solid phase = перенесенная фаза с иммобилизованными антителами). Были достигнуты уровни в 558 и 757 мг/кг/массы сырой ткани для форм целевого белка, секретированных и с удержанием ЭР, соответственно. В предложенном неограничительном примере указанный уровень экспрессии был достигнут для антитела, этот уровень в три раза выше, чем уровень, достигнутый для антитела, полученного с применением многовирусной системы транзиентной экспрессии (Girth с соавт., 2006).
[0047] Влияние разницы между растением и типичным животным N-гликозилированием было основной проблемой, вызвавшей решение использовать растения для производства лекарственных средств. Образование гликанов в растениях может вызвать сокращение наполовину жизнедеятельности выращенного в растении белка в кровотоке, или указанные гликаны могут спровоцировать у пациентов аллергические реакции.
Присутствие основных α1,3 фукозы и β1,2 ксилозы в гликопротеинах, полученных из растений, был воспринят промышленностью как нормативный вызов, так как они были также обнаружены в некоторых растительных аллергенах. В дополнение к этому, в настоящее время документально подтверждено, что удаление коровой фукозы, даже α1,6 фукозы, которая может быть обнаружена в иммуноглобулинах из клеток СНО, увеличит активность антителозависимой клеточнозависимой цитотоксичности (ADCC). Признаком рассмотренной в описании системы является возможность выполнения модуляции посттрансляционных модификаций, например устойчивое присоединение терминальной галактозы и уменьшение фукозилирования и ксилозилирования (при сравнении с аналогичным белком, полученным в диком растении). В альтернативном варианте уровень фукозилирования может быть понижен при одновременном увеличении объема галактозилирования (опять же при сравнении с аналогичным белком, полученным в диком растении).
Изменение объема фукозилирования, ксилозилирования или галактозилирования может быть определено путем применения любого подходящего способа, например использования антител против α1,3 фукозы для обнаружения наличия или отсутствия иммуносигналов о фукозе (фукозилирования), антител против β1,2 ксилозы для обнаружения ксилозилирования, или наличия, или отсутствия иммуносигналов о ксилозе, например, как показано на фиг.6. В альтернативном варианте может быть применена MALDI-TOF масс-спектрометрия для определения N-гликозилирования профиля белка или части белка, как показано на фиг.7. Может быть также использован другой известный специалисту в данной области знаний способ определения N-гликозилирования профиля белка или части белка.
Как подробно рассмотрено ниже, была использована система агроинфильтрации, базирующаяся на вакуумировании, которая была признана подходящей для получения целевого белка, например антитела с точки зрения количеств, качества и воспроизводимости. Переход к масштабируемой технологии инфильтрации позволяет получать ежедневно граммы указанного антитела внутри небольшой экспериментальной установки, что дает возможность использовать такую систему транзиентной экспрессии с целью получения материалов для клинических исследований в пределах чрезвычайно короткого временного графика и для поставки лицензированной продукции на рынок в количестве, достигающем несколько килограммов в год. Высококачественные антитела были получены из подвергнутых инфильтрации листьев после единственной операции аффинной хроматографии. Однако следует понимать, что рассмотренный в описании способ может быть также применен к стабильно транс