Способ защиты стального оборудования от коррозии в водных средах
Иллюстрации
Показать всеИзобретение относится к защите стального оборудования, трубопроводов и систем водоснабжения от коррозии в водных средах. Способ включает контролирование содержания кислорода в водной среде в интервале от 0,1 до 6,0 мг/дм3 и введение в водную среду ингибитора - цинкового комплекса 1-гидроксиэтилидендифосфоновой кислоты. При этом после введения в водную среду указанного ингибитора осуществляют избирательное осаждение защитной пленки на коррозионные очаги поверхности стального оборудования путем обеспечения содержания в водной среде магния от 0,208 до 6,23 моль/м3, температуры водной среды от 35 до 95°С и рН водной среды от 5,8 до 11,1. В частности в качестве упомянутого комплекса используют цинковый комплекс 1-гидроксиэтилидендифосфоновой кислоты, содержащий локализованную π-связь между атомами фосфора и кислорода. Изобретение позволяет повысить степень защиты стального оборудования от коррозии в водных средах в широком диапазоне величины рН. 8 з.п. ф-лы, 10 ил., 7 табл.
Реферат
Область техники
Изобретение относится к способам защиты металлов от коррозии, а более конкретно - к способам защиты стали (сплавов на основе железа) от коррозии в водных средах с использованием фосфорсодержащих соединений. Изобретение может найти применение во многих отраслях народного хозяйства, в частности, для защиты стальных частей технологического оборудования в нефтегазовой, химической, пищевой, промышленности; котлов, котельно-вспомогательного оборудования, трубопроводов и другого оборудования в энергетике и коммунальном хозяйстве; для защиты от коррозии различных систем водоснабжения и иное, тому подобное.
Уровень техники
Известен ингибитор коррозии и отложений для водогрейных котлов и способ его применения [1]. Ингибитор содержит окисленный парафин, смесь аминов, фосфонат, гидролизованный полималеиновый ангидрид и цинксодержащий комплекс. Способ использования данного ингибитора включает примешивание некоторого количества ингибитора к воде в котле, при этом значение водородного показателя воды (рН) поддерживают выше 9. (Величиной рН называют отрицательную величину логарифма по основанию 10 активности ионов водорода, выраженной в моль/дм3. Логарифмом называют показатель степени, в которую надо возвести основание, чтобы получить искомую величину активности.) К недостаткам данного технического решения относится сложность состава ингибитора и сложность способа его применения, которая заключается в необходимости постоянного контроля величины рН воды в котле и в поддержании рН выше 9. Кроме того, для эффективной защиты металла от коррозии необходимо вводить значительное количество данного ингибитора, что исключает возможность дальнейшего применения полученной горячей воды для хозяйственно-бытовых целей. Вследствие этого описанный способ имеет ограниченную область применения - только для обработки воды для нужд отопления.
Известен высокотемпературный ингибитор коррозии [2]. Способ предназначен для ингибирования коррозии, преимущественно в нефтяных средах, путем введения ингибитора, состоящего из триалкилфосфата и фенилсульфидфосфонатов щелочноземельных металлов, например, кальция. Недостатком данного способа является ограниченная область применения, что обусловлено необходимостью вводить значительное количество ингибитора для эффективной защиты металла от коррозии. Вследствие этого описанный способ неприменим для обработки водных сред, в частности, воды для хозяйственно-бытовых нужд.
Известен способ защиты металла от коррозии, описанный Г.В.Халдеевым [3, стр.394-396]. Способ включает катодную активацию выходов дислокации на поверхность металла и введение в коррозионную среду адсорбирующихся ингибиторов. В качестве агентов, активирующих выходы дислокации, могут быть использованы, например, ионы хлора, брома, йода; а в качестве адсорбирующегося ингибитора - цинковая соль дитиофосфоновой кислоты. Недостатком данного способа является сложность и ограниченная область применения из-за токсичности используемых веществ. Вследствие использования для обработки воды токсичных веществ описанный способ неприменим для обработки воды для хозяйственно-бытовых и некоторых промышленных нужд.
Наиболее близким по технической сущности и заявляемому результату к заявляемому изобретению является способ защиты стального оборудования от коррозии в нейтральных и щелочных водных средах [4]. Способ включает катодную активацию выходов дислокации на поверхность металла и введение в водную среду ингибитора, содержащего цинковый комплекс оксиэтилидендифосфоновой кислоты (1-гидрокси-этилидендифосфоновой кислоты), при этом катодную активацию выходов дислокации на поверхность металла осуществляют воздействием кислорода, растворенного в водной среде, контролируют концентрацию кислорода от 0,1 до 6,2 мг/дм3 и поддерживают значение рН водной среды от 7,5 до 10.
К недостаткам способа, принятого за прототип, относится довольно узкий интервал значений величины рН водной среды, в котором обеспечивается защита стального оборудования от коррозии. Этот интервал составляет от 7,5 до 10; в то же время, для питьевой воды, согласно СанПиН 2.1.4.1074-01 (п.3.4.1, таблица 2), величина рН может составлять от 6 до 9; для воды закрытых систем теплоснабжения, согласно Правилам технической эксплуатации электрических станций и сетей РФ (примечания к п.4.8.39, 4.8.40), величина рН может достигать 10,5. Следовательно, возможность применения известного способа, как в системах питьевого водоснабжения, так и в системах теплоснабжения, ограничена.
Кроме того, достигнутая степень защиты металла в известном способе не превосходит 93,2%, что недостаточно во многих практических случаях.
Раскрытие изобретения
Задачей заявляемого изобретения является повышение степени защиты стального оборудования и расширение условий применимости способа.
Техническим результатом, который достигается при использовании заявляемого способа, является эффективная защита стального оборудования от коррозии в водных средах, при введении в водную среду ингибитора, содержащего цинковый комплекс 1-гидроксиэтилидендифос-фоновой кислоты, в диапазонах величины рН, допускаемых СанПиН 2.1.4.1074-01 и Правилами технической эксплуатации электрических станций и сетей РФ, то есть от 6 до 10,5.
Технический результат достигается тем, что способ защиты стального оборудования от коррозии в водных средах включает контролирование содержания кислорода в водной среде в интервале от 0,1 до 6,0 мг/дм3 и введение в водную среду ингибитора - цинкового комплекса 1-гидроксиэтилидендифосфоновой кислоты. После введения в водную среду указанного ингибитора осуществляют избирательное осаждение защитной пленки на коррозионные очаги поверхности стального оборудования путем обеспечения содержания в водной среде магния от 0,208 до 6,23 моль/м3, температуры водной среды от 35 до 95°С и рН водной среды от 5,8 до 11,1.
То, что после введения в водную среду ингибитора, содержащего цинковый комплекс 1-гидроксиэтилидендифосфоновой кислоты, его осаждают на поверхность стали избирательно в коррозионных очагах, а также то, что процесс ведут при температуре от 35 до 95°С, рН водной среды от 5,8 до 11,1 и содержании магния в водной среде от 0,208 до 6,23 моль/м3, является новым по сравнению с прототипом. Избирательное осаждение защитной пленки в коррозионных очагах на поверхности стали позволяет повысить эффективность защиты стали от коррозии. Условия проведения процесса - температура от 35 до 95°С, рН водной среды от 5,8 до 11,1 и содержание магния в водной среде от 0,208 до 6,23 моль/м3 - позволяют добиться избирательного осаждения ингибитора в коррозионных очагах и его прочной фиксации на поверхности стали в широком интервале величины рН водной среды. Таким образом, вследствие новой совокупности существенных признаков способа достигается заявляемый технический результат.
В частном случае осуществления заявляемого изобретения в качестве ингибитора, содержащего цинковый комплекс 1-гидроксиэтилиденди-фосфоновой кислоты, используют цинковый комплекс 1-гидроксиэтил-идендифосфоновой кислоты, содержащий локализованную π-связь между атомами фосфора и кислорода.
В частном случае осуществления заявляемого изобретения перед введением ингибитора в водной среде контролируют содержание магния титриметрическим, электрохимическим или фотоколориметрическим способом.
В частном случае осуществления заявляемого изобретения в процессе введения ингибитора периодически контролируют в водной среде содержание магния титриметрическим, электрохимическим или фотоколориметрическим способом.
В частном случае осуществления заявляемого изобретения перед введением ингибитора водную среду подвергают деаэрации до достижения концентрации кислорода не более 6,0 мг/дм3.
В частном случае осуществления заявляемого изобретения деаэрацию водной среды осуществляют способом термической деаэрации.
В частном случае осуществления заявляемого изобретения деаэрацию водной среды осуществляют способом вакуумной деаэрации.
В частном случае осуществления заявляемого изобретения деаэрацию водной среды осуществляют взаимодействием с веществами, поглощающими растворенный в воде кислород.
В частном случае осуществления заявляемого изобретения в водную среду вводят магний в форме водорастворимого соединения до достижения содержания магния в водной среде не менее 0,208 моль/м3.
Краткое описание чертежей
На фиг.1 приведены абсорбционные инфракрасные (ИК) спектры ингибиторов, использованных для практического осуществления заявляемого способа, снятые в суспензии с вазелиновым маслом по ГОСТ 3164-78 на спектрометре ИКС-29 по двухлучевой схеме. По абсциссе отложено волновое число в см-1, по ординате - пропускание ИК излучения.
Кривая 1 представляет спектр препарата «Оптион 313-2» производства ООО «Экоэнерго» (г.Ростов-на-Дону) по ТУ 2439-005-24210860-2007, перекристаллизованный из дестиллированной воды.
Кривая 2 представляет спектр сухого остатка препарата «Афон 230-23А» производства ОАО «Химпром» (г.Новочебоксарск) по ТУ 2439-451-05763441-2004.
Подписи в поле координатной сетки представляют абсциссы максимумов полос поглощения в см-1.
На фиг.2 изображен зажим, использованный для крепления образцов при проведении коррозионных испытаний, в масштабе 3:1. Использованы следующие обозначения:
1 - лучок из березовой древесины;:
2 - тетива из вискозной нити;
3 - стрелка из березовой древесины;
4 - испытуемый образец;
5 - подвес из вискозной нити.
На фиг.3 изображена схема исследовательского комплекса «Centaur U HR», использованного для исследования поверхности образцов. Использованы следующие обозначения:
1 - оптический квантовый генератор (лазер);
2 - коллиматор;
3 - регулируемый нейтральный светофильтр (оптический клин);
4 - входная щель предмонохроматора;
5 - призменный предмонохроматор;
6 - выходная щель предмонохроматора;
7 - собирающая линза;
8 - зеркало;
9 - расширитель пучка;
10 - полупрозрачное зеркало;
11 - зеркало;
12 - делитель пучка;
13 - оптическая система сопряжения с перископом;
14 и 15 - зеркала перископа;
16 - призменный делитель света;
17 - осветитель;
18 - конденсор;
19 - полупрозрачное зеркало;
20 - собирающая линза;
21 - объектив микроскопа;
22 - исследуемый образец;
23 - предметный столик;
24 - призменный делитель света;
25 - зеркало;
26 - окуляр;
27 - устройство фоторегистрации изображения;
28 - краевой фильтр;
29 - собирающая линза;
30 - входная щель монохроматора;
31 - зеркало;
32 - сферическое зеркало;
33 - диффракционные решетки;
34 и 35 - зеркала;
36 - сферическое зеркало;
37 - устройство фоторегистрации спектра;
38 - регулируемый нейтральный светофильтр (оптический клин);
39 - собирающая линза;
40 - входная щель фотоэлектронного умножителя;
41 - фотоэлектронный умножитель.
На фиг.4 представлены оптическая микрофотография (а) и спектральное изображение (б) поверхности образца стали 20 после экспозиции в течение 10 дней в условиях по примеру №3. Использованы следующие обозначения:
1 - точка, находящаяся за пределами коррозионного очага;
2 - точка, находящаяся внутри коррозионного очага. На фиг.5 изображены спектрограммы комбинационного рассеяния света поверхностью образца в точках 1 и 2, отмеченных на фиг.4. Использованы следующие обозначения:
1 - спектрограмма, снятая в точке 1, отмеченной на фиг.4;
2 - спектрограмма, снятая в точке 2, отмеченной на фиг.4.
На фиг.6 представлены оптическая микрофотография (а), спектральное изображение (б) и конфокальное изображение (в) поверхности образца стали 20 после экспозиции в течение 10 дней в условиях по примеру №12.
На фиг.7 представлены оптическая микрофотография (а) и спектральное изображение (б) поверхности образца стали 20 после экспозиции в течение 10 дней в условиях по примеру №9.
На фиг.8 представлены оптическая микрофотография (а), спектральное изображение (б) и конфокальное изображение (в) поверхности образца стали 20 после экспозиции в течение 10 дней в условиях по примеру №13.
На фиг.9 представлены оптическая микрофотография (а), спектральное изображение (б) и конфокальное изображение (в) поверхности образца стали 20 после экспозиции в течение 10 дней в условиях по примеру №18. Использованы следующие обозначения:
1 - точка, находящаяся за пределами коррозионного очага;
2 - точка, находящаяся внутри коррозионного очага;
3 - точка, находящаяся на границе коррозионного очага.
На фиг.10 изображены спектрограммы комбинационного рассеяния
света поверхностью образца в точках 1, 2 и 3, отмеченных на фиг.9.
Использованы следующие обозначения:
1 - спектрограмма, снятая в точке 1, отмеченной на фиг.9;
2 - спектрограмма, снятая в точке 2, отмеченной на фиг.9.
3 - спектрограмма, снятая в точке 3, отмеченной на фиг.9.
Осуществление изобретения
Возможность осуществления заявляемого изобретения подтверждается изложенными далее теоретическими предпосылками и примерами практического осуществления.
Основным компонентом стали является железо. Процесс коррозии стали включает анодное окисление железа, которое является основным компонентом стали
В результате реакции (1) в коррозионную среду поступают положительно заряженные ионы железа. (Основные легирующие элементы стали - хром, марганец, никель, углерод и кремний. В анодном окислении металла они участвуют в пренебрежимо малых количествах.) Деполяризующей реакцией при кислородной коррозии является катодное восстановление кислорода
в результате которого образуются гидроксид-анионы, также поступающие в водную среду.
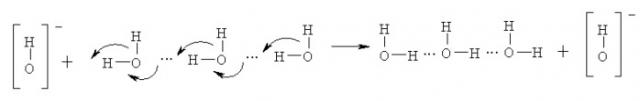
Способность ионов Fe2+ и ОН- к диффузии в водной среде существенно различается. Это объясняется более или менее упорядоченной структурой воды, молекулы которой связаны водородными связями. Водородная связь аналогична простой ковалентной и отличается только большей длиной и меньшей электронной плотностью; благодаря этому осуществляется так называемый эстафетный механизм распространения этих частиц. «Перенос» гидроксид-аниона ОН- осуществляется переменой местами простых ковалентных и водородных связей:
.
Перемещение связей достигается перераспределением электронной плотности; время такого перемещения пропорционально периоду колебаний соответствующего осциллятора, в данном случае, электронной подсистемы. Период колебаний в первом приближении может быть оценен по формуле для гармонического осциллятора
T = 2 π m * k
где m* - эффективная масса осциллятора;
k - силовая константа (жесткость) осциллятора. Эффективная масса электрона значительно (примерно на три - четыре порядка) меньше массы атомных ядер, а силовые константы этих осцилляторов равны или близки друг к другу. Следовательно, период колебаний электронной подсистемы почти на два порядка короче, чем ядерной. Вследствие этого скорость эстафетного переноса гидроксид-аниона примерно также почти на два порядка выше, чем скорость диффузии других ионов. Эстафетный механизм переноса реализуется только в водной среде; в неводных средах коэффициент диффузии гидроксид-аниона близок к коэффициентам диффузии других ионов.
Благодаря интенсивным процессам переноса, степень неоднородности концентрации ионов гидроксид-аниона в водной среде ниже неоднородностей других компонентов. Поэтому гидроксид-анионы распространены в водной среде почти равномерно, а ионы железа Fe2+ локализуются вблизи коррозионных очагов.
Заявляемый способ защиты стали от коррозии в водных средах, так же, как и известный [4], основан на введении в воду ингибитора, содержащего цинковый комплекс 1-гидроксиэтилидендифосфоновой кислоты, формула которого может быть представлена в виде [Zn(CH3C(OH)(PO3)]2-. Здесь СН3С(ОН)(РО3)2 4- - остаток четырежды депротонированной 1-гидроксиэтилидендифосфоновой кислоты СН3С(ОН)(Р(O)(ОН)2)2. Как известно из способа [4], принятого за прототип, действие этого ингибитора на процессы коррозии основано на том, что молекулы ингибитора взаимодействуют с ионами железа Fe, гидроксид-анионами ОН- и поверхностью стали, образуя на поверхности стали поверхностный комплекс, препятствующий дальнейшему переносу ионов металла в водную среду и взаимодействию кислорода с поверхностью стали. То есть применяемый ингибитор тормозит и анодный, и катодный процесс, обладая смешанным (анодно-катодным) действием. Вследствие этого интенсивность коррозии стали уменьшается.
Для наиболее эффективной защиты стали от коррозии необходимо, чтобы ингибитор взаимодействовал с ионами железа Fe2+, гидроксид-анионами ОН- и поверхностью стали именно в коррозионных очагах. Это исключает непроизводительный расход ингибитора вследствие осаждения на некорродирующей поверхности стали.
Поскольку осаждение ингибитора [Zn(СН2С(ОН)(РО3)2)]2+ вызвано действием как гидроксид-анионов ОН-, так и ионов железа Fe2+, то этот ингибитор (цинковый комплекс) в способе [4], принятом за прототип, осаждается не только на поверхности коррозионных очагов, но и на некорродирующей поверхности стали, вследствие чего ингибитор в известном способе расходуется непроизводительно и степень защиты стали оказывается недостаточной. Также, недостаточной оказывается степень защиты стали особенно в области низких и высоких значений рН, так как при низкой величине рН концентрация гидроксид-анионов оказывается недостаточной, а при большой величине рН - избыточной для нормального протекания процесса. При низких значениях рН, то есть при смещении реакции водной среды в кислую сторону, в деполяризации принимают участие также ионы водорода
что также нарушает условия нормального протекания процесса избирательного осаждения ингибитора. Все это приводит к тому, что известный способ эффективен лишь в достаточно узком интервале значений рН водной среды.
Таким образом, недостаточно высокая эффективность и недостаточно широкая применимость известного способа обусловлены контроверзой между двумя факторами, влияющими на распределение ингибитора по поверхности стали: равномерным распределением гидроксид-анионов ОН- и локальным распределением ионов железа Fe2+. Обособив влияние одного из этих факторов от другого, можно сделать осаждение ингибитора более избирательным и тем повысить эффективность защиты стали от коррозии.
В заявляемом способе, в отличие от известного способа [4], процесс ингибирования коррозии ведут при содержании в водной среде от 0,208 до 6,23 моль/м3 магния. Магний вступает с ингибитором в реакцию обмена
Реакция (4) приводит к динамическому равновесию (скорость течения реакции вправо, в конце концов, уравнивается со скоростью течения реакции влево). Однако, по данным [5, с.1651, табл.3], например, для реакции иона магния с протонированным остатком 1-гидроксиэтилиден-дифосфоновой кислоты
логарифм по основанию 10 константы равновесия, при ионной силе раствора 0,1 моль/дм3, равен 3,8, что соответствует константе равновесия 103,8=6,31-103; а для реакции иона цинка
в тех же условиях логарифм по основанию 10 константы равновесия равен 5,1, что соответствует константе равновесия 105,1=1,26·105, то есть примерно в двадцать раз больше. Примерно такое же соотношение имеет место и для непротонированных комплексов. Поэтому при прочих равных условиях концентрация непротонированного магниевого комплекса [Mg(CH3C(OH)(PO3)2)]2- сравняется с концентрацией цинкового [Zn(CH3C(OH)(PO3)2)]2- лишь при известном, необходимом и достаточном содержании магния в коррозионной среде. Аналогичный расчет с анализом цитированного источника [5, с.1651, табл.3] показывает, что содержание в коррозионной среде кальция дает эффект примерно в десять раз слабее, чем то же количество магния. Это объясняется малым ионным радиусом магния и высокой электронной плотностью его валентных 3s2 - электронов, отчего магний имеет большое преимущество в конкуренции с цинком, имеющим полностью заполненные оболочки 3d104s2 - электронов, способных к образованию донорно-акцепторных связей с кислородом. Поэтому магний образует намного более прочную донорно-акцепторную связь с атомами кислорода лиганда (CH3C(OH)(PO3)2)4-, чем цинк. Кальций же, имея 4s2-электронную конфигурацию, является в этом деле слабым конкурентом цинку.
Магниевый комплекс [Mg(CH3C(OH)(PO3)2)]2- и ионы цинка Zn2+ в водной, среде ведут себя самостоятельно и осаждаются на поверхности независимо друг от друга. Органофосфонатные комплексы, как при малых, так и при больших величинах рН, осаждаются благодаря взаимодействию с ионами железа Fe2+. При этом образуется поверхностная пленка полиядерных комплексов железа и магния, содержащих органический фрагмент CH3C(OH)=. При высоких значениях pH осаждаются гидроксокомплексы цинка и магния, образующие поверхностную пленку гидроксокомплексов [(Zn,Mg,Fe)(OH)n], содержащую также группы Р(ОН). Это позволяет добиться избирательного осаждения защитной пленки поверхностных комплексов на поверхность стали в более широком интервале значений рН и температуры коррозионной среды.
Возможность осуществления заявляемого способа защиты стального оборудования от коррозии в водных средах подтверждается также экспериментальными данными и примерами практического осуществления.
Образцы для исследования эффективности ингибирования изготавливают из стали 20 кп по ГОСТ 1050-98 в виде пластин размером 10×20×1 мм. Образцы подготавливают в соответствии с ГОСТ 9.502-82. Поверхность образцов шлифуют на плоскошлифовальном станке, трехкратно промывают этанолом (винным спиртом), затем промывают дестиллированной водой, затем в течение 1 мин. травят 15% водным раствором соляной кислоты, чтобы удалить слой металла с возникшими вследствие механической обработки поверхностными дефектами структуры. Протравленные образцы промывают дестиллированной водой и высушивают в эксикаторе с прокаленным хлоридом кальция до постоянной массы с погрешностью не более ±0,05 мг.
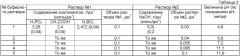
Составы агрессивных водных сред приведены в табл.1; за основу приняты составы №1 и №2 по ГОСТ 9.502-82, кроме того, использован состав №1, разбавленный в два раза, и состав №2 с концентрацией, увеличенной в три и в пять раз против требований ГОСТ 9.502-82. Таким образом, не отступая в принципе от требований ГОСТ 9.502-82, исследования проведены в интервале содержания магния от 0,104 до 10,39 моль/м3.
Величину рН водной среды контролируют, добавляя буферные растворы из расчета 0,1 дм3 буферного раствора на 1 дм3 агрессивной водной среды по ГОСТ 9.502-82. Составы буферных растворов приняты по рекомендациям [6, с.230, табл.31] и приведены в табл.2.
Содержание кислорода контролируют, добавляя к объему агрессивной водной среде, деаэрированной путем продувки аргоном по ГОСТ 10157-79 в течение 24 часов и изолированной от воздуха слоем вазелинового масла, известное количество среды того же состава, насыщенной кислородом воздуха в условиях естественной аэрации (при отекании водной среды по каплям в процессе фильтрования) при температуре 25°С и атмосферном давлении 745±5 мм. рт.ст. Содержание кислорода в водной среде, насыщенной кислородом, измеряют электрохимическим методом с помощью универсального иономера-кислородомера «АНИОН-7051». Содержание кислорода в приготовленной водной среде (изолированной от воздуха слоем вазелинового масла по ГОСТ 3164-78) вычисляют по уравнению материального баланса:
C O 2 = V 2 C O 2 0 V 1 + V 2 , ( 7 )
где C O 2 0 - содержание кислорода в насыщенной среде, мг/дм3;
V1 - объем предварительно деаэрированной среды, дм3;
V2 - объем насыщенной кислородом среды, дм3.
Приготовленные так агрессивные среды с известным содержанием кислорода сохраняют в полиэтиленовых емкостях под слоем вазелинового масла по ГОСТ 3164-78, переливая из них по резиновой трубке, чтобы защитить от контакта с воздухом.
В качестве ингибиторов коррозии используют цинковый комплекс 1-гидроксиэтилидендифосфоновой кислоты (1-гидроксиэтилидендифос-фонатоцинкдинатриевая соль). В примерах практического осуществления способа использовали два препарата:
1. Цинковый комплекс 1-гидроксиэтилидендифосфоновой кислоты, выпускаемый под маркой «Оптион 313-2» ООО «Экоэнерго» (г.Ростов-на-Дону) по ТУ 2439-005-24210860-2007, перекристаллизованный из дестиллированной воды и высушенный до постоянной массы при 105±2°С. Абсорбционный ИК-спектр полученного препарата, снятый в суспензии с вазелиновым маслом по ГОСТ 3164-78 на спектрометре ИКС-29 по двухлучевой схеме, представлен на фиг.1 (кривая 1). Сильная полоса при 1160 см-1 и слабая - при 1230 см-1 в колебательных спектрах фосфоновых соединений, согласно сведениям из открыто опубликованных источников [7, с.606, таблица, столбец 3, 4 и 5] и [8, с.44, правая колонка, абз.4], относится к колебаниям локализованной π-связи между атомами фосфора и кислорода Р=O (π-связью называют образование связывающей молекулярной орбитали в результате перекрытия двух атомных орбиталей в двух областях, расположенных симметрично по отношению к осевой линии химической связи; в химической формуле π-связь условно обозначают вторым штрихом химической связи). Следовательно, наличие этих полос свидетельствует о том, что препарат представляет собой цинковый комплекс 1-гидроксиэтилиден-дифосфоновой кислоты, содержащий локализованную π-связь между атомами фосфора и кислорода:
2. Цинковый комплекс 1-гидроксиэтилидендифосфоновой кислоты, выпускаемый под маркой «Афон 230-23А» ОАО «Химпром» (г.Новочебоксарск) по ТУ 2439-451-05763441-2004 в виде 20% водного раствора. Абсорбционный ИК-спектр сухого остатка препарата «Афон 230-23А», снятый на спектрометре ИКС-29 при тех же условиях, представлен на фиг.1 (кривая 2). Отсутствие полос поглощения при 1160 см-1 и 1230 см-1 свидетельствует о том, что препарат содержит цинковый комплекс 1-гидроксиэтилидендифосфоновой кислоты, не содержащий локализованной π-связи между атомами фосфора и кислорода:
При использовании перекристаллизованного ингибитора его добавляют в агрессивную водную среду в количестве 6 мг/дм3. При использовании ингибитора в виде 20% водного раствора его добавляют в агрессивную водную среду в количестве 30 мг/дм3, что соответствует 6 мг/дм3 основного вещества. В контрольном опыте ингибитор не вводят.
Коррозионные испытания при температуре 25, 35 и 75°С проводят в полиэтиленовых емкостях; при температурах 95 и 98°С используют тонкостенные стеклянные колбы. Сосуды продувают струей аргона по ГОСТ 10157-79, чтобы вытеснить более легкий кислород. Подготовленные, как было указано выше, образцы, посредством зажимов, представленных на фиг.2, помещают в сосудах на тонких вискозных подвесах (из кордной нити). После этого, не прерывая струи аргона, по резиновой трубке заполняют колбы приготовленной и сохраняемой под слоем вазелинового масла агрессивной водной средой. Объем агрессивной водной среды принимают в соответствии с ГОСТ 9.905-82, выбирая соотношение объема среды и поверхности образцов, при котором параметры, определяющие агрессивность среды, не могут существенно изменяться во время коррозионных испытаний. Исходя из площади поверхности образца 4,6 см2, объем водной среды был принят с заведомым запасом 2 дм3 на 1 образец. Этот запас объема водной среды обеспечивает большее постоянство ее состава по сравнению с условиями проведения опытов при разработке способа, принятого за прототип. Затем сосуды сразу же плотно запирают пробками, смазанными вакуумной смазкой, дополнительно уплотняют каучуковым колпачком, натянутым на горло, и погружают в водяной термостат с заданной температурой на 10 суток.
После испытаний с поверхности образцов продукты коррозии удаляют жесткой зубной щеткой, плотно приставшие продукты коррозии смывают травильным раствором по ГОСТ 9.907-83 (серная кислота концентрированная - 50 см2, тиомочевина - 5 г, вода дестиллированная - до 1 дм3) при температуре 20°С в течение 10 минут. Очищенные образцы промывают дестиллированной водой, трехкратно промывают этанолом (винным спиртом), высушивают и взвешивают. Определяют разность массы образца до и после испытаний Δm=(m1-m2), где m1 - масса образца до испытаний, мг; m2 - масса образца после испытаний, мг. Скорость коррозии ω, мг/(м2·с), определяют по формуле:
ω = Δ m S τ , ( 10 )
где Δm - разность массы образца до и после испытаний, мг;
S - площадь поверхности образца, S=4,6·10-4 м2;
τ - время испытаний, τ=3600×24×10=864000 с.
В случае равномерной коррозии стали, при ее плотности 7850 кг/м3, 1 мг/(м2·с) соответствует 4,016 мм/год. Степень защиты стали от коррозии Z, %, определяют по формуле:
Z = ( ω 0 − ω ) ω 0 ⋅ 100 % , ( 11 )
где ω0 - скорость коррозии в контрольном опыте (без ингибитора), мг/(м2·с);
ω - скорость коррозии в присутствии ингибитора, мг/(м2·с);
Экспериментальную проверку применимости заявляемого способа проводили в пяти сериях опытов. За приемлемую для практики принимали степень защиты, превышающую 80%.
В первой серии (примеры 1-5) варьировали концентрацию кислорода при средних значениях всех остальных параметров; использовали ингибитор, содержащий локализованную π-связь Р=O. Результаты приведены в табл.3. Из табл.3 видно, что в примере 1, при низкой концентрации кислорода, степень защиты стали от коррозии оказывается недостаточно высокой (60,0%), так же, как и в способе, принятом за прототип. Это объясняется, по-видимому, тем, что при низкой концентрации кислорода катодная реакция (2) протекает недостаточно активно, в результате поверхность металла имеет низкий потенциал, что приводит к торможению анодной реакции (1). При этом концентрация как ионов железа Fe2+, так и гидроксид-анионов недостаточна для эффективного образования поверхностных комплексов, защищающих металл. Кроме того, концентрация кислорода в коррозионной среде в этом опыте столь мала, что кислород при проведении испытаний достаточно быстро расходуется; а без кислорода не могут или реакции (2) и (1), необходимые для избирательного осаждения ингибитора на поверхности. В примерах 2-4, в которых концентрация кислорода находится в пределах от 0,1 до 6,0 мг/дм3, степень защиты стали оказывается достаточно высокой (88,8-93,3%), что подтверждает эффективность заявляемого способа и согласуется с примерами практического осуществления способа [4], принятого за прототип. При концентрации кислорода 8,0 мг/дм3 (пример 5) степень защиты стали от коррозии оказывается также невысокой (80,0%). Судя по всему, это обусловлено тем, что при такой концентрации кислорода окислительно-восстановительный потенциал среды по отношению к реакции (2) и компромиссный потенциал поверхности металла настолько высок, что площадь корродирующей поверхности металла оказывается слишком большой для ее эффективной защиты ингибитором.
Во второй серии (примеры 6-9) варьировали рН водной среды при средних значениях всех остальных параметров; использовали ингибитор, содержащий локализованную π-связь Р=O. Результаты этих опытов приведены в табл.4, причем для сравнения приведен и результат опыта по примеру 3. Из табл.4 видно, что в примере 6, при значении рН=4,6, степень защиты стали от коррозии очень низкая (52,7%). Это объясняется следующими причинами: во-первых, в этих условиях содержание гидроксид-ионов в водной среде недостаточно для осаждения поверхностных гидроксокомплексов магния и цинка; во-вторых, при рН=4,6 концентрация ионов водорода достаточна для того, чтобы протекала реакция водородной деполяризации (3); в-третьих, при этой величине рН ионы (CH3C(OH)(PO3)2)4-, необходимые для протекания реакций (5) и (6), вовлекаются в конкурирующую реакцию с ионами водорода (протонирование):
Образующиеся в результате ионы (CH3C(OH)(PO3H)2)2- образуют гораздо менее прочные поверхностные комплексы, вследствие чего защитная органофосфонатная пленка также слабо проявляет свое действие. В примерах 7, 3 и 8, при значениях рН от 5,8 до 11,1, степень защиты стали от коррозии достаточно высока (82,4-91,7%). В примере 9, в котором значение рН водной среды составляет 11,9, степеньзащиты стали ниже (78,6%). Это объясняется тем, что при таком значении рН концентрация гидроксид-ионов излишне высока; это ведет к интенсивному осаждению гидроксокомплексов цинка и магния, к распаду цинкового и магниевого комплексов 1-гидроксиэтилидендифосфоновой кислоты с образованием взвеси (гидрозоля) гидроксида цинка Zn(OH)2 и гидроксида магния Mg(OH)2:
2OH-+[Zn(CH3C(OH)(PO3)2)]2-⇆(CH3C(OH)(PO3)2)4-+Zn(OH)2↓,
2OH-+[Mg(CH3C(OH)(PO3)2)]2-⇆(CH3C(OH)(PO3)2)4-+Mg(OH)2↓.
Гидроксид цинка и гидроксид магния осаждаются на поверхности стали без всякой избирательности по отношению к коррозионным очагам; по-видимому, то же происходит и с ионами (CH3C(OH)(PO3)2)4-. Все это приводит к непроизводительному расходованию ингибитора.
В третьей серии (примеры 10-13) варьировали содержание магния в водной среде при средних значениях всех остальных параметров; использовали ингибитор, содержащий локализованную π-связь Р=O. Результаты этих опытов приведены в табл.5, причем для сравнения приведен и результат опыта по примеру 3. При содержании магния 0,104 моль/м3 (пример 10) степень защиты стали оказывается недостаточно высокой (80,0%). Это обусловлено тем, что при низком содержании ионов магния равновесие (5) смещено влево, а содержание ионов [Mg(СН3С(ОН)(РО3)2)]2- недостаточно для образования достаточно прочной защитной пеленки органофосфонатных комплексов. В примерах 11, 3 и 12, при содержании магния от 0,208 до 6,23 моль/м3, степень защиты стали высока и составляет 88,5-94,4%. В примере 13, при содержании магния 10,39 моль/м3, степень защиты стали резко падает. Это обусловлено связыванием гидроксид-анионов с интенсивным образованием взвеси гидроксида магния:
2OH-+Mg2+⇆Mg(OH)2↓
причем гидроксид магния (с примесью основного карбоната магния 3MgCO3·Mg(OH)2·3H2O) осаждается на поверхности стали в виде белого налета, имеющего вид крупных (до 10 мкм) частиц, плохо связанных с поверхностью стали и не защищающих ее от коррозии.
В четвертой серии (примеры 14-17) варьировали температуру водной среды при сред