Способ персонифицированного подбора антиагрегантных препаратов больным, нуждающимся в подобном лечении
Иллюстрации
Показать всеИзобретение относится к медицине и касается способа персонифицированного подбора антиагрегантых препаратов больным, нуждающимся в подобном лечении, включающего забор крови больного, получение богатой тромбоцитами плазмы с помощью центрифугирования крови, разделение ее на пробы и введение в них антиагрегантных препаратов, имеющих различные механизмы антиагрегационного действия на тромбоциты с последующей инкубацией проб плазмы с препаратами при температуре 36,5-37,5°C и с индуктором агрегации тромбоцитов. Изобретение обеспечивает повышение точности подбора антиагрегантных препаратов больным, нуждающимся в подобном лечении. 2 пр., 5 ил.
Реферат
Изобретение относится к области медицины, в частности к неврологии, и может быть использовано для исследования индивидуальной чувствительности и резистентности больных к антиагрегантным препаратам, что позволит улучшить лечение больных в ангионеврологических клиниках.
Известно, что разные люди по разному отвечают на одни и те же антиагрегантные препараты. Индивидуальный ответ на данные препараты является комплексным признаком, зависящим как от внешних факторов (образ жизни, возраст, взаимодействие с другими лекарственными препаратами, состояние здоровья и т.п.), так и от генетических особенностей конкретного больного.
Одним из факторов риска считается активизация сосудисто-тромбоцитарного звена гемостаза и нарушение реологических свойств крови, в частности повышение свертываемости, которое может привести к опасным последствиям для организма, тромбообразованию. В этой связи для предотвращения активации внутрисосудистого тромбообразования патогенетически обоснованным является назначение антитромбоцитарных средств, которые требуют к себе особого внимания при выборе конкретного препарата [Косарев В.В. и др. Фармакология и лекарственная терапия. Под редакцией В.К. Лепахина, М.: Эксмо, 2009, 482 с.].
Как известно, процесс тромбообразования регулируется в основном на двух уровнях: подавление метаболизма простагландинов и подавление АДФ-индуцируемой агрегации тромбоцитов. Тромбоциты можно рассматривать в качестве ключевой мишени для направленного терапевтического воздействия. Они первыми отвечают на эндотелиальное повреждение [Маслова Н.Ф. и др. Клопидогрель (плавикс) - современное антиагрегантное средство: доказанная фармакологическая эффективность. Ж. Провизор, 2007, №20, с.10-13].
Наиболее перспективными средствами, с позиции доказательной медицины, являются антиагреганты. Антиагрегантными свойствами обладают следующие группы препаратов:
- ингибиторы циклооксигеназы - нестероидные противовоспалительные средства (ацетилсалициловая кислота, индометацин, сульфинпиразон, напроксен и др.);
- ингибиторы фосфодиэстеразы цАМФ и аденилатциклазы (дипиридамол, пентоксифиллин);
- селективные ингибиторы тромбоксансинтетазы (производные имидазола);
- стимуляторы синтеза простациклина (производные пиразолина, кумарина и никотиновой кислоты);
- простаноиды (простациклин, в том числе синтетические аналоги, простагландины Е2 и D2);
- ингибиторы связывания аденозиндифосфата (АДФ) с рецепторами тромбоцитов (клопидогрель (К), тиклопидин (тиклид)).
Учитывая значение тромбоцитов для первичного и коагуляционного гемостаза, особое внимание уделяется препаратам, способным воздействовать на их активность. В настоящее время известно около 20 антитромбоцитарных средств, которые могут путем влияния на различные звенья блокировать агрегацию тромбоцитов, тем самым прекращая тромбообразование уже на начальном этапе. Однако широкое клиническое применение в качестве антиагрегантов, эффективность которых доказана различными исследованиями, получили такие лекарственные средства как ацетилсалициловая кислота (аспирин), тиклопидин и пентоксифиллин (трентал).
Аспирин (ацетилсалициловая кислота) - одно из наиболее распространенных средств профилактики тромбообразования, которое было признано «золотым стандартом» антиагрегантной терапии. Механизм действия аспирина связан с блокированием циклооксигеназы тромбоцитов, вследствие чего нарушается синтез индукторов их агрегации (простагландинов G2, Н2 и тромбоксана А2) из арахидоновой кислоты.
Несмотря на то, что антиагрегантное действие аспирина развивается быстро и отличается продолжительностью, он блокирует только один механизм агрегации тромбоцитов. К физиологически значимым индукторам агрегации относятся также АДФ, тромбин, серотонин, коллаген. Самым важным из них является АДФ. Недостатками аспирина, ограничивающими его применение как антиагреганта, являются также низкая эффективность при высоких концентрациях адреналина в плазме, возможность развития толерантности, а также отрицательное действие на желудочно-кишечный тракт: риск кровотечений и язвообразования. К тому же ему присуща довольно широкая вариабельность индивидуальных ответов, что затрудняет подбор индивидуальной дозы.
Тиклопидин является производным тиенопиридина. По химической структуре и по механизму антитромботического действия он отличается от других антиагрегантов. Предполагают, что его фармакологический эффект связан с блокадой активации рецепторов IIb/IIIa тромбоцитов, индуцированной АДФ. Тиклопидин необратимо ингибирует функцию тромбоцитов, но не оказывает влияния на циклооксигеназу и цАМФ.
Пентоксифиллин (трентал) является производным пурина. Обладает антиагрегационным действием. Ингибирует фосфодиэстеразу, стабилизирует цАМФ и снижает концентрацию внутриклеточного кальция. Блокирует аденозиновые рецепторы. Тормозит агрегацию тромбоцитов, повышает их устойчивость к деформации, улучшает реологические свойства крови, подавляет тромбообразование и нормализует микроциркуляцию.
На сегодняшний день известны способы определения индивидуальной чувствительности и резистентности больных к антиагрегантным препаратам путем капиллярного электрофореза [Minarik M, Kopeckova M, Gassman М, Osmancik P, Benesova L. Rapid testing of clopidogrel resistance by genotyping of CYP2C19 and CYP2C9 polymorphisms using denaturing on-chip capillary electrophoresis. Electrophoresis, 2012 Apr; 33(8):1306-10]. Однако в данной работе оценивается механизм резистентности только для одного препарата - клопидогрела по скорости его метаболизма ферментами цитохрома Р450.
Известен также способ персонифицированного подбора антиагрегантных лекарственных препаратов больным, нуждающимся в данном лечении путем проведения ПЦР в реальном времени [Jorge L. Sepulveda, MD, PhD. Microarray Technology and Other Methods in Pharmacogenomics Testing. - Pharmacogenomics in Clinical Therapeutics, First Edition. Edited by Loralie J. Langman and Amitava Dasgupta. 2012. - p.185-200].
Но метод ПЦР в реальном времени является дорогостоящим и трудоемким.
В качестве ближайшего аналога нами рассмотрен способ персонифицированного подбора антиагрегантных препаратов больным, нуждающимся в подобном лечении, путем определения агрегации тромбоцитов in vitro [RU 2188419 от 27.06.2000]. Однако данный способ не дает возможности установить механизм действия препаратов и визуализировать молекулярную белковую мишень - экспрессия, которая изменяется в ответ на действие про- и антиагрегантов, что непосредственно влияет на точность индивидуального подбора антиагрегантных препаратов.
Нами разработан более информативный способ в отношении определения механизмов антиагрегационной активности препаратов, в котором актин цитоплазматический 1 является маркером тромбообразования и потенциальной лекарственной мишенью.
Техническим результатом изобретения является повышение точности индивидуального подбора антиагрегантных препаратов за счет визуализации белков протеома тромбоцитов, в частности идентификация фракции белка актина цитоплазматического 1, экспрессия которого изменяется под действием про- и антиагрегантов.
Технический результат достигается тем, что для персонифицированного подбора антиагрегантых препаратов больным, нуждающимся в подобном лечении, проводят забор крови больного, получение богатой тромбоцитами плазмы с помощью ее центрифугирования, разделения плазмы богатой тромбоцитами на пробы и введения в них антиагрегантных препаратов, имеющих различные механизмы антиагрегационного действия на тромбоциты с последующей инкубацией проб плазмы с препаратами при температуре 36,5-37,5°С и с индуктором агрегации тромбоцитов, затем после инкубации проводят осаждение тромбоцитов из проб плазмы с антиагрегантными препаратами путем повторного центрифугирования при 6000 об/мин в течение 10 минут и температуре 10°С, каждый из полученных клеточных осадков растворяют в 167 мкл буфера TES, который содержит: 2% додецилсульфата натрия (SDS), 1 mM EDTA, 50 mM Tris-HCl, pH 6.8, и прогревают при 37°С в течение 60 минут при перемешивании, после чего смешивают осадки с краской для нанесения образцов на полиакриламидный гель (ПААГ) в соотношении 1:1 и прогревают 20 минут в тех же условиях, затем методом 1-D электрофореза в 14% полиакриламидном геле в присутствии SDS определяют в каждой из проб фракцию белка актин цитоплазматического 1 по м.м. 45 кДа и выявляют для каждой пробы степень его экспрессии - интенсивность окрашивания белковой полосы м.м. 45 кДа, причем оптимальным для лечения больного антиагретантным препаратом является препарат пробы, в которой фракция белка актин цитоплазматического 1 имеет наименьшую интенсивность окраски.
Способ осуществляется следующим образом.
Больному производят забор крови из кубитальной вены, затем получают обогащенную тромбоцитами плазму путем центрифугирования в течение 5 минут при 1000 об/мин и проводят разделение обогащенной тромбоцитами плазмы на пробы аликвоты по 300 мкл с внесением в каждую из них антиагрегационного препарата с определенным механизмом антиагрегационного действия на тромбоциты (при этом используются препараты с различными механизмами антиагрегационного действия). Осуществляют инкубацию проб плазмы с различными антиагрегационными препаратами с перемешиванием при температуре 36,5-37,5°С в течение 10 минут. Затем вносят в исследуемые пробы индуктор агрегации тромбоцитов АДФ или адреналин и проводят вновь инкубацию при тех же условиях. После инкубации из проб плазмы, обогащенной тромбоцитами, и с находящимися в них различными антиагрегационными препаратами проводят осаждение тромбоцитов путем повторного центрифугирования при 6000 об/мин в течение 10 минут и температуре 10°С, полученный супернатант удаляют и проводят отмывание тромбоцитов фосфатным буфером рН 7,4. Затем полученные клеточные осадки растворяют в 167 мкл буфера TES, который содержит: 2% SDS, 1 mM EDTA, 50 mM Tris-HCl, pH 6.8, и прогревают при 37°С в течение 60 минут при перемешивании и смешивают с краской для нанесения образцов на 14% полиакриламидный гель (ПААГ) в соотношении 1:1 и прогревают еще 20 минут в тех же условиях (температуре 37°С и в течение 60 минут). На гель наносят каждую пробу по 2,5 мкл образца. Краска для нанесения образцов на полиакриламидный гель содержит: 1 ml I M Tris-HCl, pH 6.8; 2.4 g глицерина; 4 ml 20% SDS; 0.4 ml 2-меркаптоэтанола; 2 mg Кумасси голубого G-250 и 2.7 ml воды. После чего проводят исследование белков кровяных пластинок в ПААГ в присутствии SDS по Леммли (U.K. Laemmli. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature, 1970; V.227, P.680-685). Электрофорез проводят в тонком слое полиакриламидного геля. Белки мигрируют в зависимости от молекулярной массы. После завершения электрофореза выявляют зону фракции белка актин цитоплазматического 1 по м.м. 45 кДа, определяют для каждой пробы степень его экспрессии - интенсивность окрашивания белковой полосы м.м. 45 кДа. Оптимальным для лечения больного антиагретантным препаратом является препарат пробы, в которой фракция белка актин цитоплазматического 1 имеет наименьшую интенсивность окраски.
Сущность предложенного нами способа состоит в том, что исследование протеома тромбоцитов позволяет добиться улучшения процесса подбора антиагрегантов у больных, имеющих цереброваскулярную патологию в короткие сроки.
Способ отличается следующим:
- позволяет проводить оценку протеома тромбоцитов и визуализировать молекулярные белковые мишени, через которые лекарственные препараты оказывают свое действие, путем исследования тромбоцитов пациентов;
- позволяет оценить белковый состав протеома тромбоцитов каждого пациента;
- позволяет визуализировать белок-маркер актин цитоплазматический 1, экспрессия которого изменяется под действием про- и антиагрегантов;
- дает возможность исследовать механизм действия большого набора известных и потенциальных антиагрегантов;
- является более простым и экономически выгодным и открывает новые возможности для исследования и подбора адекватной лекарственной терапии.
Примеры осуществления способа.
Пример 1.
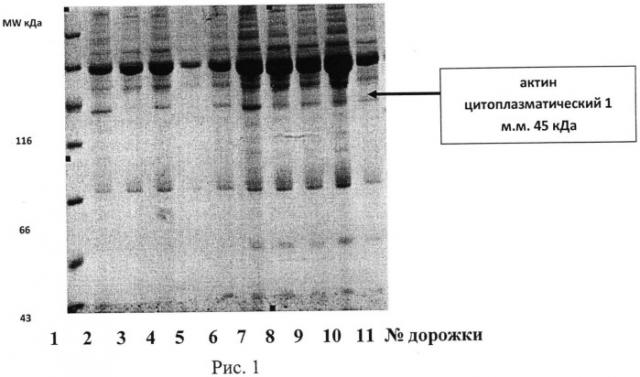
Больная С., 65 лет, наблюдалась в НЦН РАМН с артериальной гипертонией. Получала симптоматическую терапию антиагрегантным препаратом тиклопидин и гипотензивными препаратами с незначительным временным положительным эффектом на фоне прогрессирования заболевания. Проведенное исследование протеома тромбоцитов пациентки предлагаемым способом выявило, что для нее препаратом выбора является аспирин. На рисунке 1 приведены данные по исследованию протеома тромбоцитов и идентификация фракции белка-маркера актин цитоплазматического 1. Проведенное исследование выявило, что для данной больной препаратом выбора является аспирин, так как наименьшая интенсивность окраски фракции белка актин цитоплазматического 1 была в пробе плазмы, обогащенной тромбоцитами с аспирином (рис.1, дорожка 5). На рисунке 1 указаны результаты исследования для пациентки С. на дорожках 1-6:
1-дорожка - белки-маркеры молекулярного веса
2-дорожка - контроль
3-дорожка - адреналин
4-дорожка - АДФ
5-дорожка - АДФ+аспирин
6-дорожка - АДФ+тиклопидин.
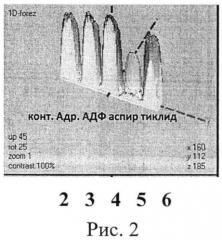
На рисунке 2 представлен результат обработки данных электрофореграммы (определение индивидуальной чувствительности к действию про- и антиагрегантов больной С.) в программе Melanie Viewer 7, которая также подтверждает, что препаратом выбора является аспирин.
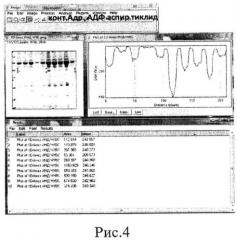
На рисунках 4 и 5 представлен результат обработки данных электрофореграммы (определение индивидуальной чувствительности (рис.4) и резистентности (рис.5) к действию про- и антиагрегантов больной С.) в программе Image J.
На основании анализа был назначен аспирин, состояние больной постепенно улучшилось, произошла нормализация показателей агрегации тромбоцитов.
Пример 2.
Больная Д., 65 лет, наблюдалась в НЦН РАМН с артериальной гипертонией и дисциркуляторной энцефалопатией. Получала симптоматическую терапию антиагрегантным препаратом аспирин и гипотензивными препаратами с незначительным эффектом на фоне прогрессирования заболевания. Проведенное исследование протеома тромбоцитов пациентки предлагаемым способом выявило, что для данной больной препаратом выбора является тиклопидин (рис.1, дорожка 11), так как наименьшая интенсивность окраски фракции белка актин цитоплазматического 1 была в пробе плазмы, обогащенной тромбоцитами с тиклопидином (рис.1, дорожка 11). На рисунке 1 указаны результаты исследования для больной Д. на дорожках 7-11:
7-дорожка - контроль
8-дорожка - адреналин
9-дорожка - АДФ
10-дорожка- АДФ+аспирин
11-дорожка- АДФ+тиклопидин.
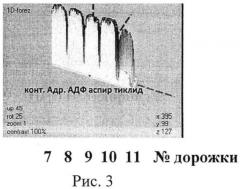
На рисунке 3 представлен результат обработки данных электрофореграммы (определение индивидуальной чувствительности к действию про- и. антиагрегантов больной Д. Компьютерная обработка результатов электрофореграммы (изменение насыщенности цвета окрашенной белковой полосы - актина цитоплазматического) в программе Melanie Viewer 7, которая также подтверждает, что препаратом выбора является тиклопидин.
На основании анализа аспирин был заменен на тиклопидин, состояние больной улучшилось, произошла нормализация показателей агрегации тромбоцитов.
Результаты, полученные с помощью протеомных методов, согласуются с результатами клинических анализов агрегации тромбоцитов, дополняя их. Для пациента 1 препаратом выбора является аспирин. Для пациента 2 препаратом выбора является тиклид. При анализе электрофореграммы видно, что белок с м.в. 45 кДа может являться как маркером тромбообразования, так и лекарственной мишенью.
Протеомная карта является визуальным документом, подтверждающим индивидуальную чувствительность к лекарственным препаратам. По полученным протеомным картам нормальных и патологически измененных клеток можно установить, какие белки важны для развития того или иного патологического состояния и выбрать их в качестве мишеней лекарственных препаратов.
Нами были исследованы протеомные карты 20 больных с различными заболеваниями (ишемические цереброваскулярные заболевания, сердечнососудистые заболевания), требующими лечения антиагрегантными препаратами (аспирин, тиклид, трентал). Анализ данных карт показал, что во всех случаях корректировка лечения на основе указанного анализа приводила к положительному результату - нормализации показателей агрегации тромбоцитов.
Предложенный нами способ лабораторного исследования антиагрегационного действия препаратов с помощью определения экспрессии актина цитоплазматического 1 методом 1-D электрофореза в ПААГ в присутствии SDS по Леммли является более информативным и позволяет визуализировать молекулярную белковую мишень экспрессии, которая изменяется в ответ на действие препаратов, что позволяет осуществлять подбор индивидуально для каждого пациента с учетом особенностей протеома его тромбоцитов и открывает возможность изучения молекулярных механизмов, лежащих в основе лекарственной резистентности.
Способ персонифицированного подбора антиагрегантных препаратов больным, нуждающимся в подобном лечении, включающий забор крови больного, получение богатой тромбоцитами плазмы с помощью центрифугирования крови, разделения ее на пробы и введения в них антиагрегантных препаратов, имеющих различные механизмы антиагрегационного действия на тромбоциты с последующей инкубацией проб плазмы с препаратами при температуре 36,5-37,5°C и с индуктором агрегации тромбоцитов, отличающийся тем, что после инкубации проводят осаждение тромбоцитов из проб плазмы с антиагрегантными препаратами путем повторного центрифугирования при 6000 об/мин в течение 10 мин и температуре 10°C, каждый из полученных клеточных осадков растворяют в 167 мкл буфера TES, который содержит: 2% SDS, 1 mM EDTA, 50 mM Tris-HCl, pH 6,8, и прогревают при 37°C в течение 60 мин при перемешивании, после чего смешивают осадки с краской для нанесения образцов на полиакриламидный гель в соотношении 1:1 и прогревают 20 мин в тех же условиях, затем методом 1-D электрофореза в 14% полиакриламидном геле в присутствии додецилсульфата натрия определяют в каждой из проб актин цитоплазматический 1 по м.м. 45 кДа, выявляют для каждой пробы степень его экспрессии - интенсивность окрашивания белковой полосы м.м. 45 кДа, причем оптимальным для лечения больного антиагретантным препаратом является препарат пробы, в которой фракция белка актин цитоплазматического 1 имеет наименьшую интенсивность окраски.