Композиции производных флавоноидных полифенолов и их применение для борьбы с патологиями и со старением живых организмов
Иллюстрации
Показать всеИзобретение относится к композиции производных полифенолов и используется в косметике, диетологии и терапии. Композиция производных полифенолов, обладающая антиоксидантной и антирадикальной активностью и оказывающая эффект на карбонильный стресс. Способ получения композиции. Косметическая композиция, обладающая антиоксидантной и антирадикальной активностью и оказывающая эффект на карбонильный стресс. Применение композиции в диетологии. Композиция для применения в качестве лекарственных средств, обладающих антиоксидантной и антирадикальной активностью и оказывающих эффект на карбонильный стресс. Фармацевтическая композиция, обладающая антиоксидантной и антирадикальной активностью и оказывающая эффект на карбонильный стресс. Вышеописанная композиция эффективно оказывает эффект на карбонильный стресс. 6 н. и 17 з.п. ф-лы, 11 ил., 5 пр.
Реферат
Изобретение относится к композициям производных флавоноидных полифенолов для предупреждения и борьбы с многочисленными патологиями и старением тканей и живых организмов. Оно относится также к способу получения указанных композиций, а также к их применению, в частности, в области косметики, диетологии и терапии.
Более полувека назад была разработана гипотеза, согласно которой старение организма человека является результатом накопления многочисленных повреждений, причиненных тканям радикалсодержащими соединениями или соединениями с реакционной способностью к химическому окислению.
К середине 50-х годов после нескольких работ с каучуком химик Гарман обнаружил, что, препятствуя образованию свободных радикалов, получают наиболее надежное средство для борьбы с деструкцией и растрескиванием каучука. По аналогии он предполагает, что старение тканей у человека (например, появление на коже морщин), по-видимому обусловлено «аномальным» образованием внутри клеток очень реакционноспособных химических соединений, в частности свободных радикалов, и реакциями, инициированными этими соединениями.
Реактивные формы кислорода (EOR) образуются на уровне митохондрий путем бесконтрольного «переноса» электрона(ов) к кислороду (EOR: супероксидный анион-радикал, пероксиды, пероксинитриты, свободные радикалы,…).
Эти реактивные формы кислорода (EOR) распространяются и в других клеточных компартментах или в цитоплазме в зависимости от их водо/жирорастворимости и наносят им значительный ущерб.
В контексте изложенного за последние десятилетия были проведены исследования активных веществ для использования в борьбе со старением, благодаря их способности прерывать окислительные реакции цепи, т.е. предотвращать окислительный стресс. Действительно, любое вещество, способное взаимодействовать с EOR и уменьшать их разрушительное действие в течение продолжительного срока, способно оказывать позитивное действие на состояние здоровья и по этим же причинам замедляет старение как причину развития основных патологий. Речь идет о ловушках свободных радикалов (способность отдавать сразу единственный электрон) и/или об антиоксидантах (одновременный перенос двух электронов), таких как витамины (Е и С) и полифенолы.
Однако разрушения, которые связаны со старением организма или сопровождают основные патологии, не являются, по-видимому, следствием только плохого контроля потока электронов, вызванного «утечками» электронов в процессе митохондриального метаболизма и во внутриклеточных EOR, в этих явлениях, очевидно, участвуют также другие источники потенциальных губительных эффектов, такие как «реакция Майярда» и карбонильный стресс.
При карбонильном стрессе карбонильная (альдегидная) группа глюкозы проявляет свои электрофильные свойства по отношению к нуклеофильным остаткам белков (аминным, тиольным,…); здесь находится отправная точка карбонильного стресса, который увеличивается при образовании агентов переноса.
Образовавшиеся химические вещества или продукты гликозилирования считаются конечными продуктами гликозилирования: это продукты AGE (“Advanced Glycated End-Products”), в которых глюкоза или ее фрагменты связаны с аминокислотными остатками обратимым образом.
Реакции Майярда, которые протекают при этом, увеличивают в то же время восстановительную способность сахаров и их производных. Образующиеся дикарбонильные соединения приобретают более сильную способность к окислению, чем их предшественники, и легко отдают свои электроны, например, кислороду. Начиная с первоначально образовавшегося супероксидного аниона последствия от EOR такие же, как и в случае внутриклеточного стресса. Таким образом, карбонильный стресс сопровождается вторым типом стресса - окислительным.
В отличие от механизмов, упомянутых выше, происходящих с EOR митохондриального происхождения, этот новый окислительный стресс происходит снаружи клеток, т.е. во внеклеточном матриксе. Он затрагивает аминокислоты или остатки белков этого матрикса, в частности волокон коллагена и эластина. Этот окислительный стресс особенно сильный в связи с тем, что ферментные системы защиты не являются такими же эффективными, как системы, находящиеся в клетке, и приводят к увеличению явлений алкилирования, продукты которых добавляются к продуктам гликозилирования и гликоокисления, полученным в результате карбонильного стресса.
Таким образом, карбонильный стресс, сопровождающийся внеклеточным окислительным стрессом, играет по меньшей мере такую же важную роль, как и внутриклеточный окислительный стресс в развитии старения и в появлении тканевых повреждений, присущих основным патологическим процессам.
Изучение авторами изобретения явлений, приводящих к старению тканей, заставило исследовать более широкий спектр биохимических механизмов, которые вовлечены в эти явления, что привело к разработке новых концепций для определения новых биологических мишеней, на которые можно дополнительно воздействовать для более эффективной борьбы с ними.
Исследования авторов изобретения привели к необходимости модифицировать структуру полифенолов, обладающих антиоксидантными свойствами и свойством улавливания свободных радикалов, таких как полифенолы, входящие в растительные экстракты, для того чтобы, дополнительно, придать им свойства улавливания карбонилсодержащих стресс-факторов.
Таким образом, задача изобретения заключается в том, чтобы предложить новые композиции производных полифенолов, состоящие из суперактивных полифенолов, которые способны действовать одновременно с большой эффективностью на множество биомишеней (окислительный и карбонильный стрессы) и являются стабилизированными.
Задача изобретения заключается также в том, чтобы предложить способ, позволяющий получить указанные производные полифенолов из полифенолов растительных экстрактов.
Согласно еще одному аспекту изобретение предназначено для использования свойств предлагаемых композиций полифенолов флавоноидного типа в косметологии, диетологии и терапии.
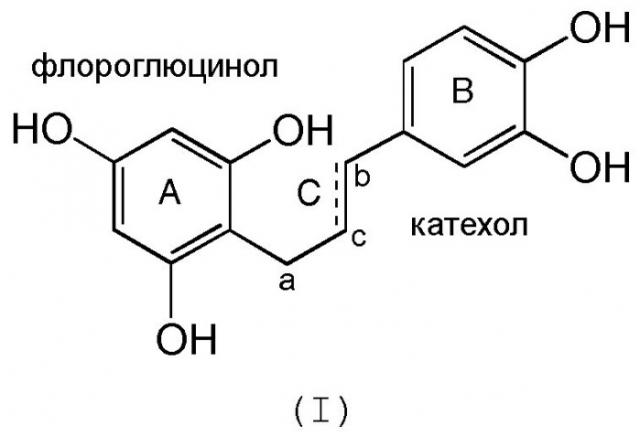
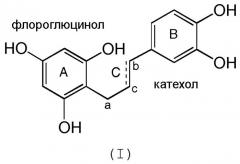
Композиции производных полифенолов согласно изобретению отличаются тем, что указанные полифенолы содержат мономеры, олигомеры или полимеры, состоящие из единиц, соответствующих формуле (I):
Эти единицы характеризуются одновременным наличием кольца флороглюцинольного типа (кольцо А) и кольца катехольного типа (кольцо В), соединенных друг с другом связью с тремя углеродами, такой как С.
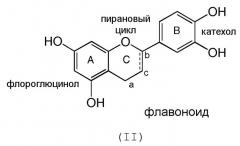
Наиболее часто в этих единицах кольцо А сопряжено с дополнительным кислородсодержащим гетероциклом путем образования связи одного из его кислородов с углеродом b фрагмента С (в случае флаваноидного скелета) формулы (II):
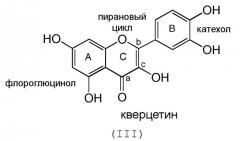
Все тремя углерода фрагмента С могут быть sp2 гибридизированными (двойная связь между b и c и карбонильная группа в положении а), как в случае кверцетина формулы (III):
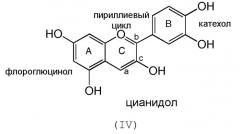
или содержат одну двойную связь между а и c и карбонильную группу в положении b, как в случае цианидола формулы (IV):
или только один его углерод а может быть sp3-гибридизированным, или же все три углерода могут быть sp3-гибридизированы, как в случае катехина формулы (V):
В этом случае углерод а фрагмента С наиболее часто служит местом присоединения с кольцами А других единиц для образования олигомеров или полимеров.
Указанные производные суперактивируют в отношении их нуклеофильной активности путем алкилирования по меньшей мере одной фенольной группы каждой единицы и стабилизируют путем этерификации всех остальных, оставшихся свободными, групп смесью жирных кислот, главным образом, ненасыщенных кислот (AGI).
Как правило, специфические замещения на производных, входящих в композиции согласно изобретению, позволяют моделировать их активность и делают их способными специфически ингибировать основные механизмы, задействованные в большинстве патологий и в процессах старения, упомянутых выше.
Преимущественно, число -О-алкильных групп на молекулу не равно числу гидроксильных групп, приходящихся, в среднем, на единицу, и составляет предпочтительно 1 или 2 группы, более конкретно 1 группу.
Алкильная или алкильные группы представляют собой, в частности, метильные, изопропильные или трет-бутильные группы.
Эффективная стабилизация достигается путем образования сложных эфиров AG между гидроксильными группами (спиртовыми и фенольными), оставшихся свободными после алкилирования (2-3, предпочтительно, 3 группы), и жирными кислотами, извлеченными из растительных масел, характеризующихся особенно большим содержанием жирных кислот, преимущественно, ненасыщенных (AGI). Масла выбирают по их благоприятному действию на здоровье. Преимущественно в полученных активных веществах содержатся ненасыщенные жирные кислоты в соотношениях, идентичных соотношениям этих кислот в маслах, из которых они извлечены.
Указанные сложные эфиры, предпочтительно, включают смеси ацильных радикалов R жирных кислот оливкового масла (Olea europea) или масла из виноградных косточек (Vitis vinifera).
Более конкретно, эти радикалы являются радикалами R насыщенных жирных кислот (AGS = стеариновая кислота; 7-8%), мононенасыщенных жирных кислот (AGMI = олеиновая кислота; 55-75%) и полиненасыщенных незаменимых жирных кислот (AGPI; 15-18%): диненасыщенных (линолевая кислота) и триненасыщенных (линоленовая кислота) групп ω-6 и ω-3, находящимися в производных согласно изобретению в соотношениях, идентичных соотношениям этих кислот в маслах, которые оказывают максимально благотворное влияние на здоровье, в соответствии с данными эпидемиологических служб.
Проведенная стабилизация позволяет, кроме того, защитить суперактивные флавоноидные полифенолы от определенной преждевременной деструкции (окисление на воздухе или на свету) и одновременно придать им липофильный характер с целью повышения их способности к ресорбции и взаимодействию.
Преимущественно эта стабилизация является временной и эффективность ее не должна далее проявляться, если производные оказываются в условиях, когда надо восстановить всю свою антиокислительную активность. Следовательно, стабилизация должна быть обратимой под действием биологических систем, которые воздействуют на стабилизирующие группы, в частности ферментов, таких как липазы, эстеразы или протеазы.
Более конкретно изобретение относится к композициям, отличающимся тем, что указанные выше производные состоят из единиц соответствующих формуле (VI):
где
- R1 обозначает водород или место присоединения такой же единицы по радикалу R7,
- R2 обозначает водород или О-ацильный радикал жирной кислоты растительного масла, обозначаемый радикалом R, описанным выше,
- R3 обозначает водород, карбонильную группу или место присоединения по радикалу R5 или R6 другой единицы,
- R4 обозначает алкильный радикал или ацильный радикал жирной кислоты растительного масла, обозначаемый радикалом R, описанным выше,
- R5 обозначает водород или место присоединения другой единицы по радикалу R3, непосредственно или через углеродную группу (метиленовую, метилметиновую,…)
- R6 обозначает водород или место присоединения другой единицы по радикалу R3, непосредственно или через углеродную группу (метиленовую, метилметиновую,…),
- R7 обозначает алкильный радикал или ацильный радикал жирной кислоты растительного масла, обозначаемый радикалом R, описанным выше, или место присоединения такой же единицы по радикалу R1,
и диастереоизомерам и региоизомерам этих единиц.
В качестве примера можно привести производные димера катехина (В3) и тримера эпикатехина (С2) формул (VII) и (VIII):
В соответствии с предпочтительным вариантом изобретения описанные выше производные соответствуют алкилированным, а затем стабилизированным производным растительных экстрактов. Следовательно, они имеют структуры полифенолов, которые находятся в этих растительных экстрактах в виде смеси.
Эти экстракты представляют собой, в частности, растительные экстракты винограда, зеленого чая или чая из ферментированных листьев, сырых и обжаренных бобов какао, или сосны.
Экстракты винограда получают из виноградных косточек или виноградных выжимок.
В соответствии с изобретением композиции производных полифенолов, описанные выше, получают путем взаимодействия соответствующих полифенольных композиций:
- на первой стадии, с алкилирующим агентом в условиях, приводящих к замещению водорода по меньшей мере 1 фенольной ОН-группы на мономерную единицу, составляющую каждую молекулу, предпочтительно, 1-2 групп, алкильной группой, и
- на второй стадии, с ацилирующим агентом, в частности с ангидридом или хлорангидридом кислоты, в условиях, приводящих к замещению водорода в группах -ОН, оставшихся свободными после алкилирования, смесью ацильных радикалов -COR, высвобождаемых агентом ацилирования, причем R имеет значения, указанные выше.
В реакции алкилирования используют реактивы, выпускаемые в продажу, такие как галогениды (иодиды, бромиды,…) или сложные сернистые эфиры, из расчета полтора химических эквивалента. Их медленно вводят в раствор полифенольного экстракта в апротонном растворителе (например, безводный ацетон) в присутствии минерального основания (карбонат калия,…) при кипении с обратным холодильником и при перемешивании в инертной атмосфере (идеально, азота, аргона).
Реакцию алкилирования останавливают после охлаждения путем добавления разбавленной кислоты (например, соляной) до получения кислого рН. Перемешивание продолжают дополнительно около 45 минут. Реакционную среду концентрирую под вакуумом (выпаривают растворитель). Водный слой экстрагируют равным объемом несмешивающегося растворителя (такого как этилацетат, дихлорметан,…), который сам промывается двумя эквивалентными объемами дистиллированной воды (до нейтральной реакции). Полученный органический слой высушивают над безводным сульфатом натрия, затем фильтруют и упаривают при пониженном давлении для выделения в виде остатка алкилированных полифенолов.
Ацилирующий агент получают из растительного масла в соответствии со следующей процедурой:
- омыление глицеридов растительного масла с последующим подкислением,
- активация путем дегидратации в случае, когда ацилирующим агентом является ангидрид кислоты, или путем хлорирования в случае, когда используют хлорангидрид кислоты, но пригодны для использования и другие производные, создающие тот же активирующий эффект (в зависимости от задачи: переэтерификация, ферментативное ацилирование).
Реакцию омыления осуществляют в водном слое в присутствии щелочного агента, такого как гидроксид калия, используемого по меньшей мере в стехиометрическом количестве, предпочтительно, при температуре кипения с обратным холодильником. Затем раствор доводят до кислого значения рН добавлением неорганической кислоты, и экстрагируют органическим растворителем для выделения смеси свободных кислот, образовавшихся в процессе реакции.
Реакцию дегидратации осуществляют с обратным холодильником в присутствии растворителя, способного образовывать азеотропную смесь с водой, которую удаляют по мере ее образования.
Используют, например, толуол, удаляя воду с помощью системы типа “Dean Stark”.
Реакцию хлорирования ведут в присутствии растворителя, способного растворять свободные жирные кислоты. Реакцию катализируют основанием Льюиса и ведут при медленном добавлении агента хлорирования и при контролируемой температуре около 0°С. Когда добавление закончено, перемешивание продолжают при комнатной температуре, затем реакционную среду концентрируют упариванием под вакуумом и полученные хлорангидриды очищают дистилляцией.
Преимущественно:
- в качестве растворителя реакции хлорирования используют, например, дихлорметан или хлороформ, при условии, что он не был стабилизирован спиртом,
- агентом хлорирования является, например, тионилхлорид или оксалилхлорид,
- катализатором может быть диметилформамид,
- очистку ацилхлоридов осуществляют отгонкой при глубоком вакууме в «шаровой печи» (Kugelrohr).
Реакцию ацилирования чаще всего осуществляют в присутствии растворителя, способного солюбилизировать, хотя бы частично, алкилированные полифенольные соединения, полученные в результате описанного выше алкилирования.
Подходящие растворители выбирают из галогенпроизводных, таких как дихлорметан, хлороформ или 1,2-дихлорэтан, или азотпроизводных, таких как пиридин, или даже гексан, в зависимости от алкилированных соединений, подлежащих растворению.
Алкилированные полифенольные производные, растворенные в выбранном реакционном растворителе, к которому, преимущественно, добавляют каталитический агент, имеющий основный характер (например, триэтиламин или пиридин), направляют для перемешивания в инертной атмосфере (аргон, азот).
В качестве агентов ацилирования берут четыре эквивалента ангидрида или хлорангидрида AG, полученных выше. Эти агенты, добавляемые по каплям, растворяют в реакционном растворителе, если этими агентами не является только пиридин. В случае, когда пиридин является одновременно растворителем и оснόвным катализатором, то осуществляют добавление в обратном порядке. Тогда раствор полифенольных производных добавляют по каплям к ацилпиридиниям, которые получают предварительно.
Можно воспользоваться вариантом осуществления, который заключается в добавлении при энергичном перемешивании щелочной водной фазы (Na3PO4, K2PO4) к органическому раствору (CHCl3, CH2Cl2) алкилированных полифенольных производных и агентов алкилирования, реализуя, таким образом, условия Шоттена-Баумана.
Независимо от принятой методики реакцию осуществляют, предпочтительно, при комнатной температуре в течение времени приблизительно от 7 до 8 часов.
Полученные этерифицированные производные очищают путем добавления подкисленной воды (HCl до кислого рН), затем осуществляют несколько промывок органического слоя дистиллированной водой. После высушивания над сульфатом натрия раствор фильтруют, выпаривают досуха и получают алкилированные и стабилизированные активные флавоноидные вещества.
Полученные активные соединения, обладающие двойной активностью согласно изобретению: улавливать активные формы кислорода (EOR) независимо от их внутриклеточного или внеклеточного происхождения и, одновременно, дикарбонильные соединения (антигликозилирование и анти-AGE), представляют огромный интерес как наиболее полные и наиболее эффективные средства на сегодняшний день для борьбы против старения кожи.
Композиции согласно изобретению особенно интересны для получения косметических препаратов.
В этих препаратах композиции соединяют с соответствующими носителями, пригодными для наружного применения. Преимущество их в том, что жирорастворимый характер этих композиций благоприятствует введению их в обычные галеновые формы, широко используемые в косметике.
Таким образом, изобретение относится к косметическим композициям, отличающимся тем, что они содержат одну или несколько композиций производных флавоноидных полифенолов, описанных выше, вместе с инертными носителями, подходящими для наружного нанесения, в количестве, эффективном для борьбы со старением кожи.
Эти композиции представлены в форме, подходящей для нанесения топическим путем, такой как крем, мазь, эмульсия, гель, липосомы, лосьон.
Композиции содержат 0,5-5% активного вещества, предпочтительно, 2-3%.
Изобретение относится также к способу предупреждения старения кожи, отличающемуся тем, что наносят на кожу или принимают внутрь одну или несколько косметических композиций, описанных выше.
Согласно другому аспекту, представляющему большой интерес, композиции согласно изобретению могут использоваться в диетологии. В частности, благодаря своей антирадикальной активности и способности улавливать карбонильные соединения, композиции обеспечивают наилучшую сохранность пищевых продуктов. Кроме того, композиции, как правило, представляют собой фактор обогащения витаминами. Поэтому их можно с успехом добавлять в напитки, например, во фруктовые соки, тонизирующие напитки, молочные продукты и продукты их переработки, такие как масло.
Композиции могут быть также использованы, как таковые, в жидкой форме или же в гранулированной, или аналогичной форме, в форме геля или пасты, и введены, например, в кондитерские изделия, такие как фруктовая паста, конфеты, жевательная резинка.
Свойства композиций согласно изобретению могут быть успешно выявлены при использовании композиций в качестве лекарственных средств.
Таким образом, изобретение относится также к фармацевтическим композициям, отличающимся тем, что они содержат терапевтически эффективное количество по меньшей мере одной композиции, описанной выше, вместе с фармацевтически приемлемым носителем.
Преимущественно, эти композиции находятся в форме, подходящей, в частности, для перорального, топического или парентерального введения.
Так, более конкретно, для перорального пути введения композиции имеют форму растворов, таблеток, желатиновых капсул или сиропов.
Для топического пути введения композиции имеют форму крема, мазей, гелей, лосьонов или пластырей.
Для парентерального пути введения композиции имеют форму стерильных или стерилизуемых растворов для инъекций.
Другие характеристики и преимущества изобретения раскрыты в качестве иллюстрации в примерах, описанных ниже, в которых дана отсылка на Фиг.1-11, которые показывают, соответственно:
- Фигура 1: хроматограмму CLHP-ESI-MS (TIC) О-метилированных катехинов,
- Фиг.2: спектр IR-FT, записанный по методу ATR, алкилированных (метилированных) флавонольных полифенолов из виноградных косточек,
- Фиг.3: спектр ЯМР 2D HMBC 1H-13C (500 МГц) флавонольных полифенолов из виноградных косточек, алкилированных диметилсульфатом,
- Фиг.4: спектр IR-FT, записанный по методу ATR, жирных кислот, полученных после омыления оливкового масла «вирджин»,
- Фиг.5: газовую хроматограмму, детектируемую масс-спектрометрией (GC-DSQ2) сложных метиловых эфиров, полученных из хлорангидридов AG оливкового масла,
- Фиг.6: спектр IR-FT хлорангидридов AG оливкового масла (метод ATR),
- Фиг.7: спектр ЯМР протона при 500 МГц (CDCl3) хлорангидридов AG оливкового масла,
- Фиг.8: спектр IR-FT флавонольных полифенолов из виноградных косточек, алкилированных и стабилизированных AG оливкового масла,
- Фиг.9: часть спектра ЯМР 1Н (500 МГц, CDCl3) в слабых полях флавонольных полифенолов из виноградных косточек, алкилированных и стабилизированных AG оливкового масла, и интегральные кривые,
- Фиг.10: часть спектра ЯМР 1Н (500 МГц, CDCl3) в сильных полях флавонольных полифенолов из виноградных косточек, алкилированных и стабилизированных AG оливкового масла, и интегральные кривые,
- Фиг.11: спектр ЯМР 2D HMBC 1H-13C (500 МГц, CDCl3) флавонольных полифенолов виноградных косточек, алкилированных и стабилизированных AG оливкового масла.
Пример 1: Стадия О-алкилирования катехина
В двугорлой колбе, снабженной холодильником, растворяют 50 мг (0,172 ммол) катехина в 5 мл безводного ацетона. При перемешивании в атмосфере аргона в присутствии 23,8 мг (0,172 ммол, 2 химических экв.) карбоната калия (К2СО3) прибавляют 8,3 мкл (0,086 ммол = 2 химических экв.) диметилсульфата (ДМС). Реакцию проводят с обратным холодильником в течение 27 часов.
Реакционную среду фильтруют на фриттированном стекле №4 для удаления К2СО3 и выпаривают ацетон. Остаток обрабатывают 20 мл этилацетата. Органический слой после промывки 2 раза 20 мл воды, сушки над сульфатом натрия, фильтрования и выпаривания досуха, дает остаток массой 48 мг (выход сырого продукта = 91,6%, включающего монометилированные производные, молекулярная масса = 304).
Полученную смесь анализируют путем высокоэффективной жидкостной хроматографии на «обратнофазной» колонке (С18) в сочетании с детектированием масс-спектрометрией при атмосферном давлении и ионизацией в электроспрее (CLHP-ESI-MS), представленной на Фиг.1. Наблюдаются потоки ионов, из которых наиболее интенсивные потоки ионов имеют массу ионов, характерную для монометилированных катехинов ([М+Н]+=305), время удержания (TR) = 15,79; 15,95; 17,75 и 17,84 минут, и наименее интенсивные потоки ионов имеют массу ([М+Н]+=319), время удержания (TR) = 21,66; 23,66; 24,67; 26,02 и 27,34 минут, соответствующую диметилированным производным катехина.
Пример 2: Стадия О-алкилирования флавоноидных полифенолов
31,18 г («108 ммол», выраженные в «катехиновых» звеньях) экстракта полифенолов из виноградных косточек растворяют в 120 мл апротонного растворителя (безводный ангидрид) в присутствии 6 химических эквивалентов карбоната калия (44,64 г = 646 ммол). В однолитровой трехгорлой колбе, снабженной холодильником, полученную суспензию нагревают с обратным холодильником при перемешивании в атмосфере аргона.
При помощи капельной воронки добавляют по каплям в течение 15 минут 7,65 мл донора метилов (диметилсульфат, 81,5 ммол; каждый моль ДМС высвобождает 2 моля «метилов» = 2×81,5 = 163 эквивалента, т.е. 1,5 химического эквивалента/масса используемого полифенольного экстракта) или изо-пропилов (2-иодопропан).
При расчете химических эквивалентов исходят из того, что «максимально» в среднем 4 гидроксильных фенольных группы способны алкилироваться на «флавонольной единице». Таким образом, считают, что каждая порция экстракта массой 290 г соответствует 1 молю катехина, который имеет 4 фенольные группы, из которых одна, даже две группы, должна(должны) быть превращена(ы) в группу(ы) метилового(вых) или изо-пропилового(ых) эфира(ов). Следовательно, химический эквивалент алкилирующего агента составляет четвертую часть от числа молей «катехина», находящихся в используемом экстракте.
После нагревания с обратным холодильником в течение восьми часов в атмосфере аргона реакционную среду охлаждают. После введения раствора десятикратно разбавленной соляной кислоты, для достижения кислого рН (540 мл), перемешивание продолжают в течение дополнительных 45 минут. Реакционную среду концентрируют под вакуумом (выпаривание ацетона). Остаточный водный слой экстрагируют равным объемом этилацетата и промывают дважды 400 мл дистиллированной воды (до нейтральной реакции промывочной воды). Эту органическую фазу сушат над безводным сульфатом натрия, фильтруют и выпаривают при пониженном давлении для получения в остатке алкилированных полифенолов (20,88 г; выход сырого продукта = 63,9%).
В предпочтительном случае, когда каждая молекула исходного экстракта подвергается только одному метилированию на флавонольную единицу («катехиновую»), получают смесь разных возможных регио- и стереоизомеров, таких как мономеры и димеры указанных ниже формул (IX)-(XXVI):
Как и в предыдущем примере, алкилированные (метилированные) структуры этих флавонольных соединений устанавливаются путем анализа различных спектров этих соединений:
- Наличие простого метилового эфира фенола отражено на IR-спектре (Фиг.2), в частности, появлением полос поглощения в диапазоне между 2974 и 2836 см-1, характерных для С-Н связей в метильной группе (элонгация) и полос поглощения в диапазоне между 1064 и 1035 см-1, характерных для С-О связей в эфирных группах (С-О).
- Спектр ЯМР 2D HMBC показывает корреляции между ароматическими углеродами, связанными с кислородом, (148-160 м.д.), и протонами простых метиловых эфиров при резонансе между 3,7-3,94 м.д. Эта зона в увеличенном масштабе включена в общий спектр, представленный на Фиг.3.
Пример 3: Получение ацилирующих агентов.
Стадия №1: омыление оливкового масла
К 50,46 г оливкового масла «вирджин» (57 ммол, = «171 экв.»), помещенного в колбу, снабженную холодильником, прибавляют 16,08 г гидроксида калия (285 ммол, 1,67 экв.), растворенного в 2,5 мл этанола и 50 мл воды. Реакцию проводят с обратным холодильником в течение 5 часов. Затем реакционную смесь перемешивают дополнительно в течение 14 часов при комнатной температуре.
После разбавления полученного раствора 300 мл воды прибавляют десятикратно разбавленную соляную кислоту (3,7%; масса/объем), для установления кислого рН водного слоя (около 250 мл). Содержимое колбы, которое включает на поверхности пастообразный «нерастворимый» продукт, переносят на делительную воронку и экстрагируют 700 мл гексана. Органический слой отделяют, затем промывают 2 раза 300 мл дистиллированной воды (до нейтрального рН этого водного слоя).
Органический слой высушивают над сульфатом натрия, фильтруют на фриттированном стекле №4, затем выпаривают с получением остатка массой 42,9 г (выход сырого продукта = 88,8%).
Инфракрасный спектр, записанный по методу ATR с Фурье-преобразованием (Фиг.4), показывает полосу, характерную для свободных органических кислот, при 1709 см-1 и в то же время исчезновение полос сложных эфиров исходного масла.
Стадия №2: Активация жирных кислот, полученных после омыления оливкового масла, посредством образования хлорангидридов:
В колбе, охлаждаемой ледяной баней, в атмосфере аргона перемешивают раствор 41,5 г свободных жирных кислот (147,1 ммол), полученных на стадии №1, в 232 мл хлороформа (стабилизированного амиленом). С помощью капельной воронки прикапывают 13,8 мл оксалилхлорида (162 мМ = 1,1 экв.) в течение 30 минут. Вводят 1 мл диметилформамида (ДМФ) и перемешивание продолжают на ледяной бане в течение 5 минут. После концентрирования при пониженном давлении реакционной смеси (хлороформ и избыток оксалилхлорида) получают 44,3 г маслянистого остатка, слегка окрашенного в желтый цвет (выход сырого продукта = 100%).
Путем отгонки в шаровой печи (kugelrhor) при значительном вакууме (2 мм рт.ст.) исчезает окрашивание полученного остатка (бесцветная жидкость), одновременно собирают фракции, отгоняемые при температуре 178-195°С.
Для проведения анализа состава полученной смеси хлорангидридов жирных кислот несколько микролитров дистиллята обрабатывают метанолом. Весь объем впрыскивают в газовый хроматограф, снабженный колонкой типа “FAME” (Fatty Acid Methyl Ester) и линейным детектором массы (DSQ-II). На хроматограмме, представленной на Фиг.5, пик со временем удержания 17,8 мин соответствует стеарату (М+. = 298), пик со временем удержания 18,07 мин соответствует олеату (М+. = 296), пик со временем удержания 18,08 мин соответствует линолеату (М+. = 294) и пик со временем удержания 19,38 мин соответствует линоленату (М+. = 292). Относительные интенсивности пиков этих компонентов хорошо указывают на их соответствующие соотношения.
Спектры IR-FT (Фиг.6) и ЯМР протона (Фиг.7) находятся в полном соответствии с образованием исключительно этих хлорангидридов:
Полоса при 1798 см-1 характерна для ацилхлоридов.
Протоны альфа-карбонильной группы (т, J=7,5 Гц) имеют химический сдвиг, равный 2,9 м.д., характерный для превращения карбоксильных групп в хлорангидриды кислоты.
Пример 4: Ацилирование экстракта алкилированных флавоноидов виноградных косточек
21,93 г (72 ммол = 288 химических экв.) экстракта флавоноидов виноградных косточек, алкилированных (метилированных) согласно примеру №2, помещают в атмосферу аргона и частично растворяют в 270 мл хлороформа (стабилизированного амиленом). К реакционной среде прибавляют агент основного характера, триэтиламин (40,56 мл = 29,45 г (d=0,726) = 291,5 ммол = 1 химический экв.) и «раствор» подвергают ультразвуковой обработке в течение 5 минут. При перемешивании магнитной мешалкой при комнатной температуре добавляют по каплям с помощью капельной воронки в течение 20 минут 87,55 г ацилирующих агентов, полученных в примере №3 (хлорангидриды AG оливкового масла = 288 ммол = 1 химический экв.), разведенные 60 мл хлороформа. Выделение газа происходит при падении каждой капли.
Реакцию ведут еще в течение семи часов с перемешиванием при комнатной температуре, затем помещают смесь в делительную воронку и промывают 190 мл десятикратно разбавленной соляной кислоты, 90 мл 10%-го (масса/объем) раствора NaHCO3 в воде и, наконец, дистиллированной водой до нейтральной реакции (три раза по 90 мл). Органическую фазу высушивают над сульфатом натрия, фильтруют, затем выпаривают досуха при пониженном давлении. Получают остаток массой 67,27 г алкилированных и стабилизированных активных флавоноидов виноградных косточек (= 49,68 ммол; выход сырого продукта = 69%, средняя молекулярная масса = 1354).
Чтобы идентифицировать полученные активные вещества, все продукты были максимально подвергнуты спектральным анализам:
- Инфракрасный спектр с Фурье-преобразованием, полученный по методу ATR (), показывает появление интенсивной полосы при 1764 см-1, характерной для карбоксилов фенольных сложных эфиров, сопровождающееся исчезновением широкой полосы с центром при 3350 см-1, которая соответствовала свободным гидроксилам фенолов.
- Спектр ЯМР протона (500 МГц, CDCl3) представлен своими интегральными кривыми в виде двух частей. В слабых полях (Фиг. 9) спектр позволяет «вычислить» долю ароматических протонов = 5,5 (область 7,95-5,90 м.д.) по отношению к олефиновым протонам: массив с центром при 5,35 м.д., откалиброванный на 8 протонов (в соответствии, в среднем, с четырьмя олефинами на катехиновую единицу). В сильных полях (Фиг. 10) можно наблюдать синглетные сигналы метоксилов ароматических простых эфиров (4,05-3,58 м.д.) и массив сигналов, характерных для метиленовых протонов альфа-карбоксилов ароматических сложных эфиров с центром при δ=2,49 м.д.
- Спектр ЯМР, двухмерный гетероциклический, 1Н-13С с наибольшей широтой спектра при 500 МГц (Фиг. 11), в режиме инверсии (HMBC), четко показывает корреляции, которые находятся в полном соответствии с разнообразными структурами флавонольных полифенолов алкилированных (простые метиловые эфиры с кислородом ароматического цикла) и этерифицированных (сложные эфиры жирных кислот, главным образом, ненасыщенных, в виде статистической смеси, получаемой из оливкового масла, используемого для получения агентов ацилирования, фенолов и алициклических спиртов).
В предпочтительных случаях, когда каждая молекула исходного экстракта подвергается только одному метилированию на флавонольную единицу («катехиновую») и когда все остаточные фенольные группы и флавонольные спиртовые группы ацилированы смесью AG оливкового масла, получают смесь разных возможных регио- и стереоизомерных мономеров и димеров, представленных ниже формулами (XXVII)-(XXXI):
Пример 5: Косметические композиции
Рецептура А
| ФАЗЫ | ИСХОДНЫЕ ВЕЩЕСТВА | % |
| 101 | Вода | 80,8000 |
| 102 | EDTA тетранатриевый | 0,0500 |
| 103 | Глицерин | 5,0000 |
| 104 | Карбомер | 0,3500 |
| 201 | Цетеарилгликозиды пшеницы | 0,7500 |
| 202 | Цетеарилгликозиды ячменя | 1,7500 |
| 203 | Цетеариловый спирт | 2,5000 |
| 204 | Композиция согласно изобретению | 0,05-1 |
| 205 | Butyrospermum Parkii | 2,5000 |
| 206 | Токоферилацетат | 0,5000 |
| 207 | Масло виноградных косточек (Vitis Vinifera) | 3,0000 |
| 208 | Цетиловый спирт | 1,0000 |
| 209 | Цетилфосфат калия | 1,0000 |
| 301 | Консерванты | 0,6000 |
| 401 | Душистое вещество | 0,2000 |
| 501 | Гидроксид натрия до рН 6,00 |
Рецептура В
| ФАЗЫ | ИСХОДНЫЕ ВЕЩЕСТВА | % |
| 101 | Вода | 79,40000 |
| 102 | EDTA тетрана |