Производное аминокислоты
Иллюстрации
Показать всеПроизводные аминокислот по настоящему изобретению предоставляют новые соединения общей формулы (I), где значения радикалов указано в описании. Производные аминокислот по настоящему изобретению представляют собой новые соединения, демонстрирующие превосходное анальгетическое действие не только в модели ноцицептивной боли на животных, но также и в модели нейропатической боли на животных, таким образом, производные аминокислот очень эффективны в качестве лекарственных средств для лечения различных заболеваний, сопровождающихся болью. 2 н. и 27 з.п. ф-лы, 175 пр., 15 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к производному аминокислоты и его соли и гидрату, которые являются фармацевтически приемлемыми, и к фармацевтическому средству, содержащему эти соединения в качестве активного ингредиента.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В настоящее время против общих "болей" используют нестероидные противовоспалительные лекарственные средства (NSAID), ненаркотические анальгетики, наркотические анальгетики и т.п. при условии, что для них начали применять терапевтические способы. Однако в настоящее время почти не существует каких-либо анальгетиков, которые могут снимать нейропатические боли.
"Боли" по причинам заболеваний приближенно классифицируют на ноцицептивную боль (так называемая общая "боль"), вызываемую сильными стимулами (ноцицептивными стимулами), которые могут приводить к разрушению тканей организма, и нейропатическую боль (нейрогенная боль), представляющую собой боль при заболевании, являющуюся результатом повреждения или дисфункции центральных или периферических нервов. Эта нейропатическая боль в дополнение к спонтанной боли обуславливает такие симптомы, как гипералгезия, которая снижает болевой порог для ноцицептивных стимулов, и сильная боль (аллодиния), вызываемая тактильной стимуляцией, которая, как правило, не вызывает боли. После возникновения патологического состояния оно становится хроническим и в результате с большим трудом поддается лечению.
В результате интенсивных исследований на соединениях, демонстрирующих действие на различного вида боли авторы настоящего изобретения выявили, что производные аминокислот по настоящему изобретению обладают превосходным анальгетическим действием не только в модели ноцицептивной боли на животных, но также и в модели нейропатической боли на животных. В качестве производных аминокислот описаны N-циннамоилтриптофан в качестве промежуточного соединения для соединения с противоаллергическим действием (непатентная публикация 1), N-циннамоил-L-триптофан, N-циннамоил-D-триптофан и N-3-хлорциннамоилтриптофан, подавляющие возбуждение гигантских нервных клеток восточно-африканской земляной улитки (непатентная публикация 2), п-кумароил-L-триптофан и кафеоил-триптофан, которые являются веществами, выделенными из кофейных зерен (непатентная публикация 3), N-акрилил-L-триптофан и N-акрилил-L-лейцин, являющиеся мономерами сополимера (непатентная публикация 4); однако ни в одной из публикаций никогда не описано, что эти соединения пригодны в качестве фармацевтического средства, и особенно в качестве анальгетиков. Кроме того, в патентной публикации 1 описан п-кумароил-L-триптофан, N-кафеоил-L-триптофан, п-кумароил-L-тирозин, или т.п., который выделяют из растений; однако, в публикации не описано, что они обладают анальгетическим действием, и т.п.
ПУБЛИКАЦИИ ИЗВЕСТНОГО УРОВНЯ ТЕХНИКИ
ПАТЕНТНАЯ ПУБЛИКАЦИЯ(И)
Патентная публикация 1: международная публикация WO 2008/009655
НЕПАТЕНТНЫЕ ПУБЛИКАЦИИ
Непатентная публикация 1: "Biomedical Problems", 58, 9-38 (1999)
Непатентная публикация 2: "Comparative Biochemistry and Physiology", 75, 329-335 (1983)
Непатентная публикация 3: "Bioscience, Biotechnology and Biochemistry", 59(10), 1887-1890 (1995)
Непатентная публикация 4: "Journal of Polymer Science: Polymer Chemistry Edition", 10, 3569-3576 (1972)
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, ПОДЛЕЖАЩИЕ РЕШЕНИЮ ПОСРЕДСТВОМ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предоставление производного аминокислоты, пригодного в качестве фармацевтического средства, такого как анальгетик.
СРЕДСТВА РЕШЕНИЯ ЗАДАЧ
В результате интенсивных исследований на соединениях, демонстрирующих действие на различного вида боли авторы настоящего изобретения выявили, что производные аминокислот, представленные приведенной ниже структурной формулой (I'), обладают превосходным анальгетическим действием в патологической модели ноцицептивной боли на животных и в патологической модели нейропатической боли на животных, таким образом, эти производные аминокислот пригодны в качестве фармацевтического средства, такого как анальгетик. Таким образом осуществлено настоящее изобретение.
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Производное аминокислоты по настоящему изобретению представляет собой новое соединение, демонстрирующее превосходное анальгетическое действие не только в модели ноцицептивной боли на животных, но также и в модели нейропатической боли на животных, таким образом, производное аминокислоты очень эффективно в качестве лекарственного средства для лечения различных заболеваний, сопровождающихся болью.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
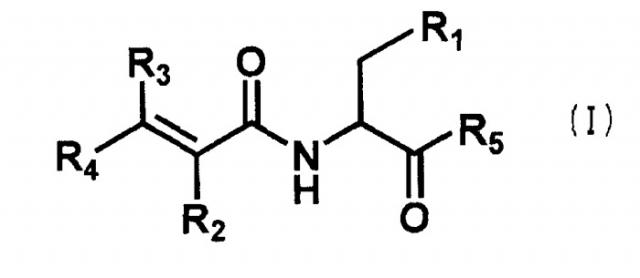
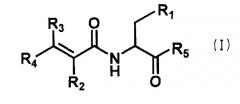
Настоящее изобретение относится к новому производному аминокислоты и его соли и гидрату, которые являются фармацевтически приемлемыми, где производное аминокислоты предтавлено следующей общей формулой (I):
где R1 означает индол, N-положение которого может быть замещено формилом, бензилом или алкилом с числом атомов углерода от 1 до 6, фенил, замещенный гидрокси или алкокси с числом атомов углерода от 1 до 4, алкил с числом атомов углерода от 1 до 6, который может быть замещен карбокси, амино, гуанидино, карбамоилом или алкилсульфанилом с числом атомов углерода от 1 до 4, или гидрокси;
R2 означает водород, алкил с числом атомов углерода от 1 до 4 или циано;
R3 означает водород или алкил с числом атомов углерода от 1 до 4;
R4 означает водород, алкил с числом атомов углерода от 1 до 4 или фенил, который может быть замещен одним или двумя заместителями, выбранными из гидрокси, галогена, циано, трифторметила, фенокси, алкила с числом атомов углерода от 1 до 6 и алкокси с числом атомов углерода от 1 до 4;
R5 означает гидрокси или амино, или
R2 и R4 могут быть связаны с образованием бензофуранового цикла или кумаринового цикла,
при условии, что в случае, когда R2 представляет собой водород, а R4 представляет собой фенил, замещенный гидрокси или хлор, фенил, замещенный гидрокси и метокси или незамещенный фенил, R1 означает заместитель, отличный от незамещенного индола и гидроксифенила; или
в случае, когда R2 представляет собой водород, а R4 представляет собой фенил, замещенный метилом, R1 означает заместитель, отличный от фенила, замещенного гидрокси или алкокси с числом атомов углерода от 1 до 4; или
в случае, когда R2 представляет собой водород, а R4 представляет собой фенил, замещенный гидрокси, R1 означает заместитель, отличный от карбоксиметила; или
в случае, когда R2 и R4 представляют собой водород, R1 означает заместитель, отличный от незамещенного алкила и незамещенного индола.
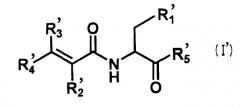
Также настоящее изобретение относится к фармацевтическому средству, такому как анальгетик, содержащему в качестве активного ингредиента по меньшей мере одного представителя из производных аминокислот и их солей и гидратов, которые являются фармацевтически приемлемыми, где производное аминокислоты представлено следующей общей формулой (I'):
где R1' означает индол, N-положение которого может быть замещено формилом, бензилом или алкилом с числом атомов углерода от 1 до 6, фенил, замещенный гидрокси или алкокси с числом атомов углерода от 1 до 4, алкил с числом атомов углерода от 1 до 6, который может быть замещен карбокси, амино, гуанидино, карбамоилом или алкилсульфанилом с числом атомов углерода от 1 до 4, или гидрокси;
R2' означает водород, алкил с числом атомов углерода от 1 до 4 или циано;
R3' означает водород или алкил с числом атомов углерода от 1 до 4;
R4' означает водород, алкил с числом атомов углерода от 1 до 4 или фенил, который может быть замещен одним или двумя заместителями, выбранными из гидрокси, галогена, циано, трифторметила, фенокси, алкила с числом атомов углерода от 1 до 6 и алкокси с числом атомов углерода от 1 до 4;
R5' означает гидрокси или амино, или
R2' и R4' могут быть связаны с образованием бензофуранового цикла или кумаринового цикла.
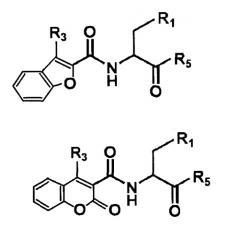
Каждая из общих формул в случае, где R2 и R4 связаны с образованием бензофуранового цикла или кумаринового цикла, является одной из формул, приведенных ниже. То же самое применимо в случае R2' и R4'.
В заместителях в общих формулах (I) и (I'), указанных выше, алкил с числом атомов углерода от 1 до 4 означает линейную или разветвленную алкильную группу, и алкильная группа предпочтительно представляет собой метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил или т.п. Алкил с числом атомов углерода от 1 до 6 означает линейную или разветвленную алкильную группу, и алкильная группа предпочтительно представляет собой метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, гексил, изогексил или т.п. Алкокси с числом атомов углерода от 1 до 4 означает линейную или разветвленную алкоксигруппу, и алкоксигруппа предпочтительно представляет собой метокси, этокси, пропилокси, изопропилокси, бутилокси или т.п. Галоген означает фтор, хлор, бром, йод или т.п.
Среди соединений по настоящему изобретению, предпочтительными соединениями являются приведенные ниже соединения.
Nα-акрилоил-L-триптофан [соединение 1]
Nα-[3-(2-гидроксифенил)акрилоил]-L-триптофан [соединение 2]
Nα-[3-(2-фторфенил)акрилоил]-L-триптофан [соединение 3]
Nα-[3-(3-фторфенил)акрилоил]-L-триптофан [соединение 4]
Nα-[3-(4-фторфенил)акрилоил]-L-триптофан [соединение 5]
Nα-[3-(3-гидроксифенил)акрилоил]-L-триптофан [соединение 6]
Nα-[3-(4-гидроксифенил)акрилоил]-L-триптофан [соединение 7]
Nα-(3-фенилакрилоил)-L-триптофан [соединение 8]
Nα-[3-(2-цианофенил)акрилоил]-L-триптофан [соединение 9]
Nα-[3-(2-трифторметилфенил)акрилоил]-L-триптофан [соединение 10]
Nα-[3-(2-метоксифенил)акрилоил]-L-триптофан [соединение 11]
Nα-[3-(2-хлорфенил)акрилоил]-L-триптофан [соединение 12]
Nα-[3-(2,6-дифторфенил)акрилоил]-L-триптофан [соединение 13]
Nα-[3-(2,4-дифторфенил)акрилоил]-L-триптофан [соединение 14]
Nα-[3-(2,5-дифторфенил)акрилоил]-L-триптофан [соединение 15]
Nα-{3-[3,5-бис(трифторметил)фенил]акрилоил}-L-триптофан [соединение 16]
Nα-[3-(3-цианофенил)акрилоил]-L-триптофан [соединение 17]
Nα-[3-(4-феноксифенил)акрилоил]-L-триптофан [соединение 18]
Nα-[3-(4-цианофенил)акрилоил]-L-триптофан [соединение 19]
Nα-(бензофуран-2-карбонил)-L-триптофан [соединение 20]
Nα-(кумарин-3-карбонил)-L-триптофан [соединение 21]
Nα-[2-циано-3-(2-фторфенил)акрилоил]-L-триптофан [соединение 22]
Nα-[3-(2-фторфенил)акрилоил]-L-триптофанамид [соединение 23]
Nα-[3-(2-фторфенил)акрилоил]-D-триптофан [соединение 24]
Nα-(2-циано-3-фенилакрилоил)-L-триптофан [соединение 25]
Nα-[3-(2-гидроксифенил)акрилоил]-1-метил-L-триптофан [соединение 26]
Nα-[3-(2-фторфенил)акрилоил]-1-метил-L-триптофан [соединение 27]
Nα-[3-(4-фторфенил)акрилоил]-1-метил-L-триптофан [соединение 28]
1-метил-Nα-(3-фенилакрилоил)-L-триптофан [соединение 29]
Nα-[3-(2-цианофенил)акрилоил]-1-метил-L-триптофан [соединение 30]
Nα-[3-(2,6-дифторфенил)акрилоил]-1-метил-L-триптофан [соединение 31]
Nα-[3-(2,4-дифторфенил)акрилоил]-1-метил-L-триптофан [соединение 32]
Nα-[3-(2,5-дифторфенил)акрилоил]-1-метил-L-триптофан [соединение 33]
Nα-[3-(3-цианофенил)акрилоил]-1-метил-L-триптофан [соединение 34]
1-метил-Nα-[3-(4-феноксифенил)акрилоил]-L-триптофан [соединение 35]
Nα-[3-(4-цианофенил)акрилоил]-1-метил-L-триптофан [соединение 36]
Nα-[2-циано-3-(2-фторфенил)акрилоил]-1-метил-L-триптофан [соединение 37]
N-акрилоил-O4-метил-L-тирозин [соединение 38]
N-[3-(2-гидроксифенил)акрилоил]-O4-метил-L-тирозин [соединение 39]
N-[3-(2-фторфенил)акрилоил]-O4-метил-L-тирозин [соединение 40]
N-[3-(3-фторфенил)акрилоил]-O4-метил-L-тирозин [соединение 41]
N-[3-(4-фторфенил)акрилоил]-O4-метил-L-тирозин [соединение 42]
N-[3-(3-гидроксифенил)акрилоил]-O4-метил-L-тирозин [соединение 43]
N-[3-(4-гидроксифенил)акрилоил]-O4-метил-L-тирозин [соединение 44]
O4-метил-N-(3-фенилакрилоил)-L-тирозин [соединение 45]
N-[3-(2-цианофенил)акрилоил]-O4-метил-L-тирозин [соединение 46]
O4-метил-N-[3-(2-трифторметилфенил)акрилоил]-L-тирозин [соединение 47]
N-[3-(2-метоксифенил)акрилоил]-O4-метил-L-тирозин [соединение 48]
N-[3-(2-хлорфенил)акрилоил]-O4-метил-L-тирозин [соединение 49]
N-[3-(2,6-дифторфенил)акрилоил]-O4-метил-L-тирозин [соединение 50]
N-[3-(2,4-дифторфенил)акрилоил]-O4-метил-L-тирозин [соединение 51]
N-[3-(2,5-дифторфенил)акрилоил]-O4-метил-L-тирозин [соединение 52]
N-{3-[3,5-бис(трифторметил)фенил]акрилоил}-O4-метил-L-тирозин [соединение 53]
N-[3-(3-цианофенил)акрилоил]-O4-метил-L-тирозин [соединение 54]
O4-метил-N-[3-(4-феноксифенилакрилоил)]-L-тирозин [соединение 55]
N-[3-(4-цианофенил)акрилоил]-O4-метил-L-тирозин [соединение 56]
N-(бензофуран-2-карбонил)-O4-метил-L-тирозин [соединение 57]
N-(кумарин-3-карбонил)-O4-метил-L-тирозин [соединение 58]
N-[3-(2-фторфенил)акрилоил]-L-лейцин [соединение 59]
N-[3-(2-фторфенил)акрилоил]-L-глутаминовая кислота [соединение 60]
Гидрохлорид Nα-[3-(2-фторфенил)акрилоил]-L-лизина [соединение 61]
N-[3-(2-фторфенил)акрилоил]-L-тирозин [соединение 62]
Гидрохлорид Nα-[3-(2-фторфенил)акрилоил]-L-орнитина [соединение 63]
Nα-[3-(2-фторфенил)акрилоил]-L-аргинин [соединение 64]
Nα-[3-(2-фторфенил)акрилоил]-L-глутамин [соединение 65]
N-[3-(2-фторфенил)акрилоил]-L-серин [соединение 66]
N-[3-(2-фторфенил)акрилоил]-L-метионин [соединение 67]
Nα-[3-(2-фторфенил)акрилоил]-1-формил-L-триптофан [соединение 68]
1-этил-Nα-[3-(2-фторфенил)акрилоил]-L-триптофан [соединение 69]
Nα-[3-(2-фторфенил)акрилоил]-1-изопропил-L-триптофан [соединение 70]
1-н-бутил-Nα-[3-(2-фторфенил)акрилоил]-L-триптофан [соединение 71]
1-бензил-Nα-[3-(2-фторфенил)акрилоил]-L-триптофан [соединение 72]
Nα-[3-(2-метилфенил)акрилоил]-L-триптофан [соединение 73]
Nα-[3-(3-метилфенил)акрилоил]-L-триптофан [соединение 74]
Nα-[3-(4-метилфенил)акрилоил]-L-триптофан [соединение 75]
Nα-[3-(4-н-бутилфенил)акрилоил]-L-триптофан [соединение 76]
Nα-[3-(4-изопропилфенил)акрилоил]-L-триптофан [соединение 77]
Nα-кротоноил-L-триптофан [соединение 78]
Nα-3-метилкротоноил-L-триптофан [соединение 79]
Nα-тиглоил-L-триптофан [соединение 80]
Nα-транс-2-гексеноил-L-триптофан [соединение 81]
Nα-(2-метил-3-фенилакрилоил)-L-триптофан [соединение 82]
Среди указанных выше соединений 1-82 в примерах, описанных ниже, соединения 1, 2, 4-11, 13, 14 и 38 синтезировали в виде натриевых солей, а соединение 60 синтезировали в виде динатриевой соли.
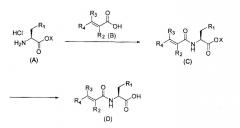
Общий способ получения соединений по настоящему изобретению приведен ниже в настоящем документе. Соединения по настоящему изобретению, представленные указанной ниже общей формулой (I), можно получать способами (1) или (2), описанными ниже (то же самое применимо к соединениям по настоящему изобретению, представленным общей формулой (I')). В настоящем документе ниже приведен пример способа получения производного аминокислоты в L-форме, которое представляет собой соединение по настоящему изобретению, а D-форму, его стереоизомер, также можно синтезировать сходным способом.
(1) в случае, когда R1 представляет собой индол, N-положение которого может быть замещено формилом, алкилом или бензилом, алкоксифенил, гидрокси или алкил, который может быть замещен карбокси, амино, гуанидино или алкилсульфанилом;
R2 представляет собой водород или алкил;
R3 представляет собой водород или алкил;
R4 представляет собой водород, алкил, или фенил, который может быть замещен одним или двумя заместителями, выбранными из гидрокси, галогена, циано, трифторметила, фенокси, алкила и алкокси; и
R5 представляет собой гидрокси, или
R2 и R4 связаны с образованием бензофуранового цикла или кумаринового цикла,
синтез осуществляли способом, приведенном на следующей схеме:
Соединение общей формулы (C) можно получать реакцией соединения общей формулы (A) и соединения общей формулы (B) в растворителе, инертном по отношению к реакционной смеси, в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или морфолин, с применением подходящего конденсирующего агента при комнатной температуре, как правило, в течение от 1 до 24 часов. Инертные растворители включает, например, растворители на основе галогенированных углеводородов, таких как дихлорметан, 1,2-дихлорэтан и хлороформ; растворители на основе простых эфиров, таких как тетрагидрофуран (THF), 1,4-диоксан, 1,2-диметоксиэтан и диэтиловый эфир; растворители на основе ароматических углеводородов, такие как бензол, толуол и ксилол; и т.п. Также можно использовать диметилформамид (DMF) или диметилсульфоксид (DMSO). Конденсирующий агент включает водорастворимый гидрохлорид карбодиимида (WSC•HCl), дициклогексилкарбодиимид (DCC), DCC-HOBt, карбонилдиимидазол (CDI) и т.п.
Соединение общей формулы (D) можно получать, подвергая соединение общей формулы (C) реакции щелочного гидролиза водным раствором неорганического основания, такого как гидроксид натрия, гидроксид калия или гидроксид кальция, в растворителе на основе спирта, такого как метанол, этанол или 2-пропанол. Кроме того, когда на R1 находится защитная группа, соединение общей формулы (D) можно получать, проводя снятие защиты в подходящих условиях. Например, снятие защиты можно проводить обработкой неорганической кислотой в случае, когда защитная группа трет-бутоксикарбонил, или органической кислотой в случае, когда защитная группа представляет собой 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонильную группу. Здесь неорганическая кислота включает хлороводород-диоксан, хлороводород-этилацетат и т.п.; а органическая кислота включает трифторуксусную кислоту и т.п.
(2) в случае, когда R1 представляет собой индол, который может быть замещен формилом, алкилом или бензилом, фенил, замещенный гидроксилом или алкокси, или карбамоилалкилом,
R2 представляет собой водород,
R3 представляет собой водород или циано,
R4 представляет собой фенил, который может быть замещен одним или двумя заместителями, выбранными из галогена или циано, и
R5 представляет собой гидроксил или амино,
синтез осуществляли способом, представленном на следующей схеме:
Соединение общей формулы (F), представляющее собой активированный эфир, можно получать реакцией соединения общей формулы (E) в растворителе, который является инертным по отношению к реакционной смеси, в присутствии подходящего конденсирующего агента с применением подходящего активирующего реагента при комнатной температуре, как правило, в течение от 1 часа до 24 часов. Соединение общей формулы (H) можно получать реакцией соединения общей формулы (F) и соединения общей формулы (G) в присутствии неорганического основания, такого как гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия или карбонат калия, в растворителе, который является инертным по отношению к реакции, при комнатной температуре, как правило, в течение от 1 часа до 30 часов. Здесь инертный растворитель включает, например, растворители на основе галогенированных углеводородов, такие как дихлорметан, 1,2-дихлорэтан и хлороформ; растворители на основе простых эфиров, такие как THF, 1,4-диоксан, 1,2-диметоксиэтан и диэтиловый эфир; растворители на основе ароматических углеводородов, такие как бензол, толуол и ксилол; и т.п. Также можно использовать смешанный растворитель, такой как 1,4-диоксан-вода или THF-DMF. Кроме того, конденсирующий агент включает WSC•HCl, DCC, DCC-HOBt, CDI и т.п.; а активирующий реагент включает имид N-гидроксиянтарной кислоты, фенол, п-нитрофенол и т.п.
Соединения, представленные общей формулой (I) и (I'), указанные выше, в случае, когда существуют их фармацевтически приемлемые соли, включают различные виды их солей. Соли включают, например, соли присоединения кислоты, такой как соляная кислота, серная кислота, азотная кислота, бромоводородная кислота, фосфорная кислота, хлорная кислота, тиоциановая кислота, борная кислота, муравьиная кислота, уксусная кислота, галогенуксусная кислота, пропионовая кислота, гликолевая кислота, лимонная кислота, винная кислота, янтарная кислота, глюконовая кислота, молочная кислота, малоновая кислота, фумаровая кислота, антраниловая кислота, бензойная кислота, коричная кислота, п-толуолсульфоновая кислота, нафталинсульфоновая кислота, сульфаниловая кислота; соли щелочных металлов, таких как натрий и калий, щелочноземельных металлов, таких как кальций и магний и алюминий; или соли с основаниями, такими как аммиак и органические амины. Эти соли можно получать из каждого соединения в свободной форме или конвертировать обратимо известным способом. Кроме того, в случае, когда соединения существует в состоянии стереоизомера, такого как цис-транс-изомер, оптический изомер или координационный изомер, или сольвата, включая гидрат или комплексного соединения с металлом, настоящее изобретение включает любые из этих стереоизомеров, сольватов и комплексных соединений.
Соединение по настоящему изобретению можно комбинировать с подходящим фармацевтическим носителем или разбавителем с получением фармацевтического средства. Также соединение можно получать в виде препаратов любым общепринятым способом, и соединения можно получать в виде составов в качестве перорально вводимого средства, такого как таблетка, капсула, тонкодисперсный порошок или жидкость, или в качестве парентерально вводимого средства для подкожного введения, внутримышечного введения, интраректального введения или интраназального введения. В составах соединения по настоящему изобретению можно использовать в форме их фармацевтически приемлемых солей, и соединения можно использовать отдельно или в подходящей комбинации. Кроме того, их можно получать в виде комбинации лекарственных средств с другими фармацевтически активными ингредиентами.
Желаемая доза соединения по настоящему изобретению может варьировать в зависимости от индивидуума, которому необходимо проводить введение, формы дозы, способа введения, периода введения и т.п. Для получения желаемого эффекта соединение по настоящему изобретению, как правило, можно вводить перорально в количестве от 0,5 до 1000 мг для взрослых, однократно или несколькими дробными введениями в сутки. В случае парентерального введения (например, инъекции) суточная доза предпочтительно составляет от одной десятой до одной третьей уровня дозирования для каждой из доз, указанных выше.
ПРИМЕРЫ
Температуру плавления определяли с применением устройства измерения температуры плавления Yamato Scientific, Model MP-21. Компенсации термометра не проводили. Спектр ядерного магнитного резонанса (1H-ЯМР) записывали посредством анализатора ядерного магнитного резонанса Model ARX500 (Bruker) с использованием в качестве вещества внутреннего стандарта TMS (δ=0). Колоночную хроматографию на силикагеле проводили с использованием силикагеля BW-127ZH для хроматографии в нормальной фазе или основного силикагеля DM1020 для хроматографии со связанными аминопропильными группами хроматография (простой эфир, FUJI SILYSIA CHEMICAL LTD.). Тонкослойную хроматографию проводили с применением силикагеля F254 (Merck, No. 5715), а детекцию осуществляли с применением УФ-лампы и реагента для развития окраски 5% фосфомолибденовой кислоты-этанола. Коммерческие продукты использовали сами по себе в качестве реагентов и растворителей.
Пример 1.
Получение метил-Nα-акрилоил-L-триптофаната.
В раствор гидрохлорида метил-L-триптофаната (5,0 г) в хлороформе (120 мл) при охлаждении на льду добавляли триэтиламин (14 мл), и, кроме того, к ним добавляли акриловую кислоту (1,6 мл). Затем к смеси по каплям добавляли раствор DCC (4,9 г) в метиленхлориде (30 мл). Смесь перемешивали при комнатной температуре в течение 24 часов, а затем половину объема растворителя отгоняли при пониженном давлении, к оставшейся смеси добавляли ацетон, и смесь оставляли в холодильнике на ночь. Гидрохлорид триэтиламина и DC-мочевину отфильтровывали, растворители фильтрата отгоняли при пониженном давлении, и полученный оставшийся маслянистый продукт очищали посредством колоночной хроматографии на силикагеле (BW-127ZH, хлороформ:метанол=19:1) с получением указанного в заголовке соединения (1,5 г, 28%) в виде маслянистого продукта.
Пример 2.
Получение метил-Nα-[3-(2-ацетоксифенил)акрилоил]-L-триптофаната.
В суспензию гидрохлорида метил-L-триптофаната (7,3 г) в метиленхлориде (180 мл) при 0°C добавляли триэтиламин (4,8 мл), 2-ацетоксикоричную кислоту (7,1 г) и WSC•HCl (6,6 г). Смесь перемешивали в течение 20 часов при комнатной температуре. Реакционную смесь промывали водой, а затем органический слой сушили над безводным сульфатом натрия. Оставшийся маслянистый продукт, полученный отгонкой растворителя при пониженном давлении, очищали посредством колоночной хроматографии на силикагеле (BW-127ZH, хлороформ:метанол=100:1) с получением указанного в заголовке соединения (8,9 г, 76%) в виде кристаллов.
Пример 3.
Получение метил-Nα-[3-(3-ацетоксифенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (3,0 г), триэтиламина (2,0 мл), 3-ацетоксикоричной кислоты (2,9 г), WSC•HCl (2,7 г) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (4,7 г, 98%) в виде аморфного твердого вещества.
Пример 4.
Получение метил-Nα-[3-(4-ацетоксифенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (3,0 г), триэтиламина (2,0 мл), 4-ацетоксикоричной кислоты (2,9 г), WSC•HCl (2,7 г) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (4,5 г, 93%) в виде маслянистого продукта.
Пример 5.
Получение метил-Nα-[3-(2-фторфенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (5,0 г), триэтиламина (2,9 мл), 2-фторкоричной кислоты (3,4 г), WSC•HCl (3,9 г) и метиленхлорида (130 мл) с получением указанного в заголовке соединения (7,1 г, 99%) в виде маслянистого продукта.
Пример 6.
Получение метил-Nα-[3-(3-фторфенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (4,0 г), триэтиламина (2,3 мл), 3-фторкоричной кислоты (2,7 г), WSC•HCl (3,2 г) и метиленхлорида (100 мл) с получением указанного в заголовке соединения (4,2 г, 74%) в виде маслянистого продукта.
Пример 7.
Получение метил-Nα-[3-(4-фторфенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (4,0 г), триэтиламина (4,8 мл), 4-фторкоричной кислоты (2,9 г), WSC•HCl (3,3 г) и метиленхлорида (150 мл) с получением указанного в заголовке соединения (4,3 г, 74%) в виде маслянистого продукта.
Пример 8.
Получение метил-Nα-(3-фенилакрилоил)-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (4,0 г), триэтиламина (4,8 мл), коричной кислоты (2,6 г), WSC•HCl (3,3 г) и метиленхлорида (150 мл) с получением указанного в заголовке соединения (3,7 г, 67%) в виде маслянистого продукта.
Пример 9.
Получение метил-Nα-[3-(2-цианофенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (4,0 г), триэтиламина (2,6 мл), 2-цианокоричной кислоты (3,3 г), WSC•HCl (3,6 г) и метиленхлорида (100 мл) с получением указанного в заголовке соединения (5,8 г, 99%) в виде маслянистого продукта.
Пример 10.
Получение метил-Nα-[3-(2-трифторметилфенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (3,0 г), триэтиламина (2,0 мл), 2-трифторкоричной кислоты (3,1 г), WSC•HCl (2,7 г) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (3,4 г, 70%) в виде маслянистого продукта.
Пример 11.
Получение метил-Nα-[3-(2-метоксифенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (4,0 г), триэтиламина (4,8 мл), 2-метоксикоричной кислоты (3,1 г), WSC•HCl (3,3 г) и метиленхлорида (150 мл) с получением указанного в заголовке соединения (5,2 г, 88%) в виде маслянистого продукта.
Пример 12.
Получение метил Nα-[3-(2-хлорфенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (3,0 г), триэтиламина (2,0 мл), 2-хлоркоричной кислоты (2,6 г), WSC•HCl (2,7 г) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (4,5 г, 99%) в виде маслянистого продукта.
Пример 13.
Получение метил Nα-[3-(2,6-дифторфенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (3,0 г), триэтиламина (2,0 мл), 2,6-дифторкоричной кислоты (2,6 г), WSC•HCl (2,7 г) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (3,9 г, 85%) в виде маслянистого продукта.
Пример 14.
Получение метил-Nα-[3-(2,4-дифторфенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (3,0 г), триэтиламина (2,0 мл), 2,4-дифторкоричной кислоты (2,6 г), WSC•HCl (2,7 г) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (4,5 г, 99%) в виде маслянистого продукта.
Пример 15.
Получение метил-Nα-[3-(2,5-дифторфенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (3,0 г), триэтиламина (2,0 мл), 2,5-дифторкоричной кислоты (2,6 г), WSC•HCl (2,7 г) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (4,1 г, 90%) в виде маслянистого продукта.
Пример 16.
Получение метил-Nα-{3-[3,5-бис(трифторметил)фенил]акрилоил}-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (3,0 г), триэтиламина (2,0 мл), 3,5-бис(трифторметил)коричной кислоты (4,0 г), WSC•HCl (2,7 г) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (2,6 г, 64%) в виде кристаллов.
Пример 17.
Получение метил-Nα-[3-(4-феноксифенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (3,0 г), триэтиламина (2,0 мл), 4-феноксикоричной кислоты (3,4 г), WSC•HCl (2,7 г, 14,1 ммоль) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (4,9 г, 94%) в виде маслянистого продукта.
Пример 18.
Получение метил-Nα-(бензофуран-2-карбонил)-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (4,0 г), триэтиламина (2,2 мл), бензофуран-2-карбоновой кислоты (3,1 г), WSC•HCl (3,6 г) и метиленхлорида (100 мл) с получением указанного в заголовке соединения (5,6 г, 98%) в виде маслянистого продукта.
Пример 19.
Получение метил-Nα-(кумарин-3-карбонил)-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-L-триптофаната (3,0 г), триэтиламина (2,0 мл), кумарин-3-карбоновой кислоты (2,7 г), WSC•HCl (2,7 г) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (2,0 г, 43%) в виде маслянистого продукта.
Пример 20.
Получение гидрохлорида метил-1-метил-L-триптофаната.
К метанолу (150 мл) при 0°C по каплям добавляли тионилхлорид (16,7 мл), а затем при комнатной температуре добавляли 1-метил-L-триптофанат (10,0 г). Смесь перемешивали в течение 20 часов, а затем нагревали и кипятили с обратным холодильником в течение 6 часов. К остатку, полученному отгонкой растворителя при пониженном давлении, добавляли диэтиловый эфир и осаждающиеся кристаллы фильтровали с получением указанного в заголовке соединения (10,7 г, 87%).
Пример 21.
Получение метил-Nα-[3-(2-ацетоксифенил)акрилоил]-1-метил-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для соединения, полученного в примере 20 (3,0 г), триэтиламина (1,7 мл), 2-ацетоксикоричной кислоты (2,5 г), WSC•HCl (2,4 г) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (3,9 г, 83%) в виде маслянистого продукта.
Пример 22.
Получение метил-Nα-[3-(2-фторфенил)акрилоил]-1-метил-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для соединения, полученного в примере 20 (4,0 г), триэтиламина (2,3 мл), 2-фторкоричной кислоты (2,7 г), WSC•HCl (3,1 г) и метиленхлорида (100 мл) с получением указанного в заголовке соединения (3,1 г, 54%) в виде маслянистого продукта.
Пример 23.
Получение метил-Nα-[3-(4-фторфенил)акрилоил]-1-метил-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для соединения, полученного в примере 20 (2,0 г), триэтиламина (1,1 мл), 4-фторкоричной кислоты (1,4 г), WSC•HCl (1,6 г) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (2,7 г, 94%) в виде маслянистого продукта.
Пример 24.
Получение метил-Nα-[3-(2,6-дифторфенил)акрилоил]-1-метил-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для соединения, полученного в примере 20 (1,4 г), триэтиламина (0,72 мл), 2,6-дифторкоричной кислоты (1,0 г), WSC•HCl (1,0 г) и метиленхлорида (50 мл) с получением указанного в заголовке соединения (1,1 г, 51%) в виде маслянистого продукта.
Пример 25.
Получение метил-Nα-[3-(2,4-дифторфенил)акрилоил]-1-метил-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для соединения, полученного в примере 20 (1,0 г), триэтиламина (0,54 мл), 2,4-дифторкоричной кислоты (0,72 г), WSC•HCl (0,75 г) и метиленхлорида (40 мл) с получением указанного в заголовке соединения (0,73 г, 49%) в виде маслянистого продукта.
Пример 26.
Получение метил-Nα-[3-(2,5-дифтофенил)акрилоил]-1-метил-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для соединения, полученного в примере 20 (2,0 г), триэтиламина (1,1 мл), 2,5-дифторкоричной кислоты (1,5 г), WSC•HCl (1,6 г) и метиленхлорида (80 мл) с получением указанного в заголовке соединения (2,9 г, 98%) в виде маслянистого продукта.
Пример 27.
Получение метил-1-метил-Nα-[3-(4-феноксифенил)акрилоил]-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для соединения, полученного в примере 20 (1,0 г), триэтиламина (0,54 мл), 4-феноксикоричной кислоты (0,94 г), WSC•HCl (0,75 г) и метиленхлорида (40 мл) с получением указанного в заголовке соединения (0,93 г, 55%) в виде маслянистого продукта.
Пример 28.
Получение метил-Nα-трет-бутоксикарбонил-1-формил-L-триптофаната.
К суспензии карбоната калия (6,2 г) в DMF (50 мл) при 0°C по каплям добавляли раствор Nα-трет-бутоксикарбонил-1-формил-L-триптофана (10,0 г) в DMF (70 мл), и смесь перемешивали в течение 1 часа при комнатной температуре. Затем при 0°C по каплям добавляли раствор йодометана (2,8 мл) в DMF (25 мл), и смесь перемешивали в течение 20 часов при комнатной температуре. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, а затем остаток, полученный отгонкой растворителя при пониженном давлении, очищали посредством колоночной хроматографии на силикагеле (BZ-127ZH, н-гексан:этилацетат=7:3) с получением указанного в заголовке соединения (9,0 г, 86%) в виде кристаллов.
Пример 29.
Получение гидрохлорида метил-1-формил-L-триптофаната.
К раствору соединения, полученного в примере 28 (8,9 г, 25,7 ммоль), в метиленхлориде (200 мл) по каплям добавляли 4 моль/л хлорида водорода-диоксана (19 мл) при комнатной температуре, и смесь перемешивали в течение 15 часов. Осаждающиеся кристаллы фильтровали и промывали диэтиловым эфиром с получением указанного в заголовке соединения (7,2 г, 99%).
Пример 30.
Получение метил-Nα-[3-(2-фторфенил)акрилоил]-1-формил-L-триптофаната.
Те же процедуры, как и в примере 2, проводили для соединения, полученного в примере 29 (4,0 г), триэтиламина (2,2 мл), 2-фторкоричной кислоты (2,6 г), WSC•HCl (3,0 г) и метиленхлорида (100 мл) с получением указанного в заголовке соединения (4,8 г, 86%) в виде маслянистого продукта.
Пример 31.
Получение метил-Nα-[3-(2-фторфенил)акрилоил]-D-триптофаната.
Те же процедуры, как и в примере 2, проводили для гидрохлорида метил-D-триптофаната (2,5 г), триэтиламина (1,6 мл), 2-фторкоричной кислоты (2,0 г), WSC•HCl (2,3 г) и метиленхлорида (80 мл) с получением указанного в заголовке соедин