Рекомбинантный штамм escherichia coli - продуцент гидролазы эфиров альфа-аминокислот из xanthomonas rubrilineans и способ микробиологического синтеза гидролазы эфиров альфа-аминокислот на основе этого штамма
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и касается рекомбинантного штамма Escherichia coli ВКПМ В-11246 - продуцента гидролазы эфиров альфа-аминокислот из Xanthomonas rubrilineans ВКПМ В-9915 и способа микробиологического синтеза такой гидролазы. Представленный штамм сконструирован путем трансформации штамма-реципиента Escherichia coli BL21(DE3) плазмидной ДНК, содержащей кодирующую область гена aehR гидролазы эфиров альфа-аминокислот Xanthomonas rubrilineans ВКПМ В-9915 под контролем промотора Т7 и ген устойчивости к канамицину Kan гидролазы эфиров альфа-аминокислот из Xanthomonas rubrilineans ВКПМ В-9915. Представленный способ синтеза гидролазы эфиров альфа-аминокислот осуществляют путем культивирования штамма-продуцента Escherichia coli ВКПМ В-11246 с добавлением в состав среды канамицина и изопропил-β-D-тиогалактозида в качестве индуктора экспрессии получаемого продукта. Изобретения обеспечивают высокий уровень биосинтеза целевого продукта, что может быть использовано для разработки методов получения биокатализаторов процессов синтеза аминопенициллинов и аминоцефалоспоринов. 2 н.п. ф-лы, 3 ил., 1 табл., 5 пр.
Реферат
Группа заявляемых изобретений относится к биотехнологии, в частности к биосинтезу гидролазы эфиров альфа-аминокислот, и представляет собой рекомбинантный штамм бактерий Escherichia coli (E.coli) BL21(DE3), содержащий ген гидролазы эфиров альфа-аминокислот, способный синтезировать гидролазу эфиров альфа-аминокислот, а также способ микробиологического синтеза гидролазы эфиров альфа-аминокислот на основе этого штамма.
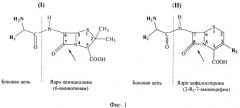
Гидролазы эфиров альфа-аминокислот (alpha-amino acid esther hydrolase, AEH) представляют собой класс ферментов, катализирующих гидролиз эфиров альфа-аминокислот, гидролиз ациламидной связи различных цефалоспоринов и пенициллинов, а также N-ацилирование 7-аминоцефема и 6-аминопенама эфирами альфа-аминокислот. Подобная субстратная специфичность позволяет использовать эти ферменты в качестве биокатализаторов процессов синтеза цефалоспоринов и пеницициллинов, содержащих в боковой цепи аминогруппу в альфа-положении - аминоцефалоспоринов и аминопенициллинов (Фиг.1; структуры I и II, соответственно), составляющих группу аминобета-лактамных антибиотиков [1].
Полусинтетические пенициллины и цефалоспорины занимают приблизительно 65% общего мирового рынка антибиотиков стоимостью 15 миллионов долларов [2]. В промышленных масштабах наиболее перспективной альтернативой химическиму синтезу антибиотиков из ключевых полупродуктов является биокатализ. Успехи генной инженерии по созданию рекомбинантных штаммов-продуцентов различных ферментов трансформации бета-лактамов создают основу для внедрения биокатализа в промышленное производство полусинтетических пенициллинов и цефалоспоринов.
В источниках информации имеются сведения о микроорганизмах - продуцентах внутриклеточной AEH, представляющих собой природные штаммы или штаммы, полученные методами селекции: Acetobacter turbidans [3-5], Pseudomonas melanogenum [6-12], Flavobacterium [13], Xanthomonas citri [14-18], Xanthomonas rubrilineans [19]. Описаны также полученные методами генной инженерии штаммы E.coli - продуценты внутриклеточных рекомбинантных AEH из Acetobacter turbidans, Zymomonas mob His Xanthomonas citri, Xanthomonas campestris pv. campestris [20-26]. В различных источниках количественная характеристика продуцентов проводилась по различным видам ферментативной активности (гидролиз эфиров; гидролиз аминобета-лактамов, например цефалексина, синтез антибиотиков, как правило цефалексина). Сопоставление имеющихся данных показало, что во всех описанных случаях удельная (в пересчете на содержание белка) ферментативная активность биомассы клеток по синтезу цефалексина из 7-аминодезацетоксицефалоспорановой кислоты и метилового эфира D-фенилглицина не превышает 2 МЕ/мг белка (За международную единицу (МЕ) ферментативной активности препарата в отношении какой-либо биокаталитической трансформации принимают такое количество препарата, которое катализирует превращение 1 мкмоля субстрата ( или образование 1 мкмоля продукта) в стандартных условиях за 1 минуту). Сопоставление проведено с учетом приблизительного соотношения скоростей перечисленных выше ферментативных реакций, а также того факта, что при применяемых мягких методах разрушения клеток удельная активность исходной клеточной биомассы не выше удельной активности получаемого из нее бесклеточного экстракта.
Известные работы по получению методами генной инженерии штаммов Escherichia
coli - продуцентов АЕН направлены, в первую очередь, на наработку чистого фермента с целью изучения его структуры и свойств и не привели к существенному увеличению продуктивности рекомбинантных штаммов по сравнению с исходными продуцентами. Например [20], при разрушении клеток ультразвуком и извлечении АЕН из Acetobacter turbidans ATCC 9325 получают бесклеточный экстракт с удельной активностью 1,3 МЕ/мг белка, а созданный на основе Е.coli генно-инженерный продуцент АЕН из Acetobacter turbidans обеспечивает удельную активность лишь 2 МЕ/мг белка.
Повышение уровня продукции гидролаз эфиров альфа-аминокислот является необходимым этапом создания высокоэффективных технологических биокатализаторов для промышленных процессов производства полусинтетических аминопенициллинов и аминоцефалоспоринов и может быть достигнуто путем использования гетерологичных микроорганизмов, на что и направлена заявляемая группа изобретений.
Ближайшим аналогом заявляемого штамма является штамм Е.coli B834(DE3), содержащий на плазмиде рЕС [27] ген aehX из Xanthomonas citri под контролем промотора tac и экспрессирующий гидролазу эфиров альфа-аминокислот [23, 25]. Штамм Е.coli B834(DE3) создан с целью получения чистого фермента и изучения его структуры и свойств и по уровню синтеза АЕН не охарактеризован. По результатам сравнительного анализа (http://blast.ncbi.nlm.nih.gov) уровень гомологии генов aehR из Xanthomonas rubrilineans ВКПМ В-9915 и aehR из Xanthomonas citri составляет 85%.
Ближайшим аналогом заявляемого способа микробиологического синтеза гидролазы эфиров альфа-аминокислот из Xanthomonas rubrilineans является способ с использованием мутантного штамма X. rubrilineans ВКПМ В-9915, продуцирующего данный фермент [28, 29]. Ферментативная активность биомассы клеток по синтезу цефалексина из 7-аминодезацетоксицефалоспорановой кислоты (7-АДЦК), взятой в концентрации 0,04 М, и метилового эфира D-фенилглицина (МЭФГ), взятого в концентрации 0,08 М, при 40°С и рН 6.0, составляет 83,3 МЕ/г влажн., 450 МЕ/г сух. Удельная активность клеток может быть примерно оценена как 1 МЕ/мг белка, учитывая, что суммарный белок составляет примерно половину сухого веса биомассы данного штамма.
Задача заявляемой группы изобретений состоит в разработке способа микробиологического синтеза гидролазы эфиров альфа-аминокислот из X. rubrilineans ВКПМ В-9915 с повышенной продуктивностью.
Задачу решают путем:
- конструирования рекомбинантного штамма бактерий Escherichia coli ВКПМ В-11246
- продуцента гидролазы эфиров альфа-аминокислот из Xanthomonas rubrilineans ВКПМ В-9915, полученного путем трансформации штамма-реципиента Escherichia. coli BL21(DE3) плазмидной ДНК, соответствующей нуклеотидной последовательности SEQ ID NO 1, содержащей кодирующую область гена aehR гидролазы эфиров альфа-аминокислот из Xanthomonas rubrilineans ВКПМ В-9915 под контролем промотора Т7, а также ген устойчивости к канамицину Kan.
- разработки способа микробиологического синтеза гидролазы эфиров альфа-аминокислот из Xanthomonas rubrilineans ВКПМ В-9915 путем культивирования рекомбинантного штамма-продуцента Escherichia coli ВКПМ В-11246 в подходящей питательной среде, в состав которой включают канамицин, а экспрессию целевого продукта осуществляют добавлением изопропил-β-D-тиогалактозида в качестве индуктора.
Работа включает:
- клонирование гена aehR, кодирующего гидролазу эфиров альфа-аминокислот из X. rubrilineans ВКПМ В-9915;
- конструирование рекомбинантной плазмидной ДНК (плазмиды) рАЕН, содержащей ген гидролазы эфиров альфа-аминокислот из X. rubrilineans ВКПМ В-9915 (aehR) под контролем Т7 промотора;
- конструирование рекомбинантного штамма бактерий E.coli BL21(DE3)/pAEH, содержащего плазмиду рАЕН и способного синтезировать гидролазу эфиров альфа-аминокислот из A: rubrilineans ВКПМ В-9915;
- разработку способа микробиологического синтеза гидролазы эфиров альфа-аминокислот из X. rubrilineans ВКПМ В-9915 на основе рекомбинантных бактерий Е.coli BL21(DE3)/pAEH, обладающих повышенным уровнем продукции целевого фермента.
Процесс конструирования заявляемого штамма состоит из нескольких этапов.
Этап 1. Конструирование рекомбинантной плазмидной ДНК рАЕН, содержащей ген aehR, кодирующий гидролазу эфиров альфа-аминокислот из X. rubrilineans ВКПМ В-9915.
Кодирующую часть гена aehR амплифицируют, используя в качестве матрицы хромосомную ДНК X. rubrilineans ВКПМ В-9915. Плазмиду рАЕН конструируют путем клонирования ПЦР-фрагмента, содержащего ген aehR в экспрессионный вектор рЕТ-28а (Novagen) (Фиг.2). Вектор рЕТ-28а размером 5369 пар оснований содержит Т7 промотор (370-386 п.о.); последовательность, кодирующую His-Tag (270-287); последовательность, кодирующую T7-Tag (207-239); полилинкер BamHI-XhoI (158-203); последовательность, кодирующую His-Tag (140-157); терминатор Т7 (26-72); кодирующую область гена lad (773-1852); участок инициации репликации pBR322 (3286); кодирующую область гена Kan, обеспечивающую устойчивость штаммов Е.coli к канамицину (3995-4807); участок инициации репликации П (4903-5358) (Фиг.2).
Плазмида рАЕН размером 7210 пар оснований наряду с генами вектора рЕТ-28а содержит кодирующую область гена adhR гидролазы эфиров альфа-аминокислот из X. rubrilineans под контролем промотора Т7. Ген adhR встроен в плазмидный вектор рЕТ-28а по сайтам рестрикции NdeI и XhoI (Фиг.3). Экспрессируемая данной плазмидой гидролаза эфиров альфа-аминокислот из X. rubrilineans с N-конца модифицирована полигистидиновой последовательностью.
Этап 2. Трансформация плазмидой рАЕН штамма Е.coli BL21(DE3)
Компетентные клетки штамма Е.coli BL21(DE3) трансформируют плазмидой рАЕН. В результате получают рекомбинантный штамм Е.coli BL21(DE3)/pAEH, который содержит ген aehR гидролазы эфиров альфа-аминокислот из X. rubrilineans ВКПМ В-9915 и способен синтезировать гидролазу эфиров альфа-аминокислот из A" rubrilineans ВКПМ В-9915.
Штамм Е.coli BL21(DE3)/pAEH депонирован во Всероссийской коллекции промышленных микроорганизмов как Е.coli ВКПМ В-11246.
Заявляемый штамм ВКПМ В-11246 имеет следующие морфологические и физиолого-биохимические характеристики.
Морфологические признаки
Клетки прямые, палочковидные, подвижные, грамотрицательные,
неспорообразующие. При выращивании в течение 24-72 час при температуре 30-37°С на агаризованных средах (LB, 2YT), содержащих канамицин (17 мг/л), колонии гладкие, круглые, блестящие, край ровный. Состав среды LB, мас.%:
Бактотриптон - 1
дрожжевой экстракт - 0,5
NaCl-1,
вода - остальное.
Состав среды 2YT, мас.%:
Бактотриптон - 1,6
дрожжевой экстракт - 1,0
NaCl-0,5
вода - остальное.
Физиолого-биохимические признаки
Штамм растет при температуре от 25 до 40°С (оптимум 37°С). В качестве источника азота использует органический азот в виде пептона, аминокислот.
Штамм Е.coli ВКПМ В-11246 синтезирует гидролазу эфиров альфа-аминокислот из X. rubrilineans после индукции 1 мМ ИПТГ (изопропил-β-D-тиогалактозидом).
Генотипические признаки
Штамм Е.coli ВКПМ В-11246 устойчив к канамицину.
Штамм Е.coli ВКПМ В-11246 содержит на плазмиде рАЕН ген гидролазы эфиров альфа-аминокислот (aehR) изХ. rubrilineans ВКПМ В-9915 под контролем Т7 промотора.
Способ микробиологического синтеза гидролазы эфиров альфа-аминокислот в общем виде
Посевной материал, представляющий собой клетки рекомбинантного штамма-продуцента Е.coli ВКПМ В-11246, подготавливают путем инкубации в течение 16 часов при температуре 37°С на среде LB, содержащей 17 мг/мл канамицина. Выросшую культуру переносят в соотношении 1:200 (по объему) в среду LB, содержащую 17 мг/мл канамицина. Процесс культивирования ведут при температуре 37°С с аэрацией. Синтез целевого белка индуцируют путем добавления ИПТГ при ОD600=0,8-1,0 ОЕ. Биомассу клеток отделяют центрифугированием, промывают фосфатным буфером и повторно центрифугируют.
Уровень синтетазной активности гидролазы эфиров альфа-амино кислот в биомассе клеток составляет не менее чем 1800 МЕ/г влажн., 9000 МЕ/г сух.
Заявляемый способ позволяет повысить уровень продукции гидролазы эфиров альфа-аминокислот до 20 МЕ/мг белка, что в 20 раз превышает продукцию ближайшего аналога.
Изобретение проиллюстрировано следующими фигурами графических изображений:
Фиг.1 - химическая структура аминобета-лактамных антибиотиков: аминопенициллинов (I) и аминоцефалоспоринов (II). Стрелкой показана фармакологически важная бета-лактамная связь в ядрах антибиотиков. Пунктирной линией показана ациламидная связь, образующаяся при ферментативном синтезе амино-бета-лактамов путем переноса ацильного радикала с ацилирующего агента (эфира альфа-аминокарбоновой кислоты), содержащего фрагмент боковой цепи антибиотика, на аминогруппу ключевого полупродукта, несущего ядро антибиотика.
Фиг.2 - схема плазмидной ДНК рЕТ-28а. Плазмидный вектор рЕТ-28а (Novagen): T7 промотор (370-386 п.о.); поликлинкер (ВатНI - XhoI) (158-203); lad (773-1852); Kan (3995-4807); участки инициации репликации pBR322 ori (3286), fl ori (4903-5358).
Фиг.3 - схема рекомбинантной плазмидной ДНК рАЕН. Плазмидный вектор рАЕН: T7 промотор (370-386 п.о.); ген гидролазы эфиров альфа-аминокислот aehR (6-1982); lad (2456-3535); Kan (5678-6490); участки инициации репликации pBR322 ori (4969), fl ori (6586-7041).
Пример 1. Конструирование рекомбинантной плазмидной ДНК рАЕН, содержащей ген aehR, кодирующий гидролазу эфиров альфа-аминокислот из X. rubrilineans ВКПМ В-9915.
В качестве источника гена aehR используют геномную ДНК, выделенную из биомассы штамма X. rubrilineans ВКПМ В-9915. Все стандартные генно-инженерные и микробиологические манипуляции проводят по известным методикам [30].
Культуру штамма X. rubrilineans ВКПМ В-9915 выращивают при 27°С в течение 28 часов. Из полученной биомассы выделяют геномную ДНК, которую используют в качестве матрицы для ПЦР.
Для амплификации кодирующей части гена aehR используют праймеры, содержащие сайты рестрикции NdeI и XhoI (PrAEHjfor 5'-gcatatgcgccgcatcgctccctg-3' и PrAEH_rev 5'-cctegagtcagtacaccggcagactgatgaaactgg-3'), и Pfu ДНК-полимеразу повышенной точности (Fermentas). Полимеразную цепную реакцию проводят согласно методике компании Fermentas. Полученный ПЦР-продукт включает кодирующую область гена aehR
размером 1914 п.о.
С целью получения плазмидной конструкции для экспрессии гидролазы эфиров альфа-аминокислот ПЦР-продукт, содержащий кодирующую область гена aehR, клонируют в экспрессионный вектор рЕТ-28а (Novagen). Для этого вектор рЕТ-28а и ПЦР-продукт обрабатывают рестриктазами Ndel и Xhol. Из рестрикционной смеси выделяют фрагмент вектора размером 5289 п.о. и фрагмент ПЦР-продукта размером 1921 п.о. Выделенные фрагменты смешивают и лигируют; полученной лигазной смесью трансформируют клетки Е.coli DH5α. Селекцию клонов проводят на агаризованной среде LB с канамицином. В результате получают рекомбинантный штамм Е.coli DH5α/pAEH, содержащий плазмиду рАЕН. Правильность клонирования и отсутствие ошибок в последовательности гена αehR подтверждают секвенированием плазмидной вставки. Штамм Е.coli DH5α/pAEH не синтезирует гидролазу эфиров альфа-аминокислот из-за отсутствия в клетках штамма Е.coli DH5α Т7 РНК полимеразы.
Рекомбинантная плазмидная ДНК рАЕН (SEQ ID NO 1) имеет размер 7210 пар нуклеотидов (п.н.) и содержит ген гидролазы эфиров альфа-аминокислот (αehR) из X. rubrilineans ВКПМ В-9915, регулируемый Т7 промотором и терминатором; ген Kan, обеспечивающий устойчивость Е.coli к канамицину; участки инициации репликации pBR322 и fl; кодирующую область гена lасI. На N-конце открытой рамки считывания, включающей кодирующую часть гена αhR, расположена последовательность, кодирующая 6 His (Фиг.3).
Пример 2. Получение заявляемого штамма Е.coli ВКПМ В-11246
С целью получения рекомбинантного штамма Е.coli - продуцента гидролазы эфиров альфа-аминокислот клетки штамма Е.coli BL21(DE3) трансформируют плазмидой рАЕН методом химической трансформации. Селекцию трансформантов проводят на LB-агаре, содержащем канамицин (17 мг/л). В результате получают заявляемый штамм Е.coli ВКПМ В-11246, синтезирующий гидролазу эфиров альфа-аминокислот из X. rubrilineans ВКПМ В-9915 (пример 3).
Пример 3. Биосинтез гидролазы эфиров альфа-аминокислот с использованием штамма Е.coli ВКПМ В-11246 и добавлением индуктора ИПТГ
Исходным посевным материалом служит культура Е.coli ВКПМ В-11246, выращенная на чашках Петри с агаризованной средой. Посевной материал выращивают путем инкубации клеток при температуре 37°С в течение 15-17 часов на среде LB, содержащей 17 мг/мл канамицина.
Процесс биосинтеза ведут к колбах Эрленмейера объемом 750 мл, содержащих 100 мл
среды LB с канамицином (17 мг/л). Посевной материал вносят в ферментационную среду в количестве, необходимом для создания его концентрации около 0,5 об.%. Процесс культивирования продуцента ведут при температуре 37°С на круговой качалке со скоростью вращения 200-220 об/мин до достижения оптической ОD600=0,8-1,0 ОЕ (около 3 часов культивирования), после чего в культуральную жидкость добавляют ИПТГ до концентрации 1 мМ. Ферментацию продолжают при тех же условиях в течение еще 3 часов.
Биомассу клеток отделяют центрифугированием при 5000 об/мин, промывают 0,1 М фосфатным буфером, рН 7.5, и вновь центрифугируют.
Из 2 л ферментационной среды (20 колб) получают 7,45 г влажной биомассы. Активность ферментных препаратов по синтезу цефалексина определяют по начальной скорости образования целевого продукта в следующих условиях: рН 6,0-6,2, температура (40±1)°С, концентрация субстратов - (0,040±0,002) М 7-АДЦК и (0,08010,004) М МЭФГ. Содержание цефалексина в реакционной смеси определяют методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Содержание сухих веществ весовым методом после высушивания препарата при (105±1)°С до постоянной массы. Содержание белка в биомассе клеток определяют методом Лоури [31], не проводя предварительной обработки нативных клеток ультразвуком, так как нами показано, что для использованных штаммов содержание белка не зависит от степени разрушения клеток ультразвуком.
Полученная биомасса клеток характеризуется следующими показателями:
- содержание сухих веществ: 21,4%;
- синтетазная активность: 2020 МЕ/г влажн.; 9440 МЕ/г сух.;
- удельная активность: 23,8 МЕ/мг белка.
Пример 4. Биосинтез гидролазы эфиров альфа-аминокислот с использованием штамма Е.coli ВКПМ В-11246 без добавления индуктора
Способ осуществляют по примеру 3, с той разницей, что культивирование ведут в течение 6 часов без добавления индуктора ИПТГ.
Из 200 мл культуральной жидкости получают 0,87 г влажной биомассы. Полученная биомасса клеток характеризуется следующими показателями:
- содержание сухих веществ -18,4%;
- синтетазная активность: 160 МЕ/г влажн.; 870 МЕ/г сух.;
- удельная активность: 1,9 МЕ/мг белка.
Пример 5. (Контроль). Биосинтез гидролазы эфиров альфа-аминокислот с использованием штамма Е.coli BL21(DE3)
Способ осуществляют по примеру 3, используя для ферментации культуру штамма Е.coli BL21(DE3), отличающегося от заявляемого штамма Е.coli ВКПМ В-11246 отсутствием плазмиды рАЕН.
Из 200 мл культуральной жидкости получают 1,05 г влажной биомассы. Полученная биомасса клеток характеризуется следующими показателями:
- содержание сухих веществ -18,4%;
- синтетазная активность не детектируется.
Высокий уровень синтетазной активности гидролазы эфиров альфа-аминокислот в биомассе рекомбинантного штамма Е.coli ВКПМ В-11246 после индукции экспрессии по сравнению с неиндуцированной культурой подтверждает экспрессию гена aehR из X. rubrilineans, находящегося в Е.coli под действием промотора Т7. Уровень синтеза гидролазы эфиров альфа-аминокислот у заявляемого рекомбинантного штамма Е.coli в 20 раз превосходит таковой у ближайшего аналога X. rubrilineans ВКПМ В-9915 (Табл.1).
Результаты биосинтеза АЕН различными штаммами-продуцентами данного фермента сопоставлены в Таблице 1.
Табл.1 Синтетазная активность гидролазы эфиров альфа-аминокислот в биомассе клеток
| Синтетазная активность | Е.coli ВКПМ В-11246+ИПТГ (по примеру 3) | Е.coli ВКПМ В-11246-ИПТГ (по примеру 4) | E.coli BL21(DE3) (по примеру 5) | X. rubrilineans ВКПМ В-9915 [28] |
| МЕ/г влажн. | 2020 | 160 | 0 | 83,3 |
| МЕ/г сух. | 9440 | 870 | 0 | 450 |
| МЕ/мг белка | 23,8 | 1,9 | 0 | Около 1 |
Таким образом, продемонстрирована возможность получения генетически модифицированных бактерий Е.coli, способных к биосинтезу гидролазы эфиров альфа-аминокислот из X. rubrilineans с высоким уровнем биосинтеза целевого продукта.
Заявляемый способ позволяет синтезировать внутриклеточную гидролазу эфиров альфа-аминокислот в значительных количествах и создает возможности для разработки простых методов получения высокоэффективных технологических биокатализаторов процессов синтеза аминопенициллинов и аминоцефалоспоринов.
Заявляемый рекомбинантный штамм-продуцент гидролазы эфиров альфа-аминокислот относят к виду Е.coli, природные представители которого не способны синтезировать данный фермент. Введение нового вида бактерий в число высокоэффективных продуцентов гидролазы эфиров альфа-аминокислот предоставляет дополнительные возможности для разработки эффективных способов ее биосинтеза.
Источники информации
1. Ныс П.С., Курочкина В.Б., Скляренко А.В., Вейнберг Г.А. (2000). Бета-лактамные соединения. Взаимосвязь структуры и биологической активности. Антибиотики и химиотерапия 11 (36-42).
2. Blum JK, Bommarius AS (2010) Amino ester hydrolase from Xanthomonas campestris pv. campestris, ATCC 33913 for enzymatic synthesis of ampicillin. J Mol CatalB:Enzym 67(21-28).
3. Takahashi T, Yamazaki Y, Kato K (1974) Substrate specificity of an alpha-amino acid ester hydrolase produced by Acetobacter turbidans ATCC 9325. Biochem J 137(3): 497-503.
4. Ryu YW, Ryu DY (1987) Semisynthetic p-lactam antibiotics synthesizing enzyme from Acetobacter turbidans: purification and properties. Enzyme Microb Technol 9: 339-344.
5. Ryu YW, Ryu DY (1988) Semisynthetic P-lactam antibiotics synthesizing enzyme from Acetobacter turbidans: catalytic properties. Enzyme Microb Technol 10: 239-245.
6. Okachi R, Kato K, Miyamura Y, Nara T (1973) Selection of Pseudomonas melanogenum KY 3987 as a new ampicillin producing bacteria. Agric Biol Chem 37 (8): 1953-1957.
7. Okachi R, Nara T (1973) Penicillin acylase of Pseudomonas melanogenum KY 3987. Agric Biol Chem 37 (12): 2797-2804
8. Shimizu M, Masuike T, Fujita H, Kimura K, Okachi R, Nara T (1975) Search for microorgamisms producing cephalosporin acylase and enzymatic synthesis of cephalosporins. Agric Biol Chem 39 (6): 1225-1232.
9. Kawamori M, Hashimoto Y, Katsumata R, Okachi R, Takayama K (1983) Enzymatic production of amoxicillin by P-Lactamase-deficient mutants of Pseudomonas melanogenum KY3987. Agric Biol Chem 47 (II): 2503-2509.
10. Kim DJ, Byun SM (1990) Purification and properties of ampicillin acylase from Pseudomomas melanogenum. Bichim Biophis Acta - Prot Structure and Mol Enzymol 1040: 12-18.
11. Kim DJ, Byun SM (1990) Evidence for involvement of 2 histiddine residues in the reaction of ampicillin acylase. Bichem Biophys Res Comm 166 (2): 904-908.
12. Wang M, Wang Z, Yue H, Han W, Jiao Q (1990) Screening of alpha-amino acid ester hydrolase producing strain and synthesis of cephalexin by Pseudomonas aeruginosa. Wei Sheng Wu Xue Bao 30: 238-241.
13. US 3716454 (A) (1973) Process for the production of a-aminobenzilpenicillin.
14. Kato K, Kavahara K, Takahashi T, Kahinuma A (1980) Purification of α-Amino Acid Ester Hydrolase from Xanthomonas citri. Agric Biol Chem 44 (5): 1069-1074.
15. Kato K, Kavahara K, Takahashi T, Kahinuma A (1980) Substrate Specificity of α-Amino Acid Ester Hydrolase from Xanthomonas citri. Agric Biol Chem 44 (5): 1075-1081.
16. Kato K, Kavahara K (1980) Dissociation and reassociation of Xanthomonas a-amino acid ester hydrolase. Agric Biol Chem 44 (7): 1663-1664.
17. Nam DH, Kim C (1985) Reaction kinetics of cephalexin synthesizing enzyme from Xanthomonas citri. Biothechnol Bioeng 27: 953-960.
18. Kato K, Kavahara K, Takahashi T (1980) Enzymatic synthesis of amoxicillin by the cell-bound α-amino acid ester hydrolase of Xanthomonas citri. Agric Biol Chem 44 (4): 821-825.
19. Крестьянова И.Н., Уваров Н.Н., Руденская Г.Н. и др. (1990) Внутриклеточная аминопептидаза из Xanthomonas rublineans, гидролизующая эфиры α-аминокислот и цефалексин. Биохимия 55(12): 2226-2238.
20. Polderman-Tijmes JJ, Jekel PA, van Merode A, Floris TAG, van der Laan JM, Sonke T, Janssen DB (2002) Cloning, sequence and expression in Escherichia coli of the gene encoding α-amino acid ester hydrolase from Acetobacter turbindance. Appi Environ Microbiol 68: 211-218 A.
21. Polderman-Tijmes JJ., Jekel PA, Jeronimus-Stratingh CM, Bruins AP, van der Laan J-M, Sonke T, Janssen DB (2002) Identification of the catalytic residues of α-amino acid ester hydrolase from Acetobacter turbindance by labeling and site-directed mutagenesis. J Biol Chem 277 (32): 28474-28482.
22. Barends RM, Polderman-Tijmes JJ, Jekel PA, Willams C, Wybenga G, Janssen DB, Dijkstra BW (2006) Acetobacter turbidans α-amino acid ester hydrolase: how a single mutation improves an antibiotic-producing enzyme. J Biol Chem 281(9): 5804-5810.
23. WO 02086111 (2002) Recombinant alpha-amino ester hydrolases and uses thereof.
24. WO 02086127 (2002) Acylase gene.
25. Barends TRM, Polderman-Tijmes JJ, Jekel PA, Hensgens CMH, de Vries EJ, Janssen DB, Dijkstra BW (2003) The sequence and crystal structure of the α-amino acid ester hydrolase from Xanthomonas citri define a new family of β-lactam antibiotic acylases. J Biol Chem 278: 23076-23084.
26. Blum JK, Bommarius AS (2010) Amino ester hydrolase from Xanthomonas campestris pv. campestris, ATCC 33913 for enzymatic synthesis of ampicillin. J Mol CatalB:Enzym 67:21-28
27. Alkema, W. B. L., Hensgens, C. M. H., Kroezinga, E. H., Vries de, E., Floris, R., van der Laan, J.-M., Dijkstra, B. W., and Janssen, D. B. (2000) Characterization of the P-lactam binding site of penicillin acylase ofEscherichia coli by structural and site-directed mutagenesis studies. Protein Eng. 13, 857-868
28. RU 2381273 (2009) Способ получения гетерогенного биокатализатора, биокатализатор на основе гидролазы эфиров альфа-аминокислот и способ синтеза аминобета-лактамного антибиотика под действием этого биокатализатора.
29. CN 101525603 (2009) Immobilized alpha-amino-acid ester hydrolase, preparation and application thereof.
30. Sambrook J, Fritsch EF, Maniatis T (1989) Molecular Cloning: a Laboratory Manual. Cold Spring Harbor Laboratory, Cold Spring Harbor.
31. Sapan CV, Lundblad RL, Price C (1999) Review. Colorimertric protein assay technoques. Biotechnol. Appl. Biochem. 29: 99-108.
1. Рекомбинантный штамм бактерий Escherichia coli ВКПМ В-11246 - продуцент гидролазы эфиров альфа-аминокислот из Xanthomonas rubrilineans ВКПМ В-9915, полученный путем трансформации штамма-реципиента Escherichia coli BL21(DE3) плазмидной ДНК, соответствующей нуклеотидной последовательности SEQ ID NO 1, содержащей кодирующую область гена aehR гидролазы эфиров альфа-аминокислот из Xanthomonas rubrilineans ВКПМ В-9915 под контролем промотора Т7, а также ген устойчивости к канамицину Kan.
2. Способ микробиологического синтеза гидролазы эфиров альфа-аминокислот из Xanthomonas rubrilineans ВКПМ В-9915, предусматривающий культивирование бактерий, содержащих ген aehR из Xanthomonas rubrilineans ВКПМ В-9915, в подходящей питательной среде, отличающийся тем, что в качестве продуцента используют рекомбинантный штамм по п.1, в состав среды включают канамицин, а экспрессию целевого продукта осуществляют добавлением изопропил-β-D-тиогалактозида в качестве индуктора.