Противокоррозионное защитное покрытие на поверхности стали и способ его получения
Иллюстрации
Показать всеИзобретение относится к защите стальной поверхности от коррозии. Предложенное противокоррозионное защитное покрытие на поверхности стали содержит цинк, фосфор, кислород и железо, атомы которого в покрытии находятся в высокоспиновом состоянии, а атомы цинка и железа связаны с атомами кислорода ионно-ковалентными связями. При этом покрытие получено путем контакта поверхности стали с водной средой, содержащей растворенный кислород и фосфатирующий реагент в виде кислотного остатка 1-гидроксиэтилидендифосфоновой кислоты и цинка, связанного с атомами кислорода вышеуказанного кислотного остатка ионно-ковалентными связями. Изобретение обеспечивает повышение плотности и прочности противокоррозионного защитного покрытия, за счет получения прочных химических связей между атомами в данном покрытии и его прочное химическое сцепление с поверхностью стали, и экономию фосфатирующего реагента при его нанесении. 2 н. и 2 з.п. ф-лы, 6 ил., 2 табл., 7 пр.
Реферат
Область техники
Изобретение относится к способам защиты металлов от коррозии, а более конкретно - к защитным противокоррозионным покрытиям на поверхности стали (сплавов на основе железа) и способам получения таких покрытий. Изобретение может найти применение во многих отраслях народного хозяйства, в частности, для защиты стальных частей технологического оборудования в нефтегазовой, химической, пищевой, промышленности; котлов, котельно-вспомогательного оборудования, трубопроводов и другого оборудования в энергетике и коммунальном хозяйстве; для защиты от коррозии различных систем водоснабжения и прочее, тому подобное.
Уровень техники
Покрытия на основе фосфорно-цинковых соединений давно находят применение в технике для защиты от коррозии стали и других металлических материалов. Однако большинство известных решений относятся к нанесению толстослойных покрытий (порядка одного или нескольких микрометров). Такие покрытия требуют значительного расхода материалов и наносятся в достаточно сложном технологическом процессе в одну или несколько стадий.
Так, известен гальванически покрытый стальной лист с высокой свариваемостью [1]. Поверхность стального листа гальванически покрыта металлом, причем масса слоя с одной стороны стального листа составляет от 15 до 80 г/м2. После этого на поверхности этого металлического слоя создают пленку фосфата цинка с массой покрытия от 0,1 до 3,0 г/м2. Покрытие осуществляют в паровой фазе электродуговым методом, при этом фосфат цинка содержит цинк, фосфор, кислород и водород. Фосфористые соединения включают фосфорно-железные соединения для закрепления цинка, и кислородные соединения цинка для образования оксида цинка и закрепления цинка. Газообразный водород способствует освобождению испаренного цинка за пределами зоны сварки. Поверхность этого металлизированного стального листа, если потребуется, может быть покрыта аморфной неорганической пленкой, растворимой в кислотном водном растворе, трудно растворимой в нейтральном или щелочном водном растворе и содержащей не менее 5% магния. К недостаткам данного технического решения относится сложная структура многослойного покрытия, значительный расход ингредиентов, многостадийность и сложность технологического процесса формирования покрытия. Если такое покрытие будет повреждено при эксплуатации изделии, восстановить его в эксплуатационных условиях затруднительно.
Известен поверхностно-обработанный стальной материал, способ его получения и жидкость для химической конверсионной обработки [2]. Поверхностно-обработанный стальной материал содержит стальную основу и химическую конверсионную пленку, которая содержит калий в количестве от 0,1 до 1000 мг/м2 и имеет толщину от 5 до 48 мкм или от более чем 48 до 50 мкм. Для получения пленки проводят обработку поверхности стали с использованием жидкости, содержащей цинк и фосфорную кислоту или марганец и фосфорную кислоту и дополнительно содержащей калий. К недостаткам данного технического решения относится значительный расход ингредиентов и включение в состав жидкости для обработки поверхности стали фосфорной кислоты, которая вызывает глубокое растравливание поверхности стали и образование рыхлой, пористой защитной пленки.
Известны коррозионно-защитные покрытия, способы их нанесения и системы реагентов для их нанесения [3, 4]. Данные технические решения обеспечивают нанесение непосредственно на поверхность стали или чугуна плотного и прочно удерживаемого слоя цинка или цинкового сплава для усиленной защиты от коррозии. Покрытие наносят последовательно в двух водных ваннах. Первая ванна включает цинксодержащий прекурсор, а вторая ванна содержит восстановитель, обеспечивающий отложение цинка непосредственно на поверхности стали или чугуна. Недостатком данного способа является значительный расход цинксодержащего прекурсора и восстановителя и необходимость последовательной обработки изделия в двух ваннах. Такое покрытие трудно нанести или восстановить в эксплуатационных условиях.
Известен способ нанесения фосфатных покрытий на металлические поверхности [5]. Способ включает смачивание поверхности металла кислым водным фосфатирующим раствором, содержащим 26-60 г/л ионов цинка, 5-40 г/л ионов марганца и 50-300 г/л (в расчете на P2O5) фосфат-ионов и 25-120 г/л (в расчете на H2O2) пероксида. В частных случаях раствор содержит также до 20 г/л ионов никеля и полимер, сополимер и/или сшитый полимер, в частности, с азотистыми гетероциклическими соединениями, преимущественно винилпирролидоном. (Ионом называют атом, несущий электрический заряд.) После смачивания раствор высушивают. Получаемое фосфатное покрытие имеет массу от 0,2 до 5 г/м2. Недостатком данного способа является высокий расход ингредиентов фосфатирующего раствора из-за его высокой концентрации, содержание в растворе токсичного марганца. Так недостатком является то, что одним из ингредиентов раствора и получаемого покрытия является полимер, который обладает ограниченной термической стойкостью. Описанный способ нанесения фосфатного покрытия невозможно или затруднительно совместить с процессом технической эксплуатации стальных изделий, так как невозможно или затруднительно создать в рабочей среде, с которой контактируют изделия, необходимые для описанного способа концентрации вышеуказанных ингредиентов.
Наиболее близким к заявляемому техническому решению является состав для антикоррозионной обработки поверхности черных металлов [6]. Состав на водной основе включает 25-45 масс.% фосфорной кислоты, 0,5-15 масс.% фосфорорганических комплексонов, 1-15 масс.% цинка (в пересчете на окись цинка), 0,1-3 масс.% меди (в пересчете на окись меди) и 0,01-5 масс.% гидрохинона. В качестве фосфорорганических комплексонов могут быть использованы гидроксиэтилидендифосфоновая кислота, нитрилотрисфосфоновая кислота, глифосат, глифосин, 2-гидрокситриметилен-динитрилотатракис-метилфосфоновая кислота и/или их соли, оптимально цинковые или медные.
Недостатком данного состава является сложность его состава, в который входит кислота, разъедающая поверхность металла. Кроме того, недостатком является использование в составе фосфорорганических комплексонов в форме кислот или солей. Как кислоты, так и соли относятся к ионным соединениям. Молекулы кислот содержат кислотный остаток и ионы водорода, связанные ионной связью и способные к диссоциации [7, с.393, столбец 778, абзац 3 сверху]. Некоторые современные теории кислот и оснований рассматривают строение кислот в точки зрения переноса анионов, катионов или электронов [7, с.393, столбец 778 - с.394, столбец 780, абзац 1 снизу], но все эти теории сводят строение и реакционную способность кислот к комбинациям и переносу заряженных частиц, то есть к взаимодействию ионов. Соли - тоже соединения ионные и являются продуктами замещения протонов водорода кислоты на ионы металлов и другие катионы (положительно заряженные ионы) [8, с.376, столбец 744, абзац 1 снизу]. Хотя в некоторых солях и прослеживается ковалентная или смешанная химическая связь, преобладает в структуре солей ионная связь. Она является недостаточно прочной для образования сплошного, плотного, хорошо соединенного с поверхностью стали защитного покрытия. Кислоты и/или соли являются, таким образом, невыгодными фосфатирующими агентами. По этой же причине для получения эффективного защитного покрытия приходится использовать значительную концентрацию ингредиентов фосфатирующего раствора. Описанный способ нанесения фосфатного покрытия невозможно или затруднительно совместить с процессом технической эксплуатации стальных изделий, так как невозможно или затруднительно создать в рабочей среде, с которой контактируют изделия, необходимые для описанного способа концентрации вышеуказанных ингредиентов.
Раскрытие изобретения
Задачей заявляемого изобретения является повышение плотности и прочности защитного противокоррозионного покрытия, а также экономия фосфатирующего реагента для его нанесения.
Техническим результатом, который достигается при использовании заявляемого способа, является получение прочных химических связей между атомами противокоррозионного покрытия и его прочное химическое сцепление с поверхностью стали, а также значительно меньший расход фосфатирующего реагента по сравнению с прототипом.
Технический результат достигается тем, что противокоррозионное защитное покрытие на поверхности стали, включающее цинк, фосфор, кислород и железо. Атомы железа находятся в высокоспиновом состоянии, при этом атомы цинка и железа связаны с атомами кислорода ионно-ковалентными связями. Способ нанесения вышеуказанного покрытия включает контакт стали с водной средой, содержащей окислитель и фосфатирующий реагент. В качестве окислителя используют растворенный кислород. Фосфатирующий реагент включает остаток 1-гидроксиэтилидендифосфоновой кислоты и цинк, связанный с атомами кислорода вышеуказанного кислотного остатка ионно-ковалентными связями, а вышеуказанный кислотный остаток содержит локализованные π-связи между атомами фосфора и кислорода.
То, что противокоррозионное защитное покрытие дополнительно содержит железо, атомы которого находятся в высокоспиновом состоянии, при этом атомы цинка и железа связаны с атомами кислорода ионно-ковалентными связями, является новым по сравнению с прототипом.
То, что в качестве окислителя используют растворенный кислород, и то, что фосфатирующий реагент включает остаток 1-гидроксиэтилиден-дифосфоновой кислоты и цинк, связанный с атомами кислорода вышеуказанного кислотного остатка ионно-ковалентными связями, а вышеуказанный кислотный остаток содержит локализованные л-связи между атомами фосфора и кислорода, также является новым по сравнению с прототипом.
Благодаря более высокой прочности (работе разрыва) ковалентной химической связи по сравнению с ионной или металлической связью те новые признаки, что противокоррозионное защитное покрытие дополнительно содержит железо, атомы которого находятся в высокоспиновом состоянии, и что атомы цинка и железа связаны с атомами кислорода ионно-ковалентными связями, позволяют повысить прочность химических связей между атомами противокоррозионного покрытия и получить высокоплотное и высокопрочное защитное покрытие, включающее атомы железа поверхностного слоя стали, соединенные с атомами кислорода ионно-ковалентными связями, вследствие чего это покрытие прочно соединено с поверхностью стали. Присутствие в водной среде растворенного кислорода позволяет активировать поверхность стали для взаимодействия с фосфатирующим реагентом и перевести атомы железа в высокоспиновое состояние. Выбранный состав фосфатирующего реагента (содержание остатка 1-гидроксиэтилидендифосфоновой кислоты и цинка) и его структура (ионно-ковалентные связи между цинком и атомами кислорода и локализованные π-связи между атомами фосфора и кислорода) позволяет получить покрытие с заданным составом и структурой, обеспечивающими высокую прочность, при малом расходе фосфатирующего реагента. Таким образом, новой совокупностью существенных признаков способа достигается заявляемый технический результат.
В частном случае осуществления заявляемого изобретения остаток 1-гидроксиэтилидендифосфоновой кислоты, входящий в состав фосфатирующего реагента, является протонированным.
В частном случае осуществления заявляемого изобретения концентрация фосфатирующего реагента в водной среде составляет от 0,0001 до 0,01 масс.%.
Краткое описание чертежей
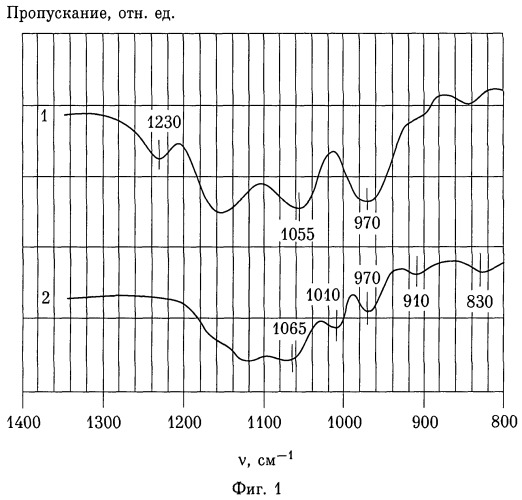
На фиг.1 приведены абсорбционные инфракрасные (ИК) спектры фосфатирующих агентов, использованных для практического осуществления заявляемого способа, снятые в суспензии с вазелиновым маслом по ГОСТ 3164-78 на спектрометре ИКС-29 по двухлучевой схеме. По абсциссе отложено волновое число в см, по ординате - пропускание ИК излучения.
Кривая 1 представляет спектр препарата «Оптион 313-2» производства ООО «Экоэнерго» (г.Ростов-на-Дону) по ТУ 2439-005-24210860-2007, перекристаллизованный из дистиллированной воды.
Кривая 2 представляет спектр сухого остатка препарата «Афон 230-23А» производства ОАО «Химпром» (г.Новочебоксарск) по ТУ 2439-451-05763441-2004.
Подписи в поле координатной сетки представляют абсциссы максимумов полос поглощения в см-1.
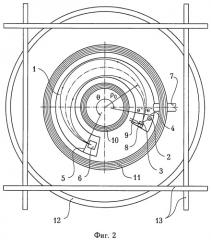
На фиг.2 изображена схема электронного спектрометра с двойной фокусировкой магнитным полем, использованного для исследования фосфатирующих агентов и поверхности образцов. На фиг.2 использованы следующие обозначения:
1 - вакуумная камера;
2 - рентгеновская трубка;
3 - исследуемый образец;
4 - входная щель энергоанализатора;
5 - выходная щель энергоанализатора;
6 - детектор электронов;
7 - вакуумный трубопровод;
8 - нагревательный элемент;
9 - датчик температуры;
10 и 11 - фокусирующие катушки;
12 - горизонтальные кольца Гельмгольца;
13 - вертикальные кольца Гельмгольца;
е- - электроны;
θ - угол фокусировки;
ρ0 - центральный радиус орбиты электрона.
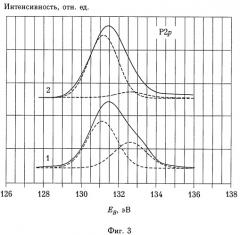
На фиг.3 представлены спектры 2р-электронов фосфора от фосфатирующих агентов, использованных для практического осуществления заявляемого способа, полученные на спектрометре, представленном на фиг.2. По абсциссе отложена энергия связи электрона в эВ, по ординате - интенсивность потока электронов.
Обозначения кривых на фиг.3 соответствуют обозначениям кривых на фиг.1.
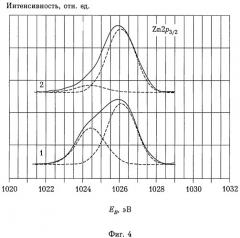
На фиг.4 представлены спектры 2р3/2-электронов цинка от фосфатирующих агентов, использованных для практического осуществления заявляемого способа, полученные на спектрометре, представленном на фиг.2. По абсциссе отложена энергия связи электрона в эВ, по ординате - интенсивность потока электронов.
Обозначения кривых на фиг.4 соответствуют обозначениям кривых на фиг.1.
На фиг.5 представлен спектр 2р-электронов фосфора от полученного заявляемым способом противокоррозионного защитного покрытия на поверхности стали 20, полученный на спектрометре, представленном на фиг.2. По абсциссе отложена энергия связи электрона в эВ, по ординате - интенсивность потока электронов.
На фиг.6 представлены спектры 2р-электронов железа от поверхности стали 20 без покрытия и от полученного заявляемым способом противокоррозионного защитного покрытия на поверхности стали 20, полученные на спектрометре, представленном на фиг.2. По абсциссе отложена энергия связи электрона в эВ, по ординате-интенсивность потока электронов.
Кривая 1 представляет спектр 2р-электронов железа от поверхности стали 20 без покрытия.
Кривая 2 представляет спектр 2р-электронов железа от полученного заявляемым способом противокоррозионного защитного покрытия на поверхности стали 20..
На фиг.7 представлены спектр валентных электронов от полученного заявляемым способом противокоррозионного защитного покрытия на поверхности стали 20, полученный на спектрометре, представленном на фиг.2, и парциальные плотности электронных состояний, вычисленные по данным: [9, с.459, рис.3] и [10, фиг.5]. По абсциссе отложена энергия связи электрона в эВ, причем за нуль отсчета принята энергия Ферми электронной подсистемы покрытия. По ординате отложены: интенсивность потока электронов и парциальные плотности электронных состояний. На фиг.7 использованы следующие обозначения:
Fe3d spin up и Fe3d spin down - парциальные плотности 3-d электронных состояний в атомах железа с противоположно направленными спинами;
O2p - парциальная плотность 2-р электронных состояний в атомах кислорода;
Р3р - парциальная плотность 3-р электронных состояний в атомах фосфора;
Fe3p - парциальная плотность 3-р электронных состояний в атомах железа;
Zn4p - парциальная плотность 4-р электронных состояний в атомах цинка;
Zn3d - парциальная плотность 3-d электронных состояний в атомах цинка.
Обозначения электронных состояний над спектрограммой соответствуют атомным орбиталям, принимающим участие в образовании связывающих молекулярных орбиталей.
Осуществление изобретения
Возможность осуществления заявляемого изобретения подтверждается изложенными далее теоретическими предпосылками и примерами практического осуществления.
Защитные свойства противокоррозионных покрытий обусловлены изоляцией металла от окружающей среды, препятствующей процессам переноса коррозионного агента к поверхности металла, а также ионов металла и электронов в коррозионную среду. Качество противокоррозионного защитного покрытия определяется, поэтому, его прочностью и плотностью, а также сцеплением с поверхностью металла. Все эти свойства зависят от прочности химических связей, соединяющих атомы покрытия друг с другом, а также атомы покрытия с атомами покрываемого металла. Чем выше прочность химических связей, тем выше защитные свойства покрытия и его противокоррозионная эффективность. Прочность химических связей принято выражать работой разрыва - количеством энергии (в джоулях или, чаще, электрон-вольтах, 1 эВ=96,5 кДж/моль), которую надо затратить для разрыва химической связи.
С приемлемой для практики точностью зависимость потенциала (потенциальной энергии) u(r) взаимодействующих атомов от расстояния между ними r описывается зависимостью [6, с.25, формула (15)]:
u ( r ) = − a r − m + b r − n , ( 1 )
где а и b - эмпирические константы;
m - показатель зависимости энергии притяжения от расстояния;
n - показатель зависимости энергии отталкивания от расстояния.
Из этой формулы можно сделать вывод, что как энергия притяжения, так и энергия отталкивания убывают с увеличением расстояния между атомами и при бесконечном расстоянии r обращаются в нуль. Однако если при взаимодействии между атомами возникает химическая связь, это соответствует тому, что n>m, то есть энергия отталкивания убывает быстрее, чем энергия притяжения. В результате этого при некоторых конечных расстояниях энергия притяжения преобладает над отталкиванием, и атомы удерживаются друг рядом с другом. Такое взаимодействие между атомами, при котором n>m, называется связывающим. Если же n<m, то при любых расстояниях между атомами отталкивание сильнее, чем притяжение, и химическая связь не образуется.
Из второго закона термодинамики следует, что все виды энергии стремятся перейти в теплоту, которая есть не что иное, как кинетическая энергия случайного (броуновского) теплового движения атомов. В соответствии с первым законом термодинамики (законом сохранения энергии), возрастание кинетической энергии влечет за собой убывание энергии потенциальной. Поэтому атомы в состоянии покоя стремятся занять положение с наименьшей потенциальной энергией, которому соответствует условие экстремума:
d u ( r ) d r = 0. ( 2 )
Подставляя (1) в (2) и вычисляя, нетрудно обнаружить, что потенциальная энергия взаимодействия атомов становится наименьшей при расстоянии [6, с.25, формула (16)]
r 0 = n b m a ( n − m ) , ( 3 )
и при этом она составляет [тот же источник]
u 0 = − a r 0 m ( 1 − m n ) . ( 4 )
Поскольку n>m, то потенциальная энергия взаимодействия атомов на расстоянии r0 отрицательна. Для того, чтобы разорвать химическую связь, надо удалить атомы на большое (в атомных масштабах - практически бесконечное) расстояние, при котором эта энергия обращается в нуль. Следовательно, для этого необходимо совершить работу А, равную разности конечной и начальной энергий:
A = 0 − u 0 = a r 0 m ( 1 − m n ) . ( 5 )
Эта работа А и есть показатель прочности химической связи.
Согласно сложившейся практике, химическую связь классифицируют на ионную, ковалентную и металлическую; также рассматривают более слабые взаимодействия между атомами - вандер-ваальсовы и водородные связи.
Ионной связью называют взаимодействие атомов, при котором атомы несут противоположные электрические заряды и их притяжение обусловлено действием электростатических (кулоновских) сил, а отталкивание - взаимодействием электронных оболочек. Для ионной связи в уравнениях (1)-(5) надо положить n=6…9, m=1 [6, с.25, абзац 5 сверху].
Ковалентной связью называют взаимодействие атомов, при котором часть принадлежащих им электронов размещается в энергетических состояниях, являющихся решениями соответствующего уравнения квантовой механики (уравнения Шредингера) для системы, включающей ядра и электронные остовы обоих взаимодействующих атомов. Такие состояния называют молекулярными орбиталями в отличие от энергетических состояний электронов в отдельных атомах, называемых атомными орбиталями. В приемлемом для практики приближении молекулярные орбитали описываются волновыми функциями, являющимися линейными комбинациями волновых функций, описывающих атомные орбитали:
ψ М О = c 1 ψ А О 1 ± с 2 ψ А О 2 , ( 6 )
где ψМО - волновая функция молекулярной орбитали;
c1 и c2 - нормировочные коэффициенты;
ψ А О 1 и ψ А О 2 - волновые функции атомных орбиталей.
Существуют и способы точного расчета молекулярных орбиталей с использованием ЭВМ. Энергия электрона на молекулярной орбитали в некоторых случаях может быть меньше, чем энергия электрона на атомной орбитали, вследствие чего общая потенциальная энергия системы уменьшается. Такие молекулярные орбитали называют связывающими. В противном случае молекулярные орбитали называют разрыхляющими. Для ковалентной связи в формулах (1)-(5) надо положить n=6…9, m=4 [6, с.43, абзац 1 сверху].
Металлической связью называют взаимодействие атомов, при котором часть принадлежащих им электронов размещается в энергетических состояниях так называемой зоны проводимости, которая описывается волновой функцией, общей для всего металла. Это возможно для тех веществ, в которых уровень энергии Ферми электронов пересекает частично заполненную зону проводимости; такие вещества называются собственно металлами. Электроны, принадлежащие зоне проводимости, делокализованы в пределах всего металлического кристалла и называются свободными электронами, или электронами проводимости. Остовы атомов в металле, стремясь погрузиться в электрическое поле свободных электронов, располагаются чаще всего в порядке одной из плотнейших кристаллографических упаковок. Энергия металлической связи описывается уравнением [6, с.51, формула (40)]:
u ( r ) = − a r + b 1 r 2 + b 2 r 3 + b 3 , ( 7 )
где b1, b2 и b3 - эмпирические константы. При малых значениях r уравнение (7) близко к уравнению (1) с показателями n=2, m=1.
Оценивая по формуле (3) влияние показателей n и m на межатомное расстояние для различных видов химической связи, можно притти к выводу, что кратчайшее расстояние между атомами соответствует ковалентной связи, а ионной и металлической связи соответствует большее расстояние.
Таким образом, исключая из рассмотрения металлическую связь, можно притти к выводу, что в неметаллических веществах химическая связь между атомами может быть либо ионной, либо ионно-ковалентной, либо ковалентной. Прочность ковалентной связи выше, чем ионной, так как в случае ковалентной связи, сопровождающейся перекрытием атомных орбиталей, равновесное расстояние между атомами, вычисляемое по формуле (3), уменьшается.
Кроме того, два атома могут образовывать друг с другом несколько ковалентных связей с различным пространственным характером распределения электронной плотности связывающих молекулярных орбиталей [6, с.38, рис.22]. В случае, если связывающая молекулярная орбиталь имеет единственный максимум электронной плотности, локализованный на оси, соединяющей ядра атомов, такую ковалентную связь называют π-связью. Если связывающая молекулярная орбиталь имеет два максимума электронной плотности, которые расположены в плоскости, проведенной через вышеуказанную ось, симметрично по отношению к вышеуказанной оси, такую ковалентную связь называют π-связью. Если максимумов электронной плотности четыре и они расположены в двух взаимно перпендикулярных плоскостях, проведенных через вышеуказанную ось, симметрично по отношению к вышеуказанной оси, такую ковалентную связь называют δ-связью. Более сложные конфигурации связывающих молекулярных орбиталей встречаются редко.
В способе [4], принятом за прототип, в состав фосфатирующей ванны входят фосфорная кислота и фосфорорганические комплексоны, в которых атом фосфора связан со всеми атомами кислорода одинаковыми σ-связями. Ионы цинка находятся в фосфатирующей ванне в свободном (диссоциированном) состоянии, вследствие чего при взаимодействии с фосфат-ионами они образуют ионные связи. С поверхностью стали фосфат-ионы и ионы цинка образуют или слабые ионные связи, или еще более слабые вандер-ваальсовы взаимодействия.
В заявляемом техническом решении в состав фосфатирующей среды входит фосфатирующий агент, включающий остаток 1-гидроксиэтил-идендифосфоновой кислоты и цинк, связанный с атомами кислорода вышеуказанного кислотного остатка ионно-ковалентными связями, при этом вышеуказанный кислотный остаток содержит локализованные π-связи между атомами фосфора и кислорода. Ионно-ковалентные связи между цинком и кислородом прочнее, чем ионные связи между ионами цинка и ионами кислот в прототипе. Локализованные π-связи усиливают связь между атомом фосфора и некоторыми из атомов кислорода, так как образуются в дополнение к существующим π-связям. Под действием кислорода поверхность стали активируется, атомы железа переходят в высокоспиновое состояние. Это способствует образованию ионно-ковалентных связей между атомами цинка, железа, фосфора и кислорода. Перекрытие атомных орбиталей этих химических элементов с образованием молекулярных орбиталей приводит к образованию единой системы молекулярных электронных орбиталей, охватывающих атомы покрытия, включая атомы железа поверхностного слоя стали. Благодаря этому заявляемый способ позволяет повысить прочность химических связей между атомами противокоррозионного покрытия и получить высокоплотное и высокопрочное защитное покрытие, прочно соединенное с поверхностью стали.
Возможность получения заявляемого противокоррозионного защитного покрытия заявляемым способом подтверждается также экспериментальными данными и примерами практического осуществления.
Экспериментальное исследование электронно-энергетической структуры химических связей фосфатирующих агентов и получаемого противокоррозионного защитного покрытия проводили при помощи электронного спектрометра с двойной фокусировкой магнитным полем, схематически представленном на фиг.2. Спектрометр имеет вакуумную камеру 1, внутри которой размещена рентгеновская трубка 2, служащая источником характеристического рентгеновского излучения. (Характеристическим называют рентгеновское излучение, спектр которого является характерным для химического элемента, из которого изготовлен антикатод трубки, и определяется по закону Мозли [7, с.272].) В непосредственной близости к рентгеновской трубке 2 размещен исследуемый образец 3. Также в вакуумной камере располагаются входная щель 4 и выходная щель 5 энергоанализатора. Непосредственно за выходной щелью энергоанализатора размещен детектор электронов 6. Посредством вакуумного трубопровода 7 вакуумная камера 1 соединена с вакуумной установкой, которая на схеме не показана. Приспособление для крепления исследуемого образца 3 включает нагревательный элемент 8 и датчик температуры 9. Основным конструктивным элементом энергоанализатора являются фокусирующие катушки 10 и 11, размещенные вне вакуумной камеры. Число витков и расположение катушек 10 и 11 выбраны с высокой точностью таким образом, чтобы создать в пределах рабочей камеры магнитное поле, напряженность которого Н изменяется обратно пропорционально квадратному корню радиуса ρ:
H ~ 1 ρ . ( 8 )
Для устранения влияния внешних магнитных полей весь спектрометр окружен системой компенсации, включающей горизонтальные 12 и вертикальные 13 кольца Гельмгольца. Компенсацию внешних магнитных полей осуществляют, регулируя ток в кольцах Гельмгольца при помощи автоматической системы регулирования, включающей магнитометр (на схеме система условно не показана).
Спектрометр работает следующим образом. Рентгеновская трубка 2 с алюминиевым антикатодом испускает рентгеновское излучение с характеристическим спектром алюминия. При попадании на исследуемый образец 3 кванты этого излучения выбивают из образца электроны e-, кинетическая энергия которых Ee, в силу закона сохранения энергии, равна разности между энергией кванта рентгеновского излучения hν и энергией связи электрона EB:
E e = h ν − E B . ( 9 )
Электроны проходят через входную щель энергоанализатора 4 и, благодаря глубокому вакууму и поддержанию с высокой точностью магнитного поля, описываемого выражением (8), подвергаются двойной фокусировке по радиусу орбиты и плоскости. Вследствие этого в плоскости выходной щели энергоанализатора 5, расположенной под углом фокусировки θ = π 2 р а д = 254 ° 3 3 ′ 3 0 ″ к входной щели 4, достигается фокусировка электронов по радиусу орбиты (соответствующему радиусу центральной орбиты ρ0) и оси энергоанализатора. В отсутствие внешних магнитных полей, которые компенсируют при помощи колец Гельмгольца 12 и 13, в плоскости выходной щели 5 фокусируются электроны только с одним значением кинетической энергии, которое зависит от напряженности магнитного поля. Изменяя силу тока в катушках 10 и 11, обеспечивают отбор через выходную щель 5 в детектор 6 электронов с узким интервалом значений Ee. Отношение ширины интервала к значению кинетической энергии электрона Ee называют аппаратурным разрешением спектрометра Δ E e E e . Спектрометр, использованный в приводимых исследованиях, имел аппаратурное разрешение Δ E e E e = 10 − 4 . Изменяя силу тока в фокусирующих катушках 10 и 11 и регистрируя интенсивность потока электронов, попадающих в детектор 6, строят зависимость интенсивности потока электронов I от их кинетической энергии Ee. Зная энергию кванта характеристического рентгеновского излучения (в приводимых примерах использовалась Kα-линия алюминия с энергией кванта hν=1486,6 эВ) и вычисляя по формуле (9), можно получить зависимость количества электронов в исследуемом образце от их энергии связи EB, то есть определить точные значения энергии различных состояний электронов и их заселенность, что позволяет судить об участии атомов в тех или иных химических связях и об образовании молекулярных электронных орбиталей.
Образцы для исследования эффективности защитных покрытий изготавливают из стали 20 кп по ГОСТ 1050-98 в виде пластин размером 10×20×1 мм. Заготовки для образцов нарезают из горячекатаного листа по ГОСТ 19903-90 одной партии, отступив 100 мм от края листа. Химический состав стали для изготовления образцов приведен в табл.1. Образцы подготавливают в соответствии с ГОСТ 9.502-82. Поверхность образцов шлифуют на плоскошлифовальном станке до чистоты поверхности Rz от 8 до 12 мкм, трехкратно промывают этанолом (винным спиртом), затем промывают дестиллированной водой, затем в течение 1 мин. травят 15% водным раствором соляной кислоты, чтобы удалить слой металла с возникшими вследствие механической обработки поверхностными дефектами структуры. Протравленные образцы промывают дестиллированной водой и высушивают в эксикаторе с прокаленным хлоридом кальция до постоянной массы с погрешностью не более ±0,05 мг.
Состав водной среды, использованной для испытаний, приведен в табл.1; этот состав соответствует составу №2 по ГОСТ 9.502-82.
Эту водную среду насыщают кислородом воздуха в условиях естественной аэрации (при отекании водной среды по каплям в процессе фильтрования) при температуре 25°С и атмосферном давлении 745:1:5 мм. рт.ст.
Пример 1. В полиэтиленовый сосуд объемом 2 дм3 помещают подготовленную водную среду, насыщенную кислородом. Фосфатирующий агент не вводят. Подготовленный, как было указано выше, образец при помощи деревянного зажима помещают в сосуде на тонком вискозном подвесе (из кордной нити) так, чтобы он не касался стенок и дна сосуда и поверхности водной среды. Сосуд погружают в водяной термостат с заданной температурой на 10 суток.
Этот опыт принимают за холостой, и впоследствии его принимают во внимание при вычислении степени защиты стали от коррозии защитным покрытием.
Примеры 2-6. Аналогично примеру 1, в полиэтиленовый сосуд объемом 2 дм3 помещают подготовленную водную среду, насыщенную кислородом. В качестве фосфатирующего агента используют цинковый комплекс 1-гидроксиэтилидендифосфоновой кислоты, выпускаемый под маркой «Оптион 313-2» ООО «Экоэнерго» (г.Ростов-на-Дону) по ТУ 2439-005-24210860-2007, перекристаллизованный из дистиллированной воды и высуше