Способ определения чувствительности опухоли легкого к терапии ингибиторами тирозинкиназ
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к молекулярной диагностике. Предложен способ определения чувствительности опухоли легкого к терапии ингибиторами тирозинкиназ у пациентов с раком легкого в цитологическом опухолевом материале методом полимеразной цепной реакции в режиме реального времени при помощи праймеров для выявления 8 делеций в 19 экзоне гена EGFR и замены L858R гена EGFR в 21 экзоне. При выявлении любой из этих мутаций определяют чувствительность опухоли легкого к терапии ингибиторами тирозинкиназ как положительную и назначают терапию гефитинибом или эрлотинибом. Способ обладает высокой информативностью и чувствительностью, прост в исполнении и интерпретации результата. 2 ил., 2 табл., 1 пр.
Реферат
Изобретение относится к области медицины, в частности к молекулярной онкологии, молекулярной диагностике, и может быть использовано для определения чувствительности опухоли легкого к терапии ингибиторами тирозинкиназ гефитинибом (Иресса) и эрлотинибом (Тарцева).
Позитивный эффект терапии ингибитрами тирозинкиназ гефитинибом и эрлотинибом определяется присутствием в опухолевой ткани активирующих мутаций в гене EGFR. Общепринятым стандартом в настоящее время является тестирование на предмет наличия генетических повреждений EGFR свежезамороженного или архивного операционного патоморфологического (гистологического) материала. Гистологический материал, однако, доступен не у всех пациентов с раком легкого: в большинстве случаев заболевание выявляется на поздних стадиях, большей части пациентов с впервые выявленным раком легкого (РЛ) (до 70%) не показано оперативное лечение. Альтернативой в таких случаях может служить цитологический материал, полученный с помощью тонкоигольной или щеточной биопсии, путем смывов с бронхов или другими малоинвазивными методами.
Использование цитологических образцов для анализа сопряжено с рядом трудностей: во-первых, они могут содержать чрезвычайно малое количество клеток, а следовательно, и генетического материала, пригодного для тестирования. Во-вторых, доля опухолевых клеток по отношению к нормальным в таких образцах может быть невысока. С учетом этих особенностей был разработан высокочувствительный тест для детекции двух наиболее частых вариантов мутаций EGFR - делеций в 19 экзоне и точечной замены L858R - в цитологическом материале.
На сегодняшний день описан и используется целый ряд способов тестирования мутаций EGFR, большинство из которых рассчитано на использование гистологического материала. Наиболее распространенный вариант - это прямое секвенирование 18-21 экзонов гена. Данная методика позволяет выявить весь спектр известных генетических повреждений EGFR, однако обладает сравнительно низкой чувствительностью. Для надежной детекции мутаций необходимо, чтобы доля опухолевых клеток в образце составляла около 50% [Smouse JH et al. EGFR mutations are detected comparably in cytologic and surgical pathology specimens of nonsmall cell lung cancer. Cancer. 2009 Feb 25; 117(1):67-72]. В связи с этим прямое секвенирование не может быть рекомендовано для рутинного анализа цитологического материала.
Другая группа способов нацелена на поиск отдельных часто встречающихся генетических дефектов EGFR и основывается на различных модификациях полимеразной цепной реакции (ПЦР): ПЦР с включением олигонуклеотидов с модифицированными основаниями (PNA-LNA PCR clamp) [Таnака Т et al. Reliability of the peptide nucleic acid-locked nucleic acid polymerase chain reaction clamp-based test for epidermal growth factor receptor mutations integrated into the clinical practice for non-small cell lung cancers. Cancer Sci. 2007 Feb; 98(2):246-52; Yamada N et al. The Peptide nucleic Acid-locked nucleic Acid polymerase chain reaction clamp-based test for epidermal growth factor receptor mutations in bronchoscopic cytological specimens of non-small cell lung cancer. Oncology. 2012; 82(6):341-6]; ПЦР с флюоресцентными метками типа TaqMan [Molina-Vila MA et al. A sensitive method for detecting EGFR mutations in non-small cell lung cancer samples with few tumor cells. J Thorac Oncol. 2008 Nov;3(ll):1224-35; van Eijk R et al. Rapid KRAS, EGFR, BRAF and PIK3CA mutation analysis of fine needle aspirates from non-small-cell lung cancer using allele-specific qPCR. PLoS One. 2011 Mar 8; 6(3):el7791] или Scorpion [Horiike A et al. Detection of epidermal growth factor receptor mutation in transbronchial needle aspirates of non-small cell lung cancer. Chest. 2007 Jun; 131(6):1628-34]; ПЦР с обогащением мутантного варианта ДНК (mutant-enriched PCR) [Asano et al. Detection of EGFR gene mutation in lung cancer by mutant-enriched polymerase chain reaction assay. Clin Cancer Res. 2006 Jan 1; 12(1): 43-8]; ПЦР с последующим гетеродуплексным анализом (loop-hybrid mobility shift assay) [Oshita F et al. Novel heteroduplex method using small cytology specimens with a remarkably high success rate for analysing EGFR gene mutations with a significant correlation to gefitinib efficacy in non-small-cell lung cancer. Br J Cancer. 2006 Oct 23; 95(8): 1070-5]; ПЦР с последующим высокоточным анализом кривых плавления (high resolution melting - HRM) [Nomoto К et al. Detection of EGFR mutations in archived cytologic specimens of non-small cell lung cancer using high-resolution melting analysis. Am J Clin Pathol. 2006 Oct; 126(4):608-15]. Чувствительность этой группы методик значительно превосходит секвенирование и позволяет обнаруживать мутации при содержании опухолевых клеток 1-5%, что делает эти методы пригодными для тестирования цитологических образцов. К их недостаткам относятся необходимость использования комбинаций дорогих флюоресцентно-меченых или модифицированных олигонуклеотидов или флюоресцентных красителей, дополнительных процедур анализа (рестрикционный анализ при mutant-enriched PCR, электрофорез при гетеродуплексном анализе), дорогого оборудования (приборы для HRM-анализа).
Еще одним вариантом поиска мутаций EGFR является иммуногистохимия с использованием специфических к мутантному белку антител [Hasanovic A et al. Use of mutation specific antibodies to detect EGFR status in small biopsy and cytology specimens of lung adenocarcinoma. Lung Cancer. 2012 Aug;77(2):299-305]. В отличие от вышеперечисленных методов, эта методика способна выявлять только один из возможных вариантов делеций в 19 экзоне EGFR (del Е746-А750). Кроме того, для иммуногистохимического исследования характерно сравнительно большое количество ложнопозитивных результатов.
Известен способ определения чувствительности опухоли легкого к терапии ингибитрами тирозинкиназ, основанный на обычной ПЦР в сочетании с электрофорезом и аллель-специфической ПЦР, позволяющий детектировать до 90% встречающихся мутаций EGFR [Того А. В. и соавт. Молекулярно-генетический способ определения чувствительности опухоли у пациентов с раком легкого к терапии гефитинибом. Патент на изобретение №2454464]. Способ обладает большой информативностью и надежностью, однако можно говорить о повышении его чувствительности.
Известен способ определения чувствительности опухоли легкого к терапии ингибиторами тирозинкиназ, основанный на аллель-специфическом дизайне ПЦР, предложенный Ohnishi с соавт.[Ohnishi Н. et al. A simple and sensitive method for detecting major mutations within the tyrosine kinase domain of the epidermal growth factor receptor gene in non-small-cell lung carcinoma. Diagn Mol Pathol. 2006 Jun;15(2): 101-8]. При высокой чувствительности способ позволяет выявить только 2 варианта делеций в 19 экзоне и точечную мутацию L858R в 21 экзоне. Этот способ принят за прототип предлагаемого изобретения.
Техническим результатом заявленного изобретения является повышение информативности и чувствительности способа при использовании цитологических образцов для анализа известных мутаций в гене EGFR у больных РЛ.
Указанный технический результат достигается тем, что Способ определения чувствительности опухоли легкого к терапии ингибиторами тирозинкиназ у пациентов с раком легкого, включающий молекулярно-генетический анализ мутаций гена EGFR в цитологическом опухолевом материале, отличающийся тем, что осуществляют аллель-специфическую полимеразную цепную реакцию в режиме реального времени при помощи праймеров для выявления делеций в 19 экзоне гена EGFR:
прямого праймера 5' - CGTCGCTATCAAGGCАТСТС-3',
прямого праймера 5' - CGTCGCTATCAAGGTACCGAA-3',
прямого праймера 5' - CGTCGCTATCAAGGAACCATC-3'
и обратного праймера 5' - GCCAGACATGAGAAAAGGTG-3,'
а для выявления замены L858R гена EGFR в 21 экзоне:
праймера, специфичного к нормальному аллелю 5' - TCCGCACCCAGCAGTTTGGCTA-3',
праймера, специфичного к мутантному аллелю 5' - TCCGCACCCAGCAGTTTGGCTC-3, общего праймера 5' - GCATGAACTACTTGGAGGAC- 3'
и при выявлении любой из перечисленных мутаций определяют чувствительность опухоли легкого к терапии ингибиторами тирозинкиназ как положительную и назначают терапию гефитинибом или эрлотинибом.
В таблицах 1, 2 представлены типы детектируемых делеций (табл.1) и последовательности праймеров для детекции делеций в 19 экзоне гена EGFR (табл.2).
| Таблица 1 | ||
| Тип мутации | Изменения на уровне ДНК | Изменения на уровне белка |
| Microdeletion (1) | c.2235_2249del | p.Glu746_Ala750del |
| Microdeletion (2) | c.2236_2250del | p.Glu746_Ala750del |
| Microdeletion (3) | c.2240_2257del | p.Leu747_Pro753delinsSer |
| Microindel (4) | c.2237_2255delinsT | p.Glu746_Ser752delinsVal |
| Microindel (5) | c.2239_2251 delinsC | p.Leu747_Thr751 delinsPro |
| Microindel (6) | c.2239_2248 delinsC | p.Leu747_Ala750 delinsPro |
| Microdeletion (7) | c.2239_2256del | p.Leu747_Ser752del |
| Microdeletion (8) | c.2237_2251del | p.Glu746_Thr751 delinsAla |
| Таблица 2 | ||
| Праймер | 5' - 3' последовательность | Типы детектируемых делеций |
| Прямой праймер 1 | CGTCGCTATCAAGGCATCTC | 1, 2, 7, 8 |
| Прямой праймер 2 | CGTCGCTATCAAGGTACCGAA | 3, 4, 6 |
| Прямой праймер 3 | CGTCGCTATCAAGGAACCATC | 5 |
| Обратный праймер | GCCAGACATGAGAAAAGGTG |
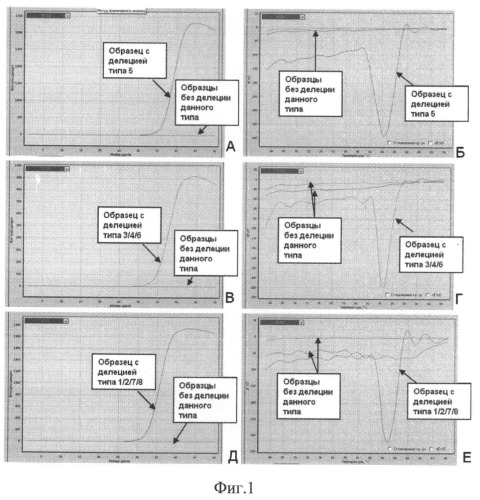
Изобретательский уровень предлагаемого способа подтверждается спектром детектируемых повреждений EGFR, представленных на фиг.1 ,2.
На фиг.1 представлен пример детекции делеций в экзоне 19 гена EGFR при помощи аллель-специфических праймеров в режиме реального времени. А, В, Д - Кривые, полученные при амплификации образцов с делениями и без с использованием трех пар праймеров (А-пара 3, В - пара 2, Д - пара 1). Б, Г, Е - Кривые плавления, полученные для тех же образцов.
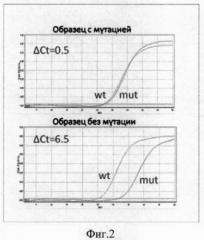
На фиг.2 представлен пример детекции замены L858R в 21 экзоне гена EGFR (wt -кривая амплификации с праймерами, специфичными последовательности дикого типа, mt - кривая амплификации с праймерами, специфичными последовательности с мутацией).
Способ осуществляют, например, следующим образом.
Тестирование рекомендовано всем пациентам с аденокарциномой легкого, а также может быть использовано у больных с другими гистологическими вариантами опухолей легкого. Материалом для исследования может служить ДНК, выделенная из цитологических образцов.
Детекция 8 наиболее частых делеций в 19 экзоне EGFR (табл.1) осуществляется методом аллель-специфической ПЦР (АС-ПЦР) в режиме реального времени при помощи трех пар праймеров (табл.2). Реакционная смесь (суммарный объем 20 мкл) содержит 1 мкл раствора ДНК (10-100 нг ДНК), 1,0 ед. «hot-start» ДНК-полимеразы, 1-кратный ПЦР-буфер (рН 8.3), 2.5 мМ MgCl2, 200 мкМ каждого из нуклеотидтрифосфатов, 0,3 мкМ одного из трех прямых и обратного праймеров. К ПЦР-смеси добавляется интеркалирующий краситель SYBR-Green I (20х раствор, добавляется из расчета 1/100 объема реакции), ПЦР-реакция начинается с 10-минутной активации Taq-полимеразы при 95°С; для накопления ПЦР-продукта проводится 45 циклов амплификации (денатурация: 15 сек при 95°С; отжиг: 30 сек при 60°С; синтез: 30 сек при 72°С). Результат оценивается но наличию/отсутствию амплификации (прироста флюоресценции) после прохождения реакции. Для контроля специфичности фрагментов используется анализ кривых плавления. Примеры детекции делеций различных типов представлены на фиг.1. Амплификация может производиться на оборудовании для ПЦР разных производителей.
Тестирование миссенс-мутации EGFR L858R в 21 экзоне проводится методом АС-ПЦР в режиме реального времени с использованием праймеров, содержащих нуклеотиды, некомплементарные матрице (mismatch-нуклеотиды) во 2 позиции от 3'-конца праймера: 5'-TCCGCACCCAGCAGTTTGGCTA-3' (праймер, специфичный для последовательности дикого типа), 5'-TCCGCACCCAGCAGTTTGGCTC-3' (праймер, специфичный для последовательности с мутацией) и 5'-GCATGAACTACTTGGAGGAC-3' (общий праймер). ПЦР может проводиться на приборах различных производителей (BioRad, ДНК-технология, Corbett Research) и состоит из 50 циклов амплификации (денатурация: 15 сек при 95°С; отжиг: 30 сек при 63°С; синтез: 30 сек при 72°С). Смесь для ПЦР (суммарный объем 20 мкл) содержит 1 мкл раствора ДНК (10-100 нг ДНК), 1,0 ед. ДНК-полимеразы, 1-кратный ПЦР-буфер (рН 8.3), 2.5 мМ MgCl2, 200 мкМ каждого из нуклеотидтрифосфатов, 0,3 мкМ каждого праймера, SYBR green I в концентрации 0,2х (исходный раствор 10 000х; Molecular Probes). Каждый сет амплификации должен включать контрольный образец (гетерозигота по исследуемой мутации), а также негативный контроль. Для оценки специфичности амплификации используется анализ кривых плавления. Генотипирование каждого образца требует постановки двух ПЦР-реакций одновременно. Первая реакция включает общий праймер и праймер, специфичный к нормальному аллелю (wt), вторая - общий праймер и праймер, специфичный к мутантному аллелю (mut). Определение генотипа основывается на разнице пороговых циклов Ct (цикл, во время которого уровень флуоресценции в пробирке начинает достоверно превышать базовый, что визуально отображается как пересечение кривой амплификации пороговой линии) в этих двух реакциях, так называемом показателе ΔCt(ΔCt=Ct(mt)-Ct(wt)). В случае гетерозиготы эффективность амплификации с обеими парами праймеров одинакова, и ΔCt составляет не более 1-2 циклов. В случае гомозиготы дикого типа реакция значительно более эффективно проходит в пробирке, содержащей пару праймеров, специфичных нормальной последовательности, и ΔCt составляет не менее 6-10 циклов.
Несомненным преимуществом предлагаемого способа является высокая чувствительность (способность выявлять генетические повреждения EGFR при содержании ДНК с мутацией в образце менее 1%) и, соответственно, возможность использования цитологического материала для проведения анализа. Предложенный способ позволяет обнаруживать оба распространенных варианта мутаций EGFR (8 делеций в 19 экзоне и замену L858R гена EGFR в 21 экзоне) при помощи оборудования для ПЦР в режиме реального времени любого производителя с использованием недорого флюоресцентного красителя SYBR Green, не требует дополнительного этапа визуализации, прост в исполнении и интерпретации результата.
Способ определения чувствительности опухоли легкого к терапии ингибиторами тирозинкиназ у пациентов с раком легкого, включающий молекулярно-генетический анализ мутаций гена EGFR в цитологическом опухолевом материале, отличающийся тем, что осуществляют аллель-специфическую полимеразную цепную реакцию в режиме реального времени при помощи праймеров для выявления делеций в 19 экзоне гена EGFR: прямого праймера 5'-CGTCGCTATCAAGGCАТСТС-3' - для делеций c.2235_2249del, c.2236_2250del, c.2239_2256del, c.2237_2251del,прямого праймера 5'-CGTCGCTATCAAGGTACCGAА-3' - для делеций c.2240_2257del, c.2237_2255delinsT, c.2239_2248delinsC,прямого праймера 5'-CGTCGCTATCAAGGAACCATC-3' - для делеции c.2239_2251delinsC и обратного праймера 5'-GCCAGACATGAGAAAAGGTG-3' и для выявления замены L858R гена EGFR в 21 экзоне:праймера, специфичного к нормальному аллелю 5'-TCCGCАСССAGCAGTTTGGCTA-3', праймера, специфичного к мутантному аллелю 5'-TCCGCACCCAGCAGTTTGGCTC-3', общего праймера 5'-GCATGAACTACTTGGAGGAC-3'и при выявлении любой из перечисленных мутаций определяют чувствительность опухоли легкого к терапии ингибиторами тирозинкиназ как положительную и назначают терапию гефитинибом или эрлотинибом.