Способ моделирования атеросклероза
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине, патофизиологии и касается моделирования атеросклероза, что может быть использовано для изучения диагностики, профилактики и лечения этого заболевания. Для этого лабораторным животным - крысам добавляют в корм порошок холестерина в количестве 1%, маргарин 10%, мерказолил 10 мг/кг и витамин D - 2,5 ME на кг массы тела. Дополнительно животным проводят операцию, состоящую из наложения лигатуры на почечную ножку левой почки нерассасывающимся шовным материалом и прошивания верхнего полюса правой почки, оставляя 2/3 органа. Способ легко выполним, не вызывает гибели животных, является адекватной моделью повреждения эндотелия и развития атеросклеротического процесса. 12 ил., 4 табл., 1 пр.
Реферат
Изобретение относится к экспериментальной медицине, патофизиологии, может быть использовано в целях диагностики, профилактики и лечения атеросклеротического процесса.
Атеросклероз и его осложнения продолжают лидировать в структуре заболеваемости и смертности западных стран и России. Летальность при сердечно-сосудистых патологиях в мире вдвое больше, чем от онкологических заболеваний, и в 10 раз выше, чем от несчастных случаев [Воробьева Е.Н., Шумахер Г.И., Осипова И.В. и др.// Кардиоваскулярная терапия и профилактика. - 2006, №5 (6). - С.129-136; Лупач Н.М., Хлудеева Е.А., Лукьянов П.А. и др. // Российский медицинский журнал. - 2010, №4. С.71-74; Титов В.Н. // Клиническая лабораторная диагностика. 2006, №4. С.310].
Одним из основных факторов риска (ФР) развития атеросклероза является нарушение липидного обмена в организме. Дислипидемия, заключающаяся в снижении α-липопротеинов высокой плотности (ЛПВП), при повышении β-липопротеинов, или липопротеинов низкой плотности (ЛПНП), пре-β липопротеинов, или липропротеинов очень низкой плотности (ЛПОНП), способствует развитию атеросклероза. Причем атерогенными свойствами обладают модифицированные, подвергнутые, чаще всего, перекисному окислению, окисленные (окси-ЛПН). Они способствуют повышению синтеза кавеолина-1, что приводит к снижению образования NO эндотелием [Воробьева Е.Н., Шумахер Г.И., Осипова И.В. и др. // Кардиоваскулярная терапия и профилактика. - 2006, №5 (6). - С.129-136; Зотова И.В., Затейщиков Д.А., Сидоренко Б.А. // Кардиология. - 2002, №4. - С.57-67; Титов В.Н. // Клиническая лабораторная диагностика. 2006, №4. С.310]. Окисленные липопротеиды являются активными раздражителями для моноцитов, которые проникают в субэндотелиальное пространство, превращаясь в макрофаги, и затем, по мере накопления в них модифицированных ЛПНП, в пенистые клетки. Активированные макрофаги и пенистые клетки высвобождают биологически активные вещества - факторы роста, противовоспалительные цитокины, молекулы клеточной адгезии, которые способствуют агрегации тромбоцитов, вазоконстрикции и адгезии лейкоцитов, а следовательно, развитию воспалительного процесса в артериальной стенке и прогрессированию атеросклероза. Также окси-ЛПНП индуцируют пролиферацию гладкомышечных клеток (ГМК) сосудов, ЛПВП напротив осуществляют обратный транспорт холестерина (ХС) из сосудистой стенки и макрофагов в печень [Титов В.Н. // Клиническая лабораторная диагностика. 2006, №4. С.310].
Артериальная гипертония (АГ) - второй важный фактор риска развития атеросклероза. Было доказано, что лекарственный контроль давления у гипертоников снижает риск инсультов на 40%, инфаркта миокарда на 8%, а общую летальность от сердечных заболеваний на 10% [Чичерина Е.Н., Милютина О.В. // Клиническая медицина. 2009. - №2. - С.18-21]. При изолированной АГ у мужчин в возрасте 47,5±8,4 г. показатели липидного спектра сдвигаются в сторону повышения общего холестерина (ОХС), триглицеридов (ТГ), ХС ЛПНП, снижения ХС ЛПВП, повышения коэффициента атерогенности (КА) [Овчинникова Л.К., Ягудина Р.И., Овчинникова Е.А. // Российские аптеки. - 2007. - №14. - С.26-31]. Гипертония способствует увеличению проницаемости эндотелия и накоплению липопротеинов в интиме [Шляхто Е.В., Гавришева Н.А., Овчинникова О.А. и др. Влияние индуцированого воспаления на метаболизм коллагена в атеросклеротических бляшках у мышей // Медицинская иммунология. 2008, №6. С.507-512]. Доказано, что причина активации перекисного окисления (ПО) белков и липидов у крыс со спонтанной АГ состоит в усилении продукции кислородных радикалов и неэффективности эндогенных систем их инактивации. Известно также, что развитие спонтанной АГ у крыс сопровождает синдром системного воспалительного ответа: его начальной стадией являются активация (прайминг) полиморфно-ядерных лейкоцитов (нейтрофилов), усиление продукции и секреции ими активных форм О2- и Н2О2 и интенсификации ПО белков и заодно жирных кислот (ЖК). Реакция О2- с оксидом азота (NO) с образует ONOO- и лишает NO его биологического действия как фактора релаксации. Снижение NO приводит к усилению АД по типу развития порочного круга [Зотова И.В., Затейщиков Д.А., Сидоренко Б.А. // Кардиология. - 2002, №4. - С.57-67].
С современных позиций ключевым звеном в патогенезе атеросклероза считается эндотелиальная дисфункция (ЭД), которая является дисбалансом между основными функциями эндотелия: вазодилатацией и вазоконстрикцией, ингибированием и содействием пролиферации, антитромботической и протромботической, антиокислительной и проокислительной [Лупач Н.М., Хлудеева Е.А., Лукьянов П.А. и др. // Российский медицинский журнал. - 2010, №4. С.71-74; Allison В. Reiss, Amy D. // Journal of investigative medicine. 2006. Vol.54, N. 3. P.123-131; Huber S.A, Sakkinen P., David С.// Circulation. 2001. - N. 103. - P. 2610-2616]. Оксид азота является важным регулятором в сердечно-сосудистой системе, мессенджер, опосредующий ауто- и паракринное влияние. В организме реакция синтеза NO катализируется семейством NO-синтаз (NOS). NOS используют L-аргинин в качестве субстрата и NADPH-диафоразу в качестве кофактора. NADPH-диафораза участвует в транспортировке электронов к простетической группе энзима. Определение NADPH-диафоразы основано на образовании диформазана в присутствии эндогенного β-NADPH и солей тетразолия [Зотова И.В., Затейщиков ДА., Сидоренко Б.А. // Кардиология. 2002, №4. С.57-67; Шуматова Т.А., Приходченко Н.Г., Григорян Л.А. и др. //Тихоокеанский медицинский журнал. 2010, №3. С.59-61; Allison В. Reiss, Amy D. Glass // Journal of investigative medicine. 2006. Vol.54, N. 3. P.123-131].
Данными клинических и эпидемиологических исследований доказано патогенетическое влияние гипертонической болезни и гиперлипидемии на сосудистую стенку, однако четко не установлен период формирования ЭД при совместном действии этих факторов в условиях эксперимента [Овчинникова Л.К., Ягудина Р.И., Овчинникова Е.А. // Российские аптеки. - 2007. - №14. - С.26-31; Воробьева Е.Н., Шумахер Г.И., Осипова И.В., Хорева М.А. и др. // Кардиоваскулярная терапия и профилактика. - 2006. - №5(6). - 129-136; Нагорнев В.А., Воскаянц А.Н. // Вестн. РАМН, 2006. - №9-10. С.66-74; Davignon J. Ganz P. //Circulation. - 2004; 109: 27-32].
Экспериментальные модели на животных играют важную роль в исследовании заболеваний, в том числе и атеросклероза. Крысы часто используются в моделировании гиперлипидемии, как фактора риска атеросклероза [Мещерская К.А., Бородина Г.П., Королева Н.П. О методике отбора средств, влияющих на обмен холестерина. // Элеутерококк и другие адаптогены из дальневосточных растений. / Под ред. К.А.Мещерской. - Владивосток, 1966. - С.289-294; Санникова А.А., Н.Н.Чучкова, Гайсина Э.Ш. Иммуномодулирующее действие глюкозаминилмурамилдипептида при измененном липидном обмене и атеросклерозе. // Вестник Уральской медицинской экономической науки. - 2008. - №1. - С.64-66. 10; Юдина Т.П., Чаревач Е.И., Цыбулько Е.И., Масленникова Е.В., Плаксен Н.В. Гиполипидемическое действие комплексного эмульгатора, содержащего водоросль ламиналь и водный экстракт из корней мыльнянки Sa ponaria officinalis L., в эксперименте на крысах.// Вопросы питания. - 2008. - Т. 77, №2. - С.76-79]. Их приобретение и содержание относительно недороги, животные просты в обращении, хорошо размножаются в неволе. Из всех экспериментальных животных у крыс лучше всего изучен метаболизм [Куликов В.А., Чиркин А.А. Особенности метаболизма липопротеинов у крыс // Патологическая физиология и экспериментальная терапия. - 2004. - №1. - С.26-27].
Однако вышеперечисленные исследователи оценивали изменение лишь липидного состава крови в течение небольшого срока наблюдения (от 16 дней до 3 месяцев), в моделях отсутствуют данные о морфологических и функциональных изменениях стенки сосудов, не учитывается включение долговременных компенсаторных механизмов, препятствующих формированию сосудистого поражения.
Известны способы моделирования атеросклероза (п. RU №2033646; кл. G09В 23/28, 1995; п. RU №2327228, кл. G09В 23/28, 2008, бюл. №17; п. RU №2127113, кл. А61К 31/70, А61К 31/505, 1999).
Однако вышеупомянутые способы предусматривают введение медикаментозных препаратов (обзидана - 1 мг на 100 г массы, суспензии гидрокортизона ацетата - 1,5 мг на 100 г массы животного, уридина в дозе 50 мг на 1 кг массы тела один раз в сутки в течение 6-8 дней) на фоне диеты, обогащенной жирами, искусственно изменяют метаболизм животного и неадекватно отражают формирование естественных патогенетических механизмов, играющих ключевую роль в развитии атеросклероза.
За прототип принято моделирование гиперлипидемии у крыс на протяжении длительного времени [Кропотов А.В. Влияние цимифуги даурской и калужницы лесной на некоторые показатели обмена липидов и половую систему (экспериментальное исследование). Автореф. дисс.на соискание ученой степени кандидата мед. наук, Владивосток - 1975, стр.5]. Известный метод придает диете выраженные атерогенные свойства. Крысы находятся на диете с избыточным содержанием жиров в течение 7 месяцев. В корм животных добавляют порошок холестерина в количестве 1%, маргарина 10%, мерказолила 10 мг/кг и витамина D в количестве 2,5 ME на кг массы тела крысы.
Однако в прототипе не оценивалось изменение функциональных и морфологических свойств эндотелия сосудов, исследователи наблюдали лишь изменения липидного спектра в крови и в биоптатах печени крыс.
Учитывая особенности обменных процессов крыс, способствующих формированию их резистентности к жировой нагрузке, авторы изобретения применили сочетание гиперлипидемии с артериальной гипертензией для наиболее выраженного повреждения эндотелия. Способ усиливает нарушение процессов обмена холестерина, формирование стойких признаков атеросклеротического повреждения сосудов с учетом включения срочных и долговременных компенсаторных механизмов.
Задача заявляемого изобретения - разработать экспериментальную модель эндотелиальной дисфункции на основе изучения сочетанного влияния гиперлипидемии и артериальной гипертензии на морфологическую структуру сосудов крыс.
Поставленная задача заявляемого способа достигается путем комбинации вскармливания лабораторных животных атерогенным рационом, состоящим из добавления в корм порошка холестерина в количестве 1%, 10% маргарина, 10 мг/кг мерказолила, и витамина D - 2,5 ME на кг массы тела крысы, и проведения операции, включающей наложение лигатуры на почечную ножку левой почки нерассасывающимся шовным материалом и прошивание верхнего полюса правой почки, при этом оставляя 2/3 органа, что способствует развитию стойкой реноваскулярной артериальной гипертензии. В ходе эксперимента были выполнены следующие этапы:
- Проведен мониторинг состояния липидного обмена сыворотки крови при изолированной экспериментальной гиперлипидемии (ЭГ) и при комплексном воздействии атерогенной диеты и артериальной гипертензии (Д+АГ).
- Мониторирование уровня артериального давления в моделях ЭГ и Д+АГ.
- Определение активности NADPH-диафоразы в эндотелии аорты, бедренных артерий и микрососудах передней брюшной стенки (ПБС) в двух экспериментальных моделях.
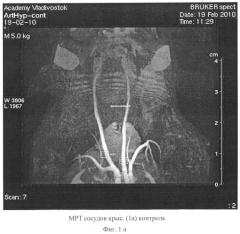
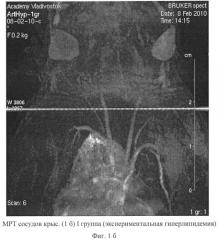
- Оценка состояния просвета сосудов у экспериментальных животных методом компьютерной магнито - резонансной томографии (МРТ).
Технический результат заявляемого способа заключается в получении стойких структурных нарушений сосудистой стенки, по сравнению с изолированной атерогенной диетой, в целях создания модели атеросклероза на лабораторных животных для диагностики, профилактики и лечения атеросклероза.
Сущность заявляемого изобретения состоит в сочетании гиперлипедемии и реноваскулярной гипертензии у лабораторных крыс.
Гиперлипидемия достигнута с помощью добавления в корм порошка холестерина в количестве 1%, 10% маргарина, 10 мг/кг мерказолила и витамина D - 2,5 ME на кг массы тела крысы.
Реноваскулярная гипертензия осуществлялась путем наложения лигатуры на почечную ножку левой почки нерассасывающимся шовным материалом и прошиванием верхнего полюса правой почки (оставляя 2/3 органа).
Данная методика позволяет получить стойкие структурные нарушения сосудистой стенки, по сравнению с изолированной экспериментальной гиперлипидемией.
Сущность заявляемого способа поясняется чертежами, где на фиг.1 а-1 в изображено увеличение у опытных крыс ширины общей сонной артерии, плечеголовного ствола и грудной части аорты, соответственно, на 2 месяце исследования, на фиг.2 показано в моделе Д+АГ определение неравномерного контрастирования артерий, что предполагает локальные атерогенные изменения стенки артерий, на фиг.3 - в аорте опытных крыс при окраске гематоксилином и эозином показаны изменения архитектоники эластических волокон, смещение ядер миоцитов на периферию, их уплотнение, клеточная инфильтрация стенки, утолщение эндотелия, Увеличение×400 (камера A×Cam MRc, Германия), окраска гематоксилин и эозин, на фиг.4 визуализируются перинуклеарные оптически пустые образования, увеличение×400 (камера A×Cam MRc, Германия), окраска гематоксилин и эозин; на фиг.5 - окраска гематоксилином и эозином аорта (контроль), увеличение×100 (камера A×Cam MRc, Германия), окраска гематоксилин и эозин; на фиг.6 в бедренных артериях визуализируются перинуклеарные оптически пустые образования увеличение×400, Окраска гематоксилин и эозин; на фиг.7 - окраска гематоксилином и эозином бедренная артерия (контроль), увеличение×400 (камера A×Cam MRc, Германия) окраска гематоксилин и эозин; на фиг.8 - в группе крыс с Д+АГ при окраске аорты Суданом 4 (по методу Окамото), изображена инфильтрация сосуда жировыми включениями, окраска сосудов по методу Окамото, увеличение×100; на фиг.9 в группе крыс с Д+АГ при окраске бедренной артерии Суданом 4 (по методу Окамото) показана инфильтрация сосуда жировыми включениями, увеличение×400; на фиг.10изображен график толщены стенки и интимы аорты и бедренных артерий крыс в модели гиперлипидемии (I группа) и в комплексной модели: гиперлипидемии и артериальной гипертензии (II группа).
Пример конкретного исполнения
Материалом для экспериментальных исследований явились крысы линии Вистар - 45 самцов массой 200-250 г. Животные были распределены на 2 группы:
1 группа - 15 крыс-самцов находились на холестериновой диете в течение 6 месяцев (прототип). Диета заключалась в добавлении в корм порошка холестерина в количестве 1%, 10% маргарина, 10 мг/кг мерказолила и витамина D - 2,5 ME на кг массы тела крысы.
2 группа 15 крыс-самцов за 15 дней перед началом кормления аналогичным атерогенным рационом (добавление в корм порошка холестерина в количестве 1%, 10% маргарина, 10 мг/кг мерказолила, и витамина D - 2,5 ME на кг массы тела крыс) была произведена операция - наложение лигатуры на почечную ножку левой почки нерассасывающимся шовным материалом и прошивание верхнего полюса правой почки, оставляя 2/3 органа (заявляемый способ). Данная операция развивает стойкую реноваскулярную артериальную гипертензию к 8-10 неделе эксперимента.
III группа - контрольная - 15 здоровых крыс-самцов питались обычным рационом. Через 6 месяцев исследования животных каждой группы выводили из эксперимента под эфирным наркозом путем декапитации. Проводили забор сыворотки крови, фрагментов аорты, бедренных артерий и ПБС. Эксперимент осуществлялся со строгим соблюдением требований Европейской конвенции (Страсбург, 1986) по содержанию, кормлению и уходу за подопытными животными, а также выводу их из эксперимента и последующей утилизации. В постановке опытов руководствовались требованиями Всемирного общества защиты животных (WSPA) и Европейской конвенции по защите экспериментальных животных. Исследование одобрено междисциплинарным этическим комитетом (протокол №4, дело №21 от 24.01.2011).
Определение содержание ОХ; ТГ; холестерина ЛПНП, ЛПВП проводили с помощью стандартного колориметрического метода с использованием реагентов «Ольвекс диагностикум» (Россия).
Артериальное давление измеряли в хвостовой артерии с помощью анализатора MLU/ 4С 501 (MedLab КНР). Во время опыта животные находились под наркозом, который избавил их от переживаний и связанных с ними скачков давления.
Метод магниторезонансной томографии заключается в следующем.
Животных перед сканированием усыпляли растворами рометара (Xylazinum, SPORA, PRAHA) в концентрации 1 мг/мл и реланиума в концентрации 2 мг/мл, внутрибрюшинно. МРТ диагностика выполнена на томографе для экспериментальных исследований «PharmaScan US 70/16» (Bruker, Германия) с напряженностью магнитного поля 7,0 Тесла, частотой 300 MHz и катушкой типа BGA 09P. Для ангиографии использовали протокол Head_Angio со следующими параметрами: TR/TE=50.0/5.6; угол наклона 25,0; поле изображения 3,0/3,0/3,0; эффективная толщина среза 30 мм; перекрытие 30,0 мм; матрица 256/256/64 элементов; одно усреднение сигнала, время сканирования 14 мин.
Гистологические препараты фиксировали в 10% нейтральном формалине и заливали в парафин. Срезы окрашивали гематоксилином и эозином, Ван-Гизон, Маллори и суданом-4 (Метод Окамото). Описание микропрепаратов проводилось на микроскопе Olympus BX 41. Снимки делались электронной камерой Olympus DP 12, при постоянном увеличении на 100 и на 400. Морфометрия проводилась с использованием окуляр-микрометра MOB - 1-16 ×.
В эксперименте использован гистохимический метод на NADPH-диафоразу по стандартной прописи Hope, Vincent (1989): фрагменты сосудов животных выделяли с помощью лезвия и опускали в охлажденный, приготовленный на 0,1 М фосфатном буфере (рН 7,4) 4% параформальдегид, который из всего класса диафораз сохраняет активность только NADPH-диафоразы. Материал фиксировали в течение 2 часов при температуре 4°С, сутки промывали при той же температуре в 15% растворе сахарозы, 7-8 раз меняя раствор. Из образцов ткани, замороженных в криостате, изготавливали срезы толщиной 10 мкм, монтировали на предметные стекла и помещали в инкубационную среду. Состав и конечная концентрация среды были следующими: 50 мМ Трис-буфер (рН 8,0), 1 мМ NADPH («Sigma»), 0,5 мМ нитросинего тетразолия («Sigma») и 0,2% Тритон Х-100 («Serva»). Инкубацию проводили в течение 60 минут в термостате при температуре 37°С. Затем срезы ополаскивали в дистиллированной воде, обезвоживали и заключали в бальзам по общепринятой в гистологии методике.
Измерение активности фермента производили в эндотелии и гладких миоцитах аорты, бедренных артериях и микрососудах ПБС крыс.
Активность фермента определяли при помощи программы "ImageJ1.37 v" и выражали в единицах оптической плотности. Имеются доказательства прямой зависимости между концентрацией исследуемого фермента и оптической плотностью преципитата, образующегося в результате гистохимической реакции [Djuricic B.M., Rodac L.S., Spatz M., Mrsulja B.B. Drain microvessels Enzymic Activities. Adv In Neurology 1978; 20: 197-205].
Для математической обработки полученных данных использовали программу SPSS v. 16. Сравнение средних значений в выборках осуществляли с помощью непараметрического U-критерия Вилкоксона-Манна-Уитни.
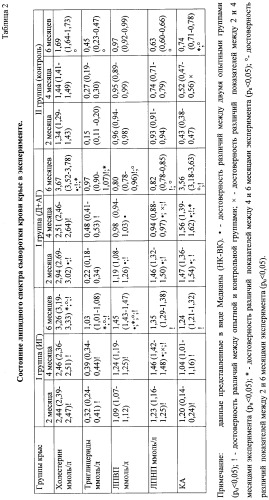
Мониторинг артериального давления показал, что во II экспериментальной группе (Д+АГ) артериальное давление было выше, чем в I группе и в группе здоровых крыс на протяжении всего эксперимента (2, 4, 6 месяцев), что подтверждает формирование реноваскулярного и ренопривного механизмов артериальной гипертензии (таблица 1).
| Таблица 1 | ||||||
| Показатели артериального давления крыс в моделях экспериментального атеросклероза | ||||||
| Группы крыс | Эксперимент 2 месяца | Эксперимент 4 месяца | Эксперимент 6 месяцев | |||
| Систолич. АД (мм рт.ст.) | Диастолич. АД (мм рт.ст.) | Систолич. АД (мм рт.ст.) | Диастолич. АД (мм рт.ст.) | Систолич. АД (мм рт.ст.) | Диастолич. АД (мм рт.ст.) | |
| I группа (ИГ) | 113,8±3,6 | 68,8±1,22 | 122,06±1,05 | 66,18±7,08 | 141,70±4,41• | 90,89±1,83 |
| II группа (Д+АГ) | 131,3±1,5•;* | 83,4±3,2•;* | 140,12±3,25 •;* | 90,24±4,44 •;* | 161,70±1,66 •;* | 99,33±3,41 •;* |
| III группа (контроль) | 115,1±0,7 | 73,4±0,53 | 116,25±0,84 | 70,20±2,18 | 116,01±3,05 | 71,44±1,70 |
| *- достоверность различий между I и II группами (рu<0,05); | ||||||
| • - достоверность между экспериментальными группами и контрольной группой (рu<0,05). |
При исследовании липидного спектра в опытных группах крыс через 2 месяца эксперимента установлено увеличение уровня ОХ, ТГ, ЛПНП, ЛПВП и КА, по сравнению с контрольной группой (рu<0,05) (таблица 2). При этом в группе крыс с артериальной гипертензией значения ОХ, ЛПНП, ЛПВП и КА были достоверно выше (рu<0,05), а уровень ТГ - несколько ниже (pu>0.05), чем в группе крыс с изолированной гиперлипидемией (таблица 2). На 4 месяце эксперимента в I группе крыс сохранялись нарушения липидного профиля, достоверно повышался уровень ЛПНП (рu<0,05). Во II группе значения ЛПВП и ЛПНП снизились и стали ниже, чем в I группе животных, при этом происходило увеличение уровня ТГ и КА. К 6 месяцу эксперимента в обеих опытных группах животных достоверно нарастал уровень ОХ и ТГ. У крыс с атерогенной диетой к этому периоду эксперимента отмечалось увеличение содержания липопротеинов высокой плотности по сравнению с их уровнем на 4 месяце исследования, при этом значения ЛПНП и КА не повышались (рu<0,05), тогда как во II группе крыс (Д+АГ) продолжалась тенденция снижения показателей ЛПНП и ЛПВП. При этом уровень ЛПВП у крыс данной группы стал ниже, чем у здоровых крыс (рu<0,05), произошло увеличение КА - в 2,5 раза по сравнению с I группой и в 4,8 раза по сравнению с контрольной группой крыс (таблица 2). Выявленные изменения подтверждают более выраженные нарушения липидного спектра у крыс II группы (Д+АГ). Снижение сывороточного содержания ЛПНП и ЛПВП у крыс с артериальной гипертензией и гиперлипидемией, вероятно, указывает на усиление их рецепции эндотелием сосудов.
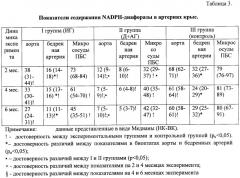
При оценке NADPH-диафоразы сосудов установлено, что в бедренных артериях I опытной и контрольной группы животных содержание NADPH-диафоразы было ниже, чем в аорте, что можно объяснить анатомическими особенностями строения стенок данных сосудов (в бедренных артериях более выражен мышечный компонент) (рu<0,05). В бедренных артериях II группы крыс значения NADPH-диафоразы были несколько ниже, чем в аорте, однако показатели не имели достоверной разницы, что может свидетельствовать о более выраженном нарушении синтеза этого кофермента в аорте при моделировании реноваскулярной гиперетензии. При мониторинге NADPH-диафоразы зарегистрировано снижение ее уровня во фрагментах аорты и бедренных артерий I и II опытных групп крыс с достоверностью различий с контролем (рu<0,05) (табл.3).
Не установлено достоверных различий в содержании кофермента сосудов в зависимости от времени проведения эксперимента (2, 4, 6 месяцев) во всех экспериментальных группах. Наибольшее снижение уровня NADPH-диафоразы определялось на 2 месяце исследования с относительной стабилизацией значений кофермента на низком уровне при последующем мониторинге.
У крыс с гиперлипидемией и артериальной гипертензии значение NADPH-диафоразы в динамике всего эксперимента было ниже, чем в прототипе (pu<0,05), что свидетельствует о более глубоком нарушении функциональных свойств эндотелия. У крыс II группы уровень NADPH-диафоразы в сосудах микроциркуляторного русла снижался ко 2 месяцу исследования, тогда как в группе крыс I группы (ЭГ) достоверное снижение его уровня происходило только к 6 месяцу эксперимента.
При мониторинге состояния артериального русла методом магниторезонансной томографии (МРТ) установлено, что на 2 месяце исследования у опытных крыс ширина общей сонной артерии, плечеголовного ствола и грудной части аорты увеличивалась (таблица 4, фиг.1, фиг.2). Данная сосудистая реакция, обусловлена включением защитно-приспособительных механизмов для поддержания центральной гемодинамики.
Однако к 6 месяцу эксперимента отмечалось сужение просвета перечисленных сосудов (таблица 4), наиболее выраженное во II группе крыс (достоверность различий с I группой (рu<0,05). У крыс II группы регистрировалось уменьшение ширины просвета подвздошных артерий, что свидетельствует о мультифокальности поражения артериального русла при комплексном действии гиперлипидемии и артериальной гипертензии. Определялось неравномерное контрастирование артерий в моделе Д+АГ, что предполагает локальные атерогенные изменения стенки артерий (фиг.2).
| Таблица 4 | ||||||
| Диаметр просвета сосудов крыс (мм), установленный методом МРТ. | ||||||
| Сосуды | I (диета) | II группа (диета+операция) | Контроль (размер в мм) | |||
| 2 мес | 6 мес | 2 мес | 6 мес | 2 мес | 6 мес | |
| Общая сонная | 1,57(1,49-1,63)! | 1,41(1,38-1,54) | 1,34;(1,26-1,47) | 1,14;(1,10-1,19)• | 1,27(1,19-1,32) | 1,23(1,20-1,31) |
| Внутренняя сонная | 0,79(0,76-0,81) | 0,72(0,70-0,73) | 0,78(0,76-0,84) | 0,44(0,42-0,50)•! | 0,8(0,78-0,89) | 0,77(0,75-0,91) |
| Плечеголовной ствол | 1,54(1,51-1,58)! | 1,38(1,43-1,50) | 1,47(1,60-1,65)! | 1,23(1,21-1,25)• | 1,31(1,28-1,33) | 1,30(1,27-1,32) |
| Мозговые артерии | 0,49(0,46-0,56) | 0,40(0,38-0,41) | 0,49(0,45-0,52) | 0,44(0,42-0,50) | 0,40(0,37-0,47) | 0,41(0,39-0,44) |
| Гр. часть аорты | 2,13(2,05-2,16)! | 1,78(1,76-1,79)× | 2,32(2,26-2,33)! | 1,51; (1,47-1,53)•!× | 1,95(1,83-1,97) | 1,86(1,80-1,93) |
| Бр. часть аорты | 1,61 | 1,41 | 1,66 | 1,64 | 1,62(1,54-1,63) | |
| (1,59-1,63) | (1,40-1,44) | (1,60-1,68) | 1,53(1,43-1,56) | (1,60-1,66) | ||
| Общие подвздошные артерии | 1,1(0,94-1,05) | 0,82(0,80-0,87) | 0,94(0,92-0,96) | 0,74(0,71-0,75)!× | 0,98(0,96-1,2) | 0,93(0,90-0,99) |
| Примечание: данные представленные в виде Медианы (НК-ВК). | ||||||
| ! - достоверность между экспериментальными группами и контрольной группой (рu<0,05). | ||||||
| • - достоверность различий между I и II группами (pu<0,05); | ||||||
| × - достоверность различий между показателями на 2 и 6 месяцах эксперимента. |
Оценка гистологической структуры артериальной стенки показала, что наиболее выраженные изменения сосудов регистрируются к 6 месяцу эксперимента. В аорте и бедренных артериях опытных крыс при окраске гематоксилином и эозином наблюдаются изменения архитектоники эластических волокон, визуализируются перинуклеарные оптически пустые образования, смещение ядер миоцитов на периферию, их уплотнение, клеточная инфильтрация стенки, утолщение эндотелия (фиг.3, фиг.4, фиг.6,) по сравнению с интактными крысами (фиг.5, фиг.7). При этом наиболее выраженные изменения морфологии артерий регистрируются во второй экспериментальной группе (Д+АГ) (фиг.4, фиг.6). При окраске артерий Суданом 4 по методу Окамото у опытных крыс с Д+АГ выявлена инфильтрация сосуда жировыми включениями. При этом отложение жира заполняют пустоты, выявленные при окраске гематоксилином и эозином (фиг.8, фиг.9).
В ПБС у опытных крыс наблюдается уменьшение числа микрососудов (в I группе крыс выявляются 5-7 микрососудов, во II группе - 3-4 микрососуда в поле зрения, тогда как у контрольных крыс - 8-10 микрососудов). Сосуды микроциркуляторного русла у крыс II экспериментальной группы в виде штрихов с пролиферацией эндотелиоцитов, тогда как у контрольных крыс - овальной или округлой формы. Увеличивалась толщина микрососудов передней брюшной стенки в опытных группах крыс. При этом максимальное утолщение стенки микрососудов наблюдалось во II экспериментальной группе (М=4,62 (4,36-4,72) мкм во второй группе, М=2,31 (2,12-2,36) мкм в I группе, и 1,54 (1,50-1,62) мкм - у контрольных крыс). Зарегистрировано увеличение толщины стенки аорты и бедренных артерий у опытных крыс. У крыс с артериальной гипертензии регистрировалось увеличение толщины стенки и интимы сосудов, по сравнению с моделью изолированной экспериментальной гиперлипидемии (фиг.10).
Сопоставительный анализ заявляемого решения с прототипом показывает, что в заявляемом способе, сочетающем артериальную гипертензию и гиперлипидемию к 6 месяцу эксперимента установлены изменения липидного спектра сыворотки крови (повышение уровня OX, ТГ, снижение ЛПВП, увеличение КА) по сравнению с прототипом. Заявляемый способ позволяет установить стойкое увеличение систолического и диастолического артериального давления со 2 по 6 месяц исследования. По сравнению с прототипом зарегистрировано снижение активности NADPH-диафоразы в эндотелии сосудов к 6 месяцу эксперимента. Наблюдалось повреждение сосудов: деформация эластических волокон, увеличение толщины стенки и интимы, клеточная инфильтрация, отложение жировых включений в стенке, сужение просвета сосудов, уменьшение количества микрососудов ПБС.
Способ моделирования атеросклероза, включающий кормление исследуемых животных атерогенным рационом, состоящий из добавления в корм порошка холестерина в количестве 1%, маргарина 10%, мерказолила 10 мг/кг и витамина D - 2,5 ME на кг массы тела крысы, отличающийся тем, что наряду с кормлением атерогенным рационом животным проводят операцию, состоящую из наложения лигатуры на почечную ножку левой почки нерассасывающимся шовным материалом и прошивания верхнего полюса правой почки, при этом оставляя 2/3 органа.