Иммуномодулирующие экстракты из бактерий lactobacillus и способы их получения и применения
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к экстракту одного или более бактериальных штаммов Lactobacillus. Экстракт одного или более бактериальных штаммов Lactobacillus, представляющий собой растворимый экстракт, где экстракт содержит химически модифицированные бактериальные молекулы, полученные в результате воздействия щелочной среды на один или более бактериальных штаммов Lactobacillus, экстракт полезен в лечении заболеваний, связанных с дисбалансом продукции противовоспалительных цитокинов. Способ получения экстракта одного или более бактериальных штаммов Lactobacillus. Фармацевтическая композиция, полезная для уменьшения, по меньшей мере, одного симптома, связанного, по меньшей мере, с одним состоянием, выбранным из респираторного расстройства, аллергического состояния, расстройства мочевых путей и пищеварительного расстройства, содержащая экстракт. Нутрицевтическая композиция. Фармакологическая композиция, полезная в лечении заболеваний, связанных с дисбалансом продукции противовоспалительных цитокинов, содержащая экстракт. Способ уменьшения указанных симптомов. Экстракт, полученный указанным способом. Вышеописанный экстракт эффективен в лечении заболеваний, связанных с дисбалансом продукции противовоспалительных цитокинов. 7 н. и 14 з.п. ф-лы, 8 ил., 22 табл., 5 пр.
Реферат
Область, к которой относится изобретение
Варианты осуществления настоящего изобретения включают экстракты из бактерий Lactobacillus, которые могут оказывать иммуномодулирующие эффекты у индивидуумов. Варианты осуществления настоящего изобретения могут применяться, например, в качестве нутрицевтиков или фармацевтических средств для лечения заболеваний, таких как заболевания, связанные с дисбалансом продукции противовоспалительных или провоспалительных цитокинов, таких как инфекции, аллергические состояния, аутоиммунные расстройства и воспаление, или в качестве адъювантов, обеспечивающих оздоровительные благоприятные воздействия у индивидуумов. Наряду с другими аспектами, изобретение также включает способы получения и применения таких экстрактов. Изобретение также относится к конкретным штаммам бактерий Lactobacillus.
Предпосылки и краткое описание сущности изобретения
Иммуномодуляция представляет собой глобальный термин, который относится к широкому диапазону иммунного вмешательства, которое изменяет нормальные или патологические иммунные ответы. Микробы продуцируют и секретируют широкий диапазон молекул, которые могут модулировать эукариотические иммунные ответы (Lavelle et al., Curr Top Med Chem. 2004, 4(5), 499-508). Они включают факторы, которые разрушают защитные механизмы для содействия колонизации и персистенции патогенного возбудителя. Были идентифицированы происходящие из вирусов, бактерий и паразитов молекулы, которые могут ингибировать воспалительные реакции. В дополнение к микробным факторам, которые могут подавлять иммунные ответы, сами мощные иммунные активаторы могут также иметь микробное происхождение. Они включают бактериальные энтеротоксины, экскреторные-секреторные продукты паразитарного происхождения и вирусные нуклеиновые кислоты.
Считается, что семейство, по меньшей мере, 11 рецепторов, называемых толл-подобными рецепторами (TLR), и экспрессируемых организмом хозяина, играет ключевую роль в иммунологическом выявлении и врожденной реактивности в отношении микробов. На фиг. 1 представлен список лигандов TLR (Gay and Gangloff, Ann. Rev. Biochem., 2007, 76:141-65). TLR распознают широкий диапазон молекул, также известных как связанные с патогеном молекулярные типы (PAMP), продуцируемых вирусами, бактериями и грибами (Tse and Horner, Ann Rheum Dis. 2007 Nov; 66 Suppl 3:iii77-80). Связанная с TLR иммуномодуляция применялась при разработке новых способов лечения широкого спектра патологических состояний, включая инфекционные, злокачественные, аутоиммунные и аллергические заболевания.
Агонисты и антагонисты TLR исследовались в качестве потенциальных терапевтических средств для профилактики и лечения заболеваний. В относительно небольших клинических испытаниях, агонисты TLR использовались в качестве адъювантов для вакцин, предназначенных для профилактики инфекций, устранения аллергической гиперчувствительности и удаления злокачественных клеток. Агонисты TLR также исследовались в качестве средств для монотерапии и дополнительной терапии для лечения пациентов и инфекционными, аллергическими и злокачественными заболеваниями. Применение антагонистов TLR также исследовалось в преклинических исследованиях и клинических испытаниях в качестве потенциальных терапевтических средств по поводу аутоиммунных заболеваний и сепсиса.
Пробиотики представляют собой живые микроорганизмы, которые могут оказать оздоровительные эффекты на индивидуума при введении в адекватных количествах (Mottet et al., Digestive and Liver Disease, 2005, 37: 3-6; Ezendam et al., Nutr Rev, Jan. 2006, 64(1): 1-14; Gill and Prasad, Adv Exp Med Biol, 2008, 606: 423-54). Биологические механизмы, участвующие в стимуляции иммунного ответа пробиотическими микроорганизмами и определенными клеточными компонентами этих микроорганизмов, были предметом исследования. Например, грамположительные бактерии имеют характерные макромолекулы, составляющие клеточную стенку, такие как липотейхоевая кислота (LTA). LTA может быть связана с иммуностимулирующей активностью (например, Bhakdi et al., Infect. Immun., 1991, 59: 4614-4620; Setoyama et al., J Gen Microbiol, 1985, 131 (9): 2501-2503; Cleveland et al., Infect Immun, 1996, 64(6): 1906-1912). См. также (Deininger et al., Clin Vaccine Immunol, 2007, 14(2): 1629-1633). Кроме того, пробиотические бактерии могут содержать разнообразные лиганды TLR с иммуномодулирующими характеристиками. Было обнаружено, что фрагменты клеточной стенки из различных бифидобактериальных штаммов стимулируют продукцию интерферона-гамма (IFN-γ) in vitro в мышиных спленоцитах (T. Ambrouche, "Contribution a l'etude du pouvoir immunomodulateur des bifidobacteries: Analyse in vitro et etude ex vivo des mecanismes moleculaires impliques," Ph.D. Thesis, Universite Laval, Quebec, 2005). Капсулы, изготовленные из фрагментов клеточной стенки в виде частиц определенных молочнокислых бактерий (Del-Immune V®, Pure Research Products, LLC, Colorado), также предназначены для стимуляции иммунной системы.
Однако прием внутрь пробиотических бактерий в живой или убитой форме или прием внутрь фрагментов клеточной стенки в виде частиц таких бактерий может не быть самым эффективным путем обеспечения иммуномодулирующего эффекта у индивидуумов. Например, живые клеточные экстракты могут содержать крупные белки и липопептиды, размер которых препятствует эффективной абсорбции индивидуумом, таким образом, ограничивая локальную концентрацию полезных молекул из пробиотических бактерий в организме. Условия внутри организма могут также разрушить активные бактериальные компоненты или иным образом модифицировать химические структуры этих компонентов, делая их неактивными. Риски, связанные с пероральным введением живых пробиотических микроорганизмов (Lactobacillus), включают бактериемию и сепсис (Lactobacillus Sepsis Associated With Probiotic Therapy, Pediatrics, Jan. 2005, 115 (1): 178-181). Следовательно, существует потребность в других средствах для обеспечения благоприятных эффектов пробиотических бактерий у нуждающихся в них индивидуумов.
Настоящее изобретение относится к экстрактам Lactobacillus, некоторые варианты осуществления которых могут проявлять высокую иммуномодулирующую активность. Например, варианты осуществления настоящего изобретения относятся к экстрактам из бактериальных штаммов, которые могут быть полезными в качестве нутрицевтиков или в качестве фармацевтических средств, в некоторых случаях для лечения инфекционных заболеваний, аллергии, респираторных расстройств и воспалительных патологических состояний, или действовать в качестве дополнения в связи с протоколом лечения. Настоящее изобретение также относится к композициям, содержащим экстракты, и способам получения экстрактов, например, с использованием сред, которые не создают риск прионовых заболеваний. Способы в соответствии с изобретением включают, например, лизис клеток в щелочных условиях, или в щелочных условиях с последующими кислотными условиями. В некоторых вариантах осуществления, экстракты по изобретению представляют собой растворимые экстракты, означая, что они не содержат значительных количеств твердого или представленного в виде частиц вещества. В некоторых вариантах осуществления, экстракты содержат химически модифицированные лиганды TLR. В некоторых вариантах осуществления, щелочная обработка может вызвать химическую модификацию клеточных материалов, включая лиганды TLR, компоненты клеточной стенки, белки, липотейхоевые кислоты, липопептиды и фосфолипиды.
Некоторые варианты осуществления изобретения могут включать экстракты, полученные из одного или более из следующих видов:
Lactobacillus fermentum, Lactobacillus rhamnosus, Lactobacillus plantarum, Lactobacillus johnsonii, Lactobacillus helveticus, Lactobacillus casei defensis, Lactobacillus casei ssp. casei, Lactobacillus paracasei, Lactobacillus bulgaricus, Lactobacillus paracasei, Lactobacillus acidophilus, Lactobacillus reuteri, Lactobacillus salivarius, Lactobacillus lactis и Lactobacillus delbrueckii.
В некоторых вариантах осуществления, экстракты содержат, по меньшей мере, один штамм из каждого из перечисленных выше видов бактерий, тогда как в других вариантах осуществления, один или более определенных штаммов из приведенного выше списка могут быть удалены или замещены одним или более других штаммов. Некоторые варианты осуществления настоящего изобретения включают экстракт, полученный из одного или более следующих бактериальных штаммов: Lactobacillus fermentum I-3929, Lactobacillus rhamnosus 71.38, Lactobacillus plantarum 71.39, Lactobacillus johnsonii 103782 и Lactobacillus helveticus 103146. Указанные выше штаммы депонированы в соответствии с Будапештским Договором. Каждый из Lactobacillus fermentum I-3929, Lactobacillus rhamnosus 71.38, Lactobacillus plantarum 71.39, Lactobacillus johnsonii 103782 и Lactobacillus helveticus 103146 депонирован в Национальной Коллекции Культур Микроорганизмов Института Пастера Collection Nationale de Culture des Microorganismes at the lnstitut Pasteur, 25 rue du Dr. Roux, 75724 Paris, France. Lactobacillus fermentum I-3929 была депонирована 27 февраля 2008 г. Другие штаммы находятся среди коллекций депозитария и могут быть получены контактом с депозитарием.
Настоящее изобретение также, наряду с другими аспектами, относится к штамму Lactobacillus fermentum I-3929, экстрактам, полученным из этого штамма, способам получения таких экстрактов и видам их применения. Этот штамм был получен предоставлением возможности этим штаммам из Lactobacillus plantarum и Lactobacillus fermentum подвергнуться хромосомному обмену, таким образом, получая новый штамм Lactobacillus. Было обнаружено, что экстракты, полученные из Lactobacillus fermentum I-3929, активны на нескольких моделях in vivo и in vitro, коррелирующих с инфекцией и иммунологическими расстройствами.
В некоторых вариантах осуществления, экстракт получен только из одного определенного бактериального штамма. Альтернативно, может использоваться более чем один штамм. В других вариантах осуществления, может добавляться один или более экстрактов из другого типа микроорганизма, например, бактериального вида, отличного от Lactobacillus.
Экстракты могут быть получены лизисом бактериальных клеток в определенных условиях после того как клетки выращиваются до подходящей концентрации в культуральной среде. В некоторых вариантах осуществления, бактерии выращиваются в среде, которая не создает риска связанных с прионами заболеваний или риска других заболеваний, которые могут передаваться посредством приема внутрь продуктов, полученных из сред на животной основе. Например, в некоторых вариантах осуществления для выращивания клеток используется среда на растительной основе, такая как среда на соевой основе.
Лизаты (т.е., продукты лизиса клеток) могут также фильтроваться для удаления нуклеиновых кислот и более крупных клеточных осколков, таких как нерастворимый или имеющий форму частиц материал. В некоторых вариантах осуществления, количество нуклеиновых кислот, присутствующих в экстрактах, составляет менее чем 100 мкг/мл. Следовательно, в некоторых вариантах осуществления полученный экстракт содержит растворимые молекулярные компоненты и не содержит значительных количеств нерастворимого или имеющего форму частиц материала.
Молекулы мембран и клеточной стенки, включая липопротеины, липопептиды, пептидогликаны, липополигосахариды, липотейхоевые кислоты и тейхоевые кислоты, могут быть растворены или суспендированы в экстрактах. Во время процесса лизиса, молекулы в клетках, такие как мембраны и клеточные стенки, могут стать химически модифицированными, например, расщепленными на более мелкие структуры, обработкой щелочью. Несмотря на такие химические модификации, варианты осуществления изобретения могут сохранять свою биологическую активность, по сравнению с цельными клетками, или такие варианты осуществления могут даже демонстрировать повышенную биологическую активность, по сравнению с цельными клетками.
Например, щелочная обработка может использоваться для лизиса клеток или может применяться к клеткам, которые ранее были лизированы другим способом. Во время процесса щелочной обработки в соответствии с некоторыми вариантами осуществления изобретения, L-аминокислоты, обнаруживаемые в натуральных белках и липопептидах, по меньшей мере частично рацемизированы в D-аминокислоты. D-аминокислоты могут оказывать благоприятное воздействие в отношении увеличения продолжительности эффективности экстрактов, поскольку они не подвергаются эффективному перевариванию в желудочно-кишечном тракте млекопитающих. D-аминокислоты могут также защитить более мелкие пептиды и белки от разрушения во время переваривания. Примеры D-аминокислот включают связанные с белком D-аминокислоты и в меньшей степени лизиналанин (de Vrese et al., J Nutrition, 2000, 2026-2031). Таким образом, антигенные молекулы в экстрактах, химически модифицированные во время лизиса для содержания D-аминокислот, могут оставаться в организме человека в течение более длительного времени, потенциально обеспечивая возможность более сильного иммуностимулирующего эффекта в некоторых вариантах осуществления.
В некоторых вариантах осуществления, процесс фильтрации может также повлиять на свойства полученных экстрактов, поскольку размер пор фильтра, и в некоторых случаях химические свойства поверхности фильтра (т.е., ее полярность) могут изменить тип материалов, которые удаляются и удерживаются. Например, в некоторых вариантах осуществления используется процесс фильтрации, предназначенный для удерживания представляющих интерес молекул, но удаления других молекул, таких как нуклеиновые кислоты или нерастворимые или имеющее форму частиц материалы.
Фильтрованные экстракты могут также подвергаться дальнейшей очистке органической экстракцией, органо-водной экстракцией, хроматографией, ультрацентрифугированием, ультрафильтрацией или их комбинацией.
Краткое описание чертежей
Фиг.1: Лиганды для семейства из 11 толл-подобных рецепторов (TLR), экспрессируемые организмом хозяина.
Фиг.2: Чертеж устройства для фильтрации в тангенциальном потоке (TFF) для получения бактериальных экстрактов после лизиса бактерий. На чертеже показаны две различные конфигурации для фильтров: параллельного типа, где все фильтры работают одновременно, и змеевикового типа, где фильтры сконфигурированы по серийному типу.
Фиг.3: Обобщенная корреляция между функциональными параметрами и потоком, указывающие области регулировки давления и регулировки переноса массы для способа фильтрации в тангенциальном потоке (TFF).
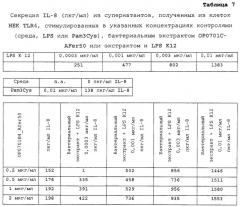
Фиг.4: Стимуляция клеток селезенки, культивированных в течение 48 ч в присутствии различных разведений лизатов AFer300, CFer300 и DFer300, и ARahr300, CRahr300 и DRahr300. После добавления 30 мкл/лунку раствора Alamar blue®, разведенного в соотношении 1:1, к среде для клеточной культуры, клетки далее инкубировали (a) 8,5 ч (первый эксперимент); (b) 24 ч (второй эксперимент). Показана средняя величина эмиссии при 590 нм ± стандартное отклонение культур в двух повторениях.
Фиг.5: Индукция продукции оксида азота (NO) у мышей, получавших лечение экстрактами Lactobacillus fermentum I-3929 и Lactobacillus rhamnosus 71.38, в (a) первом анализе, и (b) втором анализе. Результаты выражены в мкМ оксида азота (NO) в виде средней величины ± стандартное отклонение.
Фиг.6: Воздействие экстрактов по изобретению на гиперреактивность дыхательных путей (AHR), определенное плетизмографией всего тела (Emka) при увеличивающихся концентрациях вдыхаемого метахолина через один день после последней антигенной стимуляции. Результаты (средняя величина увеличенной паузы ± стандартная ошибка средней) показаны для животных из группы отрицательного контроля, получавших лечение солевым раствором с фосфатным буфером (PBS) (n=4), не леченых животных с антигенной стимуляцией LACK (в качестве группы положительного контроля, n=8), мышей, получавших лечение OM-1009A, с антигенной стимуляцией LACK (n=8), и мышей, получавших лечение OM-1009B, с антигенной стимуляцией LACK (n=7).
Детальное описание изобретения
Определения
Экстракт: Экстракт, как определено в настоящем описании, означает материал, полученный после лизиса одного или более бактериальных штаммов. В некоторых случаях, экстракт получают только из одного штамма, тогда как в других экстракт получают из смеси нескольких различных штаммов.
В некоторых случаях, экстракт представляет собой растворимый экстракт, означая, что он не содержит значительных количеств, представленных в виде частиц и нерастворимых материалов, таких как фрагменты в виде частиц или твердых клеточных стенок. Вместо этого, компоненты из клеточных стенок, органелл и клеточных мембран могут содержаться в экстрактах в той степени, в которой они растворены или суспендированы. Например, экстракт может быть обработан для удаления представленных в виде частиц и нерастворимых материалов, например, посредством фильтрации, центрифугирования или другой методики отделения.
Химический лизис: Это способ лизиса бактериальных клеток в основных, кислотных и/или осмотических условиях.
Лизат: Используемый в настоящем описании, этот термин означает экстракт бактерий, полученных в результате процедуры лизиса клеток.
Фильтрация: Процесс фильтрации, как описано в настоящем описании, означает пропускание экстракта или смеси экстрактов через один или более фильтров, таких как микрофильтры (т.е., микрофильтрацию) и/или ультрафильтры (т.е., ультрафильтрацию). Такая фильтрация может необязательно удалять 100% компонентов, для удаления которых она предназначена, но может, в некоторых вариантах осуществления, сделать экстракты по существу свободными от этих компонентов. В некоторых случаях, фильтрация повторяется в несколько прохождений или циклов.
Исходный pH: Этот термин означает pH, измеренный в начале процедуры, такой как лизис или фильтрация.
Сахариды: Сахарид, как определено в настоящем описании, включает моносахариды, дисахариды, а также более крупные сахариды, такие как линейные и разветвленные полисахариды. Сахариды также включают замещенные или химически модифицированные сахариды, такие как липополисахариды (LPS) и их химически модифицированные варианты.
Липопротеины: Этот термин относится к макромолекулам, которые включают и белковые или пептидные цепи, и липиды, например, белок или пептид, ковалентно связанный с липидом. Используемый в настоящем описании термин липопротеин также включает липопептиды.
Пептидогликаны: Этот термин относится к полимерам. Содержащим сахара и аминокислоты.
Липотейхоевая кислота (LTA): Этот термин относится к ассоциированной с поверхностью адгезионной амфифильной молекуле, присутствующей в грамположительных бактериальных штаммах.
Тейхоевая кислота: Этот термин относится к полимерам глицеринфосфата или рибитолфосфата, соединенных вместе посредством фосфодиэфирных связей.
D-аминокислоты: Этот термин относится к аминокислотам, которые существуют в правовращающих изомерных формах, в отличие от биосинтетически полученных L-аминокислот, которые существуют в левовращающих изомерных формах.
Рацемизация: Этот термин указывает, по меньшей мере, частичную химическую модификацию L-аминокислот в D-аминокислоты.
Среда, которая позволяет избежать риска основанных на прионах заболеваний, означает культуральную среду, используемую на любой стадии получения экстрактов, которые не содержат материалы, такие как сыворотка или мясные экстракты, взятые у животных, таких как коровы или овцы, или у любого другого животного, которое может передавать основанные на прионах заболевания. Примеры таких сред включают синтетические среды на растительной основе, а также среды с использованием лошадиной сыворотки или среды, содержащие материалы, взятые у видов животных, которые не передают прионовые заболевания. Примеры основанных на прионах заболеваний включают, например, губчатую энцефалопатию крупного рогатого скота, почесуху и болезнь Крейтцфельда-Якоба.
Не животная среда представляет собой среду на растительной основе (т.е., растительную) среду, такую как соевая среда и синтетическая среда.
Используемый в настоящем описании термин нутрицевтическая означает любую композицию, которая может оказывать оздоровительные эффекты у индивидуума после введения, где композиция, например, доступна для индивидуума без прописи врача.
Термин лечение, используемый в терапевтическом контексте в настоящем описании, означает и лечение текущих заболеваний и расстройств, а также, например, профилактику или защиту от развития новых заболеваний или расстройств.
Используемый в настоящем описании термин адъювант для характеристики вариантов осуществления изобретения, относится к вариантам осуществления изобретения, проводимых у индивидуума в сочетании с планом медицинского лечения.
Используемые в настоящем описании термины иммуномодуляция, иммуномодулирующий и тому подобные относятся к способности модифицировать иммунные ответы у индивидуума таким образом, который может оказывать оздоровительные эффекты, например, обеспечить противовоспалительный или иммуностимулирующий эффект.
Используемые в настоящем описании термины противовоспалительные и тому подобные относятся к иммуномодулирующим эффектам, служащим для уменьшения воспаления.
Используемые в настоящем описании термины иммуностимулирующие и тому подобные относятся к стимуляции иммунной системы.
Используемый в настоящем описании термин защитный иммунитет означает, что вариант осуществления изобретения применяется у индивидуума с тем, чтобы обеспечить защиту от последующей антигенной стимуляции инфекционным агентом или аллергеном. Как следствие, во время антигенной стимуляции уровень инфекционного агента или аллергена у индивидуума имеет достаточно низкую концентрацию с тем, чтобы не вызвать значительного ущерба здоровью индивидуума. Продолжительность времени, в течение которого эффективна такая защита от антигенной стимуляции, может быть ограничена, например, периодом в несколько часов, дней или недель.
Используемый в настоящем описании термин индивидуум означает любого животного индивидуума, включая млекопитающих индивидуумов, таких как люди и домашние животные. Домашние животные могут, например, включать млекопитающих, таких как собаки, кошки, лошади, свиньи, коровы, овцы, козы или другой скот, а также может включать не млекопитающих, таких как птицы, например, куры, утки, гуси, индейки и другие виды сельскохозяйственных птиц.
Понятно, что определенные бактериальные штаммы, идентифицированные в настоящем описании и используемые в изобретении, могут включать штамм, полученный из первоначального депозита, указанного в настоящем описании, или его генетического клона, включая штамм, который был повторно депонирован в более позднее время под другим депозитным кодовым названием, но который считается генетически таким же штаммом, как первоначально депонированный вариант.
Все числа, используемые в настоящем описании, являются приблизительными, с учетом ошибок, присущих их измерению, округления и цифр статистической значимости.
Получение экстрактов
Настоящее изобретение включает экстракт одного или более бактериальных штаммов Lactobacillus, где экстракт представляет собой растворимый экстракт, и где экстракт содержит химически модифицированные бактериальные молекулы.
Экстракты по настоящему изобретению могут быть получены, например, культивированием клеток с последующим сбором полученной биомассы, лизисом и очисткой. Для каждого штамма для получения достаточного количества материала, ферментационные культуры могут начинаться с лота рабочего посева с последующим внесением посевного материала в более крупные ферментационные контейнеры.
Используемые среды могут быть одинаковыми для каждого вида. В некоторых вариантах осуществления, для выращивания всех подлежащих использованию штаммов может применяться среда, которая избегает риска основанных на прионах заболеваний.
После ферментации полученная биомасса из одного штамма или из набора штаммов может быть инактивирована тепловой обработкой, концентрирована и заморожена. Следовательно, в некоторых вариантах осуществления исходным материалом, используемым для образования экстрактов, могут быть не подвергнутые лизису цельные клетки.
В других вариантах осуществления исходный материал, используемый для получения экстрактов, может представлять собой биомассу, полученную из клеток, уже, по меньшей мере, частично лизированных механически, ферментативно или химически. В еще одних вариантах осуществления, исходный материал может представлять собой фракцию таких предварительно лизированных клеток, такую как фракция, содержащая клеточные стенки.
В некоторых вариантах осуществления исходный материал обрабатывается щелочной средой, такой как состоящая из сильного основания, такого как гидроксид или другие сильные минеральные или органические основания. На этой стадии лизиса или обработки основанием, не лизированные клетки в исходном материале лизируются, тогда как в некоторых вариантах осуществления, клеточные компоненты могут быть химически модифицированы. Следовательно, в некоторых вариантах осуществления химически модифицированные бактериальные молекулы получаются обработкой основанием, такой как обработка сильным основанием одного или более бактериальных штаммов Lactobacillus, из которых получен экстракт (т.е., обработка основанием не лизированных клеток или компонентов или фракций из бактериальных клеток, как только что было объяснено).
В некоторых вариантах осуществления обработке основанием может быть подвергнута концентрация сухой массы биомассы от 2 до 90 г/л, например, от примерно 2 до примерно 80 г/л, или от примерно 3 до примерно 40 г/л, например, 3, 5, 10, 15, 20, 25, 30, 35, или 40 г/л, или даже от 5 до 50 г/л или другие диапазоны, ограниченные перечисленными выше концентрациями. В некоторых вариантах осуществления, обработке основание подвергаются от примерно 40 до примерно 80 г/л, например, 40, 50, 60, 70 или 80 г/л или другие диапазоны, ограниченные перечисленными выше концентрациями.
Сухая масса биомассы определяется в настоящем описании сухой массой материала в г на литр образца. Она может быть измерена сушкой образца в небольшой фарфоровой чашке примерно при 105°C до тех пор, пока она не достигнет постоянной массы.
Температура может составлять от 30 до 60°C, например, от 30 до 55°C, от 30 до 50°C, от 30 до 45°C, от 30 до 40°C или от 30 до 35°C. В некоторых вариантах осуществления, температура обработки основанием может составлять от 35 до 60°C, например, от 35 до 55°C, от 35 до 50°C, от 35 до 45°C или, например, от 35 до 40°C. В некоторых вариантах осуществления, температура обработки основанием может составлять 31°C, 32°C, 33°C, 34°C, 35°C, 36°C, 37°C, 38°C, 39°C или даже 40°C, или диапазоны, ограниченные перечисленными выше температурами.
Время обработки основанием может варьироваться от 2 часов до нескольких дней, например, 1, 2, 3, 4, 5 или даже 10 дней, или от 3 до 120 ч, или от 3 до 48 ч, например, 3, 5, 8, 15, 14, 16, 18, 20, 22, 24, 26, 28, 30, 36, 40, 44 или 48 ч, или от 15 до 120 ч, например, от 60 до 120 ч, например, 60, 72, 84, 96, 108 или 120 ч, или диапазонов, ограниченных перечисленными выше интервалами времени. Понятно, что эти диапазоны времени включают любое фракционное число дней, часов или минут в их пределах.
В некоторых вариантах осуществления, используется концентрация сильного основания от 0,001 N до 1,0 N, например, от 0,001 N до 0,6 N, или от 0,10 N до 0,8 N, или от 0,6 N до 1,0 N, или диапазон, начинающийся или заканчивающийся от 0,001, 0,002, 0,003 или 0,1 N, или от 0,1 N до 0,6 N, или диапазон, начинающийся или заканчивающийся от 0,6, 0,7, 0,8, 0,9, 1,0 или 1,0 N или другие диапазоны, ограниченные перечисленными выше концентрациями. В некоторых вариантах осуществления, используется такая концентрация основания. Чтобы достичь первоначальный pH больше чем 9,0, или pH больше чем 9,5, pH больше чем 10,0 и меньше чем 13,5, например, больше чем 11,5, больше чем 12,0, больше чем 12,5, больше чем 13,0 или от pH 9,0 до pH 13,5. В еще одних вариантах осуществления, может использоваться такая концентрация основания, чтобы, например, достичь исходный pH больше чем 10,0 и меньше чем 13,0 или от pH 9,0 до pH 13,0.
В некоторых вариантах осуществления, pH во время обработки основанием может быть снижен после экстракции растворимых компонентов. Например, исходный pH может представлять собой основный pH, такой как от pH 9,0 до pH 13,0, или от pH 9,5 до pH 12,5. Обработке основанием может быть предоставлена возможность продолжаться в течение определенного периода времени, например, от 3 до 120 ч, например, от 3 до 48 ч, или в течение периодов времени, перечисленных выше, при перечисленных выше температурах. Затем, в некоторых вариантах осуществления, возможно придание кислотности pH добавлением, например, хлористоводородной кислоты с тем, чтобы получить pH от 2,0 до 4,5, или pH от 2,5 до 4,5 или pH от 2,5 до 4,0, например, 2,5, 3,0, 3,5, 4,0 или в диапазоне, ограниченном любыми из величин pH, перечисленных выше. Вторая обработка при низком pH может проводиться при температуре от 30 до 60°C, от 35 до 55, или от 35 до 45°C, например, 35°C, 36°C, 37°C, 38°C, 39°C, 40°C, 41°C, 42°C, 43°C, 44°C или даже 45°C. Время кислотной обработки может варьироваться от 1 часа до нескольких часов или до 72 ч, например, от 1 часа до 24 ч. или от 1 часа до 6 ч, или от 3 ч до 48 ч, или от 3 ч до 24 ч. или от 4 до 72 ч, или даже от 24 ч до 72 ч, или в любом диапазоне времени, ограниченном перечисленными выше периодами времени.
В некоторых вариантах осуществления изобретения щелочная обработка выполняется на бактериальной биомассе, содержащей, например, материал из Lactobacillus fermentum, имеющий сухую массу биомассы от 10 г/л до 40 г/л. В других вариантах осуществления изобретения щелочная обработка выполняется на бактериальной биомассе, содержащей смесь штаммов Lactobacillus, и имеющей сухую массу биомассы от 10 г/л до 40 г/л. В таких вариантах осуществления, щелочная обработка может выполняться при концентрации иона гидрохлорида от 0,025 N до 0,25 N или при pH от 9,5 до 12,5 при температуре от 35 до 45°C в течение периода времени от 3 ч до 48 ч. В некоторых вариантах осуществления, щелочная обработка выполняется на бактериальной биомассе, содержащей материал из одного или более штаммов Lactobacillus при концентрации иона гидрохлорида от 0,025 N до 0,20 N, от 0,025 до 0,15 N, от 0,025 до 0,10 N, от 0,05 N до 0,25 N, от 0,05 N до 0,20 N, от 0,05 до 0,15 N, от 0,05 N до 0,10 N, от 0,10 N до 0,25 N, от 0,10 N до 0,20 N, от 0,10 N до 0,15 N, от 0,15 N до 0,25 N, от 0,15 N до 0,20 N или даже от 0,20 N до 0,25 N. В таких вариантах осуществления, pH может, например, составлять от 9,5 до 12,0, от 9,5 до 11,5, от 9,5 до 11,0, от 9,5 до 10,5, от 9,5 до 10,0, от 10,0 до 12,5, от 10,0 до 12,0, от 10,0 до 11,5, от 10,0 до 11,0, от 10,0 до 10,5, от 10,5 до 12,5, от 10,5 до 12,0, от 10,5 до 11,5, от 10,5 до 11,0, от 11,0 до 12,5, от 11,0 до 12,0, от 11,0 до 11,5, от 11,5 до 12,5, от 11,5 до 12,0 или даже pH от 12,0 до 12,5. Время щелочной обработки для таких вариантов осуществления может составлять от 3 ч до 36 ч, от 3 ч до 24 ч, от 3 ч до 18 ч, от 3 ч до 12 ч, от 3 ч до 6 ч, от 6 ч до 48 ч, от 6 ч до 36 ч, от 6 ч до 24 ч, от 6 ч до 18 ч, от 6 ч до 12 ч, от 6 ч до 8 ч, от 8 ч до 48 ч, от 8 ч до 36 ч, от 8 ч до 24 ч, от 8 ч до 18 ч, от 8 ч до 12 ч, от 12 ч до 48 ч, от 12 ч до 36 ч, от 12 ч до 18 ч, от 18 ч до 48 ч, от 18 ч до 36 ч, от 18 ч д 24 ч, от 24 ч до 48 ч, от 24 ч до 36 ч или от 36 ч до 48 ч. Щелочная обработка может выполняться в течение любых периодов времени, граничащие с указанными выше диапазонами, например, 3, 6, 8, 12, 18, 24, 36 или даже 48 ч. такие условия могут обеспечить умеренную щелочную обработку.
В других вариантах осуществления 10 г/л и 40 г/л сухой массы биомассы из одного или более штаммов Lactobacillus могут быть подвергнуты воздействию концентрации иона гидроксида от 0,15 N до 0,50 N или pH от 11,5 до 13,5, при температуре от 35 до 45°C в течение периода времени от 15 ч до 120 ч. Например, в некоторых вариантах осуществления концентрация гидроксида может составлять от 0,15 N до 0,45 N, от 0,15 N до 0,40 N, от 0,15 N до 0,35 N, от 0,15 N до 0,30 N, от 0,15 N до 0,25 N, от 0,15 N до 0,20 N, от 0,20 N до 0,50 N, от 0,20 N до 0,40 N, от 0,20 N до 0,30 N, от 0,25 N до 0,50 N, от 0,30 N до 0,50 N, от 0,30 N до 0,40 N или от 0,40 N до 0,50. В таком варианте осуществления pH может составлять, например, от 11,5 до 13,0, от 11,5 до 12,5, от 11,5 до 12,0, от 12,0 до 13,5, от 12,0 до 13,0, от 12,0 до 12,5, от 12,5 до 13,5, от 12,5 до 13,0, от 13,0 до 13,5. Период времени для щелочной обработки может составлять от 15 ч до 100 ч, от 15 ч до 90 ч, от 15 ч до 75 ч, от 15 ч до 60 ч, от 15 ч до 48 ч, от 15 ч до 36 ч, от 24 ч до 120 ч, от 24 ч до 100 ч, от 24 ч до 90 ч, от 24 ч до 75 ч, от 24 ч до 60 ч, от 24 ч до 48 ч, от 36 ч до 120 ч, от 36 ч до 100 ч, от 36 ч до 90 ч, от 36 ч до 75 ч, от 36 ч до 60 ч, от 36 ч до 48 ч, от 48 ч до 120 ч, от 48 ч до 100 ч, от 48 ч до 90 ч, от 48 ч до 75 ч, от 48 ч до 60 ч, от 60 ч до 120 ч, от 60 ч до 100 ч, от 60 ч до 90 ч, от 60 ч до 75 ч, от 75 ч до 120 ч, от 75 ч до 100 ч, от 75 ч до 90 ч, от 90 ч до 120 ч или, например, от 100 до 120 ч. Периоды времени, также предусмотренные для щелочной обработки в таких вариантах осуществления, включают 15, 24, 48, 60, 75, 90, 100 и 120 ч. Такие условиях могут обеспечить обработку сильной щелочью.
В других вариантах осуществления от 10 г/л до 40 г/л исходной сухой массы биомассы могут обрабатываться концентрацией гидроксида от 0,025 N до 0,25 N или pH от 9,5 до 12,5, при температуре от 35 до 45°C в течение периода времени от 3 ч до 48 ч. Затем pH доводиться до уровня от 2,5 до 4,0 добавлением кислоты, такой как хлористоводородная кислота (HCl), что составляет кислотную обработку. Кислотная обработка может выполняться при температуре от 35 до 45°C в течение периода времени от 1 ч до 24 ч. Например, в таких вариантах осуществления, щелочная обработка бактериальной биомассы, содержащей один или более штаммов Lactobacillus может выполняться при концентрации гидроксида от 0,025 N до 0,20 N, от 0,025 до 0,15 N, от 0,025 до 0,10 N, от 0,05 N до 0,25 N, от 0,05 N до 0,20 N, от 0,05 до 0,15 N, от 0,05 N до 0,10 N, от 0,10 N до 0,25 N, от 0,10 N до 0,20 N, от 0,10 N до 0,15 N, от 0,15 N до 0,25 N, от 0,15 N до 0,20 N или даже от 0,20 N до 0,25 N. Во время щелочной обработки в таких вариантах осуществления pH может, например, составлять от 9,5 до 12,0, от 9,5 до 11,5, от 9,5 до 11,0, от 9,5 до 10,5, от 9,5 до 10,0, от 10,0 до 12,5, от 10,0 до 12,0, от 10,0 до 11,5, от 10,0 до 11,0, от 10,0 до 10,5, от 10,5 до 12,5, от 10,5 до 12,0, от 10,5 до 11,5, от 10,5 до 11,0, от 11,0 до 12,5, от 11,0 до 12,0, от 11,0 до 11,5, от 11,5 до 12,5, от 11,5 до 12,0 или даже pH от 12,0 до 12,5. Время щелочной обработки для таких вариантов осуществления может составлять от 3 ч до 36 ч, от 3 ч до 24 ч, от 3 ч до 18 ч, от 3 ч до 12 ч, от 3 ч до 6 ч, от 6 ч до 48 ч, от 6 ч до 36 ч, от 6 ч до 24 ч, от 6 ч до 18 ч, от 6 ч до 12 ч, от 6 ч до 8 ч, от 8 ч до 48 ч, от 8 ч до 36 ч, от 8 ч до 24 ч, от 8 ч до 18 ч, от 8 ч до 12 ч, от 12 ч до 48 ч, от 12 ч до 36 ч, от 12 ч до 18 ч, от 18 ч до 48 ч, от 18 ч до 36 ч, от 18 ч до 24 ч, от 24 ч до 48 ч, от 24 ч до 36 ч, или от 36 ч до 48 ч. Щелочная обработка может выполняться в течение любого периода времени, граничащего с указанными выше диапазонами, например, 3, 6, 8, 12, 18, 24, 36 или даже 48 ч. Затем pH может доводиться до уровня от 2,5 до 3,5, от 2,5 до 3,0, от 3,0 до 4,0, от 3,0 до 3,5 или от 3,5 до 4,0 добавлением кислоты для кислотной обработки после щелочного лизиса. Кислотная обработка может выполняться в течение периода времени от 1 ч до 18 ч, от 1 ч до 12 ч, от 1 ч до 6 ч, от 1 ч до 3 ч, от 3 ч до 24 ч, от 3 ч до 18 ч, от 3 ч до 12 ч, от 3 ч до 6 ч, от 6 ч до 24 ч, от 6 ч до 18 ч, от 6 ч до 12 ч, от 12 ч до 24 ч, от 12 ч до 18 ч, от 18 ч до 24 ч. Периоды времени, также предусмотренные для кислотной обработки, включают 1, 3, 6, 12, 18 и 24 ч.
Лизаты, полученные после описанной выше основной обработки, могут затем очищаться центрифугированием и/или фильтрацией, например, для удаления представленных в виде частиц и нерастворимых компонентов. Например, лизаты могут центрифугироваться при 9000 х гравитацию с последующим одним или более циклами фильтрации через фильтр с размером пор 0,2 мкм. В некоторых случаях могут использоваться последовательные циклы фильтрации через фильтры с большим размером пор с последующей фильтрацией через фильтр с размером пор 0,2 мкм. Могут также использоваться способы ультрафильтрации для содействия экстракции растворимых материалов из экстракта, например, рециркуляцией пермеата ультрафильтрации для дальнейшей микрофильтрации.
В некоторых вариантах осуществления способ фильтрации может применяться для фильтрации лизатов и для экстракции растворимых молекул из более крупных клеточных осколков (фиг.2). См., например, руководство Separations Technology, Pharmaceutical and Biotechnology Applications, Wayne P. Olson, Editor, lnterpharm Press, Inc., Buffalo Grove, IL, U.S.A., p.126-135 - ISBN:0-935184-72-4. В начале такого процесса, разбавленный бактериальный лизат может храниться в первом резервуаре. Например, при TFF экстракт может быть подвергнут и фильтрации и через микрофильтр, и через ультрафильтр. Например, включается петля микрофильтрации (MF), и производится прокачка продукта. Полученный ретентат MF подвергается рециркуляции, в то время как пермеат MF переносится во второй резервуар.
После достижения подходящей степени концентрации, включается петля ультрафильтрации (UF). Пермеат UF может подвергаться рециркуляции назад в первый резервуар для непрерывной экстракции солюбилизированных экстрактов из лизата, в то время как ретентат UF хранится во втором резервуаре. Во время непрерывной экстракции, объемы в резервуарах 1 и 2 могут подбираться регулировкой скоростей потока пермеатов микрофильтрации и ультрафильтрации.
Могут выполняться несколько таких циклов экстракции, или TFF, или другим способом фильтрации. В вариантах осуществления, в кото