Способ получения концентрата хлорофиллов из ламинарии сахаристой, обладающего антимикробным и ранозаживляющим действием
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к фармацевтической промышленности, касается получения концентрата хлорофиллов из ламинарии сахаристой. Способ получения концентрата хлорофиллов из измельченной ламинарии сахаристой путем ее экстракции этиловым спиртом в защищенном от света месте трехкратно, далее отделяют экстракт от шрота, извлечения объединяют, отгоняют экстрагент, к полученному остатку добавляют воду, фильтруют через бумажный фильтр, остаток на фильтре промывают двумя порциями воды, растворяют в 96% этиловом спирте, сумму хлорофиллов растворяют в стерильном оливковом масле до получения 25% концентрации суммы хлорофиллов, остаток 96% спирта этилового отгоняют под вакуумом, способ проводят при определенных условиях. Концентрат хлорофиллов, полученный вышеописанным способом, характеризуется повышенной чистотой и стабильностью действующих веществ. 7 ил., 1 табл.
Реферат
Изобретение относится к медицине, а именно к фармацевтической промышленности. Масляный концентрат хлорофиллов из ламинарии сахаристой, обладающий антимикробным и ранозаживляющим действием, может быть использован для лечения ожоговых повреждений кожных покровов и для приготовления лекарственных форм для наружного применения на его основе.
Аналогом получения данного концентрата хлорофиллов является «Способ комплексной переработки сухого сырья водорослей» /Пат. №2142812, A61K 35/80, B01D 11/02. публ. 20.12.1999/ при котором проводят экстракцию водно-спиртовой смесью сухого сырья водорослей. Осуществляют отделение экстракта от шрота, выделение маннита и минерального концентрата из водно-спиртовой фазы, а альгината из шрота. При этом сухое сырье экстрагируют одновременно маслом или жиром и водно-спиртовой смесью при соотношении компонентов: сырье 1, масло или жир 3-40, спирт этиловый 1,5-15, вода 1-30. Затем выделяют масляную или жировую фазу. Однако, масляная фаза содержит помимо хлорофиллов, каротиноиды и стерины, хлорофиллы экстрагируются не полностью, так как наилучшим экстрагентом для исчерпывающей экстракции сырья является спирт этиловый 96% / Wasmund N. Optimising the storage and extraction of chlorophyll samples / N.Wasmund, I.Topp, D.Schories // J.Oceanologia. - 2006. - Vol.48. - N.1. - P.125-144./
Известен «Способ переработки бурых водорослей» (Некрасова В.Б., Никитина Т.В., Курныгина В.Т., Белозерских О.А. Патент РФ №2132622; A23L 1/0532, A61K 35/80), который заключается в следующем: сухие слоевища водорослей экстрагируют 80-90% спиртом (или органическим растворителем с числом углеродных атомов от 1 до 6) при температуре кипения растворителя в течение 4 часов. Из полученного спиртового экстракта производят отгонку спирта при температуре 80-90°С до водного остатка и отделяют липидные фракции, содержащие в том числе, хлорофиллы. Данный способ является наиболее близким к предлагаемому и поэтому взят нами за прототип. Недостатками этого способа являются: значительная степень деградации хлорофиллов как в процессе экстракции кипящим спиртом в течении 4 часов, так и при у паривания спиртового экстракта за счет замещения катионов магния в порфириновом ядре протонами водородов, сопровождающегося изменением цвета экстракта и потерей фармакологической активности (Kalinowski P.M. / Stabilisation of chlorophyll using medium chain triglyceride oils / P.M. Kalinowski // Pat. WO / 2003/002133 Prior. Dat. 0115982.1 29.06.2001 G.B. A61K 47/44, A61K 47/14 (2006.01). Кроме того, однократная кратковременная экстракция также не позволяет полностью извлечь хлорофиллы из сырья, а нагревание смеси не оказывает влияния на интенсификацию процесса экстрагирования / Wasmund N. Optimising the storage and extraction of chlorophyll samples / N. Wasmund, I. Topp, D. Schories // J. Oceanologia. - 2006. - Vol.48. - N.1. - P.125-144./
Задачей данного изобретения является разработка способа переработки воздушно-сухого сырья ламинарии сахаристой с целью повышения степени чистоты продукта - суммы хлорофиллов (a, с1 и с2) для дальнейшего получения на его основе стерильных лекарственных форм, пригодных для лечения раневых поверхностей различной этиологии.
Поставленная задача реализуется исчерпывающей экстракцией суммы хлорофиллов трехкратным экстрагированием спиртом этиловым 96%. Органическое извлечение подвергается дополнительной очистке. В отличие от «Способа переработки бурых водорослей» экстракцию проводят не при 80°C (температура кипения спирта этилового 78,15°C), а при 20°C в защищенном от света месте, отгонку растворителя проводят при 30°С, проводится дополнительная очистка от водорастворимых примесей; полученную сумму хлорофиллов растворяют в стерильном оливковом масле до получения 25% концентрации.
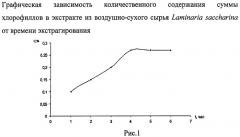
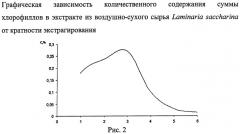
Поставленная задача реализуется предлагаемым способом, который заключается в следующем: воздушно-сухое сырье ламинарии сахаристой измельчают до размера частиц, проходящих через сито с диаметром отверстий 0,5 мм. К измельченному сырью добавляют спирт этиловый 96% в соотношении 1:10. Процесс экстрагирования проводят в плотно укупоренных сосудах при 20°C в защищенном от света месте в течении четырех часов при периодическом перемешивании смеси. Полученный экстракт декантируют. К растительному сырью добавляют новую порцию экстрагента. Процесс повторяют трижды. После последней экстракции растительный остаток отжимают, пропуская через ватно-марлевый пресс. Степень измельчения сырья, соотношение экстрагента и сырья, время и кратность экстрагирования были подобраны экспериментально. Количественное содержание суммы хлорофиллов в экстрактах определяли методом УФ спектрофотометрии относительно спирта этилового 96%. Полученные результаты подвергались статистической обработке, представлены на рис.1-4 в виде графической зависимости. Приведенные графики свидетельствуют, что подобранные условия экстрагирования обеспечивает исчерпывающую экстракцию суммы хлорофиллов из воздушно-сухого сырья Laminaria saccharina. Полученные органические извлечения объединяют и отгоняют растворитель под вакуумом при 30°C в защищенном от света месте. К полученному остатку добавляют воду в соотношении 1:10 и образовавшуюся смесь фильтруют через бумажный фильтр - очистка от водорастворимых примесей. Остаток на фильтре промывают еще двумя порциями воды. Остаток на фильтре распределяют тонким слоем и подсушивают при комнатной температуре в защищенном от света месте в течение 2 часов. Остаток на фильтре растворяют в спирте этиловом 96% в соотношении 1:0,5. Концентрацию суммы хлорофиллов определяют методом УФ-спектрофотометрии в кварцевых кюветах с толщиной слоя 1 см относительно растворителя в области 200 нм - 700 нм с шагом дискретизации 1 нм (рис.5). Контроль деструкции хлорофиллов проводят, рассчитывая значение отношений оптической плотности при 415 нм к значению оптической плотности раствора при 670 нм (А415/А670), которое не должно превышать 2,2 (Фомин В.В. / Способ комплексной переработки сухого сырья водорослей / В.В.Фомин, В.А.Вайнштейн, И.Е. Каухова, Ю.А. Лимаренко // Пат РФ, Заяв. 98107768/14. - Опубл 20.12.1999.). Концентрацию суммы хлорофиллов рассчитывают по общепринятым формулам формулам (Lichtenthaler H.K. / Chlorophylls and carotenoids, the pigments of photosynthetic biomembranes / H.K. Lichtenthaler // J. Met. Enzym. - 1987. - Vol.148. - P.350-382).
К экстракту добавляют стерилизованное оливковое масло до получения 25% концентрации суммы хлорофиллов, остаток спирта этилового 96% отгоняют под вакуумом при 30°С.
Так как растительные масла содержат хлорофиллы а и b, полученную концентрацию смеси хлорофиллов снова определяют спектрофотометрически (Jeffrey S.W. New Spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae, and natural phytoplankton /S.W.Jeffrey, G.F.Humphrey // J.Biochem. Physiol. Plants. - 1975. - N167. - P.191-194).
Существенным отличительным признаком предлагаемого изобретения от прототипов является исчерпывающая экстракция сырья, предотвращение деградации хлорофиллов в процессе экстрагирования и отгонки растворителя под вакуумом при 30°С, получение стерильного 25% концентрата суммы хлорофиллов в масле оливковом, обеспечивающем стабильность действующих веществ, возможность использования в качестве лекарственного средства как самого концентрата, так и получения лекарственных форм на его основе.
С целью определения оптимальной концентрации, обеспечивающей антибактериальный эффект, проводили микробиологические исследования в опытах in vitro на примере динамики ингибиции роста S.aureus, так как при бактериологическом исследовании отделяемого из патологических очагов, локализующихся на коже, золотистый стафилококк в монокультуре выделяется в 79,9-90,8% (Кириченко И.М. / Современные подходы к терапии инфекционных заболеваний кожи / И.М. Кириченко // Ж. Consilium medicum. - 2006. - Т.8. - №1). Из тестовых культур свежевыделенного при гнойно-воспалительном процессе S.aureus и штамма S.aureus ATCC 25923 (США) готовили инокулюм - бактериальную взвесь стафилококка на стерильном физиологическом растворе и доводили до мутности 0,5 по Мак-Фарланду (1,5×108 КОЕ/мл). Стерильной пипеткой переносили стандартную взвесь микроорганизма в количестве 0.1 мл в пробирки, содержащие одинаковое количество (0,1 мл) масляного концентрата хлорофиллов с концентрациями: 0,05%, 0,10%, 0,15%, 0,20%, 0,25%, 0,30%, 0,35%, 0,40%, 0,45% и 0,5% суммы хлорофиллов. Пробирки интенсивно встряхивали в течении 30 сек. Инокуляцию проводили в момент приготовления инокулюма (взвесь №1), далее через 2 часа (взвесь №2), 4 часа (взвесь №3), 6 часов (взвесь №4), и 24 часа (взвесь №5), в чашки Петри на твердую питательную среду - 5% кровяной агар. С помощью микропипетки наносили 0,1 мл взвеси микроорганизма с масляным концентратом хлорофиллов на поверхность питательной среды и равномерно распределяли стерильным шпателем. Инкубировали при температуре 37°С в течении 20-24 часов. После инкубации определяли интенсивность роста S.aureus. На рисунке 6, показан процесс замедления роста S.aureus в течение 24 часов под воздействием: 1 - 0,05%; 2 - 0,10%; 3 - 0,15%; 4 - 0,20%; 5 - 0,25% масляного концентрата хлорофиллов. Таким образом, установлено, что подавление роста исследуемых штаммов достигается применением 0,25% концентрации суммы хлорофиллов.
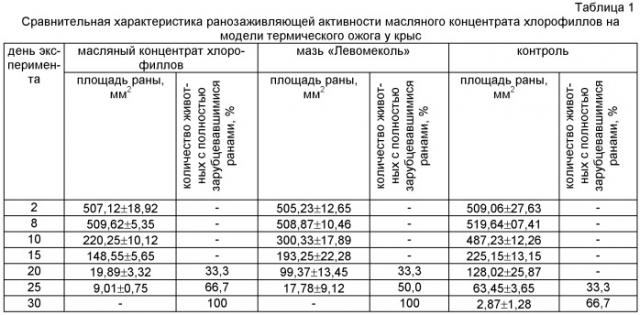
Определение ранозаживляющей активности полученного масляного концентрата хлорофиллов проводили на модели термического ожога (Болтовскоая В.В. Патоморфология раневого процесса в зоне глубокого ожога кожи в условиях применения низкоинтенсивного электромагнитного излучения / В.В. Болтовская // автореф. канд. мед. наук. - Саратов. - 2006. - С.9-10) в сравнении мазью «Левомеколь», как эффективного и часто используемого в комбустиологии средства (Алексеев А.А. / Микробиологическая оценка эффективности современных антимикробных препаратов для местного лечения ожоговых ран / А.А. Алексеев, А.Э. Бобровников, Р.П. Терехова, М.Г. Крутиков // Науч.-практ. Ж. Комбустиология. - -2010. - №5). Эксперимент проводили на белых беспородных крысах самцах массой 200,0±20,0 г. Экспериментальный ожог III Б степени площадью 6% от поверхности тела получали следующим образом: у крыс под эфирным наркозом тщательно выбривали кожу. Операционное поле обрабатывали спиртом этиловым 70°. Плоскодонную стеклянную колбу с диаметром дна 5 см, наполняли водой температурой 95°C, прикладывали к выбритому участку кожи на 35 секунд. Такое воздействие вызывало у крыс развитие коагуляционного некроза, распространяющегося на все слои кожи. Ожоговая рана формировалась на вторые сутки от начала опыта (Удост. рац. предлож. №400 от 7.04.2004). В экспериментальных и контрольной группах было по шесть животных, которых содержали в отдельных клетках на обычном рационе и свободном доступе к воде. Лечение начинали на вторые сутки после воспроизведения ожогов до полного заживления ран. Течение раневого процесса оценивали по определению размеров и сроков заживления ран (рис.7). Максимальная площадь раны в эксперименте была зафиксирована на восьмые сутки после нанесения ожога. Площадь раны определяли путем ее обведения на стерильной целлофановой пленке с последующим перенесением трафарета на миллиметровую бумагу. Измерения повторяли через равные промежутки времени. Процент уменьшения площади раневой поверхности вычисляли по формуле:
ΔS = (S − S n ) ⋅ 100 S ⋅ t ,
где ΔS искомая величина, S величина площади раны при предшествующем измерении, Sn величина площади раны в настоящий момент, t число дней между измерениями (Кузин М.И. Раны и раневая инфекция. / М.И. Кузин // М.: «Медицина». - 1990. - 258 с.). Полученные данные обрабатывали статистически, используя критерий Стьюдента (Государственная фармакопея СССР, одиннадцатое изд., вып.1 // М.: «Медицина». - 1987. - С.199-251). В ходе эксперимента фиксировали процент животных в группах с полностью зарубцевавшимися ранами (табл.1).
В ходе проведенных исследований подтверждена антимикробная, ранозаживляющая активность масляного концентрата хлорофиллов из ламинарии сахаристой. При сопоставлении ранозаживляющего эффекта исследуемых композиций установлено, что при применении масляного концентрата хлорофиллов происходит статистически значимое уменьшение площади раны на 49% по сравнению с группой животных, леченных мазью «Левомеколь» и на 86% - с контрольной группой на 25 сутки после нанесения ожоговой травмы.
В ходе анализа научно-технической и патентной документации установлено, что предлагаемый масляный концентрат хлорофиллов из ламинарии сахаристой, обладающий антимикробной и ранозаживляющей активностью, отличается от ранее опубликованных материалов и соответствует критерию «изобретательский уровень».
Краткое описание чертежей
Рис.5 - Спектр концентрата хлорофиллов из Laminaria saccarina в спирте этиловом 96%
Рис.6 - Определение антимикробной активности масляного концентрата хлорофиллов различной концентрации на примере динамики ингибиции роста S.aureus
Рис.7 - Динамика заживления раны на модели термического ожога у крыс
Список литературы
1. Алексеев А.А. / Микробиологическая оценка эффективности современных антимикробных препаратов для местного лечения ожоговых ран / А.А. Алексеев, А.Э. Бобровников, Р.П. Терехова, М.Г. Крутиков // Науч.-практ. Ж. Комбустиология. - 2010. - №5
2. Болтовская В.В. Патоморфология раневого процесса в зоне глубокого ожога кожи в условиях применения низкоинтенсивного электромагнитного излучения / В.В. Болтовская // автореф. канд. мед. наук. - Саратов. - 2006. - С.9-10
3. Государственная фармакопея СССР, одиннадцатое изд., вып.1 // М.: «Медицина». - 1987. - С.199-251
4. Кириченко И.М. / Современные подходы к терапии инфекционных заболеваний кожи / И.М. Кириченко // Ж. Consilium medicum. - 2006. - Т.8. - №1
5. Кузин М.И. Раны и раневая инфекция. / М.И. Кузин // М.: «Медицина». - 1990. - 258 с.
6. Некрасова В.Б., Никитина Т.В., Курныгина В.Т., Белозерских О.А. Патент РФ №2132622; A23L 1/0532, A61K 35/80
7. Способ комплексной переработки сухого сырья водорослей Патент №2142812, A61K 35/80, B01D 11/02. публ. 20.12.1999/
8. Фомин В.В. / Способ комплексной переработки сухого сырья водорослей / В.В.Фомин, В.А. Вайнштейн, И.Е. Каухова, Ю.А. Лимаренко // Пат РФ, Заяв. 98107768/14. - Опубл 20.12.1999.
9. Jeffrey S.W. New Spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae, and natural phytoplankton / S.W. Jeffrey, G.F. Humphrey // J. Biochem. Physiol. Plants. - 1975. - №167. - P.191-194
10. Kalinowski P.M. / Stabilisation of chlorophyll using medium chain triglyceride oils / P.M. Kalinowski // Pat. WO/2003/002133 Prior. Dat. 0115982.1 29.06.2001 G.B. A61K 47/44, A61K 47/14 (2006.01)
11. Lichtenthaler H.K. / Chlorophylls and carotenoids, the pigments of photosynthetic biomembranes / H.K. Lichtenthaler // J. Met. Enzym. - 1987. - Vol.148. - P.350-382
12. Wasmund N. Optimising the storage and extraction of chlorophyll samples / N. Wasmund, I. Topp, D. Schories // J. Oceanologia. - 2006. - Vol.48. - №.1. - P.125-144.
Способ получения концентрата хлорофиллов из измельченной ламинарии путем ее экстракции 96%-ным этиловым спиртом при 20°C, отличающийся тем, что экстрагируют ламинарию сахаристую в защищенном от света месте трехкратно при соотношении сырья к экстрагенту 1:10 в течение 4-х ч, отделяют экстракт от шрота, извлечения объединяют, отгоняют экстрагент под вакуумом при 30°C в защищенном от света месте, к полученному остатку добавляют воду при соотношении 1:10, фильтруют через бумажный фильтр, остаток на фильтре промывают водой двумя порциями воды, растворяют в 96%-ном этиловом спирте в соотношении 1:0,5, сумму хлорофиллов растворяют в стерильном оливковом масле до получения 25% концентрации суммы хлорофиллов, остаток 96%-ного спирта этилового отгоняют под вакуумом при 30°С.