Биокомпозиты и способы их получения
Иллюстрации
Показать всеИзобретение относится к области медицины, конкретно к искусственным биоматериалам, методам их производства и использования. Описаны биополимеры и биокомпозиты на основе коллагена. Для получения ориентированного фибриллярного биополимерного материала готовят раствор геля фибриллярного биополимера в жидкокристаллической фазе, наносят этот раствор равномерным слоем на подложку и высушивают слой ориентированием фибриллярного биополимера. В случае необходимости биополимер снимают с подложки в виде пленки. Для получения фибриллярного биополимерного волокна берут ленту ориентированного биополимерного материала и погружают в раствор, затем извлекают ее из раствора таким образом, что биополимерный материал сворачивается в волокно на границе воздуха и жидкости. Техническим результатом его использования является упрощение и удешевление способа получения ориентированных биополимерных материалов, повышение технологичности, повышение биосовместимости таких материалов с живыми тканями. 4 н. и 32 з.п. ф-лы, 4 табл., 14 ил., 2 пр.
Реферат
Изобретение относится к области искусственных биоматериалов, методов их производства и использования. В частности, настоящее изобретение связано с биополимерами и биокомпозитами на основе коллагена
Коллагеновые гели, повязки, губки и волокна часто используются в качестве носителей стволовых клеток. Коллаген является естественным белком, встречающимся во многих тканях организма. Он обеспечивает прочность самих тканей, а также формирует структуры для прикрепления, миграции и размножения клеток. Однако коллагеновые гели и распыленный коллаген не обладают достаточной прочностью и такие структуры распадается в тканях при создании усилий. Поэтому они плохо подходит для поддержания роста клеток в определенных участках.
Коллаген может быть выделен в чистом виде, из некоторых тканей, как раствор белка, из которого затем формируют коллагеновые волокна. Обычно структура коллагена в волокнах отличается от структуры в живых тканях. Это также ограничивает его применение в медицине.
Повреждения тканей сердца, поперечно-полосатых мышц, кожи, костей, хряща, позвоночника и т.д., часто прогрессируют, приводя к дальнейшему распаду окружающей ткани и увеличению области повреждения. Все это сильно затрудняет нормальное функционирование органов. В свете современных представлений, введение в область повреждения стволовых клеток, может предотвратить дальнейший распад или даже способствовать восстановлению поврежденной области. На практике, доклинические и клинические исследования показали улучшение сердечной функции, после введения мезенхимальных стволовых клеток в область повреждения. Однако эти же исследования продемонстрировали и то, что значительная часть введенных клеток, выносится из области введения, а большинство оставшихся клеток в скором времени умирают. Таким образом, существует необходимость создания структур, позволяющих доставлять клетки различных типов в определенные участки поврежденных тканей и обеспечивать их выживание и рост. Однако физико-химические свойства разных тканей существенно различаются (например, сердечные и поперечно-полосатые мышцы и кожа или спинной мозг). Следовательно структура для доставки должны обладать достаточным потенциалом для фиксации клеток в определенных тканях и не вызывать изменений последних в связи с плохой совместимостью их свойств. Это требует материалов, физические свойства которых соответствуют тканям, в которых они будут использованы. Также, клеткам требуются определенные условия для их выживания, миграции и функционирования по восстановлению ткани. И так, лечение поврежденных тканей может быть улучшено новыми средствами, доставляющими и поддерживающими стволовые и другие клетки в определенных местах, и позволяющие тем выживать и участвовать в восстановлении поврежденной ткани.
Повреждения сухожилий и связок относятся к наиболее распространенным проблемам взрослого населения, требующим медицинского вмешательства. В 2000 году в США было проведено около 175000 восстановлений передней крестообразной связки, стоимостью более 2 млрд. долларов. Более 50000 пациентам потребовалось хирургическое восстановление ротаторной манжеты плеча. И каждый год, только в США, отмечается более 5 миллионов случаев бурсита локтевого сустава. Также 11% людей, регулярно занимающихся бегом, страдают от ахиллесовой тендопатии. В 2000 году, лечение болей в плечевых суставах стоило правительству США около 7 млрд. долларов, а общая стоимость травм сухожилий и связок оценивается в 30 млрд. долларов ежегодно (Chen J, Xu J, Wang A, Zheng M Scaffolds for tendon and ligament repair: review of the efficacy of commercial products. Expert Rev Med Devices. 2009 Jan; 6(1): 61-73).
Существующие методы для лечения травм сухожилий и связок конечностей успешны только частично. В некоторых случаях суставы иммобилизуются на срок до 4-х недель, для накопления рубцовой ткани. Рубцовая ткань предназначена для замены ткани связок и сухожилий, однако обладает неудовлетворительными механическими свойствами и низкой степенью компенсации. В других случаях используются не рассасывающиеся швы, концы которых «заякориваются» на костях. Такие швы не обладают нужной эластичностью и часто вызывают иммунный ответ. Иногда полное восстановление не возможно и вводятся различные ограничения на двигательную активность.
В текущей исследовательской и клинической практике использует животные и человеческие трансплантаты в качестве основного материала при восстановление дефектов связок и сухожилий. Биологические заменители включают в себя аутотрансплантаты, аллотрансплантаты и ксенотрасплантаты.
Аутогенные трансплантаты надколенного сухожилия и подколенного сухожилия считаются «золотым стандартом» для восстановления тканей и обычно выбираются во избежание отторжения. Однако такие аутотрансплантаты обладают рядом недостатков: требуются дополнительного хирургического вмешательства, которое может приводить к осложнениям донорского участка, увеличению времени восстановления, и/или болям и заражению донорского участка, повреждению нервов и повреждению колена. Дополнительные трудности вызывает использование подколенного сухожилия для реконструкции передней крестцообразной связки. Недостаточно эффективное восстановление соединений сухожилия с костью из-за нестабильности процесса сращивания затрудняет реабилитацию пациента.
Аллотрансплантаты получают из сухожилий, дермы и других тканей кадавров (трупов). Ксенографты получают из сухожилий, желудочной подслизистой оболочки, дермы и перикарда. Аллотрансплантаты и ксенотрансплантаты в основном состоят из коллагена 1-го типа, имеющего схожие свойства с сухожилиями человека. Однако, аллотрансплантаты и ксенотрансплантаты могут быть переносчиками заболеваний или инфекций, а также могут вызывать неблагоприятный иммунный ответ у донора.
Синтетические трансплантаты показывают отличные краткосрочные результаты, однако долгосрочные прогнозы остаются неудовлетворительными. В 40-78% случаев из-за фрагментации и напряжения новых инородных тканей, усталости, деформации, износу это может приводить к развитию синусита и артрита.
Современными методами высевания клеток являются: а) нанесение смеси геля и клеток на остов; б) доставка суспензии клеток к остову, находящемуся в неподвижном или динамическом состоянии. Однако у этих методов существуют недостатки, такие как низкая степень прикрепления клеток к плотному волокнистому остову или матриксу и плохие механические свойства гель-систем. Эти недостатки существенно затрудняют высевание клеток на плотные тканевые трансплантаты. Таким образом, рамки современных технологий не позволяют использовать стволовые клетки для повышения эффективности больших тканевых трансплантатов при восстановлении ткани. Для преодоления этих ограничений были разработаны методы с обработкой остова ультразвуком и нанесением надрезов, для того чтобы дать возможность клеткам проникать в сухожилие перед имплантацией. Без нанесения надрезов или обработки ультразвуком, клетки, высеянные на внешнюю поверхность сухожилия, с трудом проникают внутрь ткани. Однако такая обработка уменьшает механическую прочность трансплантата, что ограничивает его клинические возможности.
Несколько исследовательских групп предприняли попытки получить новые связки, для замены сухожилий и связок, методами тканевой инженерии, как описано в Hairfield-Stein M and etc., 2007. Development of self-assembled, tissue-engineered ligament from bone marrow stromal cells. Tissue Eng. 2007 Apr;13(4):703-10. Один из первых многообещающих результатов, в этом направлении, был опубликован Голдштейном с соавторами в Goldstein JD and etc., 1989 Development of a reconstituted collagen tendon prosthesis. A preliminary implantation study. J Bone Joint Surg Am. 1989 Sep; 71(8):l183-91 Искусственные остовы коллагеновых волокон упаковывались в различных конфигурациях с или без использования коллагеннового геля для их стабилизации. Дунн с соавторами, а также другие группы, использовали коллагенновые остовы с или без высевания клеток. Основными недостатками данного подхода являлись: (а) скорость деградации коллагена остова, которая была выше скорости синтеза нового коллагена, что приводило к неспосбности коллгена поддерживать нагрузку in vivo и (б) стоимость продукции - слишком высокая при низкой воспроизводимости результатов.
Для уменьшения скорости деградации, несколько исследовательских групп использовали шелк и другие синтетические материалы. Это решило проблему с ферментативной деграцией, однако породило другие, связанные с иммунными реакциями, фиброзом и накоплением продуктов распада. Подходы, основанные на внеклеточных матриксах, привело к разработке так называемой «функциональной тканевой инженерии» и «разработке спонтанных 3-х мерных тканей», как описано в Calve S, Dennis RG, Kosnik РЕ 2nd, Baar К, Grosh К, Arruda ЕМ. Engineering of functional tendon. Tissue Eng. 2004 May-Jun; 10(5-6):755-61. Данный метод не так зависит от свойств материалов уже существующих искусственных или биологических остовов, которые ограничивают механические или физиологические свойства новообразованных тканей. Скорее, такие материалы как коллагеновые гели, фибриновые гели, Матригель или синтетические гели используются для управляемой модификации новой ткани. Хио Чен и др. представляют подробный обзор этого и других методов тканевой инженерии с использованием стволовых клеток для восстановления сухожилий (Xiao Chen, Xiao Hui Zou, Guo Li Yin, Hong Wei Ouyang. Tendon tissue engineering with mesenchymal stem cells and biografts: an option for large tendon defects? Frontiers in Bioscience S1, 23-32, June 1, 2009). Однако упомянутые ранее проблемы (а) и (б) все еще сохраняются и в случае функциональной тканевой инженерии.
Было предпринято несколько попыток по получению коллагенновых структур, воспроизводящих структуры «живых тканей» и обладающих некоторой степенью ориентационной анизотропии. В лабораторных условиях была продемонстрирована возможность ориентации молекул с применением различных технологий: механических сдвиговых нагрузок, использования микрокапиллярных каналов, ориентации магнитным полем или потоком жидкости, электрохимической обработкой подложки, ориентированным электропрядением, метода Лэнгмюра-Блоджетта, прессованием. Коллагеновые матрицы, полученные этими способами, успешно ориентировали разные типы клеток. Однако структура таких матриц существенно отличается от структуры естественных внеклеточных матриц: не учитывается, например, контролируемый диаметр фибрилл, ориентирование фибрилл, волнистость укладки, периодичность и угловое распределение. Отсутствие вторичной структуры искусственного коллагенового матрикса приводит к снижению его прочности и влияет на выживание и поведение клеток. Буллис с соавторами в 2007 году продемонстрировали важность клеточного окружения в новосинтезированном внеклеточном матриксе. Некоторым группам удалось лучше контролировать размер фибрилл и получить образование тканеподобных узоров. Однако в этих экспериментах существуют проблемы с размером производимого материала и большой длительностью процесса. Важность нано- и микроструктур и их ориентации особенно важна для сухожилий и связок, так как этим тканям требуется прочность, эластичность и ориентирование клеток для их прикрепления и миграции. Например, в недавнем обзоре, посвященном клеточной/внеклеточной архитектуре человеческих тканей говорится, что «в тканевой архитектуре все больше осознается важность архитектуры остова, что привело к изменению тренда в проектировании остова, от изотропных остовов к гетерогенным или анизотропным «биоимитирующим» остовам, с целью имитации клеточной организации (такой как ориентация и агрегация) и/или ВКМ рассматриваемой ткани» (Singh M, Berk-land С, Detamore MS. Strategies and applications for incorporating physical and chemical signal gradients in tissue engineering. Tissue Eng Part В Rev. 2008 Dec; 14(4):341-66).
Известна патентная заявка США №2009/0069893 и заявка РСТ WO 2008/070166, где были описаны методы размещения коллагена упорядоченными массивами на стеклянных и пластиковых подложках в виде тонких пленок с коже-подобными, сухожилие-подобными, упорядоченно-сплетенными фибриллярными структурами. Раскрытие сущности изобретения, двух вышеупомянутых патентов приведены в настоящем описание в виде ссылок. Важно, что эти специальным образом выровненные и ориентированные структуры коллагена направляют ориентацию нанесенных на них клеток. В частности клетки прикрепляются и выстраиваются на пленках и затем мигрируют вдоль осей упорядочения. Такие пленки могут быть обработаны вещества, такими как факторы роста, которые улучшают выживание, миграцию и пролиферацию клеток. Другие биополимеры хотя и разрабатывались для доставки клеток в ткани, однако зачастую им не хватает биосовместимости, и они не встраиваются в живую ткань или значительно отличаются от нее по своим свойствам, или изменяют ее функцию.
Несмотря на значительные усилия, приложенные к разработке биоматериалов, имитирующих сухожилия, кожу, и другие фибриллярные ткани на коллагеновой основе, на настоящий момент не существует метода промышленного производства таких материалов. И новые разработки в этой области по-прежнему востребованы.
Техническим результатом настоящего изобретения является упрощение и удешевление способа получения ориентированных биополимерных материалов, повышение технологичности, повышение биосовместимости таких материалов с живыми тканями.
Некоторые варианты настоящего изобретения предоставляют способы производства ориентированных фибриллярных биополимерных материалов, состоящие из следующих шагов:
приготовление раствора или геля фибриллярного биополимера в требуемой фазе; нанесение раствора или геля фибриллярного биополимера достаточно тонким слоем; перевод раствора или геля фибриллярного биополимера из жидкой фазы в твердую для образования ориентированного фибриллярного биополимерного материала.
В некоторых вариантах требуемой фазой, в которой находится раствор или гель фибриллярного биополимера является жидкокристаллическая фаза. В некоторых вариантах растворы или гели фибриллярного биополимера обладают ионной силой от 0,001 до 0,5 М и рН от 2 до 9. В других вариантах ионная сила находится в пределах от 0,1 до 0,3 М, и рН в пределах от 2 до 5. В некоторых вариантах переход раствора или геля фибриллярного биополимера в твердую фазу достигается высушиванием раствора или геля. Высушивание может быть достигнуто различными методами, такими как, например, контролем за влажностью, температурой, электростатическими условия, для стимуляции испарения и т.д..
В некоторых вариантах раствор или гель фибриллярного биополимера наносится на функционализированном субстрате. Субстрат может быть функционализирован любым количеством необходимых компонентов, такими как вещества, способствующие адгезии, разделению, и влияющими на фибриллярную структуру и тому подобное.
Особым преимуществом является то что, биополимеры созданные в соответствии с вариантами настоящего изобретения могут быть дальше использованы для образования биокомпозитных материалов и структур. В одном варианте, предоставляется ориентированный фибриллярный материал, имеющий форму одной или нескольких лент. В некоторых других вариантах фибриллярные биополимерные материалы предоставляются в виде слоя с усредненной ориентацией фибрилл, расположенной параллельно поверхности слоя. В других вариантах поверхность имеет среднюю ориентацию фибрилл перпендикулярную поверхности слоя. В некоторых вариантах фибриллярные биополимерные материалы имеют форму трубы со средней ориентацией фибрилл или паралелльной поверхности, или имеющей угол с осью трубы. Ориентированный фибриллярный биополимерный материал может иметь одинарный извилистый узор. Также ориентированный фибриллярный биополимерный материал может иметь двойной извилистый узор с произвольными углами между завитками. В некоторых вариантах изобретения ориентированный фибриллярный биополимерный материал имеет извилистый рисунок в форме шеврона с параллельными линиями с перемено-равными противолежащими углами.
С другой стороны, варианты настоящего изобретения предоставляют способы формирования одного или более фибриллярных биополимерных материалов, таких как псевдо-волокна и состоящих из следующих этапов: погружение ориентированного биополимерного материала в раствор с нйетральным рН; извлечение ориентированного биополимерного материала из раствора таким образом, что материал коллапсирует в псевдо-волокно на границе воздуха и жидкости.
Сформированное псевдо-волокно может быть высушено и подвергнуто дальнейшим операциям: стериализации, химической сшивки и т.д. в зависимости от желаемой области применения.
Еще одним преимуществом использования фибриллярных биополимерных псевдоволокон является их использование в биокомпозитные материалы и стурктуры. В некоторых вариантах предоставляется биокомпозитная структура состоящая из, по крайней мере, одного ориентированного фибриллярного биополимерного материала и биодеградируемой биосовместимой с ним матрицы. В других вариантах предоставляется биокомпозитная структура, состоящая из множества ориентированных фибриллярных биополимерных материалов, располагающимися под произвольными углами друг к другу и скрепленных вместе биодеградируемой биосовместимой матрицей. Биодеградируемая матрица может состоять из любых подходящих материалов выбранных из группы: глюкозаминогликанов, протиогликанов, ванадата, фосфатов кальция, живых клеток, ростовых факторов и иных.
В некоторых вариантах ориентированный фибриллярный биополимерный материал используется в качестве матрицы и субстрата для применения в клеточных и тканевых методах. В других вариантах ориентированный фибриллярный биополимерный материал используется в качестве направляющего клетки остава in vivo. В еще одном варианте ориентированный фибриллярный биополимерный материал используется в качестве средства доставки требуемых фармацевтических компонентов в определенные ткани и органы человека. В одном варианте материал используется для доставки компонентов плазмы обогащенной тромбоцитами. В другом варианте материал специально сформирован для доставки живых клеток при восстановлении и регенерации тканей. В еще одном варианте материал формируется для доставки пептидов, лекарств, ростовых факторов и малых молекул.
Биополимерный материал может быть сформирован на подложке устройством для нанесения жидких пленок, состоящим из: как минимум двух продольных боковых элементов, имеющих форму параллельных клинообразных рельсов с основаниями расположенным в той же плоскости, что и подложка; поперечного элемента конструкции в форме моста между двумя боковыми элементами, при котором указанный поперечный элемент имеет хотя бы одну плоскую поверхность и контактирует с рельсами хотя бы в одной точке; и систему захватов, обеспечивающую строгую фиксацию моста в любой позиции на указанных рельсах, так что такой мост может совершать движения вдоль обоих рельс, таким образом что плоская поверхность образует двухгранный угол в 0-10 угловых минут с поверхностью субстрата и зазор между плоскостью субстрата и плоской частью моста составляет 5-50 микрон
Биополимерный материал может быть сформирован следующим способом: наносят коллагеновый раствор на поверхность с помощью двух паралельных плашек,, установленных параллельно друг другу с зазором 5-50 микрон между ними; в зазор помещают раствор коллагена; относительным перемещением плашек создают сдвигающую силу, обеспечивающую тонкослойное ориентированное коллагеновое покрытие. Обычно концентрация коллагена в растворе составяет 20 мг/мл - 100 мг/мл. Предпочтительно, чтобы концентрация коллагена была не менее 25 мг/мл. Коллаген в растворе обычно находится в состоянии нематического жидкого кристалла. Ориентированный слой коллагена могут формировать также продавливанием концентрированного раствора коллагена через фильеру.
В некоторых вариантах, в качестве биополимерного раствора используют концентрированный раствор коллагена, выбранного из группы коллагенов I, II, III, VI и XI типов, включая биологически и химически модифицированный коллаген. Раствор может также содержать одну из добавок, способствующих ориентации или адгезивности коллагена, например АТФ. Сущность настоящего изобретения поясняется следующими рисунками:
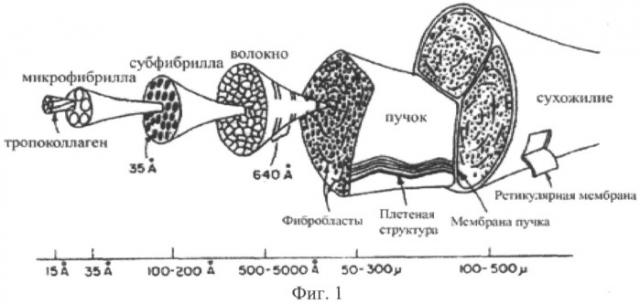
На Фиг.1 изображена иерархическая диаграмма тканей сухожилия;
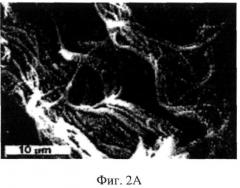
На Фиг.2А представлена СЭМ (силового электронного микроскопа) фотография, показывающая спиральную структуру извитых коллагеновых волокон в сухожильных нитях;
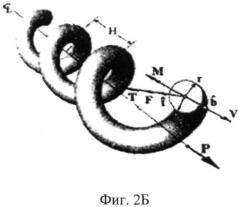
На Фиг.2Б изображена спиральная пружина, использованная в математической модели коллагеновых волокон;
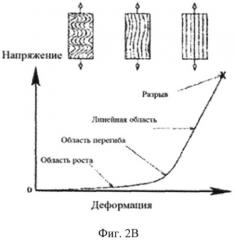
На Фиг.2В кривая напряжения растяжения волокна спирального коллагена;
На Фиг.3 приведены фотографии полученные методом атомной силовой микроскопии (АСМ), показывающие различные коллагеновые пленки или материалы, полученные в соответствии с разными воплощениями настоящего изобретения;
На Фиг.4А представлена СЭМ фотография сухожилия хвоста крысы и на Фиг.4Б - АСМ фотография нового матрикса из бычьего коллагена I;
На Фиг.5А-5В представлены АСМ фотографии различных коллагеновых пленок, полученных с использованием настоящего изобретения;
На Фиг.6А представлена СЭМ фотография свиного митрального фактора и на Фиг.6Б АСМ фотография сухожилие-подобного биополимерного матрикса, полученного в соответствии с настоящим изобретением;
На Фиг.7А-7Б приведены фотографии коллагеновых псевдо-волокон, полученных в соответствии с настоящим изобретением;
На Фиг.8А-8В иллюстрируется двойная супер спиральная структуру с различной ориентацией ориентацию петель;
На Фиг.9 представлена схема устройства для осуществления одного из вариантов изобретения;
На Фиг.10 приведена АСМ фотография спирального, неуплотненного, биополимерного материала с линейно-сплетенной ориентацией волокон, полученного с использованием настоящего изобретения;
На Фиг.11 приведена АСМ фотография двойного извитого биополимерного материала, полученного с использованием настоящего изобретения;
На Фиг.12А-В представлены фотографии человеческих фибробластов, мезенхимальных стволовых клеток и мышечных клеток соответственно на ориентированных коллагеновых слоях, выполненных в соответствии с настоящим изобретением;
На Фиг.13 представлена схема формирования псевдо-волокон в соответствии с настоящим изобретением;
На Фиг.14 приведена фотография клеток, высеянных на псевдо-волокна из ориентированного коллагена, изготовленного в соответствии с настоящим изобретением.
Приведенное описание является лишь иллюстративным и пояснительным и настоящее изобретение не ограничивается комбинациями, пленками и методами, описанными в данном документе. В данном тексте использование единственного числа подразумевает и множественное число, если обратное не указано отдельно. Кроме того, использование «или» означает «и/или» если обратное не указано отдельно. Так же слова «относиться», «относится», «включать», «включает» и «включая» не являются ограничивающими. Термины «пласт» или «слой» или «тонкий слой» или «матрица» могут использоваться взаимозаменяемо повсеместно в описании.
В целом представленное изобретение относится к биокомпозитным материалам и структурам, а так же способам их получения и использования. В некоторых примерах данное изобретение направлено на ориентированные, основанные на коллагене биокомпозитные материалы, конструкции, а так же методы их получения. В других приводятся методы формирования основанных на коллагене пленок, в которых коллаген выстраивается в различных формах (выровненный, изломами, витой или комбинации перечисленных выше форм). Основанные на коллагене пленки могут быть преобразованы или сформированы в отдельные псевдоволокна последовательным применением водного растворителя и сил натяжения на границе раздела растворителя и воздуха. В некоторых примерах такие псевдоволокна могут быть химически сшиты, что увеличит их прочность, а так же обработаны различными реагентами или материалами, такими например как гепарин, что увеличивает их способность вмещать факторы роста и/или увеличить их гидратацию.
Следующее определение, используемое в данном тексте - "волокнистые биополимеры", оно без ограничения общности относится к различным типам коллагена, ламинина, фибронектина, фибрина, шелка, других полипептидов и их комбинаций.
Термин "ориентированные волокнистые биополимерные материалы " относится к материалам, имеющим повторяющийся структурный мотив. В частности это может быть кристаллизованный волокнистый биополимер или полукристаллизованный волокнистый биополимер. В некоторых примерах биополимер относят к "ориентированным", если у его поверхности есть повторяющийся мотив. В частности поверхностный мотив может быть установлен одной из 17 плоскостных кристаллографических групп. Ориентация может быть оценена любым из представленных методов: оптической поляриметрией, поляризационный микроскопией, лазерной дифракцией, рентгеновской дифракцией, микроскопией с использованием атомарного зонда, электронной микроскопией.
Упоминаемые в тексте "волокнистые биополимерные растворы и гели" имеют различные фазовые состояния в зависимости от концентрации, температуры, рН, ионной силы, и добавок. В некоторых примерах эти фазовые состояния - жидкокристаллические фазы с ориентацией дальнего порядка (например, изотропической, холистерической, смектической, нематической, гексагональной). Различные фазовые состояния могут быть определены дифракцией и рассеиванием света, матричной поляриметрией Мюллера, измерением плотности, а так же методом дифференционной поляриметрии. Коллаген, ламинин, ДНК, многие полипептиды, и другие волокнистые биополимеры - хорошие примеры лиотропных жидкокристаллических материалов. Небольшое количество неорганических добавок (например, ортованадат) может изменить переход фазового состояния. Исчерпывающая информация о формировании фазовых состояний коллагена представлена в работе [Mosser G, Anglo A, Helary С, Bouligand Y, Giraud-Guille MM. 2006]; плотные тканеподобные коллагеновые матрицы формируются во внеклеточных условиях [Matrix Biology. 25:3-13]. Известные факты полностью отражены в данном тексте посредством ссылок.
Применение стабильных (безвихревых) условий потока жидкой фазе приводит к формированию регулярной структуры. Другими словами раствор или гель биополимера течет в ламинарном режиме. Примеры таких условий течения включают в себя, но не ограничиваются следующими: течение Куэтта, течение Тэйлора-Куэтта, плоскостное и осесимметричное течение Пуазейля.
Изменение окружающих условий (влажности, температуры, использование УФ, рентгеновского излучения, электронного облучения, электрического или магнитного поля) или основных параметров волокнистого биополимера таких как рН и ионная сила, может привести к процессу самосборки и вызвать переход от фазы жидкости/геля к твердой фазе у ориентированного материала. Типичным примером перехода от фазы жидкости/геля к твердой фазе является процесс высыхания. Структура биополимера в твердой фазе зависит от структуры биополимера в жидкой фазе, а так же от процесса самосборки. В одном из примеров процесс быстрого высыхания коллагена приводит к формированию спиральных волокон с маленьким диаметром (прозрачный материал), а процесс медленного высыхания приводит к формированию спиральных волокон с большим диаметром (матовый материал). В случае с тонким слоем коллагена (толщиной в несколько микрон) получающаяся ориентация существенно зависит от химических и физических свойств подложки. В некоторых случаях функционализация подложки может использоваться для управления ориентацией.
"Псевдоволокно" получают путем продольного скручивания вдоль длинной оси свободно располагающихся лент ориентированного коллагена прочно удерживаемых на месте электростатическими силами.
"Нить" образуется путем переплетения вместе множества псевдоволокон, как правило, трех или более псевдоволокнон.
Под "биологически разлагаемой матрицей" здесь подразумевается материал, который может разрушиться естественным путем и затем резорбироваться в физиологической среде. Под биосовместимыми матрицами подразумеваются биосовместимые материалы, используемые для связи боиполимеров между собой.
Полезно кратко рассмотреть структуру связок и сухожилий, которая обсуждалась в литературе. Хотя характеристики коллагена на молекулярном уровне были хорошо изучены и полностью осмысленны, есть менее четкое представление о его свойствах и структуре на уровне сухожилий и связок.
В некоторых примерах данного изобретения описывается изготовление каркасных материалов, имеющих структуру схожую с сухожилиями и связками млекопитающих. Методика изготовления получение коллагена, как правило, типа I, и сборка его с помощью патентованного метода в молекулярный каркас. При этом создается каркасная структура без присутствия клеточного или другого биологического материала. Отсутствие дополнительных компонентов позволяет получить в исследованиях более четкую картину самой каркасной структуры и ее геометрии. При этом возникает понимание того, как эти части тела млекопитающих организованы и как они создаются, что на сегодняшний день еще не было отражено в литературе.
При описании структуры связок и сухожилий используется модель организационной иерархии, которая проявляет различные свойства на каждом уровне. В зависимости от того, как определяется каждый уровень, исследователи выделяют шесть, семь или восемь уровней. В приведенной ниже таблице 1 показана терминология обычно используемая для описания восьми уровней, ("Tissue Mechanics" by Cowin & Doty, 2007).
| Таблица 1 | |
| Уровень 1 | Полипептид |
| Уровень 2 | Тропоколлаген |
| Уровень 3 | Микрофибриллярный |
| Уровень 4 | Субфибриллярный |
| Уровень 5 | Фибриллярный |
| Уровень 6 | Волокно |
| Уровень 7 | Пучок |
| Уровень 8 | Связки и сухожилия |
Шесть уровней (2, 3, 4, 5, 7 и 8) показаны на Фиг.1. На Уровне 1, каждая полипептидная альфа цепь которая составляет молекулу коллагена состоит приблизительно из 1000 аминокислотных остатков. Каждая цепочка закручивается в левую спираль около 1,2 HM в диаметре.
На Уровне 2, тропоколлаген или "молекула коллагена" составляет примерно 300 нм в длину и 1,5 нм в диаметре. Она состоит из трех полипептидных альфа цепей. Эти три левозакрученные спирали переплетены вместе и образуют правозакрученный рулон состоящий их трех спиралей. Эта тройная спираль является "супер-спиралью", поскольку она является правозакрученной спиралью состоящей из трех левозакрученных спиралей.
На Уровне 3, микрофибриллы формируются пятью нитями молекул коллагена. Каждая нить состоит из молекул коллагена соединенных конец-к-концу с дискретными разрывами между ними. Эти нити сплетены вместе в левую супер-супер спираль электростатическими силами, и формируют микрофибриллу диаметром от 3,5 до 4 нм.
На Уровне 4, субфибрилла имеет диаметр 10-20 нм и состоит из кластеров микрофибрилл.
На Уровне 5, фибрилла формируется путем сплетения вместе субфибрилл, которые образуют правозакрученную супер-супер-суперспираль с шагом около 1090 нм и диаметром 30-500 нм. Интервалы между концами коллагеновых молекул микрофибрилл выстраиваются и образуют характерный повторяющийся мотив "D-band" размером 67 HM.
На Уровне 6, волокна имеют диаметр 1-20 мкм и состоят из кластеров фибрилл.
На Уровне 7, пучки состоят из волокон собранных в структуры, организованные по модели витков, которые описывают как ундулирующую волнистость, волнообразное колебание или зигзаги. Функция витков - обеспечить эластичность, необходимую тканям, подвергающимся воздействию сил натяжения, таким как связки, сухожилия, перикард сердца, и т.д. Такие витки не встречаются в коллагене костей который в значительной степени подвергается силам сжатия. Клеточные врастания происходят на уровне пучков.
На Уровне 8, связки и сухожилия состоят из групп пучков. Между пучками нет боковых сцеплений, поэтому они могут свободно скользить относительно друг друга, что создает плавно функционирующий механический агрегат.
Проводились многочисленные исследования механического поведения сухожилий и связок, такие как: «Эластичная модель для извитого коллагенового волокна» (A.D. Freed, T.C. Doering, in Freed AD & Doehring TC, 2005, J. Biomech. Eng. 127. 587-593). Авторы отметили, что мягкие ненагруженные ткани являются многокомпонентными структурами, которые, с точки зрения восприятия нагрузки, в основном состоят из двух упругих веществ, коллагена и эластина, погруженных в протеогликановый гель. Они отметили, что пучки состоят из групп волокон и не обсудили промежуточные формы "волокна". Они предположили, что появление извитого образования связано с незначительным коэффициентом сжатия волокна, которое изгибается под действием внутренних сил упругости эластина всякий раз, когда фиброзная ткань освобождается от внешней нагрузки. Такая бугристая форма известна как виток (или извив). Настоящее изобретение описывает другой механизм, приводящий к образованию извивов. Это происходит в результате процесса регенерации коллагена в отличие от явления сморщивания коллагена.
Как упрощающее допущение было предположено, что волокно, формирующее извив, будет рассматриваться как механическая спиралевидная пружина. Это предположение хорошо сопоставимо с наблюдаемым нелинейным поведением извитых коллагеновых тканей при деформации вследствие напряжения. Оно отличается тем, что пружина демонстрирует линейное поведение при низкой нагрузке (нижняя часть кривой) на кривой "напряжение-деформация", представленной на Фиг.2 В, до тех пор, пока спираль не становиться растянутой. В этот момент спираль начинает становиться жестче и жестче, вызывая непрерывное увеличение наклона кривой (область перегиба). После того как спираль полностью растянута, поведение снова становиться линейным, но с куда более крутым уклоном (линейная область). Благодаря своей форме эта кривая называется "J" кривая. Предложенная математическая модель хорошо сопоставима с экспериментальными данными.
На Фиг.2А представлена фотография, сделанная на сканирующем электронном микроскопе (СЭМ) и демонстрирующая спиралевидную природу извитых коллагенных волокон сухожильных нитей полученных из свиного митрального клапана. Фиг.2Б демонстрирует спиральную пружину, используемую Фридом (Freed) и Дьюрингом (Doering) в их математических моделях. Она показывает, как центральная сила, действующей вдоль оси спирали переносится в другие области спирали. Следует обратить внимание, что фотографии СЭМ на Фиг.2А показывает левозакрученную спираль, в то время как диаграммы на Фиг.2Б показывает правозакрученную спираль. Нигде в статье ни указывается разница между данными рисунками, а так же не обсуждается концепция хиральности, что свидетельствует о недостатках понимания и доктрины в известном уровне техники.
Хотя в литературе есть много ссылок на спиралевидную природу извивов сухожилий и связок, не удается найти обсуждения хиральности. Работы Фрида и Дьюринга являются примером того, как понятие хиральности остается незамеченным.
В некоторых примерах настоящего изобретения описывается процесс получения биоэквивалентных реконструированных матриц, полученных из растворов очищенного мономерного коллагена, подобных сухожилиям. Эти новые матрицы несут в себе, ряд преимуществ, не ограничиваясь только этим: а) биосовместимость, б) высокую механическую прочность и свойство "J" - упругости в направлении волокон, в) отсутствие дефектов на большой площади (2"×10"), г) биомиметичность (т.е. приближенно к нативной структуре связки как в макро так и в нано масштабе), д) биоразлагаемость в зависимости от степени сшивания. На Фиг.3А-3Е продемонстрированны примеры коллагеновых пленок и мембран в соответствии с вариантами осуществления настоящего изобретения. Фиг.4А и 4Б демонстируют подобие структур тонкого сухожилия и коллагеновой матрицей, полученной в соответствии с настоящим изобретения. Совокупность извивов и выровнено-переплетенные структуры матриц могут включать в себя факторы рост