Средство для ингибирования фермента поли(адф-рибозо)полимеразы-1 человека
Иллюстрации
Показать всеИзобретение относится к средству для ингибирования фермента поли(АДФ-рибозо)полимеразы-1 человека, представляющее собой 6-ацетил-7,9-дигидрокси-8,9b-диметил-2-етилид-2,11-ен-1,9b,2,3-тетрагидро-11-N-карбоксифенилметиламино-1,3-диоксодибензофуран общей формулы (I):
Данное средство оказывает специфическое ингибирующее действие на фермент поли(АДФ-рибозо)полимераза-1 человека (ПАРП-1) и, являясь дешевым и доступным, расширяет арсенал специфических ингибиторов данного фермента и может быть использовано для разработки лекарственных препаратов, применимых в клинической медицине. 2 ил., 4 пр.
Реферат
Изобретение относится к молекулярной биологии, биохимии и биотехнологии, конкретно к известному соединению 6-Ацетил-7,9-дигидрокси-8,9b-диметил-2-етилид-2,11-ен-1,9b,2,3-тетрагидро-11-N-карбоксифенилметиламино-1,3-диоксодибензофуран, представляющему собой фенилаланиновое производное усниновой кислоты формулы (I):
у которого выявлена новая биологическая активность, заключающаяся в способности ингибировать действие фермента поли(АДФ-рибозо)полимеразы-1 человека.
В последние годы ведутся активные поиски ингибиторов фермента поли(АДФ-рибозо)полимеразы-1 (ПАРП-1), который рассматривается как перспективный фермент-мишень для создания лекарственных препаратов для лечения инсульта, ишемии, диабета, артритов, колитов и других воспалительных заболеваний. Ингибиторы ПАРП-1 также могут быть использованы как потенциальные противораковые и противовирусные агенты [N.J. Curtin. Expert Rev. Mol. Med., 7, 1-20, 2005; P. Jagtap, C. Szabo. Nat. Rev. Drug Discov., 4, 421-440, 2005; A.M. Reed, et al. Future Oncol., 5, 713-726, 2009].
Поли-АДФ-рибозилирование - посттрансляционная модификация белков в эукариотических клетках. Процесс катализируется поли(АДФ-рибозо)полимеразами (ПАРП). Эти ферменты осуществляют превращение никотинамид-адениндинуклеотида (НАД+) в полимер, поли(АДФ-рибозу), с высвобождением никотинамида. В обзорах [D.D'Amours, et al. Biochem J., 342, 249-268, 1999; P.O.Hassa, et al., Microbiol. Mol. Biol. Rev., 70, 789-829, 2006] рассматривается многообразная биологическая роль поли(АДФ-рибозы). Известно, что она вовлечена в процессы модуляции структуры хроматина, репликации, транскрипции, репарации ДНК (главным образом, процесс эксцизионной репарации оснований), дифференцировки клеток и клеточной гибели.
В настоящее время клинические испытания проходят одиннадцать ингибиторов ПАРП-1, относящихся к циклическим аминам [1]. Эти соединения являются узкоспецифичными препаратами, которые предполагается использовать для лечения конкретных видов новообразований, в то время как для других заболеваний, связанных с функционированием ПАРП-1, лекарств-ингибиторов ПАРП-1 пока не существует.
К недостаткам существующих ингибиторов ПАРП-1 в первую очередь следует отнести плохую растворимость гетероциклических соединений в воде, а также небольшое время жизни их в организме. В последнее время появляются данные о водорастворимых ингибиторах ПАРП-1 [напр., Н. Nakajima, et al., J. Pharmacol. Exp. Therapeutics. 312, 472-481, 2005]. Хотя такие соединения обладают хорошими фармакокинетическими свойствами, их цитотоксичность не изучена.
Наиболее близким к заявляемому средству для ингибирования ПАРП-1 - прототипом, является ксантуреновая кислота [Banasik et al., J. Biol. Chem. 267, 1569-1575, 1992, Banasik et al., Mol. Neurobiol. Published online 04 April 2012] формулы (II):
К недостаткам прототипа относится то, что ксантуреновая кислота является метаболитом триптофана и участвует в многочисленных процессах в клетке, что исключает специфичность ее воздействия на определенный фермент [Q.Han, В.Т.Beerntsen J. Insect. Physiol., 53, 254-263, 2007; S.Gobaille et al., J. Neurochem., 105, 982-993, 2008].
Задачей изобретения является создание более эффективного и специфичного ингибитора ПАРП-1 на основе природных полифенольных соединений.
Поставленная техническая задача решается применением известного соединения формулы (I), представляющего собой енаминовое производное усниновой кислоты, у которого выявлена новая биологическая активность, заключающаяся в ингибировании фермента поли(АДФ-рибозо)полимеразы-1 человека (ПАРП-1).
Технический результат: получен эффективный селективный ингибитор ПАРП-1, являющийся нетоксичным, дешевым и доступным соединением.
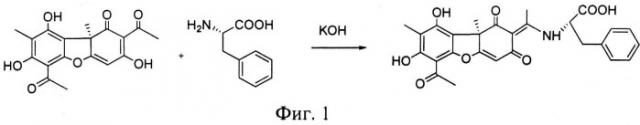
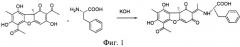
Предлагаемое соединение получают известным способом, описанным в [Luzina О.А. et al., Russian Chemical Bulletin., 56, 1249-1251, 2007]. Метод синтеза заключается во взаимодействии усниновой кислоты с L-фенилаланином.
На фиг.1 представлена схема синтеза предлагаемого соединения.
Структура и чистота полученного соединения подтверждались данными ЯМР-, УФ-, КД-спектроскопии и масс-спектрометрии.
Ниже приводятся конкретные примеры реализации заявляемого технического решения.
Пример 1. Синтез 6-Ацетил-7,9-дигидрокси-8,9b-диметил-2-етилид-2,11-ен-1,9b,2,3-тетрагидро-11-N-карбоксифенилметиламино-1,3-диоксодибензофурана.
0.5 г (3 ммоль) L-фенилаланина растворили в 10 мл водно-спиртовой смеси (1:1 по объему). Добавили 0.25 г КОН (или более до pH ~ 9.5). Кипятили на водяной бане 10 мин. Порциями добавляли взвесь 1 ммоль (344 мг) (+)-усниновой кислоты в 5 мл спирта в течение 30 минут. Кипятили на водяной бане 3 часа, поддерживая pH на уровне ~ 9.5. Охладили, добавили разбавленной соляной кислоты до pH ~ 5. Реакционную смесь экстрагировали трижды хлороформом (по 30 мл), экстракт сушили над MgSO4 безводным, отгоняли на ротационном испарителе, продукт выделяли колоночной хроматографией на SiO2, элюент - хлороформ с градиентом этилацетата от 0 до 50%. 6-Ацетил-7,9-дигидрокси-8,9b-диметил-2-етилид-2,11-ен-1,9b,2,3-тетрагидро-11-N-карбоксифенилметиламино-1,3-диоксодибензофуран выделен с выходом 59%, т.пл. 240°C с разложением.
Элементный состав полученного соединения определяли из масс-спектров высокого разрешения. Спектры ЯМР 1H и 13C регистрировали на спектрометрах АМ-400 (рабочие частоты 400.13 MHz для 1Н и 100.61 MHz для 13С) и DRX-500 (500.13 MHz и 125.76 MHz соответственно) для растворов вещества в CDCl3. В качестве внутреннего стандарта использовали сигналы растворителя (δH 7.24 и δC 76.9 м.д).
ЯМР 1H (CDCl3, δ, м.д., J Гц): 1.63 с (3H, C15H3), 1.97 с (3H, C10H3), 2.39 с (3H, C12H3), 2.63 с (3H, C14H3), 3.15 и 3.29 д (2Н, С18Н2), 5.06 д (Н16), 5.84 с (Н4), 7.20-7.27 (5Наром), 12.02 с (С9-OH), 13.35 ш.с (NH), 13.35 с (С7-OH). ЯМР, 3C (CDCl3, δ, м.д.): 7.5 (С15), 18.5 (С12), 31.0 (С14), 31.6 (С10), 38.1 (С18), 56.4 (C9b), 57.3 (С16), 100.8 (С2), 101.7 (С6), 102.4 (С4), 105.0 (С9а), 106.4 (С8), 1278.1 1C, 128.4 2С, 129.5 2C, 135.4 1С - все аром., 155.7 (С5а), 157.6 (С9), 162.5 (С7), 170.8 (С11), 172.9 (С17), 174.5 (С4а), 188.8 (С3), 197.7 (С1), 200.9 (С13). ИК спектр (ν, см-1): 848, 1070, 1201, 1287, 1372, 1460, 1542, 1632, 1701, 1738, 2926, 3042, 3436. Найдено: m/z 491.15982 [M]+ C27H25NO8. Вычислено: M=491.15800.
Пример 2. Исследование влияния предлагаемого соединения на активность ПАРП-1.
Рекомбинантная поли(АДФ-рибоза)-полимераза 1 человека (КФ 2.4.2.30) была экспрессирована в системе Escherichia coli (штамм BL21 DE3 (pLys Е)). Синтез ПАРП-1 индуцировали добавлением IPTG до 1 мМ, далее клеточную культуру инкубировали в течение 3 ч при 37°. Затем клетки осаждали центрифугированием и полученный осадок суспендировали в буфере, содержавшем 50 мМ Tris-HCl, pH 8,0, 10%-ный глицерин, 1 мМ β-меркаптоэтанол, 1 мМ PMSF (фенилметилсульфонил фторид), 1 мМ бензамидин (буфер A), AntPrt-Coctail в количестве, рекомендованном производителем, и 2 М NaCl. Клетки разрушали ультразвуком. Дальнейшая схема очистки включала ряд последовательных хроматографии с использованием никелевой сефарозы (элюция 250 мМ имидазолом в буфере A), гепарин-сефарозы (элюция линейным градиентом NaCl (0,1-0,8 М) в буфере A) и одноцепочечной ДНК-целлюлозы (элюция линейным градиентом NaCl (0,1-1 М) в буфере A). Чистоту полученных препаратов ПАРП-1 контролировали на всех стадиях очистки с помощью электрофореза по методу Лэммли [Laemmli, U.K. Nature, 227, 680-685, 1970]. Диализ конечного препарата проводили против буфера A, содержавшего 0,1М NaCl. Конечный препарат хранили в аликвотах по 20 мкл при -70°.
В качестве тест-системы для определения ингибирующих свойств предлагаемого соединения использована реакция автополи(АДФ-рибозил)ирования, катализируемая ПАРП-1. Условия проведения реакции: 50 мМ Трис-HCl, pH 8.0, 20 мМ MgCl2, 150 мМ NaCl, 7 мМ β-меркаптоэтанол, активированная ДНК 2°А260/мл, степень активации 25%, 0,3° мМ [3H] НАД+ (изотопное разбавление 1:1000) при температуре 37°C. Концентрация предлагаемого соединения (потенциального ингибитора) варьировалась в пределах от 10 нМ до 1 мМ. Реакцию запускали добавлением ПАРП-1 до конечной концентрации 500 нМ и останавливали нанесением на бумажные фильтры Whatman 1, пропитанные 5% ТХУ, через 30 сек. Фильтры отмывали в 5% ТХУ 4-х кратно, затем удаляли ТХУ 90% этанолом. Фильтры сушили на воздухе.
Обсчет включения радиоактивности в кислотонерастворимый продукт проводили на сцинтилляционном счетчике QuantaSmart в толуольном сцинтилляторе. Детекция радиоактивномеченого продукта проводилась на линейном участке зависимости скорости от времени реакции при концентрации природного субстрата НАД, равной Km. В качестве показателя эффективности ингибирования использовали значение IC50. Значение IC50 представляет собой концентрацию испытуемого соединения, которая вызывает 50% снижение активности ПАРП-1. Расчет значений IC50 проводили с помощью программы OriginPro 7.0.
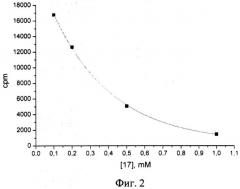
На фиг.2 приведена типичная кривая зависимости скорости реакции автополи(АДФ-рибозил)ирования от концентрации ингибитора.
Из фиг.2 видно, что скорость включения радиоактивности в кислотонерастворимый продукт падает с увеличением концентрации ингибитора.
Пример 3. Исследование специфичности ингибирования ПАРП-1 предлагаемым соединением.
Для оценки специфичности ингибирования ПАРП-1 предлагаемым соединением исследовали влияние этого соединения на ПАРП-2, другого представителя семейства ПАРП, а также два других фермента - участника эксцизионной репарации оснований (ЭРО): ДНК-полимеразу β (β-пол) и апуриновую/апиримидиновую эндонуклеазу 1 (АРЕ-1).
ПАРП-2 - второй, помимо ПАРП-1, белок из семейства ПАРП, который активируется при повреждении ДНК. Каталитический домен ПАРП-2 имеет 69% аналогии с ПАРП-1, оба фермента локализованы в ядре [Huber et al., DNA Repair, 3, 1103-1108, 2004]. Исследования с участием нокаутных по ПАРП-1 и ПАРП-2 животных показывают, что эти ферменты участвуют в схожих процессах и имеют ряд общих белковых партнеров. Тем не менее, функциональная роль этих белков различна [Yelamos et al., Trends Mol. Med., 14, 169-178, 2008]. Таким образом, селективные ингибиторы ПАРП-1 могут иметь существенное значение для дальнейшего изучения роли каждого из этих белков в биологических процессах и, возможно, использоваться для создания на их основе лекарственных препаратов с избирательным действием.
β-пол - фермент ЭРО, участвующий как в короткозаплаточном пути (встраивание одного нуклеотида и удаление 5′-дезоксирибозофосфатного остатка), так и в длиннозаплаточном (включение первого нуклеотида, а по некоторым данным и ресинтез более протяженного участка) [Podlutsky A.J. et al, EMBO J., 20, 1477-1482, 2001; Matsumoto Y., et al., Science, 269, 699-702, 1995; Sobol R.W., et al., Nature, 379, 183-186, 1996].
Были исследованы ингибирующие свойства предлагаемого соединения в концентрации 1 мМ на активность β-пол в реакции синтеза ДНК с использованием активированной ДНК (смесь двухцепочечных ДНК с брешами различного размера). Установлено, что исследованное соединение оказывало несущественное влияния на активность β-пол (активность фермента в присутствии ингибитора составляла 30% от контрольной). Слабое ингибирование β-пол этим соединение указывает на его специфичность по отношению к ПАРП-1.
АРЕ-1 является основным белком клеток человека, ответственным за процессинг АП-сайтов [Wilson 3rd D.M., Barsky D. Mutat. Res., 485, 283-307, 2001]. Действие АРЕ-1 на поврежденную ДНК предшествует действию β-пол, предоставляя последней дуплекс с одноцепочечным разрывом, содержащим 3′-гидроксил и 5′-рибозофосфат для последующего удаления 5′-рибозофосфата и заполнения бреши.
Активность АРЕ-1 тестировали в присутствии 32-мерного дуплекса, содержащего АП-сайт в 16-ом положении. Для получения этого субстрата сплавляли 32-мерный олигонуклеотид, радиоактивно меченый по 5′-концу и содержащий остаток dUMP в средине цепи, с комплементарной ему цепью. АП-сайт генерировали непосредственно перед экспериментом, удаляя остатки урацила за счет активности урацил-ДНК-гликозилазы. Отбирали аликвоты реакционных смесей и обрабатывали их боргидридом натрия, что делает нерасщепленные АП-сайты устойчивыми в процессе дальнейшего разделения продуктов реакции в полиакриламидном геле.
Установлено, что предлагаемое соединение не влияло на активность АРЕ-1 в концентрации 1 мМ, что указывает на специфичность этого ингибитора по отношению к ПАРП-1.
Таким образом, предлагаемое соединение осуществляет избирательное ингибирование поли(АОР-рибоз)илирования, не затрагивая ключевые этапы процесса эксцизионной репарации оснований. Кроме того, это соединение является селективным ингибиторов ПАРП-1, не влияя на активность другого члена семейства ПАРП-ПАРП-2.
Пример 4. Цитотоксическое действие предлагаемого соединения
Для оценки цитотоксичности предлагаемого соединения использовались клетки аденокарциномы человека MCF-7 и мышиные фибробласты LMTK. Клетки инкубировали 24 часа при 37°C в среде IMDM или RPMI 1640 (5% CO2), а затем обрабатывали ингибитором ПАРП-1. После 72 часов инкубации проводили стандартный МТТ-тест [Mosmann T.J., Immunol. Methods, 65, 55-63, 1983.] для определения количества живых клеток. Тест показал, что предлагаемое соединение не влияет на выживаемость клеток в концентрации 100 мкМ.
Отсутствие цитотоксичности этого соединения делает его перспективным для разработки на его основе более эффективных ингибиторов ПАРП-1.
Следовательно, предлагаемое соединение оказывает эффективное специфическое ингибирующее действие на фермент ПАРП-1, являясь нетоксичным, дешевым и доступным соединением, расширяет арсенал специфических ингибиторов данного фермента и может быть использовано для создания лекарственных препаратов, применимых в клинической медицине.
Средство для ингибирования фермента поли(АДФ-рибозо)полимеразы-1 человека, представляющее собой 6-ацетил-7,9-дигидрокси-8,9b-диметил-2-етилид-2,11-ен-1,9b,2,3-тетрагидро-11-N-карбоксифенилметиламино-1,3-диоксодибензофуран общей формулы (I):