Рекомбинантный штамм бактерий bacillus subtilis - продуцент фосфолипазы с
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и представляет собой штамм бактерий Bacillus subtilis ВКПМ В-11270 - продуцент фермента фосфолипазы C. При ферментации полученного штамма в 3 л лабораторном ферментере в минимальной среде при температуре 30°C, активность фермента в культуральной жидкости достигает уровня 210 ЕД/мл. Изобретение позволяет получать фосфолипазу C с высокой степенью эффективности. 3 ил., 5 пр.
Реферат
Изобретение относится к микробиологии и биотехнологии и касается штамма Bacillus subtilis - продуцента фермента фосфолипазы С.
Фосфолипазы - ферменты, осуществляющие гидролиз фосфолипидов - сложных эфиров фосфатидной кислоты (глицерофосфорной) и многоатомного спирта, являющихся основным компонентом всех биологических мембран.
В зависимости от положения гидролизуемой связи различают четыре основных класса фосфолипаз: А1, А2, С и D. Фосфолипазы А1 и А2 приводят к образованию лизофосфолипидов и свободных жирных кислот, фосфолипаза D - фосфатидной кислоты и аминоспирта.
Фосфолипазы класса С гидролизуют фосфодиэфирную связь в фосфолипидах с образованием 1,2-диацилглицерола и фосфорного эфира соответствующего амина, и различаются по субстратной специфичности, определяемой полярной группой.
В настоящее время фосфолипазы С используют в пищевой промышленности в процессе рафинирования растительных масел: соевого, подсолнечного, рапсового и др. Неочищенное растительное масло состоит преимущественно из триглицеридов, но содержит до 3% (по массе) фосфолипидов (в основном, фосфатидилхолин и фосфатидилэтаноламин, в меньших количествах - фосфатидилинозитол и фосфатидную кислоту), которые вызывают потемнение масла в ходе дальнейших этапов его рафинирования, а также уменьшают окислительную стабильность масла. Для удаления фосфолипидов при рафинировании, в частности, используют фосфолипазы [Oil Mill Gazetteer. - 2009. - V.115. - P.2-4].
Поддержание повышенной температуры (50-70°C) на стадии отделения фосфолипидов позволяет облегчить процесс за счет снижения вязкости масла и увеличения скорости реакции, поэтому целесообразно использование термофильных ферментов.
В настоящее время для производства рафинированного растительного масла предложен препарат Lecitase Novo™ (Novozymes A/S), содержащий фосфолипазу A1 [Applied Microbiology and Biotechnology. - 2007. - V.74. - N.2. - P.290-300]. Однако использование фосфолипазы С в процессе рафинирования предпочтительнее, поскольку не приводит к высвобождению жирных кислот, которые необходимо удалять в процессе дальнейшей обработки. Это позволяет сократить потери сырья.
Аналогичную стадию рафинирования осуществляют также для предварительной обработки масла перед получением биодизеля.
Другой перспективной областью приложения фосфолипазы С является получение диацилглицеридов с определенной энантиомерной структурой, которые находят применение в синтезе стереоспецифичных соединений, а также являются клеточными медиаторами [Trends in Biotechnology. - 1997. - V.15. - N.3. - P.90-6]. Исследователями продемонстрировано, что последовательное действие двух классов фосфолипаз: С и D может быть использовано, например, для синтеза дигидроксиацетонфосфата (DHAP) - интермедиата тонкого химического синтеза [Appi Microbiol Biotechnol - 2007. - V.75. - P.33-45], или такого важного для медицины и фармацевтики биоактивного соединения, как сфингозин 1-фосфат (S1P), которое является главным регулятором сосудистой и иммунной системы [Journal of Chemical Research. - 1998. - V.998. - N.12. - P.774-5].
К фосфолипазам С, обладающим широким спектром субстратной специфичности, относится фосфолипаза С бактерий Bacillus cereus, которая характеризуется ценными технологическими свойствами: способностью гидролизовать большинство фосфолипидов, представленных в растительных маслах (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин), и работать в водных, органических [Journal of Molecular Catalysis В: Enzymatic. - 1999. - V.6. - P.125-32] и двухфазных системах. Фермент также обладает высокой удельной активностью и термостабильностью: сохраняет активность после нагрева до 100°С, температурный оптимум катализируемых реакций лежит в диапазоне 60-70°С.
Фосфолипаза С из B.cereus является оптимальным ферментом для использования в промышленном рафинировании растительных масел, поскольку не проявляет гемолитической активности, обладает наиболее подходящим спектром субстратной специфичности, термостабильностью и высокой удельной активностью.
Благодаря высокой степени сходства с фосфолипазой С млекопитающих и способности мимикрировать под нее, вызывая, например, биосинтез простагландинов, фосфолипаза из В.cereus является, помимо прочего, предметом медицинских исследований, в качестве модели менее доступного фермента млекопитающих.
Однако, поскольку бактерии В.cereus относятся к группе условно патогенных микроорганизмов и способны вызывать пищевые отравления, их использование в качестве продуцента невозможно. Поэтому для получения фосфолипазы С целесообразно использовать рекомбинантные продуценты. Существуют примеры создания таких продуцентов на основе бактерий Escherichia coli, Bacillus siihtilis и дрожжей Pichia pastoris.
Экспрессия гена фосфолипазы С в клетках E.coli [Protein Expression and Purification. - 1997. - V.10. - P.365-72] приводит к накоплению больших количеств неактивной формы данного фермента в виде телец включения, поэтому для получения активного фермента дополнительно осуществляют стадии разрушения клеток, очистки, рефолдинга и активации белка, что повышает стоимость конечного продукта.
Экспрессия гена фосфолипазы С в Р.pastoris приводит к секреции активного фермента в культуральную жидкость (до 365 ед/мл) [Biotechnology Letters. - 2004. - V.26. - P.1475-9]. Однако культивирование этого продуцента требует присутствия метанола в качестве индуктора и дорогих сред, что делает его использование не выгодным.
На международном рынке фосфолипаза С представлена препаратом Purifine™, производства компании Verenium (Сан Диего, США; ранее Diversa), основой которого является фосфолипаза С BD16449, выделенная из почвенного метагенома и высоко гомологичная фосфолипазе из В.cereus [Regulatory Toxicology and Pharmacology. - 2006. - V.45. - N.1. - P.1-8]. Фермент имеет оптимум pH, равный 7.3, и температурный оптимум около 60°С. Продуцентом является штамм Р.pastoris, в хромосому которого интегрировано шесть тандемных копий экспрессионной кассеты с геном фосфолипазы, однако нет открытых данных об уровне продукции фермента этим штаммом.
Известен [Applied Microbiology and Biotechnology. - 2006. - V.74. - N.3. - P.634-9] продуцент секретируемой фосфолипазы С из В. cereus SBUG 516 на основе штамма В.suhlilis, дефицитного по восьми протеазам. При ферментации в ферментере на богатых средах при температуре 37°С данный штамм синтезирует фосфолипазу С, обладающую активностью 200 ед/мл или 15 мг белка на литр.
Интерес к созданию высокоэффективных продуцентов фосфолипазы С на основе Bacillus subtilis связан с достаточно хорошей генетической изученностью этого объекта и тем, что данный вид бактерий удобен для промышленной ферментации.
Кроме того, работа со штаммами Bacillus subtilis не требует специальных мер предосторожности, так как бактерии этого вида относится к непатогенным микроорганизмам.
Технической задачей заявляемого изобретения является расширение арсенала рекомбинантных микроорганизмов, продуцирующих фосфолипазу С.
Задача решена путем конструирования рекомбинантного штамма бактерий Bacillus subtilis ВКПМ В-11270 - продуцента фосфолипазы С.
Рекомбинантный штамм Bacillus subtilis ВКПМ В-11270 получен из штамма Bacillus subtilis AJ 73 (ВКПМ В-5036) путем трансформации последнего экспрессионной репликативной плазмидой, полученной на основе вектора pHY300PLK (J. Bacteriol (1983), 153, 813-821), названной p-plc и содержащей ген р1С, кодирующий фосфолипазу С из Bacillus cereus ATCC 14579.
Заявляемый штамм Bacillus subtilis депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) по адресу 117545 Москва, 1-ый Дорожный проезд, д.1 и имеет регистрационный номер ВКПМ В-11270.
Штамм Bacillus subtilis ВКПМ В-11270 характеризуется следующими признаками:
Культурально-морфологические признаки.
Грамм-положительная спорообразующая палочковидная бактерия. Суточная культура в жидкой LB среде (мас.%: дрожжевой экстракт - 0.5, пептон - 1, NaCl - 1, вода - остальное) представлена подвижными одиночными палочковидными клетками размером 3-5×0,6 мкм. К третьим суткам образует овальные споры, не превышающие размер клетки, расположенные центрально. При росте на агаризованной LB среде образует мелкоморщинистые, бархатисные колонии белого или кремового цвета размером 1-4 мм.
Физиолого-биохимические признаки.
Облигатный аэроб. Сахара не сбраживает. Ассимилирует: сахарозу, D-глюкозу, L-арабинозу, D-ксилозу, D-маннитол, казеин. Отсутствует способность к гидролизу крахмала. Отличается пониженной протеолитической активностью и способностью к восстановлению нитрата.
Оптимальное значение pH для роста - 5,5-8,0. Не растет при 50°C. Оптимальная температура роста - 30-37°С.
Заявляемый штамм при выращивании в колбах на среде LB способен синтезировать фосфолипазу с активностью до 105 ЕД/мл культуральной жидкости, при выращивании в лабораторном ферментере в минимальной среде М9 (мас.%: NH4Cl - 0,1, CaCl2 - 0,06, KH2HPO2 - 0,06, Na2HPO4×3H2O - 0.12, глюкоза - 1, вода - остальное), при температуре 30°С способен синтезировать фосфолипазу С, обладающую активностью до 220 ЕД/мл культуральной жидкости.
Изобретение проиллюстрировано следующими фигурами графического изображения:
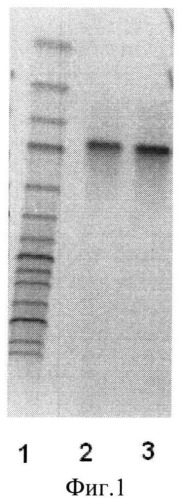
Фиг.1 - Электрофореграмма ПЦР-анализа исследуемых штаммов с помощью проверочных праймеров.
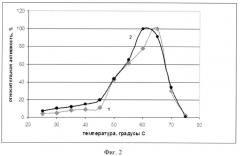
Фиг.2 - График зависимости активности рекомбинантной и нативной фосфолипазы С от температуры.
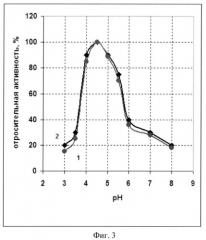
Фиг.3 - График зависимости активности рекомбинантной и нативной фосфолипазы С от pH инкубационной среды.
Получение и культивирование штамма Bacillus subtilis ВКПМ В-11270 подтверждено следующими примерами.
Пример 1. Получение штамма Bacillus subtilis ВКПМ В-11270.
Трансформацию Bacillus subtilis осуществляют методом, основанном на свойстве природной компетенции клеток Bacillus subtilis (J.Bacteriol. - 1961 - N.81 - P.741-746.).
Для приготовления компетентных клеток используют штамм Bacillus suhtilis AJ73 (ВКПМ В-5036). В качестве ДНК используют 1 мкг ДНК плазмиды p-plC. Селекцию трансформантов ведут на агаризованной питательной среде LB с добавлением антибиотика эритромицина.
Наличие целевого рекомбинантного гена в составе плазмид трансформантов подтверждают методом ПЦР-анализа.
Из бактериальныех клонов, полученных в результате генетической трансформации, стандартными методами выделяют плазмидную ДНК, используемую в качестве матрицы для проведения полимеразной цепной реакции с использованием специфических проверочных праймеров.
Последовательность проверочных праймеров:
plc-f TTTCATATGAAAAAGAAAGTACTTGCTTTA
plc-r AAAAGCGCTTACCTCCATTTGTATAGTAAT
Режим реакции ПЦР:
95°С - 3 мин - 1 цикл
35 циклов:
95°С - 30 сек.
60°С - 30 сек.
72°С- 60 сек.
72°С - 5 мин - 1 цикл.
Для контроля величины фрагментов ДНК при электрофорезе используют молекулярный маркер GeneRuler 1kb DNA Ladder (Fermentas) (фиг.1 линия 1 размер фрагментов снизу вверх - 10000, 8000, 6000, 5000, 4000, 3500, 3000, 2500, 2000. 1500, 1000, 750, 500, 250 п.н.).
Наработка фрагментов размером 970 п.н. при использовании проверочных праймеров plc-f и plc-r подтверждает присутствие целевого рекомбинантного гена plc в составе плазмид полученных трансформантов Bacillus sublilis AJ73/p-plc (фиг.1, линии 2 и 3).
Фосфолипазную активность трансформантов первоначально оценивают по зонам помутнения в чашечном тесте [Journal of Dairy Science - 1976 - N.59 - P.2024-2030]. Данный метод позволяет подтвердить присутствие фосфолипазы в исследуемых образцах. В тесте используют агаризованною среду LB (мас.%: дрожжевой экстракт - 0,5, пептон - 1, NaCl2 - 1, агар - 2, вода - остальное) с добавлением лицетина (3 мас.%) и 5 mM хлорида кальция. В качестве контроля используют штамм Bacillus subtilis AJ73.
Клоны трансформантов, у которых обнаружено наибольшее соотношение диаметра зоны помутнения к диаметру колонии на чашках, отбирают для последующего культивирования, которое проводят при 30°С на качалке (250 об/мин) в пробирках (50 мл) с рабочим объемом 10 мл в жидкой питательной среде LB. Посев осуществляют бактериологической петлей. Ферментацию продолжают в течение 24 часов.
Фосфолипазную активность определяют по гидролизу O-(4-итрофенилфосфорил) xonHna(NPPC) [J. Biochem - 1968 - N.63 - Р.681-683].
За единицу активности принимают количество фермента, необходимое для образования 1 мкмоля нитрофенола в минуту.
По результатам ферментации отбирают заявляемый штамм Bacillus suhfilis ВКПМ В-11270, который при культивировании в пробирках позволяет получать фитазу с активностью 80 ЕД/мл культуральной жидкости.
Пример 2. Культивирование штамма Bacillus suhtilis ВКПМ В-11270 в лабораторных условиях.
Культуру Bacillus subtilis ВКПМ В-11270 наращивают в 5 мл среды LB в течение 20 часов при 30°C с аэрацией на качалке (250 об/мин).
Инокулят переносят в колбу объемом 750 мл с 45 мл свежей среды LB и растят при 30°С в течение 24 часов с аэрацией на качалке (250 об/мин).
Через 5, 10, 15, 20 и 24 часа культивирования отбирают пробы растущей бактериальной культуры, осаждают клетки методом центрифугирования и в надосадочной жидкости определяют наличие активности фосфолипазы С.
При ферментации в колбах в питательной среде LB штамм ВКПМ В-11270 синтезирует фосфолипазу С, обладающую активностью 105 ЕД/мл культуральной жидкости.
Пример 3. Культивирование штамма Bacillus subtilis ВКПМ В-11270 в лабораторном ферментере.
Для получения посевного материала в пробирках культуру Bacillus suhtilis ВКПМ В-11270 наращивают в 5 мл среды LB в течение 20 часов при 30°C с аэрацией (250 об/мин). Затем культуру их пробирки переносят в колбу с 50 мл среды LB. Культивируют в шейкере-инкубаторе (250 об/мин) при 30°С в течение 24 часов.
Полученный посевной материал переносят в 3 л ферментер и растят 48 часов в 1 литре минимальной среды (мас.%: NH4Cl - 0,1, CaCl2 - 0,06, KH2PO4 - 0,06, Na2HPO4×3H2O - 0,12, глюкоза - 1, вода - остальное).
Через 12, 24, 36 и 48 часов культивирования отбирают пробы растущей бактериальной культуры, осаждают клетки методом центрифугирования и надосадочную жидкость используют для определения активности фосфолипазы С.
При ферментации в 3 л лабораторном ферментере в минимальной питательной среде при 30°С штамм ВКПМ В-11270 синтезирует фосфолипазу С, обладающую активностью 210 ЕД/мл культуральной жидкости.
Пример 4. Исследование температурного оптимума рекомбинантной фосфолипазы С.
Для определения температурного оптимума рекомбинантной фосфолипазы С измеряют специфическую активность фермента при разных значениях температур по гидролизу O-(4-нитрофенилфосфорил) холина (NPPC). Полученные результаты, приведены на фиг.2 (кривая 2) в сравнении с аналогичными значениями нативной фосфолипазы С из Bacillus cereus ATCC 14579 (кривая 1).
Показано, что температурный оптимум действия нативной и рекомбинантной фосфолипаз С практически совпадают (63-67°C и 60-65°C, соответственно).
Пример 5. Исследование оптимума pH рекомбинантной фосфолипазы С.
Активность фосфолипазы С измеряют при разных значениях pH инкубационной среды по гидролизу 0-(4-нитрофенилфосфорил) холина (NPPC) и сравнивают с аналогичными значениями нативной фосфолипазы С из Bacillus cereus ATCC 14579. Полученные данные, приведенные на фиг.3, показывают, что pH оптимум действия рекомбинантной фосфолипазы С (кривая 1) находится в диапазоне pH от 4.5 до 5.0 и практически совпадает с оптимумом pH нативной фосфолипазы С (кривая 2).
Таким образом, заявляемый штамм Bacillus subtilis ВКПМ В-11270 растет на минимальной среде при температуре 30°C и продуцирует фосфолипазу С, обладающую активностью до 210 ед/мл культуральной жидкости, при этом полученный фермент сохраняет промышленно ценные свойства нативного фермента.
Рекомбинантный штамм Bacillus subtilis ВКПМ В-11270 - продуцент фосфолипазы C.