Рекомбинантная плазмидная днк рак380, кодирующая полипептид рекомбинантного фактора iх свертываемости крови человека, линия клеток cricetulus griseus cho 1e6 - продуцент рекомбинантного фактора iх свертываемости крови человека и способ получения полипептида, обладающего активностью рекомбинантного фактора iх
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для получения рекомбинантного фактора свертываемости крови IX человека (hFIX). Рекомбинантная плазмидная ДНК рАК380, содержащая ген белка rhFIX, MAR - область прикрепления к ядерному матриксу гена лизоцима птиц, усилитель транскрипции вируса CMV, внутренний сайт инициации трансляции IRES вируса энцефаломиокардита, ген DHFR мыши, сигнал полиаденилирования вируса SV40, ген аминогликозид-3'-фосфотрансферазы для устойчивости к генетицину (Neo), кассету для экспрессии в клетках бактерий гена β-лактамазы для устойчивости к ампицилину, используется для получения рекомбинантного фактора hFIX в клетках линии Cricetulus griseus CHO 1E6. Путем трансформации линии клеток С.griseus CHO DHFR - рекомбинантной плазмидной ДНК рАК380 получают линию клеток С.griseus CHO 1E6, продуцирующую рекомбинантный hFIX со стабильно высоким выходом на уровне 50 мг/л/24 ч. После культивирования клеток-продуцентов выделяют hFIX путем псевдоаффинной хроматографии на Q-Сефарозе с элюцией 10 мМ CaCl2, затем на Heparin-Сефарозе FF с элюцией 600 мМ NaCl и хроматографии на гидроксиапатите типа I с элюцией 600 мМ К3РО3 и хроматографии на Source 30Q с элюцией 600 мМ ацетатом аммония. 3 н. и 1 з.п. ф-лы, 5 ил., 7 пр., 3 табл.
Реферат
Область техники
Изобретение относится к биотехнологии, в частности к генной инженерии, и может быть использовано для получения рекомбинантного фактора свертываемости крови IX человека (rhFIX). Изобретение представляет собой рекомбинантную плазмидную ДНК рАК380, кодирующую полипептид с последовательностью рекомбинантного фактора свертываемости крови IX человека, и продуцент на основе линии клеток Cricetulus griseus CHO 1E6, содержащей указанную плазмидную ДНК, и синтезирующий рекомбинантный фактор свертываемости крови IX человека.
Предшествующий уровень техники
Фактор коагуляции крови IX (FIX) или, иначе, фактор Кристмаса представляет собой гликопротеин, состоящий из 415 аминокислот. Он синтезируется в гепатоцитах в виде одноцепочечного неактивного предшественника молекулярной массой 55 кД. Перед секрецией в кровяное русло происходит отщепление сигнальной последовательности из 46 аминокислот. В процессе коагуляции происходит активация фактора IX и его трансформация в активную форму под действием комплекса фактора свертывания VIIa и тканевого тромбопластина (внешний путь коагуляции) или фактора ХIа (внутренний путь коагуляции) в присутствии дивалентных катионов кальция. Активная форма фактора IX - фактор IXa - в комбинации с фактором VIII активирует фактор X, который, в свою очередь, способствует переходу протромбина в тромбин и образованию фибринового сгустка.
Недостаточность фактора IX лежит в основе гемофилии В. Частота встречаемости этого заболевания составляет 1:30000 мужчин. В России, согласно информации Национального фонда гемофилии, в настоящее время около 3000 больных гемофилией В. Заболевание сопровождается частыми кровотечениями, которые могут требовать немедленного клинического вмешательства и представлять угрозу для жизни, а также приводить к отсроченным последствиям (нарушениям в суставах, мышцах, костях скелета). Риск развития кровотечений зависит от степени выраженности гемофилии В:
концентрации фактора IX в крови. У пациентов с легкой формой (0.05-0.4 МЕ/мл) неконтролируемые кровотечения развиваются только в случае хирургических вмешательств, удаления зубов, тяжелых повреждений. Для пациентов со средней степенью гемофилии В (0.01-0.05 МЕ/мл) характерны продолжительные кровотечения при незначительных травмах. У пациентов с тяжелой формой гемофилии (<0.01-0.05 МЕ/мл) кровотечения развиваются спонтанно. Средняя и тяжелая формы встречаются у 60-70% больных гемофилией В (Thromb Haemost. 2011 Sep; 106(3):398-404. Epub 2011 Aug 11. Review).
Целью лечения гемофилии В является предотвращение и контролирование эпизодов кровотечений за счет заместительной терапии FIX. Поэтому оптимальным вариантом лечения является профилактическое введение препаратов FIX. В настоящее время используются как препараты FIX, выделенного из плазмы, так и рекомбинантный фактор IX (Benefix). Недостатком продуктов, полученных из плазмы, является риск передачи прионных и вирусных заболеваний, устойчивых к современным методам инактивации. В связи с этим предпочтительным является использование рекомбинантного продукта.
К сожалению, в РФ высокая стоимость рекомбинантных факторов коагуляции крови служит сдерживающим фактором в вопросе их широкого применения. Поэтому создание продуцента rhFIX, позволяющего получать высококачественный и сравнительно недорогой белок, который можно будет использовать в производстве отечественного препарата, что позволит расширить арсенал лекарственных средств для больных гемофилией В, является весьма актуальной и важной задачей.
Фактор IX синтезируется в виде предшественника, состоящего из 461 аминокислоты, содержащего по сравнению со зрелой формой дополнительные 46 аминокислот на N-конце. Сигнальная последовательность (28 аминокислот) необходима для секреции фактора, ее удаление происходит в эндоплазматическом ретикулуме. Pro-домен (из 18 аминокислот) представляет собой домен связывания γ-карбоксилазы, карбоксилирующей близлежащий Gla домен. Удаление Pro-домена происходит после карбоксилирования в аппарате Гольджи за счет активности РАСЕ (Paired basic Amino acid Cleaving Enzyme - «фермент, расщепляющий белок в месте спаренных основных аминокислот»). Гамма-карбоксилирование и удаление пропептидного домена являются непременным условием получения физиологически активного FIX.
Одно из основных препятствий при получении больших количеств полностью функционального рекомбинантного фактора FIX связано с наличием сложных посттрансляционных модификаций, в числе которых помимо стандартного гидроксилирования уже упомянутые: удаление Pro-домена и карбоксилирование Gla-домена. Gla-Домен содержит остатки глутаминовой кислоты, которые подвергаются посттрансляционной модификации путем присоединения карбоксильных групп. Модификация остатков глутаминовой кислоты является результатом действия витамин К-зависимого фермента, известного как γ-глутамилкарбоксилаза. Сверхэкспрессия белка приводит к тому, что оба процесса - карбоксилирование и отщепление Pro-домена проходят не полностью, и в итоге получается смесь активного белка с его неактивными недокарбоксилированными или незрелыми формами. Было показано, что при экспрессии белка в СНО клетках около 50% фактора IX сохраняет Pro-домен (J. Biol. Chem., 1989, 264 (12): 6615-18) и всего 1-2% белка оказываются карбоксилированными (J. Biol. Chem., 1986, 261 (21): 9622-28). При этом специфическая активность рекомбинантного белка оказывалась в среднем в три раза меньше, чем активность FIX, полученного из плазмы. Иными словами, первоначальные попытки получения биологически активного рекомбинантного фактора IX были связаны с существенными трудностями (Nature, 1985, v.315: 683-685, Nature, 1985, v.316: 271-273).
Сначала низкие выходы активного белка пытались объяснить проблемами с гамма-карбоксилированием. С одной стороны, было очевидно, что гамма-карбоксилирование необходимо для получения активного белка, с другой - было непонятно, содержат ли клетки млекопитающих необходимый фермент - карбоксилазу. Поэтому первые системы экспрессии конструировали с использованием клеток, заведомо содержащих нужный фермент. Так европейский патент ЕР 0195592 раскрывает две клеточные системы для экспрессии фактора IX: в первой использованы клетки гепатомы крысы Н4-11-Е-С3, известные своей способностью продуцировать гамма-карбоксилазу, во второй - клетки почек собаки (MDCK). Однако в первом случае вообще не удалось достичь заметных выходов (анализ показал, что только одна плазмида была интегрирована в геном клетки). Во втором случае (был использован вектор, содержащий промотор и последовательность полиаденилирования из SV40 и ген устойчивости к гентамицину) было получено два эффективных клона (593 и С6), и выход белка составил 100 и 250 нг/мл/день. Специфическая активность белка составляла 100% и 91% соответственно.
Патент США 4770999 предлагает дополнительный путь решения проблемы низкого выхода - добавление в среду для культивации клеток витамина К. Были использованы клетки СНО DHFR (-), а вектор содержал промотор и последовательность полиаденилирования из SV40, ген DHFR и ген устойчивости к гентамицину. Проводилась со-экспрессия данного вектора с плазмидой, экспрессирующей DHFR. Выход белка составил 43.4 мкг/мл. В присутствии витамина К удалось достичь выхода 0.275 МЕ/мл/день/106 клеток, однако специфическая активность оказалась невысока - 16.5 МЕ/мг белка. Что составляет всего 9% от активности фактора IX, полученного из нормальной плазмы.
Следующим шагом была попытка повысить выход активного фактора IX путем со-экспрессии с γ-глутамилкарбоксилазой, однако существенного увеличения продуктивности клеточной линии достичь не удалось (Biochemistry, 2002, Dec 17; 41(50):15045-55). Авторы патента RU2372401 предположили, что проблема заключалась в наличии двух одинаково сильных промоторов, и предложили вектор, включающий последовательности белка FIX и γ-глутамилкарбоксилазы, содержащий два промотора разной силы: сильный промотор CMV для FIX и более слабый SV40 для γ-глутамилкарбоксилазы, так что фактор IX и γ-глутамилкарбоксилаза экспрессируются в соотношении от 5:1 до 45:1. При соотношении 45:1 и одинаковом направлении промоторов, в клетках CHO-S удалось получить выход активного белка 7,3 мг/л.
Использование другой стратегии - введение в вектор последовательности фермента, отщепляющего пропептид фактора IX, а именно РАСЕ (другое название - фурин), для повышения выхода белка описано в нескольких статьях (J. Biol Chem. 1986 Jul 25;261(21):9622-8; Proc Nati Acad Sci USA, 1993, May 15; 90(10):4611-5; Semin Hematol. 1998 Apr; 35(2 Suppl 2):4-10). В этих работах показано, что со-экспрессия с РАСЕ приводит к увеличению выхода активного белка в 2-3 раза, но специфическая активность такого белка все еще ниже полученного из плазмы (35-75 МЕ/г и 150 МЕ/г соответственно).
Американский патент US 5460950 раскрывает системы экспрессии, включающие вектор, содержащий последовательность РАСЕ и последовательность требуемого белка или же два вектора, один - для экспрессии РАСЕ, второй - для экспрессии нужного белка. Авторы патента также показали, что присутствие РАСЕ повышает эффективность гамма-карбоксилирования. Система экспрессии в СНО клетках, содержащая вектор, экспрессирующий РАСЕ и второй вектор, экспрессирующий фактор IX, в присутствии витамина К давала в 2-3 раза больший выход активного белка, чем аналогичная система без использования РАСЕ. Выход белка достигал 20 мкг/мл или 30 пг/клетку.
Наиболее близким аналогом настоящего изобретения является система экспрессии, предложенная в международной заявке WO 2008153366. Авторы публикации объединили несколько использованных ранее подходов и предложили путь одновременной экспрессии вектора, содержащего последовательность РАСЕ или γ-глутамилкарбоксилазы вместе с вектором, содержащим последовательность фактора IX, причем этот вектор также включает последовательность MAR β-глобулина человека и последовательность интрона 1 фактора IX, для увеличения экспрессии белка. При этом по мнению авторов патента основной вклад в увеличение уровня экспрессии вносит интрон 1, позволяющий повысить выход белка в 10 раз в сравнении с вектором, в котором эта последовательность отсутствует. В результате со-экспрессии удалось достичь выходов фактора IX (лучший клон) до 11.9 мкг/мл или 14.3 мкг/106клеток/день. Авторы также отмечают, что проведение культивирования в присутствии соевого и дрожжевого гидролизатов позволяет повысить выход конечного продукта дополнительно в 2 раза.
Недостатком данного изобретения является использование собственной кассеты с отдельным промотером для гена DHFR. Это приводит к тому, что при амплификации клетки в геноме увеличивается копийность в основном кассеты, экспрессирующей DHFR, а не FIX в силу отсутствия функциональной связи между обоими трансгенами. Подобная система имеет низкий потенциал применения в промышленном производстве лекарственного средства на основе рекомбинантного FIX, поскольку использование описанного подхода обуславливает высокую вероятность вырождения клонов и, как правило, приводит к существенному снижению уровня продукции FIX при продолжительном культивировании клеточных линий в отсутствие селективного давления.
В этой связи стоит отметить, что ни в одном из приведенных выше патентных документов нет данных о стабильности полученной системы экспрессии (числе пассажей), что является одним из важнейших критериев применимости клеточной линии для промышленного производства белка, наряду с высоким уровнем экспрессии. Поэтому сохраняется потребность в создании не только эффективных, но и стабильных систем экспрессии фактора IX, позволяющих прогнозируемо получать биологически активный белок с высоким выходом.
Раскрытие изобретения
Настоящее изобретение решает задачу конструирования плазмидной ДНК, содержащей последовательность рекомбинантного фактора IX, и создания линии клеток (штамма-продуцента), позволяющей получать рекомбинантный фактор IX с высоким выходом на постоянном уровне около 23-45 мг/л/сутки и сохраняющим свою производительность на протяжении большого числа пассажей (не менее 60), что является важным и необходимым для промышленного производства белка.
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК рАК380, состоящей из 11236 п.о. и линии клеток Cricetulus griseus CHO 1E6, позволяющей получать фактор свертываемости крови со стабильно высоким выходом, достаточным для промышленного производства.
Введение различных генетических элементов генома эукариот в состав рекомбинантных конструкций, используемых для последующей трансфекции клеток млекопитающих, может оказывать положительное влияние на стабильность трансгена в геноме клетки-реципиента, существенно улучшая ростовые характеристики культуры (S.C. Makrides Gene Transfer and Expression in Mammalian Cells, (2003) Elsevier Science, chapters 10-12). Подобные элементы, в частности MAR, используются для создания промышленных штаммов-продуцентов, для которых критическим параметром, определяющим возможность его использования в производстве, является стабильность уровня продукции и скорости роста культуры.
Элементы прикрепления к ядерному матриксу MAR (Matrix Attachment Regions) представляют собой фрагменты ДНК эукариот длиной 300-3000 п.о. и играют ключевую роль в организации ядерной и хромосомной архитектуры. В интерфазе они фиксируют хроматин с белками, формирующими ядерный матрикс, разделяя геном эукариот на независимые хроматиновые петли (Mirkovitch, J., Mirault, M.E., and Laemmli, U.K. (1984) Cell 39, 223-232.). Благодаря колокализации MAR-элементов с участками активной транскрипции и регуляторных элементов в геноме, первые положительно влияют на уровень транскрипции трансгена, привлекая активаторы транскрипции и контролируя доступность ДНК в составе хроматина. Помимо указанных свойств MAR-элементы, например MAR гена лизоцима птиц, могут предотвращать постепенное снижение активности трансгенного промотера, что существенно повышает стабильность уровня экспрессии трансгена (Allen, G.C., Spiker, S., and Thompson, W.F. (2000) Plant Mol. Biol. 43, 361-376).
В процессе конструирования плазмиды мы обнаружили, что использование MAR в плазмиде, включающей ген rhFIX, позволяет поддерживать уровень экспрессии данного белка с наибольшей стабильностью.
Преимущества предлагаемого изобретения также заключаются в использовании химико-ферментативного метода синтеза гена rhFIX, что позволяет подобрать оптимальный кодонный состав гена, избежать наличия в последовательности структур ДНК, препятствующих процессу трансляции, криптических сайтов сплайсинга, полиаденилирования. Оптимизация первичной структуры гена и использование энхансера транскрипции цитомегаловируса CMV, а также фрагмента ДНК, обеспечивающего прикрепление к ядерному матриксу MAR, позволяют существенно увеличить уровень секреции фактора IX в питательную среду.
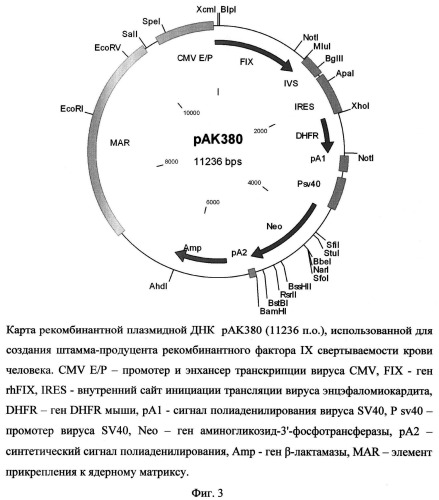
Рекомбинантная плазмидная ДНК рАК380 содержит следующие последовательности: MAR - район прикрепления к ядерному матриксу гена лизоцима птиц, энхансер и промотор транскрипции вируса CMV, кДНК гена rhFIX, внутреннего сайта инициации трансляции IRES, гена DHFR, сигнала полиаденилирования вируса SV40, кассеты, содержащей все необходимые элементы для экспрессии гена аминогликозид-3'-фосфотрансферазы (Neo), обеспечивающего устойчивость штамма клеток-продуцента к генетицину, и кассеты для экспрессии в клетках бактерий гена β-лактамазы, обеспечивающей устойчивость к ампицилину. Плазмида рАК380 (фиг. 3), кодирующая полипептид фактора FIX, характеризуется следующими признаками:
- состоит из 11236 п.о.,
- имеет молекулярную массу 7,3 МДа,
- кодирует полипептид фактора IX свертываемости крови человека;
- обеспечивает устойчивость бактериальных клеток, трансформированных данной плазмидой, к ампицилину и клеток млекопитающих, трансфицированных указанной плазмидой, к генетицину,
- содержит уникальные участки узнавания следующих эндонуклеаз рестрикции: AhdI ( 6259 п.о.), ApaI (1784 п.о.), BamHI (5082 n.o.), BbeI (4287 n.o.), BglII (1548 п.о.), BlpI (15 п.о.), BssHII (4685 п.о.), BstBI (4969 п.о.), EcoRI (8942 п.о.), EcoRV (9876 n.o.), KasI (4287 n.o.), MluI (1332 n.o.), NarI (4287 n.o.), PspOMI (1784 n.o.), PspXI (2249 n.o.), RsrII (4803 n.o.). SalI (10153 n.o.), SfiI (4040 n.o.), SfoI (4287 n.o.), SpeI (10489 n.o.), StuI (4091 n.o.), TthlllI (4403 n.o.), XcmI (11229 n.o.), XoI (2250 n.o.).
Для производства белка была выбрана линия клеток Cricetulus griseus СНО DHFR-. Исходная линия приобретена в Американской коллекции клеточных культур (АТСС), CRL 9096. Выбор линии клеток обусловлен наличием оптимального профиля гликозилирования для синтеза человеческих белков, а также стабильностью и безопасностью данной линии клеток, что является важнейшим параметром для производства терапевтических белков. На основе этой линии клеток была получена линия клеток Cricetulus griseus CHO 1Е6 - продуцент рекомбинантного фактора IX свертываемости крови человека, являющаяся производным яичников взрослого китайского хомяка Cricetulus griseus CHO и характеризующаяся следующими признаками:
Морфологические признаки: Клетки имеют типичные морфологические признаки эпителиальной культуры, и, исходно, представляет собой адгерантную культуру. Линия является гиподиплоидной (2n=22), модальное число хромосом 20.
Культуральные признаки: Клетки культивируются в монослое на простых питательных средах, например, на среде ДМЕМ в присутствии 2-10% фетальной сыворотки.
Физиолого-биохимические признаки: Клетки растут при температуре 37°С, pH 6.7-7.3.
Устойчивость к антибиотикам: Клетки обладают устойчивостью к генетицину в концентрации 1 мг/мл.
Штамм клеточной линии Cricetulus griseus CHO 1Е6, был депонирован во Всероссийскую Коллекцию промышленных микроорганизмов в ГНИИГенетика-ВКПМ под номером Н-125, дата депонирования 20.06. 2012 г.
Заявленное изобретение поясняется на следующих фигурах:
На фиг.1 представлена аминокислотная последовательность фактора IX человека, SEQ ID NO:1, состоящая из 461 аминокислотного остатка.
На фиг.2 представлена оптимизированная последовательность гена фактора IX, SEQ ID NO:2, 1386 пар оснований.
На фиг.3 представлена карта рекомбинантной плазмидной ДНК pAK380, использованная для создания штамма-продуцента рекомбинантного фактора IX свертываемости крови человека.
На фиг.4 (а и б) представлена схема получения векторной конструкции pAK380 для экспрессии рекомбинантного фактора IX свертываемости крови человека.
На фиг.5 представлена схема выделения рекомбинантного фактора IX свертываемости крови человека.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Конструирование рекомбинантной плазмидной ДНК pAK380.
Нуклеотидную последовательность, соответствующую кДНК гена коагуляционного фактора IX человека, получают химико-ферментативным синтезом. Для этого оптимизированную последовательность гена разбивают на перекрывающиеся фрагменты размером около 50 п.о. Химический синтез олигонуклеотидов, соответствующих этим фрагментам, проводят с помощью твердофазного фосфамидитного метода, например, с использованием синтезатора ASM-102U (БИОССЕТ, Новосибирск). Полученные олигонуклеотиды подвергают 5'-концевому фосфорилированию с использованием Т4 полинуклеотидкиназы (NEB, США). Фосфорилированные олигонуклеотиды смешивают в эквимолярном соотношении в 50 мкл буфера, содержащего 20 мМ трис-HCl, pH 7,56, 10 мМ MgCl2, 0,2 мМ rATP, 10 мМ дитиотреита, прогревают до 65°С, медленно охлаждают до 37°С в течение часа и добавляют Т4-ДНК-лигазу. Реакцию лигирования ДНК проводят 12 ч при 37°С, 0,1 мкл полученного раствора используют в качестве матрицы в полимеразной цепной реакции (ПНР) в присутствии термостабильной ДНК-полимеразы Pfu и специфических праймеров:
F7_fwd 5'-TAGGCTAGCCGCCACCATGCAGCGCGTGAACATGAT-3' и
F7_rev 5'-CGACGCGTTAGGTCAGCTTGGTCTTCTCCTTGAT-3'.
Синтезированный таким образом фрагмент ДНК содержит последовательность кДНК гена коагуляционного фактора IX человека, фланкированную сайтами узнавания рестриктаз NheI и MluI - SEQ ID NO:2 (фиг.2).
Продукт амплификации обрабатывают Т4-полинуклеотидкиназой, очищают электрофорезом в 1% агарозном геле, полосу ДНК величиной около 1400 п.о. выделяют из геля методом электроэлюции, осаждают ДНК из раствора этанолом и клонируют в плазмидный вектор pUC19 (New England Biolabs), предварительно обработанный HincII.
Для получения векторной ДНК pAK380 использовали серию последовательных этапов клонирования (фиг.4). Первоначально, используя сайты рестрикции XbaI и NotI, в вектор pIRES (Clontech, США) клонировали ген дигидрофолатредуктазы мыши, полученный методом ПЦР с использованием геномной ДНК, выделенной из клеток миеломы мыши SP2/0, и специфических праймеров
DHFR_rwd 5'-
CCTCTAGATGGTTGTGGCCATATTATCATCGTGTTTTTCAAAG-3' и
DHFR rev 5'-GGAAGCGGCCGCTTAGTCTTTCTTCTCGTAGACTTCA-3'
с последующим проведением сайт-направленного мутагенеза для оптимизации консенсусной последовательности в окружении инициаторного кодона IRES-элемента с помощью набора QuikChange® II XL (Stratagene, США) и следующих олигонуклеотидов:
D3_fwd
5'-CCTTTGAAAAACACGATGATAATATGGCCACAACCATGGTTCGACCA
TTGAACTGCATC-3' и
D3_rev
5'- GATGCAGTTCAATGGTCGAACCATGGTTGTGGCCATATTATCATCGT
GTTTTTCAAAGG-3'.
В полученную плазмиду рАР225 по сайтам рестрикции NheI и MluI клонировали синтезированную ранее последовательность кДНК гена фактора IX.
Первичная структура промежуточной векторной конструкции рАК379 в районе инициаторного кодона IRES-элемента была подтверждена методом секвенирования по Сэнгеру.
Плазмиду рАК379 далее последовательно обрабатывали эндонуклеазой рестрикции BgHI и Т4-ДНК полимеразой и образовавшийся вектор использовали в реакции дотирования с ПЦР-продуктом, полученным с использованием MAR-специфических праймеров
MAR_fwd 5'-GGGGATCCGTAATACAATTGTACCAGGTTTTGGTTTATTAC-3'
и MAR_rev 5'-
GAAAACAATATATTTCCAAATGAAAAAAAAATCTGATAAAAAG-3'
Отбор полученных после трансформации лигазной смеси бактериальных клеток XL-10 Gold проводили таким образом, чтобы выявить плазмидную ДНК рАК380, содержащую последовательность MAR в геномной ориентации по отношению к промотеру.
В дальнейшем первичная последовательность полученной плазмидной ДНК была подтверждена методом сиквенирования по Сэнгеру. По данным секвенирования отобрали плазмиду, нуклеотидная последовательность NheI-ММ-фрагмента которой кодирует аминокислотную последовательность, полностью идентичную последовательности hFIX, которую использовали в дальнейшей работе.
Пример 2.
Получение линии клеток Cricetulus griseus CHO 1E6 - продуцента рекомбинантного фактора IX свертываемости крови человека.
Для получения клеточной линии CHO DHFR- (1E6) - продуцента рекомбинантного фактора IX свертываемости крови человека (rhFIX), клетки линии Cricetulus griseus CHO DHFR- (АТСС, CRL 9096), трансфицируют плазмидной ДНК р380, линеаризованной по сайту рестрикции BspHI, например методом липофекции при помощи реагента jetPEI™ (Polyplus Transfection Inc., США).
Клетки Cricetulus griseus CHO DHFR- высевают на чашку Петри (например, диаметром 10 см) с плотностью 2×104 клеток/см2 в 12 мл среды DMEM, содержащей 10% бычьей фетальной сыворотки, и инкубируют 24 часа при 37°С в CO2 инкубаторе.
Далее проводят трансфекцию, используя 15 мкг линеаризованной по сайту рестрикции Bsp HI плазмиды pAK380 и 20 мкл реагента jetPEI™ на лунку согласно рекомендациям производителя (соотношение N/P=5). Через 48 часов после трансфекции начинают селекцию трансфицированной культуры с целью получения стабильных трансфектантов путем смены среды на селективную:
среда ЕМЕМ с добавлением 10% диализованной сыворотки в присутствии антибиотика генетицина в концентрации 1 мг/мл. Смену селективной среды, проводят регулярно каждые 3-4 дня. Начиная с 7-го дня, лунки анализируют на наличие клонов активно делящихся клеток. По окончании процедуры селекции (окончание селекции определялось по полной гибели не трансфицированной популяции клеток, также находящихся под давлением антибиотика) и восстановления жизнеспособности пула стабильных трансфектантов была определена его продуктивность.
Продуктивность клонов оценивают методом твердофазного иммуноферментного анализа (ELISA) используя, например, набор (AssayPro, США) или иммуноферментного анализа (с использованием моноклональных или поликлональных антител, специфических по отношению к коагуляционному фактору FIX человека. Для этого в чашках, где клетки достигли 80-90% конфлюента, культуральную среду заменяют на свежую с добавлением витамина К1 (5 мкг/мл), и инкубируют 24, 48 и 72 часа при 37°С в СО2-инкубаторе. Супернатант используют в ELISA-тесте. Продуктивность пула стабильных трансфектантов составляла не менее 4 мг/л.
Для увеличения уровня экспрессии рекомбинантного фактора IX свертываемости крови человека (rhFIX), человека пул стабильных трансфектантов был подвергнут процедуре амплификации возрастающими концентрациями метотрексата (МТХ).
Для биотехнологических целей в системе амплификации рекомбинантных генов в качестве маркера селекции часто используют ген дигидрофолатредуктазы (DHFR), интегрированный в экспрессирующий вектор. Фермент DHFR катализирует превращение фолиевой кислоты в тетрагидрофолат, необходимый для синтеза эукариотическими клетками глицина, тимидинмонофосфата и пуриновых оснований. В этой связи клетки СНО, в которых ген DHFR инактивирован под действием мутации (СНО DHFR-), не растут на средах без нуклеозидов и приобретают эту способность после трансфекции плазмидным вектором, экспрессирующим DHFR.
Растущие трансфектанты далее отбираются по признаку амплификации гена DHFR на фоне увеличивающихся концентраций метотрексата - ингибитора DHFR, в питательной среде, так как увеличение числа копий гена будет придавать клеткам устойчивость к ингибитору в больших концентрациях. После проведения множественных раундов селекции получают популяцию клеток, содержащих до нескольких сотен копий гена DHFR.
Для данного стабильно трансфицированного пула было проведено 3 последовательных раунда амплификации метотрексатом. Для этой цели клетки культивируются на среде MEM, не содержащей глицин, гипоксантин и тимидин, в присутствии 10% диализованной фетальной сыворотки с добавлением увеличивающихся количеств метотрексата (Таблица 1). Продолжительность каждого раунда составляла примерно 10-14 дней.
| Таблица 1 | ||
| Концентрация МТХ | Продуктивность, пкг/кл/24 ч | Продуктивность, мг/л |
| Без МТХ | 3,5 | 4,0 |
| 100 нМ | 5,0 | 5,2 |
| 500 нМ | 9,8 | 4,6 |
| 1 мкМ | 20 | 7,3 |
Далее амплифицированный пул стабильных трансфекантов рассевают на полужидкую среду Clone Media-CHO с плотностью 1000 клеток на чашку Петри и, после завершения клонообразования, проводят субклонирование, например, с помощью автоматизированной системы ClonePix. Всего было проанализировано методом ELISA 133 клона, диапазон уровня экспрессии составлял 1-14 мг/л. Для дальнейшей работы по соотношению уровня экспрессии целевого белка и ростовых свойств были отобраны 3 лидерных клона (Таблица 2).
| Таблица 2 | |||
| Монослойная культура, среда ЕМЕМ+10% сыворотки | 1Е6 | 2Н4 | 1А10 |
| Мг/л | 10,4 | 11,8 | 13,5 |
| пкг/кл/день | 45 | 80 | 31 |
Линия клеток Cricetulus griseus CHO 1Е6 - продуцент рекомбинантного фактора IX свертываемости крови человека (rhFIX), была успешно адаптирована к суспензионным бессывороточным условиям культивирования. Характеристики данной линии представлены в Таблице 3:
| Таблица 3 | |
| Культуральная среда: FM4CHO (Hyclone), суспензионное культивирование | |
| Продуктивность, мг/л/24ч (по ELISA) | 23-45 |
| Количество FIXa (коагулометрия),мг/л/24ч | 4-6,5 |
| Удельная продукция, пкг/клетка/24 ч | 15-31 |
| Время удвоения | 30 часов |
Для данного клона была проанализирована стабильность продуцирующей способности и ростовых характеристик. Для этой цели клетки культивируют на протяжении 50-100 генераций, периодически оценивая как уровень экспрессии rhFIX, так и ростовые характеристики клонов.
Таким образом, был получен один из наиболее производительных и стабильных клонов Cricetulus griseus CHO 1E6, который был далее использован для создания мастер-банка и последующего производства рекомбинантного фактора IX свертываемости крови человека (rhFIX).
Пример 3. Выделение FIX с использованием псевдоаффинной хроматографии на Q-Sepharose.
Q-сефароза является сильным анионо-обменным сорбентом, связывающим биомолекулы с отрицательным зарядом в условиях нанесения, и позволяющим разделять молекулы с разными поверхностными зарядами. Наличие в молекуле FIX кальций-связывающего кластера, несущего значительный локальный отрицательный заряд (Gla-домен, содержащий остатки γ-карбоксилированной глутаминовой кислоты), позволило нам использовать Q-сефарозу в псевдоаффинном варианте.
Элюцию rhFIX проводили буфером, содержащим 10 мМ хлорид кальция. Использование Q-сефарозы в процессе выделения FIX приводило к количественному захвату белка из культуральной жидкости, и позволяло эффективно проводить очистку от нейтральных и положительно заряженных примесей, а также от веществ, остающихся связанными с сорбентом в присутствие ионов кальция. Эта стадия позволяла удалять неактивные формы FIX, и одновременно - сконцентрировать белок перед следующей хроматографической стадией.
Пример 4. Выделение rhFIX с использованием псевдо-аффинной хроматографии на Heparin Sepharose FF
Heparin-сефароза представляет собой бифункциональный сорбент, обладающий катионо-обменными свойствами, а также имеющий псевдоаффинные свойства по отношению к гепарин-связывающим белкам. Heparin-сефароза связывает биомолекулы с положительным зарядом в условиях нанесения, или имеющие сродство к гепарину.
Элюат с Q-сефарозы наносили на колонку с Heparin-сефарозой без дополнительной пробоподготовки. Элюцию FIX проводили буферным раствором с высокой ионной силой, содержащим 600 мМ хлорид натрия. Использование Heparin-сефарозы в процессе выделения FIX приводило к удалению остаточных белков штамма-продуцента, и обеспечивало концентрирование и перевод белка в подходящий буфер для последующей хроматографической стадии.
Пример 5. Выделение FIX с использованием хроматографии на Ceramic Hydroxyapatite type I (CHT I)
На третьей стадии выделения был использован сорбент CHT I, представляющий собой синтетические макропористые гранулы фосфата кальция (гидроксиапатита), и позволяющий разделять белки в широком диапазоне их поверхностных зарядов и изоэлектрических точек. Элюат, содержащий FIX, наносили на гранулы гидроскиапатита при нейтральных значениях рН и затем элюировали фосфатом калия в концентрации 600 мМ. Использование гидроксиапатита в процессе выделения позволяло удалить фракцию неактивного белка FIX и остаточные примеси, а также увеличить концентрацию FIX.
Пример 6. Выделение FIX с использованием хроматографии на Source 30Q
На следующей стадии выделения использовали Source 30Q - в качестве сильного анионо-обменного сорбента высокого разрешения, позволяющего проводить эффективное разделение в том числе изоформ одного белка. Путем градиентного увеличения концентрации элюента, ацетата аммония, до значения 600 мМ отделяли FIX от родственных примесей. Полученную таким образом субстанцию FIX использовали для перевода в буфер готовой формы методом диафильтрации.
Пример 7. Измерение активности субстанции FIX
Активность FIX измеряли методом коагулометрического анализа. Метод основан на том, что время коагуляции смеси разведенного исследуемого образца FIX и плазмы, субстрат-дефицитной по FIX, зависит только от активности FIX в исследуемом образце.
Анализ проводили в пластиковых кюветах, термостатируемых при 37°С. В кювету вносили раствор исследуемого образца FIX, раствор плазмы, субстрат-дефицитной по FIX, кефалин-каолиновую смесь, раствор кальция хлорида. Конечную точку коагуляции реакционной смеси - образование сгустка - фиксировали с помощью анализатора показателей гемостаза (коагулометра). Расчет активности проводили по калибровке, построенной с использованием стандартизованной нормальной плазмы. Субстанция FIX, полученная по методике, описанной в предыдущих примерах, показывала высокую удельную активность в пределах 250-350 МЕ/мг.
Таким образом, настоящее изобретение позволяет получить рекомбинантный фактор свертываемости крови IX человека со свойствами, идентичными свойствам природного полипептида. Полученный rhFIX в дальнейшем может быть использован для изготовления лекарственных препаратов.
1. Рекомбинантная плазмидная ДНК рАК380, кодирующая полипептид с последовательностью фактора IX свертываемости крови человека, имеющая размер 11236 п.о., с физической картой, представленной на фиг.3, и состоящая из следующих элементов:- оптимизированной последовательности, кодирующей полипептид фактора IX свертываемости крови человека, SEQ ID NO: 2,- MAR - области прикрепления к ядерному матриксу гена лизоцима птиц,- усилителя транскрипции вируса CMV,- внутреннего сайта инициации трансляции IRES вируса энцефаломиокардита,- гена DHFR мыши,- сигнала полиаденилирования вируса SV40,- аминогликозид-3'-фосфотрансферазы, обеспечивающего устойчивость штамма клеток-продуцента к генетицину (Neo),- кассеты для экспрессии в клетках бактерий гена β-лактамазы, обеспечивающей устойчивость к ампицилину,- уникальных участков узнавания следующих эндонуклеаз рестрикции:AhdI (6259 п.о.), ApaI (1784 п.о.), BamHI (5082 п.о.), BbeI (4287 п.о.), BglII (1548 п.о.), BipI (15 п.о.), BssHII (4685 п.о.), BstBI (4969 п.о.), EcoRI (8942 п.о.), EcoRV (9876 п.о.), KasI (4287 п.о.), MluI (1332 п.о.), NarI (4287 п.о.), PspOMI (1784 п.o.), PspXI (2249 п.o.), RsrII (4803 п.o.). SalI (10153 п.o.), SfiI (4040 п.o.), SfoI (4287 п.o.), SpeI (10489 п.o.), StuI (4091 п.o.), Tth111I (4403 п.o.), XcmI (11229 п.o.), XoI (2250 п.o.).
2. Линия клеток Cricetulus griseus CHO 1E6 - продуцент рекомбинантного фактора IX свертываемости крови человека, полученная путем трансформации линии клеток Cricetulus griseus CHO DHFR - рекомбинантной плазмидной ДНК рАК380 по п.1.
3. Способ получения полипептида, обладающего активностью фактора IX, включающий выращивание линии клеток CHO 1E6 по п.2 и выделение полипептида, обладающего активностью фактора IX коагуляции крови, характеризующийся тем, что он включает следующую последовательность операций:1) псевдоаффинную хроматографию на Q-Сефарозе с элюцией 10 мМ CaCl2,2) псевдоаффинную хроматографию на Heparin-Сефарозе FF с элюцией 600 мМ NaCl,3) хроматографию на гидроксиапатите типа I с элюцией 600 мМ К3РО3 и4) хроматографию на Source 30Q с элюцией 600 мМ ацетатом аммония.
4. Способ по п.3, где линия клеток CHO 1E6 адаптирована к бессывороточной среде.