Способ определения концентрации гемоглобина в биологических тканях
Иллюстрации
Показать всеИзобретение относится к области лабораторного медицинского анализа, аналитического приборостроения и может быть использовано для определения концентрации общего гемоглобина в биологических тканях. Посылку излучения на ткань в одну или более точек осуществляют на длинах волн λ, равных 524, 578 и 662 нм или 524, 578 и 773 нм. Измеряют сигналы диффузного отражения P(Ln,λ) при трех или более расстояниях Ln (n=1, 2, 3…) между точками посылки и регистрации излучения. Определяют нормированные сигналы rn(λ)=P(Lт,λ)/P(L1,λ) и их главные компоненты, а концентрацию общего гемоглобина вычисляют на основе уравнения множественной регрессии, связывающего ее с главными компонентами rn(λ). Способ позволяет повысить точность определения концентрации общего гемоглобина в биологических тканях за счет учета присутствия в них молекул оксигемоглобина, деоксигемоглобина, метгемоглобина и карбоксигемоглобина, исключения влияния вариаций параметров тонкого верхнего слоя ткани (например, эпидермиса кожи) и ее рассеивающих свойств, устранения калибровочных измерений, а также снижение стоимости способа. 2 ил, 2 табл.
Реферат
Изобретение относится к области лабораторного медицинского анализа, аналитического приборостроения.
Содержание гемоглобина в крови определяет жизнедеятельность всего организма человека, поэтому мониторинг гемоглобина, является необходимой клинической процедурой для достоверной оценки текущего состояния пациента и последующего прогноза развития критических состояний в анестезиологии, реаниматологии и интенсивной терапии. Процедура, используемая в настоящее время для определения уровня гемоглобина в крови, включает взятие пробы крови, обработку ее в трансформирующем растворе, с целью разрушения эритроцитов, и прямое фотометрирование полученной пробы. Данная процедура не обладает оперативностью, требуют строгого выполнения длительных операций и высокой квалификации медперсонала. При этом в анестезиологии и хирургии часто необходимо осуществлять непрерывный мониторинг уровня гемоглобина в крови, в частности при кровоизлиянии и переливании крови во время хирургических операций. Такой мониторинг дает непрерывную информацию о динамке изменений крови, что позволяет избежать лишних переливаний и связанных с ними осложнениями, такими как послеоперационное инфицирование, увеличение вероятности метастазов и нарушение функции легких. Необходимость неинвазивного и оперативного определения содержания гемоглобина в поверхностных слоях биологических тканей (кожа, слизистые оболочки органов) существует и в онкологии [1, 2].
Известен способ определения гемоглобина и дисгемоглобиовых фракций, основанный на измерении прохождения света через пульсирующие сосуды в спектральных участках 600, 625, 660, 760, 800, 940 и 1300 нм. Для проведения измерений фотометриический датчик крепится на пальце или на мочке уха. Строгая привязка способа к анатомической части тела и кардиоритму в перфузии тканей кровью исключает возможность ее использования для определения содержания гемоглобина в поверхностных слоях кожи и слизистых оболочек органов, а также в тех случаях, когда кардиоритм отсутствует, например, при проведении операций на сердце.
Наиболее близким к предлагаемому изобретению является способ [4], в котором измеряются коэффициенты диффузного отражения R(λ) биологической ткани на двух изобестических длинах волн окси-HbO2 и деоксигемоглобина Hb, а концентрация общего гемоглобина в ткани определяется на основе ее корреляции с отношением коэффициентов R(λ) для изобестических длин волн. Для предварительного установления данной корреляции используются измерения R(λ) для множества образцов биоткани или моделирующих ее фантомов с известным содержанием гемоглобина. К недостаткам данного метода следует отнести влияние на точность измерений вариаций рассеивающих свойств ткани и ее пигментации, отсутствие учета таких форм гемоглобина, как карбоксигемоглобин и метгемоглобин. Кроме того, устройство, реализующее данный метод требует калибровки перед каждым измерением, что затрудняет его применение в широкой клинической практике.
Предлагаемое изобретение направлено на решение задачи повышения точности определения концентрации общего гемоглобина в биологических тканях за счет учета присутствия в ней молекул оксигемоглобина, деоксигемоглобина, метгемоглобина и карбоксигемоглобина, исключения влияния вариаций параметров тонкого верхнего слоя ткани (например, эпидермиса кожи) и ее рассеивающих свойств, устранения калибровочных измерений, а также снижения стоимости способа.
Для решения данной задачи в способе измерения концентрации гемоглобина в биологических тканях путем посылки оптического излучения на ткань и измерения его диффузного отражения от ткани посылку излучения на ткань в одну или более точек осуществляют на длинах волн λ равных 524, 578 и 662 нм или 524, 578 и 773 нм, измеряют сигналы диффузного отражения P(Ln,λ,) при трех или более расстояниях Ln (n=1, 2, 3 …) между точками посылки и регистрации излучения, определяют нормированные сигналы и их главные компоненты, а концентрацию общего гемоглобина вычисляют на основе уравнения множественной регрессии, связывающего ее с главными компонентами rn(λ).
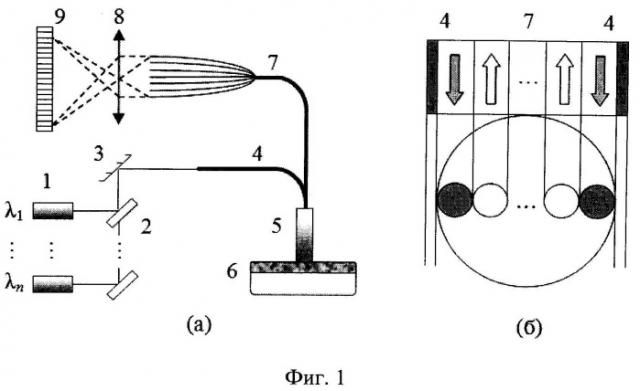
Сущность данного изобретения поясняется с помощью фиг.1, 2. На фиг.1 представлена схема экспериментальной установки, реализующей предлагаемый способ. Оптоволоконный зонд 5 для измерения коэффициентов диффузного отражения (КДО) биологических тканей содержит два передающих волокна (каналы возбуждения) 4 между которыми вплотную размещаются принимающие волокна (каналы регистрации) 7. Излучение от лазерных диодов 1 при помощи светоделительных пластинок 2 последовательно подается в каналы возбуждения 4. Рассеянное тканью 6 в заднее полупространство излучение попадает в принимающие волокна 7, через которые оно поступает на фотоприемники или фокусируется микрообъективом 8 на линейку ПЗС 9. Таким образом, излучение регистрируется одновременно во всех пространственных каналах регистрации. Сравнение профилей рассеянного излучения от симметрично расположенных каналов возбуждения позволяет оценить степень неоднородности освещаемого объема и тем самым выбирать оптимальный для проведения измерений участок кожи. В качестве альтернативы может использоваться такая конфигурация оптических волокон, при которой в центре зонда 5 находится канал посылки, а по нескольким направлениям от него симметрично размещаются каналы регистрации. Такая схема также позволяет выявлять неоднородность исследуемого участка ткани и, кроме того, позволяет увеличить уровень полезного сигнала на фоне шума за счет большей суммарной собирательной способности принимающих волокон.
Регистрируемые сигналы P(L,λ) в рассматриваемой оптоволоконной схеме зависят от спектрально-пространственного профиля КДО - R(L,λ), а также от аппаратурных констант и мощности излучения лазерных диодов P0(λ):
,
где L - расстояние между центрами посылающего и принимающего волокон, λ - длина волны излучения, S(λ) - спектральная чувствительности приемника, τ(λ) - функция пропускания оптической системы. Коэффициенты R(L,λ) зависят от оптических параметров среды и собирательной способности оптических волокон. Для устранения необходимости калибровки измерений P(L,λ) будем оперировать с отношением сигналов для пространственно разнесенных каналов регистрации (n≤NL - количество каналов регистрации), совпадающем с отношением .
Следует отметить, что помимо исключения калибровочных измерений, использование для решения обратной задачи отношений сигналов диффузного отражения для пространственно разнесенных точек на поверхности биологической ткани позволяет также исключить и влияние ее тонкого верхнего (например, эпидермиса кожи) на точность восстановления параметров нижнего слоя (например, дермы кожи). Это связано с тем, что оптические пути, проходимых светом в тонком верхнем слое, для рядом расположенных каналов регистрации примерно одинаковы и вычитаются при делении соответствующих им сигналов P(L,λ).
Известно, что измерения диффузного рассеяния на нескольких расстояниях от точки освещения позволяют разделить вклады рассеяния и поглощения в регистрируемые сигналы. Если для решения обратной задачи использовать нормированные сигналы диффузного рассеяния rn(λ), то для одновременного определения объемных коэффициентов поглощения k(λ) и рассеяния µs(λ) биологической ткани необходимо осуществлять измерение ее рассеяния не менее чем на трех расстояниях от излучающего световода. Как было отмечено выше, отношения rn(λ) не зависят от параметров тонкого верхнего слоя ткани, например от ее пигментации, а значит, определяемые на их основе спектры k(λ) характеризуют компонентный состав только нижнего слоя. Его основой является слабопоглощающая, обескровленная ткань в которой проходят сосуды, наполненные кровью. Коэффициент поглощения крови определяется концентрацией общего гемоглобина и его химическим составом. В нормальных условиях гемоглобин на 96-98% состоит из оксигемоглобина HbO2. Содержание производных гемоглобина, не способных переносить кислород обычно не велико (1-4%), но при патологических состояниях может существенно увеличиваться. Клинически значимым производными гемоглобина являются деоксигемоглобин Hb, карбоксигемоглобин COHb и метгемоглобин MetHb.
Исходя из анализа спектров поглощения Hb, HbO2, COHb и MetHb [5] для определения концентрации общего гемоглобина FtHb выбраны длины волн λ1=524 нм, λ2=578 нм, λ3=662 нм (или λ3=773 нм). Длина волны λ2 соответствует максимуму поглощения HbO2 и в тоже время является изобестической точкой Hb и COHb (kHb(λ2)=kCOHb(λ2)=0.14 г/литр). Причем, даже при низком содержании HbO2 в крови, равном 60%, его поглощение в 2.3 раза превосходит суммарное поглощение Hb и COHb. Вклад MetHb в общее поглощение на этой длине волны не значителен (kMetHb(λ2)=0.06 г/литр). Таким образом, измерение k(λ2) позволяет оценить концентрацию HbO2. Длина волны λ3=662 нм является изобестической точкой Hb и MetHb и характеризуется низким поглощением HbO2 и COHb, что обуславливает высокую чувствительность k(λ3) к суммарной концентрации Hb и MetHb. Альтернативной длиной волны является λ3=773 нм - также изобестическая точка Hb и MetHb. Коэффициенты поглощения HbO2, Hb и MetHb на этой длине волны сравнимы по величине, а поглощение COHb практически отсутствует. Следовательно, при известной концентрации HbO2 из измерения k(λ3) можно определить суммарную концентрацию Hb и MetHb. И наконец, установив суммарную концентрацию HbO2, Hb и MetHb, можно по измерению коэффициента поглощения на их изобестической длине волны λ1 оценить концентрацию COHb, а значит и FtHb.
Исходя из вышеизложенного, для определения концентрации общего гемоглобина в биологической ткани необходимы измерения ее диффузного отражения на длинах волн λ1, λ2 и λ3 не менее чем на трех расстояниях от точки освещения. Причем, исходя из точности определения FtHb, более предпочтительно восстанавливать данный параметр напрямую из измеряемых сигналов rn(λ), чем из коэффициентов k(λ). Однако сигналы rn(λ) содержат как спектральную, так и пространственную составляющие информации и не допускает простой одномерной интерпретации. Для удобства их анализа необходимо получить более однородную структуру данных. Значения ln rn(λ) можно рассматривать как компоненты случайного вектора r. Разложим вектор r по системе собственных векторов vk его ковариационной матрицы, образующих ортогональный базис [6]. Коэффициенты разложения ξk (главные компоненты) любой реализации вектора r находятся по формуле:
где - средний вектор; k=1, …, NPC; NPC - количество главных компонент. В связи с быстрой сходимостью рассматриваемого разложения на первые собственные векторы приходится большая часть изменчивости вектора r, а соответствующие им главные компоненты ξk содержат в себе практически столько же информации, сколько ее и было в исходных данных. Следовательно, для восстановления FtHb можно использовать не сам вектор измерений, а его главные компоненты.
С точки зрения оперативности мониторинга концентрации гемоглобина представляет интерес возможность ее расчета на основе аналитического выражения, связывающего ее с главными компонентами измерений rn(λ) для трех вышеуказанных λ. Такое выражение может быть получено на основе измерений или численного расчета rn(λ) для множества образцов биоткани или моделирующих ее фантомов с известными значениями FtHb и последующего регрессионного анализа ансамбля реализации FtHb и rn(λ) [7]. В частности, в качестве такого выражения может использоваться полиномиальная регрессия
где М=6 - степень полинома. Численные значения коэффициентов akm определяются путем расчета по формуле (1) главных компонент ξk для всех реализации r (каждой из которых соответствует конкретное значение FtHb) и использования метода наименьших квадратов для аппроксимации статистической связи между ξk и FtHb. После получения векторов и vk, a также вышеотмеченного аналитического выражения они могут применяться для получения по измеряемым значениям rn(λ) уже неизвестной заранее концентрации гемоглобина.
Таким образом, способ определения концентрации общего гемоглобина в биологической ткани включает измерение сигналов ее диффузного рассеяния P(L,λ) на длинах волн λ1=524 нм, λ2=578 нм, λ3=662 нм или λ3=773 нм при трех или более расстояниях L между каналами возбуждения и регистрации, вычисление нормированных сигналов , нахождение по формуле (1) их главных компонент и определение концентрации гемоглобина на основе множественной регрессии между ней и найденными главными компонентами.
Рассмотрим более детально процесс получения , vk и коэффициентов регрессии (2) на примере определения концентрации гемоглобина в тканях кожного покрова человека. Для получения ансамбля реализации FtHb и rn(λ) используется статистическая модель кожи, включающая спектры поглощения и рассеяния компонентов кожи и диапазоны вариаций ее структурных и биохимических параметров. Верхний слой кожи - эпидермис с толщиной Lepi=50-130 мкм, нижний - дерма, которая в оптическом плане считается бесконечно толстой. Показатель преломления слоев кожи относительно воздуха nskin=1.4-1.5 считается одинаковым, поэтому френелевское отражение излучения имеет место только на границе раздела кожи с внешней средой. Объемные коэффициенты поглощения эпидермиса kepi и дермы kderm моделируются как линейная комбинация коэффициентов поглощения обескровленной ткани kt, меланина kmel и гемоглобина:
,
,
где , где λ0=632 нм, A=(3-8)·10-2 (мм-1) и B=(6-8)·10-3
(нм-1) - параметры, характеризующие спектральную зависимость kt; fmel=0.5-25% - объемная концентрация меланина в эпидермисе; MHb=64500 г/моль - молярная масса гемоглобина; FtHb=0.2-14 г/литр - концентрация общего гемоглобина в дерме; εHbO2, εHb, εCOHb и εMetHb - молярные коэффициенты поглощения соответственно оксигемоглобина, деоксигемоглобина, карбоксигемоглобина и метгемоглобина в см-1/(моль/литр); fHbO2=40-98%, fHb=1-40%, fCOHb=0.1-20%, fMetHb=0.1-20% - объемные концентрации производных гемоглобина; α(Dν) - корректирующий фактор, учитывающий эффект локализованного поглощения света кровеносными сосудами, Dν=5-30 мкм - средний диаметр капилляров.
Спектр редуцированного коэффициента рассеяния µs(λ) эпидермиса и дермы моделируется как суперпозиция спектров рассеяния, соответствующих рассеивателям Ми и Рэлея с размерами d≥λ и d<<λ соответственно:
,
где λ0=632 нм; Cs=1-10 мм-1; ρMie=0.1-0.6 - доля рассеяния Ми; x=0.5-1.0 - параметр спектральной зависимости рассеяния Ми. Параметры Cs, ρMie и x являются структурными параметрами кожи, поскольку характеризуют объемное содержание и размер ее «эффективных» рассеивателей (волокон соединительной ткани). Следует отметить, что для учета возможного увеличения объемного коэффициента рассеяния кожи за счет контакта с ней измерителя, верхняя граница диапазона вариаций параметра Cs выбрана примерно в три раза выше максимального значения Cs для кожи человека.
Для моделирования вышеописанного эксперимента по распространению оптического излучения в коже человека используется метод Монте-Карло [8], основанный на прослеживании случайных блужданий большого количества фотонов (конкретно использовалось 3·106 фотонов) от точки их влета в среду до их поглощения или вылета из среды. После статистического моделирования траекторий всех фотонов рассчитывалась функция поверхностного распределения коэффициента направленного рассеяния:
,
где I - интенсивность излучения, выходящего из элементарной площадки на расстоянии r от начала координат в телесном угле ΔΩ=2πµΔµ, описанном вокруг направления µ=cosθ; F - поток излучения, падающего на среду в точке r=0 в направлении нормали к ее поверхности.
Для канала регистрации, расположенного на расстоянии L от канала возбуждения, определяемой величиной R(L,λ) является отношение мощности регистрируемого сигнала к мощности зондирующего светового пучка, которое, с учетом радиальной симметрии функции S(r,µ), можно записать как:
,
где r0 и r - соответственно радиусы передающего и принимающего световодов; l=L-x, L - расстояние между световодами; , Ac - числовая апертура оптического волокна; x и y - переменные интегрирования.
Расчет R(L,λ) осуществляется по следующей схеме. Случайным образом выбираются значения модельных параметров из вышеуказанных диапазонов, и производился расчет µs(λ), kepi(λ) и kderm(λ). Для каждой реализации оптических параметров кожи методом Монте-Карло вычисляются коэффициенты R(L,λ), соответствующие конкретным геометрическим параметрам используемой схемы оптоволоконных измерений диффузного рассеяния (диаметр сердцевины волокон, расстояние между ними и их числовая апертура).
Смоделированный ансамбль реализации R(L,λ) и FtHb, образующий обучающий массив данных, используется для расчета собственных векторов и получения регрессии (2) между rn(λ) и FtHb. Оптимальное количество главных компонент NPC в (2) определяется путем замкнутого численного эксперимента, заключающегося в следующем. Первоначально по формуле (1) определяются главные компоненты всех реализации rn(λ) и устанавливаются регрессии между NPC главными компонентами и FtHb. Далее перебираются все реализации модельных параметров и для каждой реализации осуществляется расчет FtHb с использованием (2) при наложении на rn(λ) случайных отклонений в пределах δr (моделирующих погрешности измерения). Полученное в результате значение сравнивается со значением FtHb, соответствующем рассматриваемой реализации, и рассчитывается погрешность восстановления FtHb. После перебора всех реализации вычисляется средняя погрешность восстановления FtHb. Оптимальное значение NPC находится по минимуму средней погрешности.
С использованием вышеописанного алгоритма оценим погрешности определения концентрации гемоглобина в тканях кожи из сигналов rn(λ), измеряемых на основе представленной на фиг.1 схемы оптоволоконных измерений диффузного рассеяния со следующими параметрами: λ1=524 нм, λ2=578 нм, λ3=773 нм; L1=0.43 мм, L2=1.06 мм, L3=1.69 мм; диаметр сердцевины всех волокон 600 мкм, толщина оболочки 15 мкм, числовая апертура Ас=1.0. В табл.1 приведены собственные векторы vn, а в табл.2 - коэффициенты регрессий (2), соответствующие данной схеме измерений. Результаты вышеописанных численных экспериментов позволяют заключить, что при погрешности оптических измерений δr≤5% для восстановления FtHb оптимально использовать 4 главные компоненты исходных данных. На фиг.2 приведены соответствующие результаты восстановления FtHb для всего смоделированного ансамбля реализаций FtHb и rn(λ) (n=2, 3), а также указаны средние по ансамблю погрешности восстановления FtHb. Восстановление FtHb производилось при наложении на rn(λ) случайных отклонений δr=0 и 5%. Разброс точек на рисунках относительно прямой характеризует чувствительность решения обратной задачи к погрешности оптических измерений, а также к вариациям биофизических параметров кожи. Видно, что рассматриваемый способ позволяет определять концентрацию гемоглобина во всем диапазоне ее возможных значений для кожи человека с погрешностью достаточной для решения задач онкологии и хирургии.
| Табл.1. | ||||||
| Средний вектор измерений и первые четыре собственных вектора vn ковариационной матрицы r | ||||||
| λ, нм | Ln, мм | Собственные векторы | ||||
| 1 | 2 | 3 | 4 | |||
| 524 | 1.06 | -3,9692 | 0,4305 | -0,1994 | -0,6361 | 0,4126 |
| 1.69 | -7,2598 | 0,4218 | -0,3044 | -0,3510 | -0,6125 | |
| 578 | 1.06 | -3,9336 | 0,4296 | -0,2211 | 0,3662 | 0,5312 |
| 1.69 | -7,3771 | 0,4194 | -0,3217 | 0,5800 | -0,2401 | |
| 773 | 1.06 | -1,8979 | 0,3674 | 0,6153 | 0,0194 | 0,1716 |
| 1.69 | -3,3701 | 0,3759 | 0,5802 | 0,0378 | -0,2922 |
| Табл.2. | |||||||
| Коэффициенты akm регрессии (2) при NPC=4 и M=6. | |||||||
| k | m | ||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| 0 | 0,9685 | ||||||
| 1 | 0,6414 | 0,0301 | 0,0040 | 0,0010 | 0,0001 | 0,0000 | |
| 2 | 0,4750 | -0,0642 | 0,0258 | 0,0003 | -0,0025 | 0,0003 | |
| 3 | -0,7170 | -0,9576 | -0,7321 | 0,1167 | 0,3271 | 0,0853 | |
| 4 | 2,0277 | -0,4069 | 0,2567 | -0,2753 | 0,1185 | -0,0170 |
Таким образом, измерения сигналов диффузного отражения света от биологических тканей P(L,λ) в спектральных участках λ=524, 578 и 662 нм или λ=524, 578 и 773 нм при трех или более расстояниях Ln (n=1, 2, 3 …) между точками посылки и регистрации излучения и уравнение множественной регрессии между главными компонентами нормированных сигналов и концентрацией гемоглобина составляют основу простого и эффективного способа неинвазивного оперативного определения концентрации гемоглобина в биологической ткани, учитывающего присутствие в крови основных производных гемоглобина (оксигемоглобин, деоксигемоглобин, карбоксигемоглобин и метгемоглобин), исключающего влияние вариаций параметров тонкого верхнего слоя ткани (например, пигментации кожи) и ее рассеивающих свойств на результат измерений. Точность измерений также повышается и за счет исключения необходимости калибровочных измерений. При этом упрощается процедура измерений и повышается экономичность.
Литература
1. P.R. Bargo, S.A. Prahl, T.T. Goodell, R.A. Sleven, G. Koval, G. Blair, S.L. Jacques. // J. Biomed. Opt. 2005. V.10. N3. P.034018-1-15.
2. E. Claridge, D. Hidovic-Rowe, P. Taniere, T. Ismail. // SPIE proceedings. 2007. V.6511: Medical Imaging 2007: Physiology, Function, and Structure from Medical Images, P. 65110C. DOI: 10.1117/12.709559.
3. H. Suzaki, N. Kobayashi, T. Nagaoka, K. Iwasaki, M. Umezu, S. Takeda, T. Togawa. // Engineering in Medicine and Biology Society 2006. EMBS '06, 28th Annual International Conference of the IEEE, New York, IEEE, 2006. P.799-802
4. Patent WO №2011/068998 A2, IPC. G01N 33/49, G01N 33/72, G01N 21/47, A61B 5/1455; published 09.06.2011.
5. Zijlstra W.G., Buursma A., O.W. van Assendelft. Visible and near infrared absorption spectra of human and animal haemoglobin. Utrecht: VSP, 2000. С.268-278.
6. Зуев В.Е., Комаров B.C. Статистические модели температуры и газовых компонент земной атмосферы. Ленинград: Гидрометеоиздат., 1986. С.47-50.
7. Лысенко С.А., Кугейко М.М. Регрессионный подход к анализу информативности и интерпретации данных аэрозольных оптических измерений // Журн. прикл. спектр. 2009. Т.76. №6. С.876-883.
8. Пушкарева А.Е. Методы математического моделирования в оптике биоткани. СПб: СПбГУ ИТМО, 2008. С.30-43.
Способ определения концентрации гемоглобина в биологических тканях путем посылки излучения на ткань и измерения его диффузного отражения от ткани, отличающийся тем, что посылку излучения на ткань в одну или более точек осуществляют на длинах волн λ, равных 524, 578 и 662 нм или 524, 578 и 773 нм, измеряют сигналы диффузного отражения P(Ln,λ) при трех или более расстояниях Ln, n=1, 2, 3 …, между точками посылки и регистрации излучения, определяют нормированные сигналы rn(λ)=P(Ln/λ)/P(L1/λ) и их главные компоненты, а концентрацию общего гемоглобина вычисляют на основе уравнения множественной регрессии, связывающего ее с главными компонентами rn(λ).