Соединения и способ снижения мочевой кислоты
Иллюстрации
Показать всеНастоящее изобретение относится к способу снижения концентрации мочевой кислоты в крови, включающий введение соединения формулы I или его фармацевтически приемлемой соли.
Также настоящее изобретение относится к способу лечения или профилактики множества состояний, включая подагру, гиперурикемию, повышенные уровни мочевой кислоты, не соответствующие уровням, обычно определяющим диагноз гиперурикемии. Кроме того, заявленное соединение формулы I может быть использовано в фармацевтической композиции. 5 н. и 17 з.п. ф-лы, 6 ил., 13 табл., 28 прим.
Реферат
УРОВЕНЬ ТЕХНИКИ
Заболевания, вызванные повышенными уровнями мочевой кислоты, попадают в две основные категории: заболевания, вызванные осаждением кристаллов мочевой кислоты, и заболевания, вызванные патологическим действием растворимой мочевой кислоты. Подагрический артрит является классическим примером первой категории. Отложения кристаллов урата в почках также является широко распространенной причиной почечной дисфункции. Повышенные уровни растворимой мочевой кислоты ассоциируются с множеством расстройств, включая сердечно-сосудистые и почечные заболевания.
Подагра широко известна как воспаление одного или более суставов тела, дающее от умеренной до сильной боли. Эти события могут быть эпизодическими и/или хроническими. В течение времени подагра может вызвать разрушение хряща и кости, развитие отложений кристаллов мочевой кислоты, боль в почках и дисфункцию, а также камни в почках. Подагра также может поражать другие органы.
Подагра вызывается гиперурикемией и последующим образованием и отложением кристаллов мочевой кислоты в тканях, суставах, почках и других органах. Мочевая кислота возникает при нормальном метаболизме клетки и из некоторых типов пищи и напитков. Избыточные уровни мочевой кислоты являются результатом слишком активного производства мочевой кислоты, ухудшенного очищения почками (или сочетания избыточного производства и ухудшенного очищения), а также некоторыми формами лекарственных средств, принимаемыми при других состояниях здоровья. (Примеры включают диуретики, пиразинамид, циклоспорин, низкие дозы аспирина, никотиновой кислоты и леводопа). Многие типы состояний здоровья также могут вызывать гиперурикемию и подагру, включая алкоголизм, лейкемию, лимфому, рак легких, синдром распада опухоли, курение, псориаз, ожирение, почечную дисфункцию, застойную сердечную недостаточность, голодание, анемию, высокое кровяное давление, диабет, неподвижность, синдром Леша-Найхана, синдром Дауна и дисфункцию щитовидной железы и паращитовидной железы.
Подагра обычно делится на четыре категории на основании нарастания тяжести симптомов:
1) Асимптоматическая. Повышенные уровни мочевой кислоты в крови, но отсутствие выраженных симптомов.
2) Острый подагрический артрит: неожиданное проявление симптомов, часто в единичном суставе (обычно большой палец), затем вовлечение других суставов. Симптомы включат боль, опухание, покраснение и лихорадку.
3) Интеркритическая подагра: асимптоматические фазы между приступами подагры.
4) Хроническая подагра с отложением солей: хроническое состояние, которое может включать частые приступы, постоянную умеренную боль и воспаление суставов, разрушение хряща и кости, развитие отложений кристаллов мочевой кислоты, дисфункцию почек и камни в почках.
Лекарственные средства, применяемые в настоящее время для лечения острых симптомов подагры, включают нестероидные противовоспалительные средства, колхицин и кортикостероиды. Все эти лекарственные средства могут вызывать побочные эффекты от умеренных до тяжелых. Другие средства лечения таких острых симптомов изучаются, включая антитела и антагонисты воспалительных цитокинов, таких как Интерлейкин 1.
Другие типы лекарственных средств применяют для снижения вероятности возникновения или тяжести будущих приступов через снижение уровня мочевой кислоты. Три принципиальных класса лекарственных средств включают ингибиторы ксантиноксидазы (например, аллопуринол), которые снижают производство мочевой кислоты из ксантина; средства, способствующие выведению мочевой кислоты (например, сульфинпиразон, пробенецид, бензбромарон и лозартан), которые предназначены для улучшения выведения мочевой кислоты через ингибирование повторного поглощения выделенной мочевой кислоты в почечных канальцах через ингибирование переносчика мочевой кислоты 1 (URAT1) (См. также публикацию заявки на патент США № 2007/0010670, опубликованную 11 января 2007 года (Japan Tobacco Inc.)) или других элементов повторного поглощения мочевой кислоты; и уриказы, например, пегилированная уриказа, такая как PURICASE (пегилированная рекомбинантная уриказа млекопитающих по Савье). Эти лекарственные средства также часто вызывают значительные и нежелательные побочные эффекты. Например, было описано, что аллопуринол вызывает по меньшей мере 100 случаев токсического эпидермального некролиза Стивенса-Джонсона и приблизительно 30 смертей каждый год в Европе (Halevy et al., Allopurinol is the most common cause of Stevens-Johnson syndrome and toxic epidermal necrolysis in Europe and Israel. J Am Acad Dermatol. 58(1):25-32, 2008). Пробеницид и бензбромарон сняты из продажи во множестве стран из-за нежелательных побочных эффектов, таких как отказ печени при приеме бензбромарона. Согласие пациентов на прием этих лекарственных средств по имеющимся данным крайне редко (A. A. Reidel et al. “Compliance with Allopurinol Therapy among Managed Care Enrollees with Gout: A Retrospective Analysis of Administrative Claims.” Journal of Rheumatology 2004; 31:1575-1581), предположительно из-за побочных эффектов и/или отсутствия пользы.
Более 5 миллионов людей в США страдают подагрой (National Health and Nutrition Examination Survey 111, 1988-1994). Распространение гиперурикемии и подагры в США в 1999 году, по имеющимся данным, составляет 41 на 1000 и 14 на 1000 в Соединенном Королевстве (T.R. Mikuls et al., “Gout Epidemiology: Results for the UK General Practice Research Database, 1990-1999.” Annals of the Rheumatic Diseases 2005; 64:267-272). В последующих докладах указано, что распространение в США, Соединенном королевстве и других странах уверенно растет (K. L. Wallace et al., “Increasing Prevalence of Gout and Hyperuricemia over 10 Years Among Older Adults in a Managed Care Population.” Journal of Rheumatology 2004; 31: 1582-1587). Более свежие данные позволяют предположить, что более 5 миллионов американцев в настоящее время имеют диагностируемую подагру (E. Krishnan et al., “Gout in Ambulatory Care Settings in the United States.” Journal of Rheumatology 2008; 35(3): 498-501).
Гиперурикемия и подагра являются очень значимыми для пациентов с трансплантированными органами (Stamp, L., et al, “Gout in solid organ transplantation: a challenging clinical problem”, Drugs (2005) 65(18): 2593-2611). Мочевая кислота часто повышена у пациентов с трансплантатами почек, и обычные иммунодепрессанты, такие как циклоспорин, могут вызвать особенно тяжелую гиперурикемию. У пациентов с трансплантатами аллопуринол абсолютно противопоказан из-за взаимодействия с некоторыми иммунодепрессантами, такими как азатиоприн, так как их сочетание вызывает недостаточность костного мозга. Более того, повышенная мочевая кислота может сыграть роль в отторжении трансплантата (Armstrong, K.A. et al., “Does Uric Acid Have a Pathogenetic Role in Graft Dysfunction and Hypertension in Renal Transplant Patients?” Transplantation (2005) 80(11): 1565-1571). Поэтому существует особенно острая необходимость в безопасных агентах, которые снижают гиперурикемию у пациентов с трансплантатами.
Заболевания, связанные с повышенной растворимой мочевой кислотой, часто включают проблемы с сосудами: гипертензию (Sundstrom et al., Relations of serum uric acid to longitudinal blood pressure tracking and hypertension incidence. Hypertension. 45(1):28-33, 2005), предгипертензию (Syamela, S. et al., Association between serum uric acid and prehypertension among US adults. J Hypertens. 25 (8) 1583-1589, (2007), атеросклероз (Ishizaka et al., Association between serum uric acid, metabolic syndrome, and carotid atherosclerosis in Japanese individuals. Arterioscler Thromb Vasc Biol. (5):1038-44, 2005), заболевание периферийной артерии (Shankar, A. et al., Association between serum uric acid level and peripheral artery disease. Atherosclerosis doi 10: 1016, 2007), воспаление сосудов (Zoccali et al., Uric acid and endothelial dysfunction in essential hypertension. J Am Soc Nephrol. 17(5):1466-71, 2006), сердечную недостаточность (Strasak, A.M. et al., Serum uric acid and risk of cardiovascular mortality: A prospective, long-term study of 83,683 Austrian men, Clin Chem. 54 (2) 273-284, 2008; Pascual-Figal, Hyperuricaemia and long-term outcome after hospital discharge in acute heart failure patients. Eur J Heart Fail. 2006 Oct 23; [Epub ahead of print]; Cengel, A., et al., “Serum uric Acid Levels as a Predictor of In-hospital Death in Patients Hospitalized for Decompensated Heart Failure.” Acta Cardiol. (Oct. 2005) 60(5): 489-492), инфаркт миокарда (Strasak, A.M. et al.; Bos et al., Uric acid is a risk factor for myocardial infarction and stroke: the Rotterdam study. Stroke. 2006 Jun; 37(6):1503-7), дисфункцию почек (Cirillo et al., Uric Acid, the metabolic syndrome, and renal disease. J Am Soc Nephrol. 17(12 Suppl 3):S165-8, 2006; Z. Avram and E. Krishnan, Hyperuricemia - where nephrology meets rheumatology. Rheumatology (Oxford), 47(7): 960-964, 2008), и удары (Bos et al., 2006). Мочевая кислота непосредственно вызывает дисфункцию эндотелия (Kanellis, et al., Uric acid as a mediator of endothelial dysfunction, inflammation, and vascular disease. Semin Nephrol. 25(1):39-42, 2005; Khosla et al, Hyperuricemia induces endothelial dysfunction. Kidney Int. 67(5):1739-42, 2005). У детей и подростков рано возникающая первичная гипертензия связана с повышенной мочевой кислотой в сыворотке, и снижение уровня мочевой кислоты аллопуринолом снижает кровяное давление у таких пациентов (Feig and Johnson, The role of uric acid in pediatric hypertension. J Ren Nutrition 17(1): 79-83, 2007; D.I. Feig et al., Effect of allopurinol on blood pressure of adolescents with newly diagnosed essential hypertension. JAMA 300(8): 924-932, 2008). Feig et al. также утверждают, что это новый терапевтический подход, но что побочные эффекты существующих лекарственных средств для снижения мочевой кислоты могут ограничивать или препятствовать их применению. Гиперурикемия является независимым фактором риска во всех таких состояниях.
Повышенная растворимая мочевая кислота также связана с или непосредственно вызывает воспалительные реакции. Например, мочевая кислота транспортируется в клетки гладкой мускулатуры сосудов через переносчиков органической кислоты, особенно переносчик урата URAT1, и затем стимулирует клетки гладкой мускулатуры сосудов к производству C-реакционноспособного белка, MCP-1 и других цитокинов, там самым стимулируя пролиферацию и другие изменения, связанные с атеросклерозом (Price et al., Human vascular smooth muscle cells express a urate transporter. J Am Soc Nephrol. 17(7):1791-5, 2006; Kang et al., Uric acid causes vascular smooth muscle cell proliferation by entering cells via a functional urate transporter. Am J Nephrol. 2005 25(5):425-33 (2005); Yamamoto et al., Allopurinol reduces neointimal hyperplasia in the carotid artery ligation model in spontaneously hypertensive rats. Hypertens. Res. 29 (11) 915-921, 2006), стимулирует человеческие одноядерные клетки вырабатывать IL-1β, IL-6 и TNF-α, что вызывает заметное увеличение TNF-α при вливании мышам, активирует эндотелиальные клетки и тромбоциты, и повышает прилипаемость тромбоцитов (Coutinho et al., “Associations of Serum Uric Acid with Markers of Inflammation, Metabolic Syndrome, and Subclinical Coronary Atherosclerosis”, Amer. J. Hypertens. (2007) 20: 83-89; Levya, F., et al., “Uric Acid in Chronic Heart Failure: A Marker of Chronic Inflammation”, Eur. Heart J. (1998) 19(12): 1814-1822.). Также было показано, что мочевая кислота ингибирует биодоступность эндотелиальной окиси азота и активирует систему ренин-ангиотензин. (T.S. Perlstein et al., Uric acid and the state of the intrarenal renin-angiotensin system in humans. Kidney International. 66:1465-1470, 2004). Inokuchi et al. показали, что Интерлейкин 18 (IL-18) и другие воспалительные агенты отражают местное воспаление, связанное с подагрой, и что кристаллы урата усиливают активацию IL-18 (T. Inokuchi et al., Plasma IL-18 and other inflammatory cytokines in patients with gouty arthritis and monosodium urate monohydrate crystal-induced secretion of IL-18. Cytokine. 33(1): 21-27, 206), которая, вероятно, играет причинную роль при почечной недостаточности. IL-18 и другие цитокины также значительно повышены у людей, которые не имеют самой подагры, но которые точно имеют повышенные уровни мочевой кислоты (C. Ruggiero et al. Uric acid and inflammatory markers. (C. Ruggiero et al., Uric acid and inflammatory markers. European Heart Journal. 27: 1174-1181, 2006).
Гиперурикемия также связана с ухудшением познавательной способности и другими формами дисфункции центральной нервной системы (Schretlen, D.J. et al., “Serum Uric Acid and Cognitive Function in Community-Dwelling Older Adults”, Neuropsychology (Jan. 2007) 21(1): 136-140; Watanabe, S., et al., “Cerebral Oxidative Stress and Mitochondrial Dysfunction in Oxonate-Induced Hyperuricemic Mice”, J. Health Science (2006) 52: 730-737).
Повышенные уровни мочевой кислоты в сыворотке также связаны с повышенным риском рака и смертности от рака. (Strasak, AM et al. (2007) Serum uric acid and risk of cancer mortality in a large prospective male cohort. Cancer Causes Control 18 (9) 1021-1029; Strasak, AM et al. (2007) The role of serum uric acid as an antioxidant protecting against cancer: prospective study in more than 28,000 older Austrian women. Annals Oncol 18 (11) 1893-1897; Jee, SA et al. (2004) Serum uric acid and risk of death from cancer, cardiovascular disease or all causes in men Eur. J. Cardiovascular Prev. Rehab. 11 (3) 185-191)
Повышенные уровни мочевой кислоты связаны с преддиабетическими состояниями, резистентностью к инсулину, развитием диабета 2 типа и повышенной вероятностью развития множества нежелательных состояний у человека с диабетом, таких как заболевания периферийных артерий, удар и повышенный риск смерти (Ioachimescu, A.G. et al. (2007) Serum uric acid, mortality and glucose control in patients with Type 2 diabetes mellitus: a PreCIS database study Diabet. Med. 24 (12) 1369-1374; Perry, I.J. et al (1995) Prospective study of risk factors for development of non-insulin dependent diabetes in middle aged British men BMJ 310 (6979) 560-564; Chien, K-L et al. (2008) Plasma uric acid and the risk of Type 2 diabetes in a Chinese community Clin. Chem. 54 (2) 310-316; Sautin, Y. Y. et al. (2007) Adverse effects of the classic antioxidant uric acid in adipocytes: NADPH oxidase-mediated oxidative/nitrosative stress Am. J. Physiol. Cell Physiol. 293: C584-C596; Tseng, C.H. (2004) Independent association of uric acid levels with peripheral artery disease in Taiwanese patients with Type 2 diabetes Diabet. Med. 21 (7) 724-729; Lehto, S. et al. (1998) Serum uric acid is a strong predictor of stroke in patients with non-insulin dependent diabetes mellitus Stroke 29: 635-639.
Повышенные уровни мочевой кислоты являются определяющей характеристикой синдрома Леша-Нейхана. Пациенты с апноэ или расстройством дыхания во сне также имеют повышенные уровни мочевой кислоты (Saito, H. et al., Tissue hypoxia in sleep apnea syndrome assessed by uric acid and adenosine. Chest 122: 1686-1694, 2002; Verhulst, S.L., et al., Sleep-disordered breathing and uric acid in overweight and obese children and adolescents. Chest 132: 76-80, 2007)
Повышенная мочевая кислота связана с преэклампсией (Bainbridge, S.A. and Roberts, J.M., Uric acid as a pathogenic factor in preeclampsia. Placenta Dec. 17 2007 epub ahead of print).
Существует значительная медицинская потребность в новых лекарственных средствах, которые могут безопасно, удобно и эффективно лечить и предотвращать расстройства, связанные с повышением мочевой кислоты в крови, где такие заболевания связаны с кристаллизацией мочевой кислоты, или эффектами сверхнормальных (где стандарт индивидуален или общий) уровней растворимой мочевой кислоты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
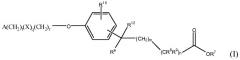
Данное изобретение относится к определенному терапевтическому применению соединения формулы I или его фармацевтически приемлемой соли.
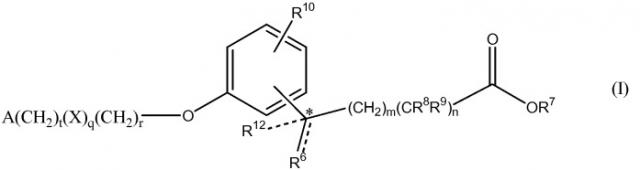
В формуле I, m равно 0, 1, 2, 3 или 4; n равно 0 или 1; m+n не более 4; t равно 0 или 1; q равно 0 или 1; и r равно 0, 1 или 2. R6 является водородом, метилом или этилом, и R12 является водородом или метилом, или R6 является гидрокси и R12 является водородом, или R6 является O и R12 отсутствует, или R6 и R12 вместе являются -CH2CH2-. R7 является водородом или алкилом, содержащим от 1 до 3 атомов углерода. Один из R8 и R9 является алкилом, содержащим от 1 до 3 атомов углерода, и другой является водородом или алкилом, содержащим от 1 до 3 атомов углерода. R10 является водородом, галогеном, алкилом, содержащим от 1 до 3 атомов углерода, или алкокси, содержащим от 1 до 3 атомов углерода. X является C(O) и r равен 0 и t равен 0; или X является NH(R11), где R11 является водородом или алкилом, содержащим от 1 до 3 атомов углерода. A является фенилом, незамещенным или замещенным 1 или 2 группами, выбранными из галогена, гидрокси, метила, этила, перфторметила, метокси, этокси и перфторметокси; или 5-6-членным гетероароматическим кольцом, содержащим 1 или 2 гетероатома в кольце, выбранных из N, S и O, и гетероароматическое кольцо ковалентно связано с остатком соединения формулы I через атом углерода кольца; или циклоалкилом, содержащим от 3 до 6 атомов углерода в кольце, где циклоалкил не замещен или один или два атома углерода в кольце независимо монозамещены метилом или этилом. Сложные эфиры и другие пролекарства соединений формулы I также включены в данное изобретение.
В данном изобретении представлен способ снижения концентрации мочевой кислоты в крови, или увеличения выведения мочевой кислоты, у млекопитающего пациента, включающий введение пациенту соединения формулы I или его фармацевтически приемлемой соли в количестве, эффективном для снижения концентрации мочевой кислоты в крови, или увеличения выведения мочевой кислоты, у пациента. В данном изобретении представлено применение биологически активного агента при производстве лекарственного средства для снижения концентрации мочевой кислоты в крови, или увеличения выведения мочевой кислоты, у млекопитающего, где агентом является соединение формулы I или его фармацевтически приемлемая соль, и оно сформулировано для введения в количестве, эффективном для снижения концентрации мочевой кислоты в крови, или увеличения выведения мочевой кислоты, у пациента. В этом изобретении представлена фармацевтическая композиция для применения для снижения концентрации мочевой кислоты в крови, или увеличения выведения мочевой кислоты, у млекопитающего пациента, содержащая соединение формулы I или его фармацевтически приемлемую соль в количестве, эффективном для снижения концентрации мочевой кислоты в крови, или увеличения выведения мочевой кислоты, у пациента. В данном изобретении представлен набор, содержащий одну или более единичных пероральных доз соединения формулы I или его фармацевтически приемлемой соли, и инструкции по введению соединения формулы I или его фармацевтически приемлемой соли для снижения концентрации мочевой кислоты в крови, или увеличения выведения мочевой кислоты, у млекопитающего пациента.
Описанное здесь снижение мочевой кислоты может применяться для лечения или профилактики множества состояний, включая подагру (любую из асимптоматической подагры, острого подагрического артрита, интеркритической подагры и хронической подагры с отложением солей), гиперурикемии, повышенных уровней мочевой кислоты, которые не соответствуют уровням, обычно соответствующим диагнозу гиперурикемии, дисфункции почек, камней в почках, сердечно-сосудистого заболевания, риска развития сердечно-сосудистого заболевания и других последствий гиперурикемии, ухудшения познавательной способности и ранней первичной гипертензии.
Данное изобретение основано на наблюдении, что соединение формулы I при введении человеку снижает уровень мочевой кислоты в крови человека и увеличивает выведение мочевой кислоты, как описано в примерах 1-5. В in vivo экспериментах применяют соединение, где R6 является O. Так как соединения CF и CR являются метаболитами соединения BI, полагают, что соединения формулы I, где R6 является водородом или гидрокси, также будут снижать in vivo уровень мочевой кислоты в крови и увеличивать выведение мочевой кислоты. Данное изобретение также основано на наблюдении, что соединения формулы I, включая соединения, где R6 является O, водородом или гидрокси, ингибируют URAT1 in vitro, как показано в примере 6. Ингибирование URAT1 является общепринятой in vitro моделью снижения мочевой кислоты in vivo.
В данном изобретении также представлены следующие соединения, их фармацевтически приемлемые соли, сложные эфиры и пролекарства:
| DQ | 2-(3-(2,6-диметилбензилокси)-4-метоксифенил)уксусная кислота; |
| EB | Метил 3-(3-(2,6-диметилбензилокси)фенил)-3-оксопропаноат; |
| DR | 2-(3-(2,6-дифторбензилокси)фенил)уксусная кислота; |
| DS | 4-(3-(2,6-дихлорбензилокси)фенил)-4-оксобутановая кислота; |
| DT | 2-(3-(2,6-диметилбензилокси)фенил)пропановая кислота; |
| DU | 2-(3-(4-трифторметил)бензилокси)фенил)уксусная кислота; |
| DV | 2-(3-(2,6-диметилбензилокси)фенил)бутановая кислота; |
| DW | 2-(3-(3,5-диметилбензилокси)фенил)уксусная кислота; |
| DX | 2-(3-(2,4-диметилбензилокси)фенил)уксусная кислота; |
| DY | 2-(3-(2,6-диметоксибензилокси)фенил)бутановая кислота; |
| DZ | 2-(3-(бензилокси)фенил)уксусная кислота; и |
| EA | 2-(2-(2,6-диметилбензилокси)фенил)уксусная кислота; |
| EC | 2-(3-(2,6-диметилбензилокси)фенил)пропановая кислота; |
| ED | 2-(3-(2,6-диметилбензилокси)фенил)бутановая кислота; |
| EE | 2-(3-(2,6-диметилбензилокси)фенил)-2-метилпропановая кислота; |
| EF | 1-(3-(2,6-диметилбензилокси)фенил)циклопропанкарбоновая кислота; |
| EG | 2-(3-(2-Хлор-6-метилбензилокси)фенил)уксусная кислота; |
| EH | 2-(3-(2,6-диметилбензилокси)-4-метилфенил)уксусная кислота; |
| EI | 2-(3-(2,6-диметилбензилокси)-4-фторфенил)уксусная кислота. |
ОПИСАНИЕ ФИГУР
Фигура 1: Соединение BI увеличивает выведение мочевой кислоты в мочу мышей, леченных ингибитором уриказы: оксонатом калия.
Фигура 2: Уровни МК (мочевой кислоты) в плазме в течение начального 24-часового периода у пациентов, получающих различные дозы соединения BI.
Фигура 3: Уровни МК (мочевой кислоты) в плазме в течение 24-часового периода на 7 день у пациентов, получающих различные дозы соединения BI.
Фигура 4: Калибровочная кривая соединения EH, AGILENT ЖХ-МС.
Фигура 5: Концентрация соединения EH в плазме крыс.
Фигура 6: Концентрация соединения EH в плазме мышей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
В данном описании термин “алкил” означает линейную или разветвленную алкильную группу. Алкильная группа, определенная как имеющая указанное количество атомов углерода, означает любую алкильную группу, содержащую указанное количество атомов углерода. Например, алкильной группой, содержащей три атома углерода, может быть пропил или изопропил; и алкильной группой, содержащей четыре атома углерода, может быть н-бутил, 1-метилпропил, 2-метилпропил или трет-бутил.
В данном описании термин “галоген” относится к одному или более из фтора, хлора и брома.
В данном описании термин “перфтор” в определениях перфторметил или перфторметокси означает, что рассматриваемая группа содержит атомы фтора вместо всех атомов водорода.
Связь между R6 и атомом углерода, к которому он непосредственно присоединен, изображена на формуле I выше сплошной и пунктирной линиями. Это изображение указывает на то, что рассматриваемая связь может быть либо одинарной связью, если R6 является водородом, метилом, этилом или гидрокси, или двойной связью, если R6 является O.
Звездочка в изображении формулы I выше указывает на возможный хиральный центр, и что атом углерода является хиральным, если R6 и R12 являются разными, т.е. если R6 является гидрокси, метилом или этилом, и R12 является водородом, или если R6 является водородом, гидрокси или этилом, и R12 является метилом. В таких случаях в данном изобретении представлен рацемат, (R) энантиомер и (S) энантиомер соединений формулы I, все из которых считаются активными. В примерах синтеза рацемат указан волнистой связью. Смеси этих энантиомеров могут быть разделены с применением ВЭЖХ, например, как описано в Chirality 11:420-425 (1999).
Термин “пролекарство(а)” рассматриваемого соединения относится к другим соединениям, которые расщепляются, обычно in vivo, с получением рассматриваемого соединения.
Определенные химические соединения обозначены здесь их химическим наименованием или двухбуквенным кодом, показанным ниже. Перечисленные ниже соединения включены в объем формулы I, показанной выше.
| BI | 4-(3-(2,6-диметилбензилокси)фенил)-4-оксомасляная кислота |
| CF | 3-(2,6-диметилбензилокси)фенилуксусная кислота |
| CR | 4-(3-(2,6-диметилбензилокси)-фенил)-4(R)-гидроксибутановая кислота |
| DQ | 2-(3-(2,6-диметилбензилокси)-4-метоксифенил)уксусная кислота |
| AN | 4-(3-(2-Метилбензилокси)фенил)-4-оксобутановая кислота |
| AW | 4-(3-(2,6-дифторбензилокси)фенил)-4-оксобутановая кислота |
| BJ | 4-(3-(2-Фтор-6-метилбензилокси)фенил)-4-оксобутановая кислота |
| BP | 4-(3-(2,6-диметилбензилокси)фенил)-2,2-диметил-4-оксобутановая кислота |
| BS | 4-(3-(2,6-диметилбензилокси)фенил)бутановая кислота |
| EB | Метил 3-(3-(2,6-диметилбензилокси)фенил)-3-оксопропаноат |
| CD | 5-(3-(2,6-диметилбензилокси)фенил)-5-оксопентановая кислота |
| CQ | 2-(3-(2,6-диметилбензилокси)фенил)-2-оксоуксусная кислота |
| CK | 5-(3-(2,6-диметилбензилокси)фенил)пентановая кислота |
| CM | 3-(3-(2,6-диметилбензилокси)фенил)пропановая кислота |
| DR | 2-(3-(2,6-дифторбензилокси)фенил)уксусная кислота |
| DS | 4-(3-(2,6-дихлорбензилокси)фенил)-4-оксобутановая кислота |
| DT | 2-(3-(2,6-диметилбензилокси)фенил)пропановая кислота |
| DU | 2-(3-(4-трифторметил)бензилокси)фенил)уксусная кислота |
| DN | 2-(3-(2,4-бис(трифторметил)бензилокси)фенил)уксусная кислота |
| DV | 2-(3-(2,6-диметилбензилокси)фенил)бутановая кислота |
| DW | 2-(3-(3,5-диметилбензилокси)фенил)уксусная кислота |
| DX | 2-(3-(2,4-диметилбензилокси)фенил)уксусная кислота |
| DY | 2-(3-(2,6-диметоксибензилокси)фенил)уксусная кислота |
| DZ | 2-(3-(бензилокси)фенил)уксусная кислота |
| BH | 4-(3-(циклопропилметокси)фенил)-4-оксобутановая кислота |
| DP | 4-(3-(2,6-диметилбензоилокси)фенил)-4-оксобутановая кислота |
| AB | 4-(4-(2-метоксибензилокси)фенил)-4-оксобутановая кислота |
| AF | 4-оксо-4-(4-(пиридин-2-илметокси)фенил)бутановая кислота |
| AG | 4-(4-(бензилокси)фенил)-4-оксобутановая кислота |
| AH | 4-(4-(2,6-дифторбензилокси)фенил)-4-оксобутановая кислота |
| AI | 4-(4-(2-Хлорбензилокси)фенил)-4-оксобутановая кислота |
| AM | гидрохлорид 4-(4-(2-((2-фторбензил)(метил)амино)этокси)фенил)-4-оксобутановой кислоты |
| AT | 4-(4-(2,5-диметилбензилокси)фенил)-4-оксобутановая кислота |
| AY | 4-(4-(2-трифторметилбензилокси)фенил)-4-оксобутановая кислота |
| BM | 4-(4-(2,6-диметилбензилокси)фенил)-4-оксобутановая кислота |
| BT | 4-(4-(2,6-диметилбензилокси)-3-метоксифенил)-4-оксобутановая кислота |
| DO | 2-(4-(2,6-диметилбензилокси)фенил)уксусная кислота |
| EA | 2-(2-(2,6-диметилбензилокси)фенил)уксусная кислота |
| EC | 2-(3-(2,6-диметилбензилокси)фенил)пропановая кислота |
| ED | 2-(3-(2,6-диметилбензилокси)фенил)бутановая кислота |
| EE | 2-(3-(2,6-диметилбензилокси)фенил)-2-метилпропановая кислота |
| EF | 1-(3-(2,6-диметилбензилокси)фенил)циклопропанкарбоновая кислота |
| EG | 2-(3-(2-Хлор-6-метилбензилокси)фенил)уксусная кислота |
| EH | 2-(3-(2,6-диметилбензилокси)-4-метилфенил)уксусная кислота |
| EI | 2-(3-(2,6-диметилбензилокси)-4-фторфенил)уксусная кислота |
В данном описании промежуточный термин “содержащий” является открытым. Предложение, в котором используется данный термин, может включать элементы, дополняющие те, которые перечислены в предложении.
В предложениях слово “или” означает “и/или” если такое прочтение имеет смысл в контексте. Таким образом, например, фраза “снижение концентрации мочевой кислоты в крови или увеличение выведения мочевой кислоты у млекопитающего пациента” эквивалентна фразе “снижение концентрации мочевой кислоты в крови и/или увеличение выведения мочевой кислоты у млекопитающего пациента”.
СОЕДИНЕНИЯ В СООТВЕТСТВИИ С ДАННЫМ ИЗОБРЕТЕНИЕМ
В одном варианте данного изобретения, описанном в разделе «Сущность изобретения» выше, A является замещенным (как определено выше) или незамещенным фенилом, например, 2,6-диметилфенилом. В других вариантах r равно 1, t равно 0 и q равно 0. В другом варианте R10 является метокси.
Два больших заместителя (т.е. отличных от R10) вокруг центрального фенильного кольца могут быть расположены в положении орто, мета или пара по отношению друг к другу. Предпочтительно, они находятся в положении мета по отношению друг к другу.
В одном варианте формулы I, A является замещенным (как определено выше) или незамещенным фенилом, t равно 0, q равно 0, r равно 1, R10 является водородом, n равно 0, m равно 0, 2 или 4. В более конкретном варианте A является 2,6-диметилфенилом.
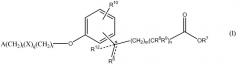
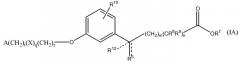
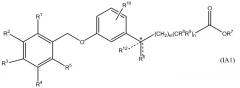
В одном варианте данного изобретения соединение представлено формулой IA. В более конкретном варианте соединение представлено формулой IA1. В формуле IA переменные такие, как определены выше. В формуле IA1 два из R1, R2, R3, R4 и R5 выбирают из группы, включающей водород, галоген, гидрокси, метил, этил, перфторметил, метокси, этокси и перфторметокси, остаток является водородом; и другие переменные такие, как определены выше. В более конкретных вариантах A является 2,6-диметилфенилом, т.е. R1 является метилом и R5 является метилом. Неограничивающие примеры соединений формулы I включают соединения AF, AG, AH, AT, BM, BT, DO и EA. Неограничивающие примеры соединений формулы IA включают соединения BH, DP и EG. Неограничивающие примеры соединений формулы IA1 включают соединения BI, CF, CR, DQ, AN, AW, BJ, BP, BS, EB, CD, CQ, CK, CM, DR, DS, DT, DU, DN, DV, DW, DX, DY и DZ, EB, EC, ED, EF, EH и EI.
В одном варианте формулы IA1 R10 является водородом, m равно 0, 2 или 4; и n равно 0. Предпочтительно, R1 является метилом и R5 является метилом.
Соединения формулы I могут быть получены в соответствии со схемами реакций, представленными ниже. Кроме того, многие соединения формулы I могут быть получены способами, описанными в WO 02/100341, WO 04/073611, WO 04/091486, WO 04/098496, WO 07/087506, WO 07/146768 и PCT/US2009/030845, содержание которых включено сюда в качестве ссылки.
СХЕМЫ РЕАКЦИЙ
Соединение формулы I, где m равно 0, q равно 0 или 1, t равно 0 или 1 и r равно 0, 1 или 2, n равно 0, R10 является водородом, галогеном, алкокси, содержащим от 1 до 3 атомов углерода, или алкилом, содержащим от 1 до 3 атомов углерода, R6 является водородом или метилом, или этилом, и R12 является водородом или метилом, или R6 и R12 вместе образуют -CH2CH2-. Один из R8 и R9 является алкилом, содержащим от 1 до 3 атомов углерода, и другой является водородом или алкилом, содержащим от 1 до 3 атомов углерода, и X является C(O), r равно 0 и t равно 0; X является NH(R11), где R11 является водородом или алкилом, содержащим от 1 до 3 атомов углерода. R7 является водородом или алкилом, содержащим от 1 до 3 атомов углерода, т.е. соединения формулы:
где A такой, как описан выше, могут быть получены согласно схеме реакций 1.
На схеме реакций 1 A, q, t, m, n, r, R6, R7, R10 и R12 такие, как определены выше. R13 является алкильной группой, содержащей от 1 до 2 атомов углерода. R17 является алкильной группой, содержащей от 1 до 3 атомов углерода, или бензильной группой. R14 является хлором или бромом, и Y является галогенидом.
Соединение формулы II может быть алкилировано соединением формулы III или соединением формулы (IV) реакцией стадии (a). Реакцию проводят в подходящем растворителе, таком как тетрагидрофуран, тетрагидрофуран/1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидинон, толуол, N,N-диметилформамид, тетрагидрофуран/гексаметилфосфорамид и подобные. В общем, реакцию проводят в присутствии от 2 до 3 молярных эквивалентов основания для получения соединения формулы V, где R6 является алкилом, содержащим от 1 до 2 атомов углерода, и R12 является водородом, или от 4 до 6 молярных эквивалентов основания для получения соединения формулы V, где R6 и R12 являются алкилом, содержащим от 1 до 2 атомов углерода, или вместе являются -CH2CH2-. Подходящим основанием для этой цели может быть гидрид натрия, гидрид калия, гидроксид натрия, гидроксид тетрабутиламмония, бис(триметилсилил)амид калия, бис(триметилсилил)амид лития, диизопропиламид лития и подобные. При проведении этой реакции обычно предпочтительно применять водный раствор гидроксида тетрабутиламмония и водный гидроксид натрия. Реакция может проводиться при температуре от -78°C до 25°C в течение от 6 до 72 часов. Обычные методики, такие как экстракция, выпаривание, хроматография и перекристаллизация, могут применяться для очистки продукта. В случае, когда R6 и R12 являются водородом, соединение формулы II может быть превращено в соединение формулы VI гидролизом нитрилов до кислоты без стадии алкилирования A.
Соединение формулы V может быть превращено в соединение формулы VI на стадии реакции (b) кислотным или щелочным гидролизом. При проведении этой реакции обычно предпочтительно применять щелочной гидролиз, например, водным гидроксидом натрия. Любые условия, обычно применяемые при гидролизе нитрилов для получения карбоновой кислоты, могут применяться для проведения реакции на стадии (b).
Соединение формулы VI может быть превращено в соединение формулы VII этерификацией соединения формулы VI с метанолом, этанолом или пропанолом. Реакция может проводиться либо с применением катализатора, например, H2SO4, TsOH и подобного, либо с применением дегидратирующего агента, например, дициклогексилкарбодиимида или подобного. Любые условия, применяемые в таких реакциях этерификации, могут применяться для проведения реакции стадии (c).
В случае, если X является C(O), соединение формулы VI может взаимодействовать с бензилбромидом в присутствии основания, например, триэтиламина, карбоната калия, с получением соединения формулы VII. Любые условия, обычно применяемые в таких реакциях, могут применяться при проведении реакции на стадии (c). Соединение формулы VII может быть превращено в соединение формулы XI сначала деалкоксилированием с применением кислоты Льюиса, например, BBr3 или BCl3 в дихлорметане или хлороформе при низкой температуре, например, -78°C. Любые условия, обычно применяемые в таких реакциях, могут применяться при проведении реакции стадии (d).
На второй стадии продукт стадии реакции (d) может быть превращен в соединение формулы XI реакцией стадии (e) через конденсацию Мицунобу с соединением IX с применением трифенилфосфина и диэтилазодикарбоксилата или диизопропилазодикарбоксилата. Реакцию проводят в подходящем растворителе, например, тетрагидрофуране. Любые условия, применяемые при реакциях Мицунобу, могут применяться для проведения реакции стадии (e).
В случае, когда X является C(O), соединение формулы VII может взаимодействовать с соединением формулы IX в присутствии дегидратирующего агента, например, дициклогексилкарбодиимида. Любые условия, обычно применяемые в таких реакциях, могут применяться при проведении реакции стадии (e).
Соединение формулы XI также могут быть получены этерификацией или алкилированием гидроксила стадии (d) с соединением формулы X реакцией стадии (e). В соединении формулы X, Y, включают, но не ограничены ими, мезилокси, тозилокси, хлор, бром, йод и подобные. Любые обычные методы этерификации гидроксильной группы взаимодействием с уходящей группой могут применяться на стадии реакции (e).
В случае, если X является C(O), соединение формулы VII может взаимодействовать с соединением формулы X, где Y является хлором. Обычно реакцию проводят в присутствии основания, например, пиридина. Любые условия, обычно применяемые в таких реакциях, могут применяться при проведении реакции стадии (e). Соединение формулы XI является соединением формулы I, где m равно 0, n равно 0 и R7 является алкилом, содержащим от 1 до 3 атомов углерода. Соединение формулы XI может быть превращено в соединение формулы XII реакцией стадии (f), где m равно 0, n равно 0 и R7 является H, гидролизом сложного эфира. Любой обычный способ гидролиза сложного эфира дает соединение формулы I, где R7 является H.
В случае, если X является C(O), бензильная группа может быть удалена каталитическим гидрированием с получением соединения формулы I, где R7 является H. Любые условия, применяемые для реакций каталитического гидрирования, могут применяться для получения соединения формулы I.
Если A является фенилом, замещенным 1 или 2 гидроксильными группами, обычно предпочтительно защищать гидроксильные группы. Подходящие защитные группы описаны в Protective Groups in Organic Synthesis by T. Greene. Защищенная группа может быть лишена защиты с применением подходящих агентов для снятия защиты, таких как описаны в Protective Groups in Organic Synthesis by T. Greene.
Схема реакций 1
Соединение формулы I, где m равно от 1 до 4, q равно 0 или 1, t равно 0 или 1 и r равно 0, 1 или 2, n равно 0, R10 является водородом, галогеном, алкокси, содержащим от 1 до 3 атомов углерода, или алкилом, содержащим от 1 до 3 атомов углерода, R6 является водородом или метилом, или этилом и R12 является водородом или метилом или R6 и R12 вместе образуют -CH2CH2-. Один из R8 и R9 является алкилом, содержащим от 1 до 3 атомов углерода, и другой является водородом или алкилом, содержащим от 1 до 3 атомов углерода, и X является C(O), r равно 0 и t равно 0; X является NH(R11), где R11 является водородом или алкилом, содержащим от 1 до 3 атомов углерода. R7 является водородом или алкилом, содержащим от 1 до 3 атомов углерода, т.е. соединения формулы:
где A такой как описан выше, могут быть получены согласно схеме реакций 2.
На схеме реакций 2 A, q, t, m, r, R6, R7, R10 и R12 такие, как определены выше, и Y является галогенидом. R17 является алкильной группой, содержащей от 1 до 3 атомов углерода, или бензильной группой.
Соединение формулы VII может быть восстановлено до со