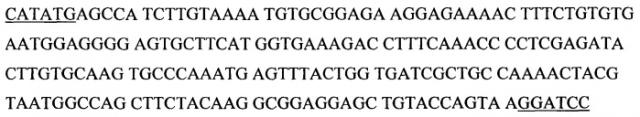Композиции и способы для лечения во время не острых периодов после неврологического повреждения цнс
Иллюстрации
Показать всеГруппа изобретений относится к медицине и фармакологии и касается способа введения полипептида, содержащего подобный эпидермальному фактору роста (EGF-подобный) домен, включающий введение указанного полипептида по меньшей мере через двое суток после неврологического повреждения, а также после достижения млекопитающим полного объема гибели клеток ишемического очага после повреждения. Группа изобретений обеспечивает лечение неврологического повреждения в пост-остром окне или в хроническом периоде после неврологического повреждения для ограничения повреждения головного мозга, восстановления функций и/или усиления восстановления после неврологического повреждения. 3 н. и 12 з.п. ф-лы, 19 пр. 18 ил., 4 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Область изобретения относится к лечению неврологического повреждения центральной нервной системы. Более конкретно, изобретение относится к введению нейрегулина [например, глиального фактора роста 2 (GGF2)] субъекту во время не острого или хронического периода после травматического неврологического повреждения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Повреждения центральной нервной системы (ЦНС) представляют собой серьезную проблему здравоохранения. Эта категория повреждений включают такие события, как ишемическое повреждение, геморрагическое повреждение, проникающая травма и не проникающая травма. Повреждения ЦНС, как правило, излечивают не полностью, оставляя субъекта с некоторой степенью стойкой дисфункции в диапазоне от чрезвычайно легкой до смерти. Остаточная дисфункция может включать моторные, сенсорные, когнитивные, эмоциональные и вегетативные аномалии.
Ключевая категория неврологического повреждения ЦНС включает повреждение головного мозга. Повреждение головного мозга представляет собой разрушительное состояние, приводящее к некоторой степени стойкой нетрудоспособности, включая моторную, сенсорную и когнитивную недостаточность и эмоциональную неустойчивость, такую как посттравматическое стрессовое расстройство, синдром нарушения внимания, депрессия и эмоциональная неустойчивость. Широко распространенные причины повреждения головного мозга включают ишемический инсульт, геморрагический инсульт, субдуральную гематому, эпидуральную гематому, закрытую травму черепа (при ускорении/торможении, сотрясении и вращении), проникающее повреждение головного мозга (огнестрельные раны и повреждения другими летящими предметами).
Инсульт является третьей из главных причин смерти и главной причинной инвалидизации в западном мире. Инсульт, таким образом, представляет собой большую социально-экономическую нагрузку. Этиология инсульта может являться либо ишемической, что является причиной большинства инсультов, либо геморрагической. Ишемический инсульт может быть вызван тромбом, который формируется где-нибудь в другом участке организма и продвигается через кровоток к головному мозгу (эмболический инсульт) или сгустком крови, формирующимся внутри артерии головного мозга (тромботический инсульт). После массовой гибели клеток в зоне центра немедленного инфаркта из-за отсутствия глюкозы и кислорода, область инфаркта расширяется в течение нескольких суток, за счет вторичных механизмов, таких как глутаматная эксайтотоксичность, апоптотические механизмы и образование свободных радикалов. После неврологических повреждений (например, ишемического события) у животных и человека функции могут восстанавливаться в течение нескольких суток, недель и месяцев без каких-либо терапевтических средств. Зачастую, однако, это восстановление является только частичным, и животные и люди страдают от стойкой инвалидности, которая может включать моторную, сенсорную и когнитивную недостаточность.
Факторы риска, увеличивающие вероятность того, что у индивидуума разовьется инсульт, хорошо известны. Они включают, и не ограничены ими, факторы риска, которые нельзя изменить: пожилой возраст, наследственность, острая церебральная энцефалопатия, пол, предшествующий инсульт или инфаркт миокарда в анамнезе; и факторы риска, которые можно изменить, излечить или контролировать: высокое кровяное давление, курение сигарет, сахарный диабет, заболевание сонной или другой артерии, фибрилляция предсердий, другое заболевание сердца, серповидноклеточная анемия, высокий уровень холестерина в крови, плохое питание и отсутствие физической активности и ожирение.
До настоящего времени, не паллиативное лечение ишемического инсульта ограничено введением терапевтических средств в острой фазе после инсульта. Острая фаза лежит в диапазоне от времени начала неврологического повреждения (например, инсульта) до приблизительно шести часов после неврологического повреждения. После острой фазы следует подострая фаза, которая лежит в диапазоне от приблизительно шести часов до двух суток после неврологического повреждения. Соответственно, современные не паллиативные лекарственные средства применяют в попытке обращения окклюзии кровотока, восстановления насыщения головного мозга кислородом и ограничения степени потери структур головного мозга. Не существует лекарственных средств для лечения инсульта, отличных от tPA, для применения в острой фазе. У пациентов остается некоторый уровень дисфункции, который в лучшем случае может улучшиться каким-либо эндогенным образом в течение приблизительно 60 суток. Это восстановление можно только дополнять физиотерапией. К сожалению, у многих пациентов остается стойкая нетрудоспособность с небольшой надеждой на улучшение.
К настоящему времени, единственным лекарственным средством, одобренным Управлением по контролю качества пищевых продуктов и лекарственных средств (FDA) для лечения ишемического инсульта, является тканевой активатор плазминогена (tPA). tPA представляет собой сериновую протеазу, превращающую плазминоген в плазмин. Плазмин затем разрушает фибрин, являющийся компонентом тромбов, которые могут осуществлять окклюзию сосудов головного мозга и вызывать инсульты. Идеально вводить его в пределах трех часов от начала симптомов. Как правило, только 3%-5% индивидуумов, страдающих инсультом, попадают в больницу вовремя, чтобы для них рассматривали возможность этого лечения. В идеале, tPA вводят в пределах первых трех часов после окклюзии, но некоторые врачи-клиницисты могут вводить его настолько поздно, как через шесть часов после окклюзии. К сожалению, подавляющему большинству пациентов, пораженных инсультом, не удается достичь больницы вовремя, чтобы для них рассматривали возможность этого лечения. Тем пациентам, которые прибыли в больницу в пределах эффективного временного окна, tPA вводят в попытке обращения окклюзии кровотока, восстановления насыщения головного мозга кислородом и ограничения степени потери структур головного мозга. Однако, существуют некоторые существенные противопоказания, ограничивающие постоянное применение tPA. После начального периода приблизительно 3-6 часов, чаще всего, tPA может вызывать интрацеребральное кровотечение и геморрагический инсульт. По этим причинам, введение tPA ограничено острой фазой для достижения какой-либо терапевтической эффективности.
До настоящего времени не одобрено другой терапии для лечения инсульта. Другие экспериментальные виды терапии, такие как доставляемая в артерии про-урокиназа, исследуют в качестве потенциальных средств разрушения тромбов и восстановления кровотока. В научной литературе, однако, описано множество средств, как доказано, являющихся благоприятными для защиты вещества головного мозга и восстановления функций в экспериментальных моделях инсульта на животных. Все эти средства сфокусированы на уменьшение в острой фазе гибели клеток, воспаления и апоптоза и должны, таким образом, быть доставлены в течение нескольких часов (некоторые вплоть до 24 часов) после ишемического события. До настоящего времени является общепринятым, что лечение повреждения ЦНС, такого как инсульт, необходимо в острой фазе. (Abe et al., 2008, J Cereb Blood Flow Metab. JuI 23, электронная публикация до печатной, Sun et al., 2008, Stroke JuI 10, электронная публикация до печатной, страницы еще не известны); Dohare et al., 2008, Behav Brain Res. 193(2):289-97; Belayev et al., 2001, Stroke 32(2):553-60).
Однако не показано, что такие средства ограничивают повреждение головного мозга, восстанавливают функции или усиливают восстановление после инсульта при введении после периода задержки нескольких часов, самое большее, в некоторых экспериментальных моделях, через приблизительно одни сутки после инсульта. Единственной терапией, для которой, как известно, показана эффективность в течение нескольких суток и недель после инсульта, является паллиативная или реабилитационная, например трудотерапия или физиотерапия. Действительно, авторам настоящего изобретения неизвестно, что для каких-либо агентов или лекарственных средств показано усиление восстановления в течение нескольких суток или недель после инсульта.
После острой окклюзии, часто присутствует локализованный участок поврежденного вещества головного мозга, окруженный зоной полутени, которая может погибнуть в течение нескольких часов, если не восстановить кровообращение. Время до гибели этой зоны полутени можно продлить на несколько часов в экспериментальных моделях с помощью нейропротекторов, таких как антагонисты NMDA, блокаторы кальциевых каналов, поглотители свободных радикалов и средства-ловушки, антиапоптотические средства, ингибиторы каспазы, ингибиторы parp и т.д. Для этой цели «нейропротектор» представляет собой что-то, что может сохранять нейроны до того, как они погибнут от множества инсультов, воздействующих на них в острой фазе. Однако, после 24-48 часов, мало надежды на защиту клеток от некротической гибели и, в то время как апоптотическая гибель продолжается в течение нескольких суток (См. фигуру 1). Не доказано, что терапевтическое окно для антиапоптотических лекарственных средств намного шире, чем для протективных лекарственных средств в острой фазе [Schulz et al., 1998, Cell Death Differ. 5(10):847-57; Komjati et al., 2004, Int J Mol. Med. 13(3):373-82].
Нейрегулин обладает нейропротекторными свойствами, для которых, подобно другим средствам, описанным выше, показано преимущество для уменьшения нетрудоспособности, наблюдаемое при введении животным в пределах нескольких часов после инсульта. См. патентную заявку Соединенных Штатов с регистрационным номером 09/530884, полное содержание которой включено в настоящее описание в качестве ссылки.
Принимая во внимание распространение неврологических повреждений, в частности, в отношении инсульта, существует необходимость в лекарственных средствах, которые можно эффективно вводить субъектам для ограничения повреждения головного мозга, восстановления функций и/или усиления восстановления после неврологического повреждения.
Нейрегулины (NRG) и рецепторы NRG включают систему фактор роста-рецепторная тирозинкиназа для передачи сигнала от клетки к клетке, которая вовлечена в органогенез в нервной, мышечной, эпителиальной, и других тканях (Lemke, Mol. Cell. Neurosci. 7:247-262, 1996 и Burden et al., Neuron 18:847-855, 1997). Семейство NRG состоит из четырех генов, кодирующих многочисленные лиганды, содержащие подобные эпидермальному фактору роста (EGF), иммуноглобулинам (Ig), и другие узнаваемые домены. Многочисленные секретируемые и связанные с мембраной изоформы функционируют как лиганды в этой системе передачи сигнала. Все рецепторы для лигандов NRG являются членами семейства рецепторов EGF (EGFR) и включают EGFR (или ErbBl), ErbB2, ErbB3 и ErbB4, известные также как HER1 - HER4, соответственно, у человека (Meyer et al., Development 124:3575-3586, 1997; Orr- Urtreger et al., Proc. Natl. Acad. Sci. USA 90: 1867-71, 1993; Marchionni et al., Nature 362:312-8, 1993; Chen et al., J. Comp. Neurol. 349:389-400, 1994; Corfas et al., Neuron 14:103- 115, 1995; Meyer et al., Proc. Natl. Acad. Sci. USA 91:1064-1068, 1994; и Pinkas-Kramarski et al., Oncogene 15:2803-2815, 1997).
Четыре гена NRG, NRG-1, NRG-2, NRG-3 и NRG-4, картированы в отдельных хромосомных локусах (Pinkas-Kramarski et al., Proc. Natl. Acad. Sci. USA 91:9387-91, 1994; Carraway et al., Nature 387:512-516, 1997; Chang et al., Nature 387:509-511, 1997; и Zhang et al., Proc. Natl. Acad. Sci. USA 94:9562-9567, 1997), и в совокупности кодируют разнообразное множество белков NRG. Продукты гена NRG-1, например, включают группу из приблизительно 15 отдельных структурно родственных изоформ (Lemke, Mol. Cell. Neurosci. 7:247-262, 1996 и Peles and Yarden, BioEssays 15:815-824, 1993). Первые идентифицированные изоформы NRG-1 включают фактор дифференцировки Neu (NDF; Peles et al., Cell 69, 205-216, 1992 и Wen et al., Cell 69, 559- 572, 1992), херегулин (HRG; Holmes et al., Science 256:1205-1210, 1992), фактор, индуцирующий активность рецепторов ацетилхолина (ARIA; Falls et al., Cell 72:801-815, 1993), и глиальные факторы роста GGF1, GGF2 и GGF3 (Marchionni et al. Nature 362:312-8, 1993).
Ген NRG-2 идентифицирован клонированием по гомологии (Chang et al., Nature 387:509-512, 1997; Carraway et al., Nature 387:512-516, 1997; и Higashiyama et al., J. Biochem. 122:675-680, 1997) и посредством геномных подходов (Busfield et al., Mol. Cell. Biol. 17:4007-4014, 1997). кДНК NRG-2 известны также как происходящий из нервов и тимуса активатор киназы ErbB (NTAK; Инвентарный № в Genbank AB005060), ответвление нейрегулина (Don-1) и происходящий из мозжечка фактор роста (CDGF; Патентная заявка PCT WO 97/09425). Экспериментальное свидетельство показывает, что клетки, экспрессирующие ErbB4 или комбинацию ErbB2/ErbB4, по-видимому, обладают особенно сильным ответом на NRG-2 (Pinkas-Kramarski et al., Mol. Cell. Biol. 18:6090-6101, 1998). Известно также, что продукт гена NRG-3 (Zhang et al., выше) связывает и активирует рецепторы ErbB4 (Hijazi et al., Int. J. Oncol. 13:1061-1067, 1998).
EGF-подобный домен присутствует в коре всех форм NRG и является необходимым для связывания и активации рецепторов ErbB. Выведенные аминокислотные последовательности EGF-подобных доменов, кодируемых тремя генами, являются приблизительно на 30-40% идентичными (попарные сравнения). Кроме того, по-видимому, существует по меньшей мере две субформы EGF-подобных доменов в NRG-1 и NRG-2, которые могут придавать различные виды биологической активности и тканеспецифической активности.
Ответы клеток на NRG опосредованы через NRG рецепторные тирозинкиназы EGFR, ErbB2, ErbB3 и ErbB4 из семейства рецептора эпидермального фактора роста. Высокоаффинное связывание всех NRG принципиально опосредовано через ErbB3 или ErbB4. Связывание лигандов NRG приводит к димеризации с другими субъединицами ErbB и трансактивации посредством фосфорилирования специфических остатков тирозина. В определенных экспериментальных условиях почти все комбинации рецепторов ErbB, по-видимому, способны формировать димеры в ответ на связывание с изоформами NRG-1. Однако, по-видимому, ErbB2 является предпочтительным партнером для димеризации, который может играть важную роль в стабилизации комплекса лиганд-рецептор. ErbB2 не связывает лиганд самостоятельно, но должен являться гетерологично спаренным с одним из других подтипов рецептора. ErbB3 не обладает тирозинкиназной активностью, но является мишенью для фосфорилирования другими рецепторами. Известно, что экспрессия NRG-1, ErbB2 и ErbB4 является необходимой для образования трабекул миокарда желудочка при развитии мыши.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому способу лечения после неврологического повреждения у млекопитающего. Способ основан на наблюдении, что терапевтических преимуществ полипептида, содержащего подобный эпидермальному фактору роста (EGF-подобный) домен, можно достигать введением терапевтически эффективного количества полипептида млекопитающему; в конкретных вариантах осуществления лечение проводят на или через час 1, час 2, час 8, час 12, час 24, час 30, час 36, час 42, сутки 2 или позже после неврологического повреждения. В одном варианте осуществления изобретения лечение начинают после острого окна после повреждения. В одном варианте осуществления изобретения лечение начинают после подострого окна после повреждения. В одном варианте осуществления изобретения лечение начинают во время и еще продолжают после острого окна после повреждения. В одном варианте осуществления изобретения лечение начинают во время и еще продолжают после подострого окна после повреждения.
Соответственно, настоящее изобретение относится к введению полипептида (или кодирующей полипептид нуклеиновой кислоты), содержащего EGF-подобный домен, млекопитающему, начиная на сутки 1, 2 или 3, даже вплоть до суток 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 включительно; неделю или более чем одну неделю, две недели или более двух недель после неврологического повреждения; три недели или более трех недель после неврологического повреждения; четыре недели или более четырех недель после неврологического повреждения; один месяц или более одного месяца после неврологического повреждения; два месяца или более двух месяцев после неврологического повреждения; три месяца или более трех месяцев после неврологического повреждения; четыре месяца или более четырех месяцев после неврологического повреждения; пять месяцев или более пяти месяцев после неврологического повреждения; шесть месяцев или более шести месяцев после неврологического повреждения. В соответствии с настоящим изобретением EGF-подобный домен кодирован геном нейрегулина. Введение по изобретению включает введение пептида, содержащего EGF-подобный домен, или кодирующей его молекулы нуклеиновой кислоты, в количестве, эффективном для лечения в хронической фазе после неврологического повреждения у млекопитающего.
Другой аспект изобретения относится к способу стимуляции неврологического восстановления во время периода, лежащего за пределами острой или подострой фазы после ишемического события у млекопитающего. Лечение по изобретению можно начинать в пределах острого или подострого периода, но оно включает по меньшей мере одну, две, три, четыре, пять, шесть или более шести обработок за пределами острого или подострого периода, соответственно.
Способ по изобретению включает введение полипептида, содержащего подобный эпидермальному фактору роста (EGF-подобный) домен, указанному млекопитающему, где указанный EGF-подобный домен кодирован геном нейрегулина (NRG)-1, и указанное введение проводят по меньшей мере через двое или трое, или четверо суток после ишемического события, хотя лечение можно начинать в пределах острых или подострых временных рамок, и в терапевтически эффективном количестве, достаточном для стимуляции неврологического восстановления во время хронической фазы после ишемического события у указанного млекопитающего.
В конкретных вариантах осуществления изобретения, ген нейрегулина может представлять собой ген NRG-1, ген NRG-2, ген NRG-3 или ген NRG-4. Полипептид нейрегулина по изобретению может, в свою очередь, являться кодированным одним из этих четырех генов нейрегулинов; полипептид нейрегулина по изобретению может, в свою очередь, являться кодированным вариантом или гомологом любого одного из этих четырех генов нейрегулинов. См. на фиг.6A-6D последовательности аминокислот и нуклеиновой кислоты полноразмерного GGF2 человека, изоформы NRG-1.
В аспекте изобретения, подходящие млекопитающие включают, в качестве неограничивающих примеров, мышей, крыс, кроликов, собак, обезьян или свиней. В более конкретном варианте осуществления изобретения, млекопитающее представляет собой человека.
Определения
Как используется в настоящем документе, термин «приблизительно» включает указанное значение плюс или минус 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15% от указанного значения. В одном варианте осуществления, «приблизительно» обозначает 98-102% от указанного значения. В одном варианте осуществления, «приблизительно» обозначает 95-105% от указанного значения.
После повреждения, «острая фаза» лежит в диапазоне от времени начала неврологического повреждения (например, инсульта) до приблизительно шести часов после неврологического повреждения. За острой фазой следует «подострая фаза», которая лежит в диапазоне от приблизительно шести часов до двух суток после неврологического повреждения. В одном варианте осуществления «подострая фаза» лежит в диапазоне от приблизительно шести часов до трех суток после неврологического повреждения. Период после подострой фазы обозначают как «хроническая фаза» после неврологического повреждения. Пост-острая фаза включает как подострый, так и хронический периоды после повреждения.
Под «подобным эпидермальному фактору роста доменом» или «EGF-подобным доменом» понимают полипептидный мотив, кодируемый геном NRG-1, NRG-2 или NRG-3, который связывает и активирует ErbB2, ErbB3, ErbB4 или их сочетания и обладает структурным сходством со связывающим EGF рецептор доменом, как описано в Holmes et al., Science 256:1205-1210, 1992; Патенте США № 5530109; Патенте США № 5716930; Патенте США № 7037888; Hijazi et al., Int. J. Oncol. 13:1061-1067, 1998; Chang et al., Nature 387:509-512, 1997; Carraway et al., Nature 387:512- 516, 1997; Higashiyama et al., J Biochem. 122:675-680, 1997; и WO 97/09425). См. на фиг.7-12 последовательность нуклеиновой кислоты и аминокислотную последовательность, соответствующие доменам 1-6 EGFL, кодируемого геном NRG-1.
Под «экспрессирующим вектором» понимают сконструированные с помощью генной инженерии плазмиду или вирус, полученные, например, из бактериофага, аденовируса, ретровируса, поксвируса, вируса герпеса, или искусственную хромосому, которые используют для переноса последовательности, кодирующей полипептид (например, нейрегулин), функционально связанный с промотором, в клетку-хозяина, так что кодируемый пептид или полипептид экспрессируется в клетке-хозяине.
Термины «неврологическое повреждение» и «повреждение» в настоящем документе часто используют взаимозаменяемо, «неврологическая травма» представляет собой один вариант «неврологического повреждения», и ее, как правило, можно рассматривать как синоним. «Неврологическое повреждение» представляет собой повреждение, вызывающее некоторое разрушение или гибель нервной ткани. Неврологическое повреждение, как правило, имеет в качестве последствий некоторые потери, например, снижение ментальной, сенсорной или мышечной функции.
«Нейропротектор» представляет собой что-то, что может сохранять нейроны до того, как они погибнут от множества инсультов, воздействующих на них в острой или подострой фазе после повреждения. После острой окклюзии часто присутствует локализованный участок поврежденного вещества головного мозга, окруженный зоной полутени, которая может погибнуть в течение нескольких часов, если не восстановить кровообращение. Время до гибели этой зоны полутени можно продлить на несколько часов в экспериментальных моделях с помощью «нейропротекторов», таких как антагонисты NMDA, блокаторы кальциевых каналов, поглотители свободных радикалов и средства-ловушки, антиапоптотические средства, ингибиторы каспазы, ингибиторы parp и т.д. Для этой цели «нейропротектор» представляет собой что-то, что может сохранять нейроны до того, как они погибнут от множества инсультов, воздействующих на них в острой фазе.
Под «нейрегулином» или «NRG» понимают полипептид, который является кодированным геном или нуклеиновой кислотой (например, кДНК) NRG-1, NRG-2, NRG-3 или NRG-4, и связывает и активирует рецепторы EGFR, ErbB1, ErbB2, ErbB3, или ErbB4, или их комбинации.
Под «нейрегулином-1», «NRG-1», «херегулином», «GGF2» или «лигандом p185erbB2» понимают полипептид, который связывает рецептор ErbB2 и является кодированным геном лиганда p185erbB2, описанным в Патенте США № 5530109; Патенте США № 5716930; и Патенте США № 7037888, полное содержание каждого из которых приведено в настоящем описании в качестве ссылки. Связывание с рецептором erbB2 может являться опосредованным через гетерологичное спаривание рецептора erbB2 с erbB1, erbB3 или erbB4.
Под «подобным нейрегулину полипептидом» понимают полипептид, который обладает EGF-подобным доменом, кодируемым геном нейрегулина, и связывает и активирует EGFR, ErbB1, ErbB-2, ErbB-3, ErbB-4 или их комбинацию. Связывание с рецептором erbB2 может являться опосредованным через гетерологичное спаривание рецептора erbB2 с erbB1, erbB3 или erbB4.
Как применяют в настоящем документе, термин «неврологическое восстановление» используют для обозначения процесса, посредством которого нервная система восстанавливает свое функционирование до нормального состояния после повреждения, заболевания, инфекции или другого нарушения нервной системы, головного мозга, спинного мозга или периферических нервов.
Под «функционально связанным» понимают, что нуклеиновая кислота, кодирующая полипептид (например, кДНК), и одна или несколько регуляторных последовательностей соединены таким образом, чтобы позволять экспрессию гена, когда соответствующие молекулы (например, белки - активаторы транскрипции) связываются с регуляторными последовательностями.
Как применяют в настоящем документе «пептид» содержит, в основном состоит из, или состоит из пептида приблизительно из: 625, 600, 575, 550, 525, 500, 475, 450, 425, 400, 375, 350, 325, 300, 275, 250, 225, 200, 175, 150, 125, 100, 75, 50 или менее 50 аминокислот.
Под «промотором» понимают минимальную последовательность, достаточную для управления транскрипцией. Изобретение относится также к тем промоторным элементам, которые являются достаточными для осуществления зависимой от промотора экспрессии гена, которую можно контролировать для типа клеток или физиологического статуса (например, состояние гипоксии против состояния нормоксии), или можно индуцировать внешними сигналами или средствами; такие элементы могут быть локализованы в 5'- или 3'-, или внутренних областях нативного гена.
Термин «терапевтически эффективное количество» предназначен для обозначения такого количества лекарственного средства или фармацевтического средства, которое вызывает биологический или медицинский ответ в ткани, системе, у животного или человека, как считает исследователь, ветеринар, лечащий врач или другой клиницист. Терапевтическое изменение представляет собой изменение поддающихся измерению биохимических характеристик в том направлении, которое, как ожидают, облегчает рассматриваемое заболевание или состояние. Более конкретно, «терапевтически эффективное количество» представляет собой количество, достаточное для уменьшения симптомов, связанных с медицинским состоянием или инвалидностью, для нормализации функций организма при заболевании или нарушениях, приводящих к ухудшению конкретных функций организма, или для обеспечения улучшения одного или нескольких поддающихся измерению в клинических условиях параметров заболевания.
Как применяют в настоящем документе, термин «лечение» означает получение восстановления после неврологического повреждения, где в ином случае его бы не было; увеличение скорости естественного восстановления после неврологического повреждения; или стимуляцию восстановления до более высокого уровня функционирования. Без связи с теорией, не ожидают, что в хроническом окне после повреждения возможно уменьшать какую-либо дальнейшую гибель нервов, т.е., это понимают в том смысле, что нервы погибают ко времени начала хронического окна. Однако, лечение по изобретению включает во время хронического периода, например, уменьшение снижения функций или жизнеспособности ткани (например, мышцы или кости), которые в ином случае могут происходить в ткани, обслуживаемой входящим в ее состав нервом. Кроме того, лечение по изобретению включает во время хронического периода, например, уменьшение атрофии (например, мышцы или кости), которая в ином случае может происходить в ткани, обслуживаемой входящим в ее состав нервом.
Под «трансформированной клеткой» понимают клетку (или потомство клетки), в которую молекула ДНК, кодирующая нейрегулин или полипептид, обладающий EGF-подобным доменом нейрегулина, введена посредством способов рекомбинантной ДНК или известных способов генотерапии.
Если не определено иначе, все технические и научные термины применяемые в настоящем документе, обладают таким же значением, которое является общепринятым для обычного специалиста в области, к которой относится это изобретение.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показана схема прогрессирующих фаз после инсульта/ишемии. На фигуре «OT» обозначает трудотерапию, и «PT» обозначает физиотерапию.
На фиг.2 показаны баллы поведения передних конечностей после постоянного лигирования средней мозговой артерии. Крыс обрабатывали GGF2, NRG1, FGF или носителем, как указано. Для FGF и GGF2 при 100 мкг/кг показали значимое улучшение на сутки 21 теста поведения теста поведения (¶, +, ¥, * обозначают значимые отличия от носителя для bFGF, NRG1, GGF2 при 6,5 мкг/кг и GGF2 при 100 мкг/кг по ANOVA и апостериорному тесту Тьюки).
На фиг.3 показаны баллы поведения задних конечностей после постоянного лигирования средней мозговой артерии. Крыс обрабатывали GGF2, NRG1, FGF или носителем, как указано. GGF2 при 6,5 мкг/кг и NRG при 1,0 мкг/кг были значимо лучше носителя на сутки 7 и 14 тестирования поведения, но не в конечной точке исследования на сутки 21. GGF2 при 100 мкг/кг и FGF были значимо лучше носителя во всех моментах времени тестирования поведения после обработки (¶, +, ¥, * обозначают значимые отличия от носителя для bFGF, NRG1, GGF2 при 6,5 мкг/кг и GGF2 при 100 мкг/кг кг по ANOVA и апостериорному тесту Тьюки).
На фиг.4 показаны баллы поведения поворота тела после постоянного лигирования средней мозговой артерии. Крыс обрабатывали GGF2, NRG1, FGF или носителем, как указано. GGF2 при 100 мкг/кг и FGF были значимо лучше носителя на сутки 21 (¶, +, ¥, * обозначают значимые отличия от носителя для bFGF, NRG1, GGF2 при 6,5 мкг/кг и GGF2 при 100 мкг/кг по ANOVA для повторных измерений и апостериорному тесту Тьюки).
На фиг.5A показаны баллы поведения передних конечностей после постоянного лигирования средней мозговой артерии. Крыс обрабатывали GGF2, начиная на 1, 3 или 7 сутки после лигирования. GGF2 вводили при 0,1 мг/кг, IV ежесуточно в течение 10 суток. Баллы поведения передних конечностей были значимо лучше, чем для носителя, при всех парадигмах обработки во временной точке 21 сутки (*, ¥, + обозначают значимые отличия от носителя для групп с началом обработки на сутки 1, 3 и 7, соответственно, по ANOVA для повторных измерений и апостериорному тесту Тьюки).
На фиг.5B показаны баллы поведения задних конечностей после постоянного лигирования средней мозговой артерии. Крыс обрабатывали GGF2, начиная на 1, 3 или 7 сутки после лигирования. GGF2 вводили при 0,1 мг/кг, IV ежесуточно в течение 10 суток. Баллы поведения задних конечностей были значимо лучше, чем для носителя, когда обработку начинали на 1 или 7 сутки после лигирования, и были лучше по сравнению с носителем, когда обработку начинали на сутки 3 после лигирования, во временной точке сутки 21 (*, ¥, + обозначают значимые отличия от носителя для групп с началом обработки на сутки 1, 3 и 7, соответственно по ANOVA для повторных измерений и апостериорному тесту Тьюки).
На фиг.5C показаны баллы поведения поворота тела после постоянного лигирования средней мозговой артерии. Крыс обрабатывали GGF2, начиная на 1, 3 или 7 сутки после лигирования. GGF2 вводили при 0,1 мг/кг, IV ежесуточно в течение 10 суток. Баллы поворота тела были значимо лучше, чем для носителя, когда обработку начинали на 1 сутки после лигирования, и были лучше по сравнению с носителем, когда обработку начинали на сутки 3 или 7 после лигирования (*, ¥, + обозначают значимые отличия от носителя для групп с началом обработки на сутки 1, 3 и 7, соответственно, по ANOVA для повторных измерений и апостериорному тесту Тьюки).
На фиг.6A-D показаны последовательность нуклеиновой кислоты и аминокислотная последовательность полноразмерного GGF2.
На фиг.7-12 показаны последовательности нуклеиновой кислоты и аминокислотные последовательности подобных эпидермальному фактору роста (EGFL) доменов 1-6.
На фиг.13 показаны последовательность нуклеиновой кислоты и аминокислотная последовательность подобного эпидермальному фактору роста пептида для гена NRG-1.
На фиг.14 показаны последовательность нуклеиновой кислоты и аминокислотная последовательность подобного эпидермальному фактору роста (EGFL) бета-фрагмента из NRG-1.
На фиг.15 показаны последовательность нуклеиновой кислоты и аминокислотная последовательность подобного эпидермальному фактору роста (EGFL) альфа-фрагмента из NRG-1.
На фиг.16 показаны последовательность нуклеиновой кислоты и аминокислотная последовательность подобного эпидермальному фактору роста (EGFL) альфа-фрагмента из NRG-2 альфа.
На фиг.17 показаны последовательность нуклеиновой кислоты и аминокислотная последовательность подобного эпидермальному фактору роста (EGFL) альфа-фрагмента из NRG-2 бета.
На фиг.18 показано выравнивание аминокислотных последовательностей различных EGF-подобных пептидов. EGF-подобный домен можно определить как суб-домены NRG, для которых выравнивание последовательности выявляет по меньшей мере 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 или 45 % гомологии аминокислотной последовательности по сравнению с молекулой EGF человека (последовательность P01133|971-1023, внизу выравнивания на фигуре). Гомологичные аминокислоты обладают идентичными, консервативными или полуконсервативными физико-химическими и структурными свойствами, как обозначено символами '*', ':' и '.', соответственно.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Как указано в настоящем документе, не паллиативное лечение ишемического инсульта до настоящего времени ограничено терапевтическим введением лекарственных средств в острой фазе после инсульта.
Немедленная гибель клеток обусловлена, по меньшей мере частично, недостатком кислорода, наблюдаемым на протяжении острой фазы. Более того, как показано на фиг.1, окклюзия кровотока приводит к высвобождению внутриклеточных запасов свободных радикалов, глутамата, и кальция и натрия, которые, как считают, разрушают ткани головного мозга и расширяют область повреждения.
Подострая фаза, приблизительно от шести часов до двух суток (или трех суток, по некоторым определениям) после неврологического повреждения, характеризуется продолжающимся высвобождением свободных радикалов, выбросом глутамата, высвобождением кальция и натрия, недостатком кислорода в области окклюзии и немедленной локализованной гибелью клеток. До настоящего времени не существует одобренных для применения в клинике средств для применения у человека во время подострой фазы после инсульта.
Как показано на фиг.1, ограниченное окно для фармацевтической терапии после неврологического повреждения по меньшей мере частично можно объяснить патофизиологией повреждения и его прогрессированием с течением времени. Например в пределах нескольких минут окклюзии, нейроны в центре инфаркта разрушаются. Несколько часов после окклюзии, свободные радикалы, эксайтотоксические и провоспалительные агенты высвобождаются/продуцируются, и эти молекулы продолжают разрушать ткани головного мозга и расширять область повреждения. Степень повреждения можно ограничить, как описано выше, посредством восстановления кровотока (с использованием одобренного для применения в клинике средства для разрушения тромбов, т.е., tPA) и таким образом, достижения восстановления снабжения кислородом пораженной области.
Как указано в научной литературе, различные соединения, по-видимому, обладают эффективностью в остром и подостром периодах. Однако, после отметок 24, 36 или 48 часов после неврологического повреждения ЦНС, потенциальные терапевтические средства прогрессивно теряют способность к лечению повреждения. Фактически, некоторые из терапевтических воздействий, например, tPA, которые оказывали эффект в остром периоде, начинают обладать серьезными, опасными для жизни противопоказаниями с течением времени после повреждения.
Несколько суток, недель или месяцев после ишемического события, во время хронической фазы после инсульта, способы терапии должны быть направлены на стимуляцию неврологического восстановления. Стимуляция неврологического восстановления после травматического события, такого как инсульт в центральной нервной системе, включает совершенно другие физиологические феномены и терапевтические способы, чем действовали в пре-хроническом окне. Пре-хронические способы лечения, как правило, включают средства, целью которых является восстановление кровотока и уменьшение острой гибели клеток. В отличие от этого, лекарственное средство, которое можно эффективно вводить через 48 часов или более, или через 72 часа или более после повреждения, отличается от лекарственных средств для острой фазы по его способности восстанавливать функции без изменения размера ишемического повреждения. В одном варианте осуществления, лечение по изобретению начинают после по существу полной гибели ишемического очага ЦНС после повреждения; под «по существу полной гибелью ишемического очага ЦНС после повреждения» понимают, что произошла гибель клеток ЦНС, являющаяся прямым последствием ишемического события, другая гибель клеток, вызванная возрастом или терапией (независимо от того, разработана ли терапия для нацеливания на ишемию), не входит в объем этого определения.
Как показано в настоящем документе, авторы настоящего изобретения показали, что нейрегулины являются эффективными для восстановления неврологической функции во время хронической фазы травматического неврологического повреждения. В одном варианте осуществления, травматическое неврологическое повреждение представляет собой ишемический инсульт. Как описано в настоящем описании, авторы настоящего изобретения сделали неожиданное открытие, что нейрегулин является