Соединения, композиции и способы, предназначенные для лечения бета-амилоидных заболеваний и синуклеинопатий
Иллюстрации
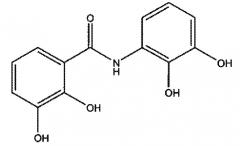
Показать всеИзобретение относится к соединению формулы
и к его фармацевтически приемлемой соли. Изобретение также касается фармацевтической композиции, предназначенной для лечения β-амилоидных заболеваний и синуклеинопатий, на основе указанного соединения. Технический результат - получено новое соединение и фармацевтическая композиция на его основе, которые могут найти применение в медицине для лечения таких заболеваний, как болезнь Альцгеймера и болезнь Паркинсона. 5 н. и 12 з.п. ф-лы, 38 ил., 14 пр.
Реферат
По настоящей заявке испрашивается приоритет на основании заявки на патент США с порядковым номером 12/244968, озаглавленной «Соединения, композиции и способы, предназначенные для лечения β-амилоидных заболеваний и синуклеинопатий» и поданной 3 октября 2008 г. Esposito и соавторами.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к бис-дигидроксиарильным соединениям и их фармацевтически приемлемым солям, их синтезу, содержащим их фармацевтическим композициям и их применению для лечения Aβ-амилоидных заболеваний, например, болезни Альцгеймера, и синуклеинопатий, например, болезни Паркинсона, а также в производстве лекарственных средств, предназначенных для лечения упомянутых заболеваний.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Болезнь Альцгеймера характеризуется накоплением пептида, состоящего из 39-43 аминокислот и именуемого β-амилоидным белком или Aβ, в фибриллярной форме, существующего в виде агрегатов во внеклеточных амилоидных бляшках и в виде амилоида в стенках кровеносных сосудов мозга. Считается, что отложение агрегатов фибриллярного Aβ-амилоида при болезни Альцгеймера приносит вред пациенту и постепенно приводит к токсическому поражению и смерти нервных клеток, т.е. характерным признакам болезни Альцгеймера. Накапливающиеся данные позволяют считать амилоид, и более конкретно, образование, отложение, накопление и/или устойчивое существование Aβ-агрегатов, основным причинным фактором патогенеза болезни Альцгеймера. Кроме того, помимо болезни Альцгеймера, образование, отложение, накопление и устойчивое существование Aβ-агрегатов характерно для ряда других амилоидных заболеваний, в т.ч. синдрома Дауна, расстройств, включающих конгофильную ангиопатию, например, но не ограничиваясь этим, наследственную церебральную геморрагию голландского типа, а также церебральную β-амилоидную ангиопатию.
Болезнь Паркинсона является другим заболеванием человека, характеризующимся образованием, отложением, накоплением, агрегацией и/или устойчивым существованием аномальных отложений фибриллярного белка, который похож на амилоид по многим характеристикам. Считается, что при болезни Паркинсона накопление цитоплазмических телец Леви, состоящих из агрегатов или нитей α-синуклеина, играет важную роль в патогенезе и является мишенью для терапевтического воздействия. Новые средства или соединения, которые способны препятствовать образованию, отложению, накоплению, агрегации и/или устойчивому существованию α-синуклеина или разрушать ранее образовавшиеся фибриллы или агрегаты (или их части), рассматриваются в качестве потенциальных терапевтических средств для лечении болезни Паркинсона и родственных синуклеинопатий. Фрагмент α-синуклеина, состоящий из 35 аминокислот и обладающий способностью образовывать амилоид-подобные фибриллы или агрегаты, был обнаружен in vitro или в тканях мозга пациентов с болезнью Паркинсона. Этот фрагмент α-синуклеина является довольно важной терапевтической мишенью, поскольку считается, что он отвечает за образование телец Леви, которые наблюдаются у всех пациентов с болезнью Паркинсона, синуклеинопатиями и родственными расстройствами. Кроме того, белок α-синуклеин, который образует фибриллы или агрегаты и является Конго красный- и Тиофлавин S-положительным (особые красители, применяемые для выявления агрегатов амилоидных фибрилл), обнаружен в качестве составной части телец Леви в ткани мозга пациентов с болезнью Паркинсона, болезнью с тельцами Леви (Lewy in Handbuch der Neurologie, M. Lewandowski, ed., Springer, Berlin pp. 920-933, 1912; Pollanen et al., J. Neuropath. Exp. Neurol. 52:183-191, 1993; Spillantini et al., Proc. Natl. Acad. Sci. USA 95:6469-6473, 1998; Arai et al., Neurosci. Lett. 259:83-86, 1999), множественной системной атрофией (Wakabayashi et al., Acta Neuropath. 96:445-452, 1998), деменцией с тельцами Леви и вариантом болезни Альцгеймера с тельцами Леви. При болезни Паркинсона в мозге пациента появляются агрегаты, которые являются Конго красный- и Тиофлавин S-положительными, и в основном включают бета-складчатые листовые вторичные структуры.
Амилоид, как терапевтическая мишень при болезни Альцгеймера
Болезнь Альцгеймера является тяжелой экономической нагрузкой на общество. По данным современных исследований стоимость ухода за одним пациентом с болезнью Альцгеймера с тяжелыми когнитивными нарушениями на дому или в доме престарелых составляет более 47000 долларов в год (A Guide to Understanding Alzheimer's Disease and Related Disorders). Для заболевания, которое может продолжаться от 2 до 20 лет, общая стоимость болезни Альцгеймера для семей и для общества является непомерно высокой. Ежегодные экономические потери от болезни Альцгеймера в Соединенных Штатах с точки зрения затрат на уход и потерь в заработке, как самого пациента, так и тех, кто за ним ухаживает, оцениваются в 80-100 млрд. долларов (2003, Progress Report on Alzheimer's Disease).
Такрина гидрохлорид («Cognex») - первое одобренное FDA лекарственное средство для болезни Альцгеймера - представляет собой ингибитор ацетилхолинэстеразы (Cutler and Sramek, N. Engl. J. Med. 328:808-810, 1993). Однако было показано, что применение этого лекарственного средства позволяет добиться лишь ограниченного улучшения когнитивной способности у пациентов с болезнью Альцгеймера и само средство обладает значительными побочными эффектами, например, токсическим действием на печень. Второй одобренный FDA препарат, а именно донепезил («Aricept»), который также является ингибитором ацетилхолинэстеразы, более эффективен, чем такрин, демонстрируя небольшое улучшение когнитивных способностей у пациентов с болезнью Альцгеймера (Barner and Gray, Ann. Pharmacotherapy 32:70-77, 1998; Rogers and Friedhoff, Eur. Neuropsych. 8:67-75, 1998), но и он, по-видимому, не является средством излечения. Поэтому очевидно, что существует потребность в более эффективных средствах лечения пациентов с болезнью Альцгеймера.
Для болезни Альцгеймера характерно отложение и накопление пептида, содержащего 39-43 аминокислотных остатков и именуемого бета-амилоидным белком, Aβ или β/A4 (Glenner and Wong, Biochem. Biophys. Res. Comm. 120:885-890, 1984; Masters et al., Proc. Natl. Acad. Sci. USA 82:4245-4249, 1985; Husby et al., Bull. WHO 71:105-108, 1993). Aβ образуется при расщеплении протеазой более крупных белков-предшественников, именуемых белками-предшественниками β-амилоида (APP), три из которых существуют в виде нескольких альтернативно сшитых вариантов. Наиболее часто встречающиеся формы APP включают белки, состоящие из 695, 751 и 770 аминокислот (Tanzi et al., Nature 31:528-530, 1988).
Малый пептид Aβ является основным компонентом, который превращает отложения амилоида в мозге пациентов с болезнью Альцгеймера в «бляшки». Кроме того, болезнь Альцгеймера характеризуется наличием многочисленных нейрофибриллярных «клубков», состоящих из парных спиральных нитей, которые аномально накапливаются в нейрональной цитоплазме (Grundke-Iqbal et al., Proc. Natl. Acad. Sci. USA 83:4913-4917, 1986; Kosik et al., Proc. Natl. Acad. Sci. USA 83:4044-4048, 1986; Lee et al., Science 251:675-678, 1991). Следовательно, патологический признак болезни Альцгеймера заключается в наличии «бляшек» и «клубков», причем в центральном ядре бляшек откладывается β-амилоид. Другими основными типами поражений, обнаруженных в мозге пациентов с болезнью Альцгеймера, является накопление β-амилоида в стенках кровеносных сосудов, как в паренхиме мозга, так и в стенках сосудов мозговой оболочки, находящейся за пределами мозга. Отложения β-амилоида, находящиеся в стенках кровеносных сосудов, именуют цереброваскулярным амилоидом или конгофильной ангиопатией (Mandybur, J. Neuropath. Exp. Neurol. 45:79-90, 1986; Pardridge et al., J. Neurochem. 49:1394-1401, 1987).
В течение многих лет происходили непрерывные споры ученых о значении «β-амилоида» в болезни Альцгеймера и о том, являются ли характерные «бляшки» и «клубки» причиной или только следствием заболевания. Исследования последних нескольких лет показали, что β-амилоид действительно является причинным фактором для болезни Альцгеймера и его не следует рассматривать в качестве безвредного свидетельства заболевания. Было показано, что Aβ-белок, обнаруживаемый при болезни Альцгеймера, в клеточной культуре способен вызывать дегенерацию нервных клеток за короткий промежуток времени (Pike et al., Br.Res. 563:311-314, 1991; J. Neurochem. 64:253-265, 1995). Исследования дают основание предположить, что именно фибриллярная структура (в основном состоящая из β-складчатых листовых вторичных структур) отвечает за нейротоксическое действие. Кроме того, было обнаружено, что Aβ проявляет нейротоксичность в срезах культур гиппокампуса (Harrigan et al., Neurobiol. Aging 16:779-789, 1995) и вызывает смерть нервных клеток у трансгенных мышей (Games et al., Nature 373:523-527, 1995; Hsiao et al., Science 274:99-102, 1996). Инъекция Aβ Альцгеймера в мозг крысы также вызывает ухудшение памяти и нарушение деятельности нейронов (Flood et al., Proc. Natl. Acad. Sci. USA 88:3363-3366, 1991; Br. Res. 663:271-276, 1994).
Возможно наиболее убедительные доказательства того, что Aβ-амилоид принимает непосредственное участие в патогенезе болезни Альцгеймера, были получены в результате генетических исследований. Было обнаружено, что выработка Aβ может являться следствием мутаций в генах, кодирующих его предшественника, т.е. белка-предшественника β-амилоида (Van Broeckhoven et al., Science 248:1120-1122, 1990; Murrell et al., Science 254:97-99, 1991; Haass et al., Nature Med. 1:1291-1296, 1995). Выявление мутаций в гене белка предшественника β-амилоида, которые вызывают раннее начало семейной болезни Альцгеймера, является сильнейшим аргументом в пользу того, что амилоид является основным участником патогенетического процесса, лежащего в основе этого заболевания. Были обнаружены и описаны четыре мутации, вызывающие заболевание, что демонстрирует важность Aβ в появлении семейной болезни Альцгеймера (смотрите обзор в Hardy, Nature Genet. 1:233-234, 1992). Все перечисленные данные дают основание предположить, что разработка лекарственного средства, способного уменьшить, устранить или предотвратить образование, агрегацию, отложение, накопление и/или устойчивое существование фибриллярного Aβ в мозге пациентов, позволит получить эффективное терапевтическое средство.
Болезнь Паркинсона и синуклеинопатии
Болезнь Паркинсона представляет собой нейродегенеративное расстройство, патология которого характеризуется наличием телец Леви в цитоплазме (Lewy in Handbuch der Neurologie, M. Lewandowski, ed., Springer, Berlin pp. 920-933, 1912; Pollanen et al., J. Neuropath. Exp. Neurol. 52:183-191, 1993), основным компонентом которых являются нити, состоящие из α-синуклеина (Spillantini et al., Proc. Natl. Acad. Sci. USA 95:6469-6473, 1998; Arai et al., Neurosci. Lett. 259:83-86, 1999), т.е. белка, состоящего из 140 аминокислот (Ueda et al., Proc. Natl. Acad. Sci. USA 90:11282-11286, 1993). Были описаны две преобладающие мутации в гене α-синуклеина, вызывающие раннее семейное начало болезни Паркинсона, и это дает основание предположить, что тельца Леви механически способствуют дегенерации нейронов при болезни Паркинсона и родственных расстройствах (Polymeropoulos et al., Science 276:2045-2047, 1997; Kruger et al., Nature Genet. 18:106-108, 1998). Не так давно в результате исследований in vitro было продемонстрировано, что рекомбинантный α-синуклеин действительно может образовывать фибриллы или агрегаты, подобные тельцам Леви (Conway et al., Nature Med. 4:1318-1320, 1998; Hashimoto et al., Brain Res. 799:301-306, 1998; Nahri et al., J.Biol.Chem. 274:9843-9846, 1999). Важнее всего то, что обе мутации α-синуклеина, связанные с болезнью Паркинсона, ускоряют этот процесс агрегации, показывая, что эти исследования in vitro могут иметь отношение к патогенезу болезни Паркинсона. Агрегация альфа-синуклеина и образование фибрилл соответствуют критериям процесса полимеризации, зависимого от образования активных центров (Wood et al., J. Biol. Chem. 274:19509-19512, 1999). В этом отношении образование фибрилл или агрегация α-синуклеина сходны с соответствующими процессами для волокон β-амилоидного белка (Aβ) при болезни Альцгеймера. Как рекомбинантный белок альфа-синуклеин, так и не-Aβ компонент (известный как NAC), который представляет собой пептидный фрагмент α-синуклеина, состоящий из 35 аминокислот, обладают способностью образовывать фибриллы или агрегаты в случае инкубирования при 37°C и демонстрируют положительную реакцию на амилоидные красители, например, Конго красный (демонстрируя двойное лучепреломление в красных/зеленых лучах при наблюдении в поляризованном свете) и Тиофлавин S (демонстрируя положительную флуоресценцию) (Hashimoto et al., Brain Res. 799:301-306, 1998; Ueda et al., Proc. Natl. Acad. Sci. USA 90:11282-11286, 1993).
Синуклеины представляют собой семейство небольших предсинаптических нейрональных белков, состоящее из α-, β- и γ-синуклеинов, из которых только агрегаты α-синуклеина связаны с несколькими неврологическими заболеваниями (Ian et al., Clinical Neurosc. Res. 1:445-455, 2001; Trojanowski and Lee, Neurotoxicology 23:457-460, 2002). Роль синуклеинов (и в частности, альфа-синуклеина) в этиологии ряда нейродегенеративных заболеваний была установлена на основе ряда наблюдений. С точки зрения патологии синуклеин был идентифицирован как основной компонент телец Леви, т.е. включений, характерных для болезни Паркинсона, и его фрагмент был выделен из амилоидных бляшек, характерных для другого неврологического заболевания, а именно болезни Альцгеймера. С биохимической точки зрения было показано, что рекомбинантный α-синуклеин образует фибриллы или агрегаты, которые повторяют особенности ультраструктуры альфа-синуклеина, выделенного из тканей пациентов с деменцией с тельцами Леви, болезнью Паркинсона и множественной системной атрофией. Кроме того, идентификация мутаций в гене синуклеина, которые, хотя и в редких случаях, возникают при семейной болезни Паркинсона, продемонстрировала однозначную связь между синуклеиновой патологией и нейродегенеративными заболеваниями. Общее участие α-синуклеина в целом ряде заболеваний, таких как болезнь Паркинсона, деменция с тельцами Леви, множественная системная атрофия и вариант болезни Альцгеймера с тельцами Леви, привело к классификации этих заболеваний под обобщающим термином «синуклеинопатии».
Фибриллы или агрегаты α-синуклеина, возникающие при болезни Паркинсона, и волокна Aβ, возникающие при болезни Альцгеймера, преимущественно состоят из β-складчатых листовых структур. Для соединений, которые, как было найдено, ингибируют образование фибрилл Aβ-амилоида при болезни Альцгеймера, была также показана эффективность при ингибировании образования или агрегации фибрилл α-синуклеина, что показано в примерах настоящего изобретения. Следовательно, помимо эффективности в качестве средства лечения болезни Альцгеймера, эти соединения могли бы также служить в качестве средств лечения болезни Паркинсона и других синуклеинопатий.
Болезнь Паркинсона и болезнь Альцгеймера характеризуются неадекватным накоплением нерастворимых агрегатов, состоящих в основном из неправильно уложенных белков, которые обогащены β-складчатыми листовыми вторичными структурами (см. обзор в Cohen et al., Nature 426:905-909, 2003; Chiti et al., Annu. Rev. Biochem., 75:333-366, 2006). При болезни Паркинсона основной компонент этих агрегатов, являющихся частями телец Леви, представляет собой α-синуклеин, и мутации α-синуклеина, которые увеличивают его склонность к неправильной укладке и агрегации, наблюдаются при семейной болезни Паркинсона (Polymeropoulos et al., Science 276:2045-2047, 1997; Papadimitriou et al., Neurology 52:651-654, 1999).
Митохондриальная дисфункция, в частности, в результате нарушения комплекса I цепи переноса электронов, также является обычной особенностью болезни Паркинсона (Schapira et al., J. Neurochem., 54:823-827, 1990; обзор в Greenamyre et al., IUBMB Life, 52:135-141, 2001). Непосредственное доказательство митохондриальной недостаточности в этиологии болезни Паркинсона было впервые получено на основании наблюдения, что MPP+ (1-метил-4-фенил-2,3-дигидропиридиний), т.е. активный метаболит токсина паркинсонизма N-метил-4-фенил-1,2,3,6-тетрагидропиридина (MPTP), ингибирует упомянутый комплекс I (Nicklas et al., Life Sci., 36:2503-2508, 1985). Затем было показано, что ротенон, т.е. другой ингибитор комплекса I, является улучшенной моделью агрегации α-синуклеина, поскольку помимо изменений в поведении и потери дофаминергических нейронов, что наблюдается в модели MPTP, он воспроизводит упомянутые выше α-синуклеин-положительные цитоплазматические агрегаты. Проявляемую ротеноном токсичность этого типа можно наблюдать в целом ряде модельных систем, включая крыс (Betarbet et al., Nat. Neurosci., 3:1301-1306, 2000; Panov et al., J. Biol. Chem., 280:42026-42035, 2005), срезы крысиного мозга (Sherer et al., J. Neurosci., 23:10756-10764, 2003; Testa et al., Mol. Brain Res., 134:109-118, 2005), C. elegance (Ved et al., J. Biol. Chem., 280:42655-42668, 2005) и культивированные клетки (Sherer et al., J. Neurosci., 22:7006-7015, 2002), и было показано, что эта токсичность является следствием повышенного окислительного поражения митохондрий, которое, в свою очередь, является результатом ингибирования комплекса I.
Для лучшего понимания взаимосвязи окислительного поражения с патогенезом мутировавшего α-синуклеина исследователями была получена клеточная линия нейробластомы (с использованием клеток BE-M17), в которой имеет место избыточная экспрессия α-синуклеина A53T. В этих клетках, в ответ на действие различных средств, вызывающих окислительный стресс, происходит агрегация α-синуклеина A53T и усиливается митохондриальная дисфункция и смерть клеток (Ostrerova-Golts et al., J. Neurosci., 20:6048-6054, 2000). Эти клетки подвержены окислительному стрессу при обработке ротеноном и, следовательно, особенно применимы для тестирования средств, которые могли бы ингибировать агрегацию/образование фибрилл α-синуклеина.
Крайне необходимо обнаружение и идентификация новых соединений или средств, которые являются потенциальными терапевтическими средствами для прекращения образования, отложения, накопления и/или устойчивого существования амилоида, что имеет место при болезни Альцгеймера и болезни Паркинсона.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к бис-дигидроксиарильным соединениям и их фармацевтически приемлемым солям. Эти соединения применимы в лечении β-амилоидных заболеваний и синуклеинопатий.
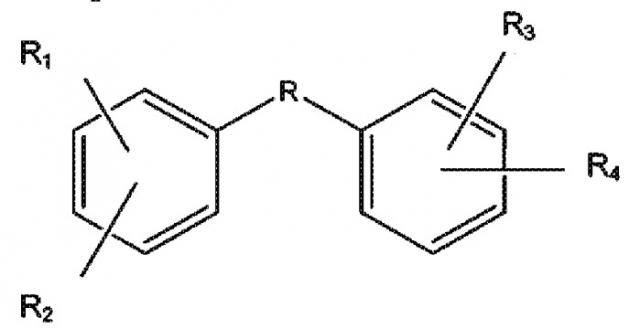
Указанные соединения представляют собой соединения формулы:
,
где
R1, R2, R3 и R4 представляют собой гидроксильные группы, независимо находящиеся в одном из положений, выбранном из группы, состоящей из 2,3; 2,4; 2,5; 2,6; 3,5; 3,6; 4,5; 4,6 и 5,6, и R выбран из сульфонамида, гетероарила, трициклоалкила и -C(O)NR', где R' выбран из H или CH3, или их фармацевтически приемлемые эфиры или соли.
Кроме того, изобретение относится к любым фармацевтически приемлемым производным этих соединений, включая соли, сложные эфиры, простые или сложные эфиры енолов, ацетали, кетали, ортоэфиры, полуацетали, полукетали, сольваты, гидраты или пролекарства соединений. Фармацевтически приемлемые соли включают, не ограничиваясь этим, соли аминов, как, например, не ограничиваясь перечисленными, N,N'-дибензилэтилендиамина, хлорпрокаина, холина, аммиака, диэтаноламина и других гидроксиламинов, этилендиамина, N-метилглюкамина, прокаина, N-бензилфенэтиламина, 1-парахлорбензил-2-пирролидин-1'-илметилбензимидазола, диэтиламина и других алкиламинов, пиперазина, трис(гидроксиметил)аминометана, соли щелочных металлов, как, например, не ограничиваясь перечисленными, лития, калия и натрия, щелочноземельных металлов, как, например, не ограничиваясь перечисленными, бария, кальция и магния, соли переходных металлов, как, например, но не ограничиваясь этим, цинка, и другие соли металлов, как, например, но не ограничиваясь этим, остатков гидрофосфата натрия и динатрий фосфата, и, кроме того, но не ограничиваясь этим, соли минеральных кислот, как, например, не ограничиваясь указанным, гидрохлориды и сульфаты, соли органических кислот, как, например, не ограничиваясь этим, ацетаты, лактаты, малаты, тартраты, цитраты, аскорбаты, сукцинаты, бутираты, валераты и фумараты.
Кроме того, изобретение относится к фармацевтическим составам, предназначенным для введения любым подходящим путем и любыми подходящими средствами, содержащим эффективные концентрации одного или нескольких соединений по настоящему изобретению или их фармацевтически приемлемых производных, таких как соли, сложные эфиры, простые или сложные эфиры енолов, ацетали, кетали, ортоэфиры, полуацетали, полукетали, сольваты, гидраты или пролекарства соединений, которые доставляют действующее начало в количестве, эффективном для лечения амилоидных заболеваний.
Упомянутые составы представляют собой композиции, подходящие для введения любым желаемым путем, и в их число входят растворы, суспензии, эмульсии, таблетки, диспергируемые таблетки, пилюли, капсулы, порошки, сухие порошки для ингаляции, составы с замедленным высвобождением, аэрозоли для доставки в нос и дыхательные пути, пластыри для трансдермальной доставки, а также композиции для доставки любым другим подходящим путем. Композиции должны подходить для перорального введения, парентерального введения с помощью инъекций, включая подкожные, внутримышечные или внутривенные инъекции в форме водных или масляных растворов или эмульсий, трансдермального введения и других выбранных путей введения.
В настоящем изобретении разработаны способы с применением указанных соединений и композиций, предназначенные для разрушения, измельчения, удаления, уменьшения или выведения фибрилл или агрегатов β-амилоида и α-синуклеина, и, за счет этого, обеспечивающие новые пути лечения β-амилоидных заболеваний и синуклеинопатий.
Кроме того, в изобретении разработаны способы лечения, предупреждения или облегчения одного или нескольких симптомов амилоидных заболеваний или амилоидозов, включая, но не ограничиваясь этим, заболевания, связанные с образованием, отложением, накоплением или устойчивым существованием β-амилоидных фибрилл.
Способы лечения амилоидных заболеваний включают, не ограничиваясь этим, способы лечения болезни Альцгеймера, синдрома Дауна, наследственной церебральной геморрагии с амилоидизом голландского типа и церебральной β-амилоидной ангиопатии.
Кроме того, в изобретении разработаны способы лечения, предупреждения или облегчения одного или нескольких симптомов синуклеиновых заболеваний или синуклеинопатий. В одном из вариантов осуществления эти способы позволяют ингибировать или предупредить образование фибрилл α-синуклеина, ингибировать или предупредить рост фибрилл α-синуклеина и/или вызвать измельчение, разрушение и/или дезагрегацию ранее сформировавшихся агрегатов α-синуклеина и отложений белка, связанных с α-синуклеином. Синуклеиновые заболевания включают, не ограничиваясь указанными, болезнь Паркинсона, семейную болезнь Паркинсона, болезнь с тельцами Леви, вариант болезни Альцгеймера с тельцами Леви, деменцию с тельцами Леви, множественную системную атрофию и комплекс Гуама паркинсонизм-деменция.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Настоящая заявка на патент содержит по меньшей мере один рисунок, выполненный в цвете. Копии настоящей патентной публикации с цветным рисунком (рисунками) будут предоставлены в патентное бюро по запросу и после внесения необходимой оплаты.
На фиг.1A приведено несколько спектров кругового дихроизма, показывающих разрушение Aβ-фибрилл, характерных для болезни Альцгеймера, под действием тестируемых соединений в разбавлении 1:1 масс./масс. На фиг.1B графически показано ингибирование в %.
На фиг.2 приведены сравнительные спектры кругового дихроизма, показывающие, что α-синуклеин образует структуру, обогащенную β-слоями после 4 дней встряхивания при 37°C.
На фиг.3 приведено несколько спектров кругового дихроизма, показывающих, что тестируемые соединения ингибируют агрегацию α-синуклеина при разбавлении 1:1 масс./масс. На фиг.3B графически показано ингибирование в %.
На фиг.4 приведено несколько спектров кругового дихроизма, показывающих, что тестируемые соединения ингибируют агрегацию α-синуклеина при разбавлении 1:0,1 масс./масс. На фиг.4B графически показано ингибирование в %.
На фиг.5 графически суммированы результаты, полученные с использованием Тиофлавина T, относящиеся к ингибированию образования или агрегации фибрилл Aβ при действии тестируемых соединений.
На фиг.6 графически суммированы результаты, полученные с использованием Конго красного, относящиеся к ингибированию образования или агрегации фибрилл Aβ при действии тестируемых соединений.
На фиг.7 графически суммированы результаты, полученные с использованием Тиофлавина T, относящиеся к ингибированию образования или агрегации волокон α-синуклеина при действии тестируемых соединений.
На фиг.8 графически суммированы результаты, полученные с использованием Конго красного, относящиеся к ингибированию образования или агрегации фибрилл α-синуклеина при действии тестируемых соединений.
На фиг.9A-D приведены примеры флуоресцентных микрофотографий, демонстрирующих влияние ротенона на количество тиофлавин S-положительных агрегатов. На фиг.9A показан результат для чистого носителя, фиг.9B соответствует 1 мкМ ротенону, на фиг.9C показан результат для 5 мкМ при низком увеличении, и на фиг.9D - результат для 5 мкМ при высоком увеличении. На фиг.9E суммированы результаты исследования количественного изменения тиофлавин S-положительных агрегатов в ответ на обработку ротеноном.
На фиг.10A-C приведены примеры флуоресцентных микрофотографий, демонстрирующих уменьшение тиофлавин S-положительных агрегатов (зеленая флуоресценция) при действии положительного контрольного соединения. На фиг.10A показаны необработанные образцы, на фиг.10B - образцы, обработанные 500 нг/мл положительного контроля, и на фиг.10C - 1 мкг/мл положительного контрольного соединения. На фиг.10D суммированы результаты количественного анализа дозозависимого уменьшения агрегации.
На фиг.11A-D приведены примеры флуоресцентных микрофотографий, демонстрирующих дозозависимое влияние соединения 1 на образование в клетках тиофлавин S-положительных агрегатов (зеленого цвета) под действием ротенона. На фиг.11A показаны необработанные образцы (только ротенон), и на фиг.11B-D показаны образцы, обработанные, соответственно, 500 нг/мл, 1 мкг/мл и 2 мкг/мл соединения 1. На фиг.11E суммированы результаты количественного анализа действия соединения 1.
На фиг.12A-D приведены примеры флуоресцентных микрофотографий, демонстрирующих, что соединение 2 значительно уменьшает количество тиофлавин S-положительных агрегатов (зеленого цвета) в клетках, образовавшихся под действием ротенона. На фиг.12A показаны необработанные образцы (только ротенон), и на фиг.12B-D показаны образцы, обработанные, соответственно, 500 нг/мл, 1 мкг/мл и 2 мкг/мл соединения 2. На фиг.12E суммированы результаты количественного анализа анти-агрегирующего действия соединения 2.
На фиг.13A-D приведены примеры флуоресцентных микрофотографий, демонстрирующих, что соединение 3 дозозависимым образом уменьшает количество тиофлавин S-положительных агрегатов (зеленого цвета) в клетках, образовавшихся под действием ротенона. На фиг.13A показаны необработанные образцы (только ротенон), и на фиг.13B-D показаны образцы, обработанные, соответственно, 500 нг/мл, 1 мкг/мл и 2 мкг/мл соединения 3. На фиг.13E суммированы результаты количественного анализа анти-агрегирующего действия соединения 3.
На фиг.14A-D приведены примеры флуоресцентных микрофотографий, демонстрирующих, что соединение 4 дозозависимым образом незначительно уменьшает количество тиофлавин S-положительных агрегатов (зеленого цвета) в клетках, образовавшихся под действием ротенона. На фиг.14A показаны необработанные образцы (только ротенон), и на фиг.14B-D показаны образцы, обработанные, соответственно, 500 нг/мл, 1 мкг/мл и 2 мкг/мл соединения 4. На фиг.14E суммированы результаты количественного анализа действия соединения 4.
На фиг.15A-D приведены примеры флуоресцентных микрофотографий, демонстрирующих, что соединение 5 дозозависимым образом умеренно понижает количество тиофлавин S-положительных агрегатов (зеленого цвета) в клетках, образовавшихся под действием ротенона. На фиг.15A показаны необработанные образцы (только ротенон), и на фиг.15B-D показаны образцы, обработанные, соответственно, 500 нг/мл, 1 мкг/мл и 2 мкг/мл соединения 5. На фиг.15E суммированы результаты количественного анализа анти-агрегирующего действия соединения 5.
На фиг.16A-D приведены примеры флуоресцентных микрофотографий, демонстрирующих, что соединение 6 оказывает минимальное дозозависимое влияние на количество тиофлавин S-положительных агрегатов (зеленого цвета) в клетках, образовавшихся под действием ротенона. На фиг.16A показаны необработанные образцы (только ротенон), и на фиг.16B-D показаны образцы, обработанные, соответственно, 500 нг/мл, 1 мкг/мл и 2 мкг/мл соединения 6. На фиг.16E суммированы результаты количественного анализа действия соединения 6.
На фиг.17A-C приведены примеры флуоресцентных микрофотографий, демонстрирующих, что соединение 7 дозозависимым образом умеренно понижает количество тиофлавин S-положительных агрегатов (зеленого цвета) в клетках, образовавшихся под действием ротенона. На фиг.17A показаны необработанные образцы (только ротенон), и на фиг.17B-C показаны образцы, обработанные, соответственно, 500 нг/мл и 2 мкг/мл соединения 7. На фиг.17D суммированы результаты количественного анализа анти-агрегирующего действия соединения 7.
На фиг.18A-D приведены примеры флуоресцентных микрофотографий, демонстрирующих, что соединение 8 дозозависимым образом умеренно понижает количество тиофлавин S-положительных агрегатов (зеленого цвета) в клетках, образовавшихся под действием ротенона. На фиг.18A показаны необработанные образцы (только ротенон), и на фиг.18B-D показаны образцы, обработанные, соответственно, 500 нг/мл, 1 мкг/мл и 2 мкг/мл соединения 8. На фиг.18E суммированы результаты количественного анализа анти-агрегирующего действия соединения 8.
На фиг.19A-D приведены примеры флуоресцентных микрофотографий, демонстрирующих, что соединение 9 дозозависимым образом понижает количество тиофлавин S-положительных агрегатов (зеленого цвета) в клетках, образовавшихся под действием ротенона. На фиг.19A показаны необработанные образцы (только ротенон), и на фиг.19B-D показаны образцы, обработанные, соответственно, 500 нг/мл, 1 мкг/мл и 2 мкг/мл соединения 9. На фиг.19E суммированы результаты количественного анализа анти-агрегирующего действия соединения 9, где *p<0,05 соответствует только 1 мкМ ротенону.
Фиг.20 представляет собой график, демонстрирующий 35-45% уменьшение выживаемости клеток после двух дней обработки ротеноном по данным пробы на цитотоксичность XTT.
Фиг.21 представляет собой график, демонстрирующий способность положительного контрольного соединения ингибировать индуцированную ротеноном токсичность по данным пробы на цитотоксичность XTT.
Фиг.22A представляет собой график, демонстрирующий, что соединение 1 не является токсичным до концентрации 10 мкг/мл. Фиг.22B представляет собой график, демонстрирующий способность соединения 1 защищать от индуцированной ротеноном токсичности по данным пробы на цитотоксичность XTT.
Фиг.23A представляет собой график, демонстрирующий, что соединение 2 не является токсичным до концентрации 25 мкг/мл. Фиг.23B представляет собой график, демонстрирующий способность соединения 2 защищать от индуцированной ротеноном токсичности по данным пробы на цитотоксичность XTT.
Фиг.24A представляет собой график, демонстрирующий, что соединение 3 не является токсичным до концентрации 50 мкг/мл. Фиг.24B представляет собой график, демонстрирующий способность соединения 3 защищать от индуцированной ротеноном токсичности по данным пробы на цитотоксичность XTT.
Фиг.25A представляет собой график, демонстрирующий, что соединение 4 не является токсичным до концентрации 25 мкг/мл. Фиг.25B представляет собой график, демонстрирующий способность соединения 4 защищать от индуцированной ротеноном токсичности по данным пробы на цитотоксичность XTT.
Фиг.26A представляет собой график, демонстрирующий, что соединение 5 не является токсичным до концентрации 25 мкг/мл. Фиг.26B представляет собой график, демонстрирующий способность соединения 5 защищать от индуцированной ротеноном токсичности по данным пробы на цитотоксичность XTT.
Фиг.27A представляет собой график, демонстрирующий, что соединение 6 не является токсичным до концентрации 50 мкг/мл. Фиг.27B представляет собой график, демонстрирующий способность соединения 6 защищать от индуцированной ротеноном токсичности по данным пробы на цитотоксичность XTT.
Фиг.28A представляет собой график, демонстрирующий, что соединение 7 не является токсичным до концентрации 50 мкг/мл. Фиг.28B представляет собой график, демонстрирующий способность соединения 7 защищать от индуцированной ротеноном токсичности по данным пробы на цитотоксичность XTT.
Фиг.29A представляет собой график, демонстрирующий, что соединение 8 не является токсичным до концентрации 25 мкг/мл. Фиг.29B представляет собой график, демонстрирующий способность соединения 8 защищать от индуцированной ротеноном токсичности по данным пробы на цитотоксичность XTT.
Фиг.30A представляет собой график, демонстрирующий, что соединение 9 не является токсичным до концентрации 25 мкг/мл. Фиг.30B представляет собой график, демонстрирующий неспособность соединения 9 защищать от индуцированной ротеноном токсичности по данным пробы на цитотоксичность XTT.
Фиг.31 представляет собой график, демонстрирующий время прохождения по перекладине и эффект от введения соединений. Введение соединений 2 и 7 улучшает двигательную активность в тесте на прохождение по перекладине. После трех месяцев введения соединение 2 статистически значимо (p<0,05) улучшает двигательную активность (измеренную по уменьшению времени прохождения) в тесте на прохождение по перекладине на 49% по сравнению с мышами того же возраста, которым вводили носитель. После шести месяцев введения соединение 7 статистически значимо (p<0,05) улучшает двигательную активность в тесте на прохождение по перекладине на 35% по сравнению с мышью того же возраста, которой вводили носитель. Кроме того, соединение 7 демонстрирует общую тенденцию по улучшению двигательной активности на 39% в течение трех месяцев введения по сравнению с мышами того же возраста, которым вводили носитель.
Фиг.32 представляет собой график, на котором отображено время переворота в тесте с вертикальной стойкой и результат от введения соединений. Введение соединения 7 улучшает двигательную активность в тесте с вертикальной стойкой. Через 3 месяца введения соединение 7 способствует улучшению двигательной активности (измеренное по уменьшению времени переворота) в тесте с вертикальной стойкой, и через 6 месяцев введения соединение 7 статистически значимо (p<0,01) улучшает активность на 41% по отношению к активности перед началом введения. Через 6 месяцев введения соединения 7 активность примерно соответствует таковой у нетрансгенных мышей в возрасте 16 месяцев. Мыши, которым вводили носитель, демонстрировали примерно одинаковую активность до введения и через 3 и 6 месяцев введения.
Фиг.33 представляет собой график, на котором показано время в тесте на прохождение по перекладине и эффект от введения соединения 7. Через 6 недель введения соединение 7 статистически значимо улучшает двигательную активность в тесте на прохождение по перекладине (что определяли по 36% уменьшению времени прохождения) по сравнению с мышами того же возраста (**p<0,01), которым вводили носитель. Столбцы отображают среднее значение + SEM, n=8 на группу.
Фиг.34 (врезки A-F) представляют собой микрофотографии, которые демонстрируют, что обработка соединением 7 вызывает уменьшение уровней α-синуклеина в мозге трансгенных мышей в возрасте 18 месяцев, что показывают данные иммуногистохимического исследования. Мыши, которым вводили соединение 7 (врезки C-D), продемонстрировали значительно более низкие внутринейрональные уровни α-синуклеина в лобной доле коры, по сравнению с мышами, которым вводили носитель (врезки A-B). Ткани мозга нетрансгенных мышей дикого типа не подвергаются окрашиванию, характерному для человеческого α-синуклеина, и показаны в качестве контроля специфичности антитела для трансгенного человеческого α-синуклеина (врезки E и F). Анализ и количественная обработка изображений позволяет установить, что введение соединения 7 вызывает статистически значимое уменьшение количества α-синуклеин-положительных объектов на 81%. Данные выражены в виде площади, занятой α-синуклеин-положительными объектами, в процентах. Столбцы гистограммы отображают среднее значение + SEM, n=5 для группы, которой вводили носитель, n=11 для группы, которой вводили соединение 7, и n=4 для группы нетрансгенных (Non-Tg) мышей. ***p<0,001 при сравнении с группой, которой вводили носитель, по данным однопараметрического анализа ANOVA и post hoc критерия Тьюки-Крамера.
Фиг.35, врезка A представляет соб