Производные пиридоксина с нелинейными оптическими свойствами
Иллюстрации
Показать всеДанное изобретение относится к новым производным пиридоксина общей формулы (I)
где R1 представляет собой атом водорода или метил, R2 представляет собой атом водорода, метил, линейный, разветвленный алкил или никло- алкил или R1 и R2 вместе образуют циклический алкил, обладающие способностью к порошковой генерации второй гармоники (ГВГ). Изобретение может найти применение в лазерной технике и средствах связи. 1 табл., 7 пр.
Реферат
Изобретение относится к области органической химии, а именно органическим веществам, обладающим способностью к порошковой генерации второй гармоники (ГВГ), и представляющим собой производные пиридоксина общей формулы I:
где R1 - представляет собой атом водорода или метил, R2 представляет собой атом водорода, метил, линейный или разветвленный алкил или циклоалкил или R1 и R2 вместе образуют циклический алкил, обладающие способностью к порошковой генерации второй гармоники (ГВГ).
Заявленное техническое решение относится к соединениям с нелинейными оптическими свойствами, которые нашли широкое применение в лазерной технике, средствах связи, поэтому в настоящее время проводятся активные исследования в области создания новых более эффективных преобразователей лазерного излучения. Заявляемые соединения могут быть использованы для удвоения частоты лазерного излучения.
Для создания материалов с нелинейными оптическими свойствами применяются как неорганические, так и органические соединения [Pat. US 5202891, IPC G02F 1/355. Nonlinear optical material / OREGON STATE. - Опубл. - 13.04.1993; Пат. РФ 2344208, МПК C30B 29/46. Нелинейный монокристалл литиевых халькогенидов / Институт геологии и минералогии СО РАН. - Опубл. - 20.01.2009; Pat. US 4181515, IPC C03B 37/023. Method of making dielectric optical waveguides / POST OFFICE. - Опубл. - 01.01.1980; Pat. US 4077699, IPC C03B 37/014. Optical devices / POST OFFICE. - Опубл. - 07.03.1978]. Отдельное внимание уделяется получению полимеров, способных к генерации второй гармоники [Пат. РФ 2369597, МПК C07C 255/65. Замещенные 4-фенилазофталонитрилы и полимеры с нелинейными оптическими свойствами, содержащие эти фрагменты в боковой и основной цепи полимера / ГОУ ВПО Ярославский государственный технический университет. - Опубл. - 10.10.2009].
В настоящее время широкое применение в промышленности получили материалы, изготовленные из неорганических соединений. Основным преимуществом неорганических соединений является простота получения материалов с нелинейными оптическими свойствами. Следует отметить, что недостатком неорганических соединений являются их относительно невысокие коэффициенты преобразования порошковой ГВГ [Pat US 2004033038, IPC G02F 1/065. Method for producing non-linear optical organic crystal film / XU JIANJUN,; FAN BUNSEN,; REVEO, INC. - Опубл. - 19.02.2004].
В отличие от неорганических соединений некоторые из известных органических материалов обладают более высокими коэффициентами преобразования порошковой ГВГ, но при этом низкой химической устойчивостью к воздействию лазерного излучения [Suresh, S.Review on theoretical aspect of nonlinear optics [Текст] / S.Suresh, A.Ramanand, D.Jayaraman, P.Mani // Rev. Adv. Mater. Sci. - 2012. - V.30, N.2. - P.175-183].
Так аналог заявленных соединений мета-нитроанилин проявляет нелинейно оптические свойства, но не устойчив к действию лазерного излучения и обладает невысоким коэффициентом преобразования порошковой ГВГ.
Сущность заявленного технического решения заключается в следующем. Производные пиридоксина общей формулы (I)
где R1 - представляет собой атом водорода или метил, R2 представляет собой атом водорода, метил, линейный или разветвленный алкил или циклоалкил или R1 и R2 вместе образуют циклический алкил, обладающие способностью к порошковой генерации второй гармоники (ГВГ).
Задача заявленного технического решения состоит в создании новых органических соединений, обладающих высоким коэффициентом преобразования порошковой ГВГ и более высокой устойчивостью к воздействию лазерного излучения.
Техническим результатом заявленного изобретения является получение новых соединений общей формулы (I).
Поставленная задача решается, и указанный технический результат достигается получением заявляемых новых производных пиридоксина формулы (I):
Заявляемые вещества обладают высокими коэффициентами преобразования порошковой ГВГ по сравнению как с неорганическими соединениями (йодат лития, дигидрофосфат калия), так и с органическим соединением (мета-нитроанилином). Важным достоинством заявляемых соединений является их высокая устойчивость под действием лазерного излучения.
Заявителем не выявлены источники, содержащие информацию о технических решениях, идентичных настоящему изобретению, что позволяет сделать вывод о его соответствии критерию «новизна».
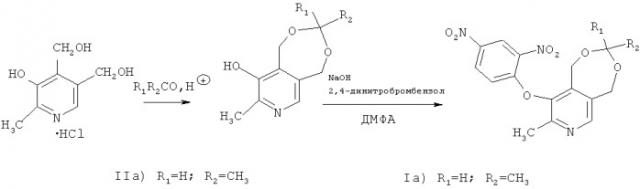
Предлагаемые в данном изобретении соединения формулы (I) получали согласно нижеприведенной схеме:
| IIб) R1=CH3; R2=CH3 | Iб) R1=CH3; R2=CH3 |
| IIв) R1=R2=H | Iв) R1=R2=H |
| IIг) R1=Н; R2=C2H5 | Iг) R1=Н; R2=C2H5 |
| IIд) R1=Н; R2=CH2CH2CH3 | Iд) R1=Н; R2=CH2CH2CH3 |
| IIе) R1=H; R2=CH(CH3)2 | Iе) R1=H; R2=CH(CH3)2 |
| IIж) R1=Н; R2=CH(CH3)CH2CH3 | Iж) R1=H; R2=CH(CH3)CH2CH3 |
| IIз) R1=Н; R2=C(CH3)3 | Iз) R1=Н; R2=C(CH3)3 |
| IIи) Ri=H; R2=CH(CH3)C3H7 | Iи) R1=H; R2=CH(CH3)C3H7 |
| IIк) R1=Н; R2=C7H15 | Iк) R1=H; R2=C7H15 |
| IIл) R1=Н; R2=C8H17 | Iл) R1=H; R2=C8H17 |
| IIм) R1=H; R2=CH(CH3)C9H19 | Iм) R1=H; R2=CH(CH3)C9H19 |
| IIн) R1=H; R2=цикло-C6H11 | Iн) R1=H; R2=цикло-C6H11 |
| IIо) R1, R2=цикло-С5Н8 | Iо) R1, R2=цикло-C5H8 |
| IIп) R1, R2=цикло-C6H10 | Iп) R1, R2=цикло-C6H10 |
| IIр) R1, R2=цикло-C7H12 | Iр) R1, R2=цикло-C7H12 |
| IIс) R1=CH3; R2=C5H11 | Iс) R1=CH3; R2=C5H11 |
| IIт) R1=CH3; R2=C8H17 | Iт) R1=CH3; R2=C8H17 |
Характеристики новых соединений приведены в примерах конкретного выполнения. Спектры ЯМР регистрировали на приборе Bruker» AVANCE 400 (400 МГц) и Varian Unity-300 (300 МГц). Химический сдвиг определялся относительно сигналов остаточных протонов дейтерированных растворителей (1H и 13C). Контроль за ходом реакций и чистотой соединений проводили методом тонкослойной хроматографии (далее ТСХ) на пластинах Sorbfil Plates.
Примеры конкретного выполнения заявленного технического решения
Пример 1
Синтез 1,5-дигидро-3,8-диметил-[1,3]диоксепино[5,6-с]пиридин-9-ола (IIа). Через суспензию 20 г (0.096 моль) пиридоксингидрохлорида в 300 мл уксусного альдегида, при охлаждении до 3-5°C и перемешивании, пропустили 22 г (0.603 моль) хлористого водорода. Полученную реакционную смесь перемешивали в течение 2 ч, затем осадок отфильтровали, промыли эфиром и нейтрализовали 25%-ным водным раствором поташа. Продукт отфильтровывали, сушили на воздухе и перекристаллизовывали из этилового спирта. Выход составил 65%. Т.пл. 186-186.5°C (лит. 189.5-190°C [Pat. GB 1034483, C07D 213/67. A process for the manufacture of pyridine derivatives [Текст] / ROCHE PRODUCTS LTD. - Опубл. - 29.26.1966.]), ЯМР 1H (300 МГц, ацетон-d6): δ 1.31 (д, 3JHH=6 Гц, CH3, 3H); 2.36 (с, CH3, 3H); 4.73, 5.21 (АВ, 2JHH=-15.4 Гц, CH2); 4.74, 4.86 (АВ, 2JHH=-14.4 Гц, CH2); 5.05 (к, 3JHH=6 Гц, 1H); 7.74 (с, CH, 1H).
Пример 2
Синтез 1,5-дигидро-3,3,8-триметил-[1,3]диоксепино[5,6-с]пиридин-9-ола (IIб). Через суспензию 20 г (96 ммоль) осушенного в вакууме водоструйного насоса коммерчески доступного пиридоксингидрохлорида (1) в 300 мл ацетона, при охлаждении до 3-5°C и перемешивании, пропускали 22 г (603 ммоль) хлористого водорода. Полученную реакционную смесь перемешивали в течение 5 ч, выдерживали 20 ч при комнатной температуре, затем осадок отфильтровали, промыли эфиром и нейтрализовали 25%-ным водным раствором поташа. Продукт отфильтровывали, сушили на воздухе и перекристаллизовывали из этилового спирта. Выход 17.9 г (выход 87%.), т.пл. 184.5-186°C (лит 184-185°C [Korytnyk, W.A Seven-Membered Cyclic Ketal of Piridoxol [Текст] / W. Korytnyk // J. Org. Chem. - 1962. - V.27, N.10. - P.3724-3726.]). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.44 с (6H, 2CH3), 2.38 с (3H, CH3), 4.74 с (2H, CH2), 4.86 с (2H, CH2), 7.75 с (1H, CH).
Пример 3
Общая методика получения семичленных ацеталей пиридоксина (IIв-и, н) конденсацией в абсолютном диметилсульфоксиде.
К раствору хлористого водорода (полученного из 10.5 г хлористого кальция и избытка конц. серной кислоты) в 130 мл абсолютного диметилсульфоксида добавили 15 г (0.073 моль) пиридоксина гидрохлорида и 0.2 моль карбонильного соединения. Реакционная масса нагревалась 2 часа при 50-60°C. Затем выливалась в 30 мл водного раствора 14.5 г карбоната натрия при перемешивании. Нейтрализованный раствор перегонялся в вакууме до кубового остатка 30 мл. Кубовый остаток в колбе заливался 100 мл этилацетата и непрореагировавший пиридоксин отфильтровывался. Маточный раствор промывался несколько раз водой, сушился и пропускался через 1 см слой силикагеля. Элюент-этилацетат. Элюат выпаривался и перекристализовывался из этилового спирта. Выход 40-70%.
1,5-Дигидро-[1,3]диоксепино-[5,6-с]-пиридин-9-ол (IIв). Т.пл. 174-175°C. ЯМР 1H (300 МГц, ДМСО-d6): δ 2.36 (с, CH3, 3H); 4.78 (с, CH2, 2H); 4.91 (с, CH2, 2H); 4.96 (с, CH2, 2H); 7.80 (с, CH, 1H); 8.92 (с, OH, 1H).
1,5-Дигидро-3-этил-8-метил-[1,3]диоксепино[5,6-с]пиридин-9-ол (IIг). Т.пл. 153°C, ЯМР 1H. (300 МГц, ДМСО-d6): δ 0.86 (т, 3JНН=7.5 Гц, CH3., 3H); 1.58 (м, CH2., 2H); 2.34 (с, CH3, 3H); 4,65, 5.13 (AB, 2J=15.3 Гц, CH2, 2H); 4,69, 4.77 (AB, 2J=15,0, CH2, 2H); 4,81 (т 3J=5.6 Гц, CH, 1H); 7,75 (с, CH., 1H).
1,5-Дигидро-3-пропил-8-метил-[1,3]диоксепино[5,6-с]пиридин-9-ол (IIд). Т.пл. 136°C, ЯМР 1H (300 МГц, ДМСО-d6): δ 0.89 (т, 3JНН=7.4 Гц, CH3., 3H); 1.35 (м, CH2., 2H); 1,56 (м, CH2, 2H); 2,35 (с, CH3., 3H); 4,68 5,13 (AB, 2J=15.3 Гц, CH2., 2H); 4,73 4,79 (AB, 2J=14,3, CH2., 2H); 4,92 (т 3J=5.5 Гц, CH., 1H) 7,80 (с, CH., 1H) 8,94 (с, OH., 1H).
1,5-дигидро-3-изопропил-8-метил-[1,3]диоксепино[5,6-с] пиридин-9-ол (IIе). Т.пл. 163.5-164°C (лит. 164-164.5°C [Pat. FR 1384099, C07D 491/04. Precédé pour la préparation de dérivés de pyridine [Текст] / Hoffmann La Roche. - Опубл. - 04.01.1965.]), ЯМР 1H (300 МГц, ацетон-d6): δ 1.31 (д, 3JНН=6 Гц, CH3, 3H); 2.36 (с, CH3, 3H); 4.73, 5.21 (AB, 2JНН=-15.4 Гц, CH2); 4.74, 4.86 (AB, 2JНН=-14.4 Гц, CH2); 5.05 (к, 3JНН=6 Гц, 1H); 7.74 (с, CH, 1H).
1,5-Дигидро-3-(1-метилпропил)-8-метил-[1,3]диоксепино[5,6-с]пиридин-9-ол (IIж). ЯМР 1H (400 МГц, CDCl3): δ 0.82-0.90 (м.,, 2CH3, 6H), 1.07-1.18 (м., CH2, 1H), 1.48-1.57 (м., CH2, 1H), 1.59-1.70 (м., CH, 1H), 2,36 (с., CH3, 3H), 4.66 (д.д., 3JНН=4.6 Гц,, 4JНН=-2,0 Гц, CH, 1H), 4.66, 5.18 (AB-кв., 2JНН=-16 Гц,, 4JНН=-2,0 Гц, CH2, 2H), 4.74, 4.79 (AB-кв., 2JНН=-16 Гц, CH2, 2H), 7.81 (с., CH, 1H), 8.97 (уш.с., OH, 1H).
1,5-Дигидро-3-трет-бутил-8-метил-[1,3]диоксепино-[5,6-с]-пиридин-9-ол (IIз). Т.пл. 178°C. ЯМР 1H (300 МГц, ДМСО-d6): δ 0.87 (с, 3 CH3, 9H); 2.37 (с, CH3, 3H); 4.66, 5.31 (AB, 2JНН=-14.4 Гц, CH2); 4.51 (с, CH, 1H); 4.81 (д, CH2, 2H); 7.85 (с, CH, 1H); 8.99 (с, OH, 1H). Найдено, %: C 65.75; H 8.35; N 5.85. C13H19NO3. Вычислено, %: C 65.80; H 8.07; N 5.90.
1,5-Дигидро-3-(1-метилбутил)-8-метил-[1,3]диоксепино[5,6-с]пиридин-9-ол (IIи). ЯМР 1H (400 МГц, CDCl3): δ 0,91 (т, 3J=7.5 Гц., CH3, 3H); 0.95 (д, 3J=6.5 Гц., 2CH3, 6H); 1,07 (т, 3J=6.5 Гц., CH3, 3H);1.12-1.68 (м, 4CH2, 8H); 1.76-1.85 (м, CH, 1H); 1.91-2.00 (м, CH, 1H); 2.40 (с, 2CH3, 6H); 4.55 (с, CH2, 2H); 4.69 (д, 3J=7.0 Гц., CH, 1H); 4.70, 4.89 (AB, 2J=-14.4 Гц., 4JAH=1.8 Гц., CH2, 2H); 4.73, 5.31 (AB, 2J=16.0 Гц, 4JАН=1.8 Гц., CH2, 2H); 4.84 (дд, 3J=4.0 Гц., 4J=1.8 Гц., CH, 1H); 4.99, 5.01 (AB, 2J=-16.0 Гц., CH2, 2H); 8.99 (уш.с, 2OH, 2H); 7.76 (с, CH, 1H); 7.85 (с, CH, 1H).
1,5-Дигидро-3-цикло-гексил-8-метил-[1,3]диоксепино-[5,6-с]-пиридин-9-ол (IIн). ЯМР 1H (400 МГц, ДМСО-d6): δ 0.96-1.23 (м, CH, 2CH2, 5H); 1.50-1.76 (м, 3CH2, 6H); 2.37 (с, CH3, 3H); 4.59 (д, 3J=6.0 Гц., CH, 1H); 4.64, 5.15 (AB, 2JНН=-15.6 Гц, CH2); 4.72, 4.80 (AB, 2JНН=-14.2 Гц, CH2); 7.81 (с, CH, 1H).
Пример 4
Методика получения семичленных ацеталей пиридоксина (IIк-м, о-т) конденсацией в бензоле с азеотропной отгонкой воды.
В круглодонной колбе, снабженной насадкой Дина-Старка, приготовили суспензию 5 г (0.024 моль) пиридоксингидрохлорида, 1.34 г (0,007 моль) моногидрата п-толуолсульфокислоты и 0.02 моль карбонильного соединения в 150 мл бензола. Реакционную массу кипятили 2 ч, затем растворитель отгоняли в вакууме. К полученной смеси добавили раствор 0.32 г (0,008 моль) гидроксида натрия в 100 мл воды и нейтрализовали до pH 7 разбавленной соляной кислотой. Выпавший маслянистый осадок отфильтровали, промыли водой и смесью ацетон-гептан в соотношении 1:1 и перекристаллизовали из этилового спирта. Выход 30-35%.
1,5-Дигидро-3-гептил-8-метил-[1,3]диоксепино[5,6-с]пиридин-9-ол (IIк). Т.пл. 145°C, ЯМР 1H (400 МГц, ДМСО-d6): δ 0,86 (т 3J=7 Гц., CH3, 3H); 1,25 (м, CH2, 10H); 1,57 (м, CH2, 2H); 2,35 (с, CH3, 3H); 4,66 5,14 (AB, 2J=15 Гц., CH2, 2H); 4,71 4,77 (AB, 2J=14 Гц, CH2, 2H); 4,89 (т 3J=5,4 Гц, CH, 1H); 7,76 (с, CH, 1H).
1,5-Дигидро-3-октил-8-метил-[1,3]диоксепино[5,6-с]пиридин-9-ол (IIл).
ЯМР 1H (400 МГц, ДМСО-d6): δ 0,86 (т 3J=6.7 Гц., CH3, 3H); 1.24 (уш.с, 6CH2, 12H); 1.56 (м, CH2, 2H); 2.34 (с, CH3, 3H); 4.65 5.13 (AB, 2J=-15.3 Гц., CH2, 2H); 4.71 4.77 (AB, 2J=-14.1 Гц., CH2, 2H); 4,86 (т 3J=5.4 Гц., CH, 1H); 7.74 (с, CH, 1H).
1,5-Дигидро-3-(1-метилдецил)-8-метил-[1,3]диоксепино[5,6-с]пиридин-9-ол (IIм). ЯМР 1H (400 МГц, ДМСО-d6): δ 0,85 (т, 3J=7.0 Гц., CH3, 3H); 0.85 (д, 3J=6.5 Гц., CH3, 3H); 1.24 (уш.с, 7CH2, 14H); 1.32 (м, CH2, 1H); 1.46 (м, CH2, 1H); 1.68 (м, CH2, 2H); 2.35 (с, CH3, 3H); 4.65 (д, 3J=5.26 Гц., CH, 1H); 4.66 5.18 (AB, 2J=-15.2 Гц., CH2, 2H); 4.75 4.78 (AB, 2J=14.2 Гц, CH2, 2H); 7.80 (с, CH, 1H).
8-Метил-1,5-дигидроспиро[[1,3]диоксепино[5,6-с]пиридин-3,1'-циклопентан]-9-ол (IIо) Т.пл.: 163-164°C, ЯМР 1H (400 МГц, ДМСО-d6): δ 1,63 (м, 2CH2, 4Н); 1,81 (м, 2CH2, 4Н); 2,28 (с, CH3, 3H); 4,63 (с, CH2, 2H); 4,76 (с, CH2, 2H); 7,51 (с, CH, 1H).
8-Метил-1,5-дигидроспиро[[1,3]диоксепино[5,6-с]пиридин-3,1'-циклогексан]-9-ол (IIп) Т.пл.: 162-163°C, ЯМР 1H (300 МГц, ДМСО-d6): δ 1,40 (м, CH2, 2H); 1,49 (м, 2CH2, 4Н); 1,72 (м, 2CH2, 4Н); 2,33 (с, CH3, 3H); 4,71 (с, CH2, 2H); 4,83 (с, CH2, 2H); 7,72 (с, CH, 1H), 8,83 (уш.с, OH, 1H).
8-Метил-1,5-дигидроспиро[[1,3]диоксепино[5,6-с]пиридин-3,1'-циклогептан]-9-ол (IIр) ЯМР 1H (400 МГц, CDCl3): δ 1,37-1,47 (м., CH2, 1H), 1,49-1,65 (м., 4CH2, 7H), 1,66-1,83 (м., CH2, 1H), 1,84-2,03 (м., 2CH2, 3H), 2,32 (с., 3H, CH3), 4,73 (с., CH2, 1,3H), 4,75 (с., CH2, 0,7H), 4,97 (с., CH2, 1,4H), 4,98 (с., CH2, 0,6H), 7,61 (с., CH, 1H), 8,78 (уш.с., OH, 1H).
1,5-Дигидро-3-8-диметил-3-пентил-[1,3]диоксепино[5,6-с]пиридин-9-ол (IIс). ЯМР 1H (400 МГц, CDCl3): δ 0,89 (т., 3JНН=6,5 Гц, CH3, 3H), 1,20-1,44 (м, 3CH2, 6H), 1,40 (с., CH3, 3H), 1,67-1,83 (м., CH2, 2H), 2,32 (с., CH3, 3H), 4,74, 4,77 (AB-кв., 2J=-16 Гц, CH2, 2H), 4,95, 4,99 (AB-кв., 2J=-18 Гц, CH2, 2H), 7,66 (с., CH, 1H), 8,34 (уш.с., OH, 1H).
1,5-Дигидро-3-8-диметил-3-октил-[1,3]диоксепино[5,6-с]пиридин-9-ол (IIт). ЯМР 1H (400 МГц, CDCl3): δ 0,87(т., 3JНН=6,9 Гц, CH3, 3H), 1,17-1,66 (уш.м., 12Н, 6CH2), 1,41 (с., CH3, 3H), 1,63-1,87 (м., CH2, 2H), 2,34 (с., CH3, 3H), 4,74, 4,77 (AB-кв., 2JНН=-16 Гц, CH2, 2H), 4,95, 4,98 (AB-кв., 2JНН=-17,2 Гц, CH2, 2H), 6,74 (уш.с., OH, 1H), 7,68 (с., CH, 1H).
Пример 5.
Общая методика получения 9-(2,4-динитрофенилокси) производных ацеталей пиридоксина (Iа-т).
К раствору 0.005 моль в 20 мл этилового спирта добавляется 0.276 г метилата натрия и смесь выпаривается досуха. Сухой остаток растворяется в 5 мл диметилформамида. К полученному раствору добавляли по каплям при перемешивании раствор 0.005 моль 2,4-динитрохлорбензола в 3 мл диметилформамида. Выдерживали реакционную массу 30 мин при комнатной температуре и далее еще 30 мин при нагревании на водяной бане. Далее продукт высаживали из реакционной смеси водой и после фильтрования сушили. Продукт перекристаллизовывали из спирта. Выход 85-90%.
1,5-Дигидро-3,8-диметил-9-(2,4-динитрофенилокси)-[1,3]диоксепино[5,6-с]пиридин (Iа). Т.пл. 189-189.5°C. ЯМР 1Н (300 МГц, CDCl3): δ 1.37 (д, 3JHH=5.2 Гц, CH3, 3H); 2.35 (с, CH3, 3H); 5.01,4.81 (АВ, 2JHH =-14.6 Гц, CH2); 4.37-5.06 (м, уш., CH2); 5.11 (к, 3JHH=5.2 Гц, 1H); 6.67-8.90 (м, ар., 3H); 8.31 (с, CH, 1H).
1,5-Дигидро-3,3,8-триметил-9-(2,4-динитрофенилокси)-[1,3]диоксепино[5,6-с]пиридин (Iб). Т.пл. 177.5-178°C. ЯМР 1Н (300 МГц, ДМСО-d6): δ 1.38 (с, 2CH3, 6Н); 2.25 (с, CH3, 3H); 4.63(с, CH2, 2Н); 4.88 (с, CH2, 2Н); 8.32 (с, CH, 1H), 6.89-8.94 (м, C6H3N2O4, 3H).
1,5-Дигидро-8-метил-9-(2,4-динитрофенилокси)-[1,3]диоксепино[5,6-с]пиридин (Iв). Т.пл. 148-149°C. ЯМР 1Н (400 МГц, CDCl3): δ 2,35 (с., CH3, 3H), 4,50-5,07 (м., CH2, 2Н,), 4,92 (с., CH2, 2Н), 4,94 (с., CH2, 2Н), 6,72 (д., 3JHH=9,0 Гц, CH, 1H), 8,29 (с., CH, 1H), 8,32 (д.д., 3JHH=9,2 Гц,, 4JHH=-2,3 Гц, CH, 1H), 8,86 (д., 4JHH=-2,3 Гц, CH, 1H).
1,5-Дигидро-3-этил-8-метил-[1,3]-диоксепино[5,6-с]-пиридин (Iг). Т.пл. 112-114°C. ЯМР 1Н (400 МГц, CDCl3): δ 0,94(т., 3JHH=7,6 Гц, CH3, 3H), 1,69 (м., CH2, 2Н), 2,37 (с., CH3, 3H), 4,34-5.24 (уш.м., 2CH2, 4Н), 4,82 (т, 3JHH=5,5 Гц, CH, 1H), 6,74 (уш.с., CH, 1Н,), 8,32 (с., CH, 1H), 8,34 (д.д., 3JHH=9,0 Гц,, 4JHH=-2,8 Гц, CH, 1H), 8,89 (д, 4JHH=-2,8 Гц, CH, 1H).
1,5-Дигидро-3-пропил-8-метил-9-(2,4-динитрофенилокси)-[1,3]диоксепино[5,6-с]пиридин (Iд). Т.пл. 119-120°C. ЯМР 1H (400 МГц, CDCl3): δ 0,93 (т., 3JHH=7,2 Гц, CH3, 3H), 1,40 (м., CH2, 2Н), 1,64 (м., CH2, 2Н), 2,37 (с., CH3, 3H), 4,29-5,20 (уш.м., 2CH2, 4Н), 4,89 (т., 3JHH=5,7 Гц, CH, 1H), 6,74 (д., 3JHH=8,5 Гц, CH, 1H), 8,31 (с., CH, 1H), 8,33 (д.д., 3JHH=8,5 Гц, 4JHH=-2,5 Гц, CH, 1H), 8,87 (д., 4JHH=-2,5 Гц, CH, 1H).
1,5-Дигидро-3-изо-пропил-8-метил-9-(2,4-динитрофенилокси)-[1,3]диоксепино[5,6-с]пиридин (Iе). ЯМР 1H (400 МГц, CDCl3): δ 0,93 (д., 3JHH=6,5 Гц, CH3, 3H), 0,96 (д., 3JHH=6,8 Гц, CH3, 3H), 1,92 (уш с., CH, Н), 2,36 (с., CH3, 3H), 4,33-5,17 (уш.м., 2CH2, CH; 5Н), 6,75 (уш.с., CH, 1H), 8,32 (с., CH, 1H),8,33 (д.д., 3JHH=9,2 Гц, 4JHH=-2,7 Гц, CH, 1H), 8,89 (д., 4JHH=-2,7 Гц, CH, 1H).
1,5-Дигидро-3-(1-метилпропил)-8-метил-9-(2,4-динитрофенилокси)-[1,3]диоксепино-[5,6-с]пиридин (Iж). Т.пл. 133-134°C. ЯМР 1H (400 МГц, CDCl3): δ 0,79-0,99 (уш.м., 2CH3, 6H), 1,06-1,23 (м., CH2, 1H), 1,48-1,63 (м., CH2, 1H), 1,68 (уш.с., CH, 1H), 2,35 (с, CH3, 3H), 4,55 (д., 3JHH=5,1 Гц, CH, 1H), 4,30-5,29 (уш.м., 2CH2, 4Н), 6,74 (уш.с., CH, 1H), 8,30 (с., CH, 1H), 8,30-8,36 (уш.м., CH, 1H), 8,84-8,87 (м., CH, 1H).
1,5-Дигидро-3-трет-бутил-8-метил-9-(2,4-динитрофенилокси)-[1,3]диоксепино[5,6-с]пиридин (Iз). Т.пл. 145-146°C. ЯМР 1Н (400 МГц, CDCl3): δ 0,87 (с., 3CH3, 9Н), 2,34 (с., CH3, 3H), 4,38 (с., CH, 1H), 4,54-5,12 (уш.м., 2CH2, 4Н), 6,81 (уш.с., CH, 1H), 8,29-8,36 (уш.м., CH, 1H), 8,34 (с., CH, 1H), 8,85 (д., 4JHH=-2,5 Гц, CH, 1H).
1,5-Дигидро-3-(1-метилбутил)-8-метил-9-(2,4-динитрофенилокси)-[1,3]диоксепино[5,6-с]пиридин (Iи). Т.пл. 96-97°C. ЯМР 1Н (400 МГц, CDCl3): δ 0,8-0,95 (м., 2CH3, 6Н,), 1,02-1,56 (уш.м., 2CH2, 4Н,), 1,77 (уш.м., CH, 1H), 2,35 (с, CH3, 3H), 4,33-5.26 (уш.м., 2CH2, 4Н), 4,53 (уш.с., CH, 1H), 6,74 (уш.с., CH, 1H), 8,30 (с, CH, 1H), 8,32 (д.д., 3JHH=9,0 Гц,, 4JHH=-2,6 Гц, CH, 1H), 8,86 (д., 4JHH=-2,6 Гц, CH, 1H).
1,5-Дигидро-3-гептил-8-метил-9-(2,4-динитрофенилокси)-[1,3]диоксепино [5,6-с] пиридин (Iк). Т.пл. 104-105°C. ЯМР 1Н (400 МГц, CDCl3): δ 0,87 (т., 3JHH=7,0, CH3, 3H), 1,2-1,44 (м., 5CH210H), 1,66 (м., CH2, 2Н), 2,38 (с., CH3, 3H), 4,34 (уш.м., 2CH2, 4Н), 4,88 (т., 3JHH=5,7 Гц, CH, 1H), 6,74 (д., 3JHH=7,3 Гц, CH, 1H), 8,32 (с., CH, 1H), 8,34 (д.д., 3JHH=7,3 Гц,, 4JHH=-2,4 Гц, CH, 1H), 8,88 (д., 4JHH=-2,4 Гц, CH, 1H).
1,5-Дигидро-3-октил-8-метил-9-(2,4-динитрофенилокси)-[1,3]-диоксепино[5,6-с]пиридин (Iл). Т.пл. 110-111°C. ЯМР 1Н (400 МГц, CDCl3): δ 0,84 (.т, 3JHH=6,8 Гц, CH3, 3H), 1,14-1,42 (м., 6CH2, 12Н), 1,63 (уш.с., CH2, 2Н), 2,34 (с., CH3, 3H), 4,33-5,23 (уш.м., 2CH2, 4Н), 4,86 (м., CH, 1H), 6,73 (д., 3JHH=6,1 Гц, CH, 1H), 8,29 (с, CH, 1H), 8,32 (д.д., 3JHH=6,1 Гц,, 4JHH=-2,1 Гц, CH, 1H), 8,85 (д., 4JHH=-2,1 Гц, CH, 1H).
1,5-Дигидро-3-(1-метилдецил)-8-метил-9-(2,4-динитрофенилокси)-[1,3]-диоксепино[5,6-с]пиридин (Iм). Т.пл. 74-76°C. ЯМР 1H (400 МГц, CDCl3): δ 0,79-0,94 (уш.м., 2CH3, 6Н), 1,01-1,56 (уш.м., 8CH2, 16H), 1,73 (м., CH, 1H), 2,33 (с., CH3, 3H), 4,31-5,07 (уш.м., 2CH2, 4Н), 4,53 (уш.с., CH, 1H), 6,73 (уш.с., CH, 1H), 8,28 (с, CH, 1H), 8,31 (д.д., 3JHH=9,0 Гц,, 4JHH=-2,5 Гц, CH, 1H), 8,85 (д., 4JНН=-2,6 Гц, CH, 1H).
1,5-Дигидро-3-цикло-гексил-8-метил-9-(2,4-динитрофенилокси)-[1,3]-диоксепино[5,6-с]пиридин (Iн). Т.пл. 102-103°C. ЯМР 1Н (400 МГц, CDCl3): δ 0,90-1,27 (уш.м., 3CH2, 5Н), 1,53-1,85 (уш.м., 3CH2, 6Н), 2,35 (с., CH3, 3H), 4,32-5,21 (уш.м., 2CH2, 4Н), 4,50 (д., 3JHH=5,5 Гц, CH, 1H), 6,73 (д., 3JHH=7,0 Гц, CH, 1H), 8,29 (с., CH, 1H), 8,32 (д.д., 3JHH=7,0 Гц,, 4JHH=-2,5 Гц, CH, 1H), 8,86 (д., 4JHH=-2,5 Гц, CH, 1H).
8-Метил-9-(2,4-динитрофенилокси)-1,5-дигидроспиро[[1,3]диоксепино [5,6-с]пиридин-3,1'-циклопентан] (Iо) Т.пл. 172-173°C. ЯМР 1Н (400 МГц, CDCl3): δ 1,62-1,75 (м., 2CH2, 4Н,), 1,77-1,95 (м., 2CH2, 4Н), 2,32 (с., CH3, 3H), 4,27-5,20 (уш.м., CH2, 2Н), 4,85 (с., CH2, 2Н), 6,71 (д., 3JHH=9,4 Гц, CH, 1H), 8,24 (с., CH, 1H), 8,31 (д.д., 3JHH=9,4 Гц, 4JHH=-2,8 Гц, CH, 1H), 8,85 (д, 4JHH=-2,8 Гц, CH, 1H).
8-Метил-9-(2,4-динитрофенилокси)-1,5-дигидроспиро[[1,3]диоксепино[5,6-с]пиридин-3,1'-циклогексан] (Iп) Т.пл. 121-122°C. ЯМР 1Н (400МГц, CDCl3): δ 1,42 (м., CH2, 2Н,), 1,53 (м., 2CH2, 4Н), 1,72 (м., 2CH2, 4Н), 2,32 (с, CH3, 3H), 4,43-5,09 (м., CH2, 2Н,), 4,89 (с., CH2, 2Н,), 6,71 (д., 3JHH=9,08, CH, 1H), 8,24 (с., CH, 1H,), 8,31 (д.д., 3JHH=9,08, 4JHH=-2,5, CH, 1H), 8,86 (д., 4JHH=-2,5, CH, 1H).
8-Метил-9-(2,4-динитрофенилокси)-1,5-дигидроспиро[[1,3]диоксепино[5,6-с]пиридин-3,1'-циклогептан] (Iр) Т.пл. 140,5-141°C. ЯМР 1Н (400 МГц, CDCl3): δ 1,36-1,45 (м., CH2, 1H) 1,45-1,65 (м., 4CH2, 7Н), 1,65-1,81 (м., CH2, 1H), 1,81-2,01 (м., 2CH2, 3H), 2,32 (с., CH3, 3H), 4,44-5.09 (м., CH2, 2Н), 4,87 (уш.с., CH2, 2Н), 6,72 (д., 3JHH=9,1 Гц, CH, 1H), 8,23 (с, CH, 1H), 8,32 (д.д., 3JHH=9,1 Гц,, 4JHH=-2,6 Гц, CH, 1H), 8,86 (д., 4JНН=-2,4 Гц, CH, 1H).
1,5-Дигидро-3-пентил-3,8-диметил-9-(2,4-динитрофенилокси)-[1,3]-диоксепино[5,6-с]пиридин (Iс). ЯМР 1Н (400 МГц, CDCl3): δ 0,87 (м., CH3, 3H), 1,18-1,62 (уш.м., 3CH2, 6Н),1,38 (с, CH3, 3H), 1,72 (м., CH2, 2Н), 2,32 (с, CH3, 3H), 4,42-5,07 (уш.м., CH2, 2Н), 4,87 (с, CH2, 2Н), 6,72 (д., 3JHH=9,0 Гц, CH, 1H), 8,24 (с., CH, 1H), 8,32 (д.д., 3JHH=9,0 Гц,, 4JHH=-2,5 Гц, CH, 1H), 8,87 (д., 4JHH=-2,5 Гц, CH, 1H).
1,5-Дигидро-3-октил-3,8-диметил-9-(2,4-динитрофенилокси)-[1,3]-диоксепино[5,6-с]пиридин (Iт). ЯМР 1Н (400 МГц, CDCl3): δ 0,86 (т., 3JHH=6,7, CH3, 3Н,), 1,18-1,43 (м., 6CH2 12Н), 1,39 (с., CH3, 3H), 4,42-5,04 (м., CH2, 2Н), 4,88 (с., CH2, 2Н), 6,72 (д., 3JHH=9,2 Гц, CH, 1H), 8,25 (с., CH, 1H), 8,33 (д.д., 3JHH=9,2 Гц,, 4JHH=-2,8 Гц, CH, 1H), 8,88 (д., 4JHH=-2,8 Гц, CH, 1H).
Пример 6
Результаты исследования нелинейно оптических свойств заявленных соединений.
Исследования проводили на импульсном неодимовом лазере (1064 нм) с частотой 10 Гц, размер пятна 2,5×1 мм. Максимальная плотность энергии при вышеуказанном размере пятна: 0,7 Дж/см2. В качестве реперных соединений были использованы мета-нитроанилин и йодат лития. Результаты испытаний представлены в таблице 1.
| Таблица 1. | ||
| Пороговые значения энергии накачки и коэффициент преобразования порошковой ГВГ наиболее активных из заявленных соединений. | ||
| Соединение | Пороговые значения энергии накачки, mW | Коэффициент преобразования |
| Iб | 26 | 0,65 |
| Iк | 72 | 0,46 |
| Iл | 44 | 0,038 |
| Iм | 48 | 0,018 |
| Iо | 31 | 0,069 |
| In | 33 | 0,22 |
| мета-нитроанилин | 19 | 0,24 |
| йодат лития | 19 | 0,40 |
Из представленных данных видно, что заявленные соединения обладают способностью к порошковой ГВГ, при этом некоторые из них обладают значительно большим коэффициентом преобразования лазерного излучения чем мета-нитроанилин (усиление до 2,5 раз) и йодат лития (усиление до 1,5 раза).
Пример 7
Исследование устойчивости заявленных соединений проводили на неодимовом лазере (длина волны 1064 нм). Частота повторения импульсов накачки 12.5 Гц. Длительность импульса лазерного излучения ~10 нс. Средняя мощность лазерного излучения 430 мВт. Энергия лазерных импульсов ~34.4 мДж. Импульсная мощность лазерного излучения ~3.4 МВт. Поверхностная площадь лазерного излучения на образцах ~1.15 Дж/см2.
Результаты исследования показали, что в отличие от реперного мета-нитроанилина потери эффективности преобразования при облучении образца Iб в течение 100 с не наблюдается (м-нитроанилин за этот же период экспозиции теряет почти 20%).
Производные пиридоксина общей формулы (I) где R1 представляет собой атом водорода или метил, R2 представляет собой атом водорода, метил, линейный, разветвленный алкил или циклоалкил или R1 и R2 вместе образуют циклический алкил, обладающие способностью к порошковой генерации второй гармоники (ГВГ).