Новый аллерген-простатический калликреин
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается калликреина, его варианта или фрагмента, имеющих общие эпитопы, распознаваемые антителами, с калликреином дикого типа, использующегося для получения диагностической композиции для in vitro диагностики аллергии I типа, где калликреин получен у собаки; способа получения композиции аллергенов, включающего стадию добавления калликреина собаки, или его варианта или фрагмента; способа выделения калликреина из мочи собаки. Группа изобретений обеспечивает увеличение чувствительности в диагностических тестах. 7 н.и 9 з.п. ф-лы, 11 пр., 13 ил., 5 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к аллергологии. Более конкретно, изобретение относится к идентификации новых аллергенов млекопитающих и диагностики и лечения аллергии на млекопитающих.
Предпосылки изобретения
Перхоть собак часто является причиной аллергии в жилых помещениях, симптомы которой включают ринит, конъюнктивит, бронхиальное воспаление и астму. Аллергены собак можно обнаружить не только в домах, где собак содержат в качестве домашних животных, но также и в других местах, например, школах и детских садах, где собаки не находятся регулярно (1).
Аллергия на собак сопровождается сенсибилизацией на белки собачьей шерсти и перхоти и зависит от нее. В случаях подозрения аллергии на собак клиническое исследование включает оценку сенсибилизации методом кожных проб или измерением уровня специфических IgE с использованием экстракта шерсти и/или перхоти собаки. С помощью лабораторного иммунологического анализа на специфические IgE (такого как ImmunoCAP от компании Phadia) с использованием экстракта перхоти собаки, как правило можно обнаружить сенсибилизацию на собак из-за благоприятных условий анализа и большой площади поверхности твердой фазы, доступной для прикрепления аллергена.
Экстракты собачьей шерсти и перхоти содержат большое количество аллергенных и неаллергенных белков (2, 3). На сегодняшний момент идентифицированы и подробно изучены 3 аллергена собак: Can f 1, Can f 2 и Can f 3. Аллерген Can f 1, относится к семейству белков липокалинов, имеет молекулярный вес 21-25 кДа, впервые был очищен de Groot et al. (4) и позже был клонирован и экспрессирован как рекомбинантный белок (5). Аллерген Can f 2 относится к тому же семейству белков, но отличается от белков Can f 1 (4, 5). Аллерген Can f 3, сывороточный альбумин собак, является относительно консервативным белком с сильной перекрестной реактивностью в отношении других альбуминов млекопитающих (6).
Из известных аллергенов собак наиболее важным является Can f 1, связывающий антитела IgE приблизительно у половины индивидуумов, страдающих аллергией на собак (7). У приблизительно 20% индивидов с аллергией на собак IgE связывается с Can f 2, но большинство из них также сенсибилизированы в отношении Can f 1. Хотя у 30-40% взрослых индивидуумов с аллергией на собак IgE могут связывать Can f 3 (2, 8), специфическая клиническая значимость сывороточных альбуминов млекопитающих непонятна.
Давно известно, что основные аллергены, связанные с аллергией на грызунов, таких как мыши и крысы, присутствуют в моче животных, и эти аллергены были выделены и подробно охарактиризованы (9-13). Также было опубликовано, что IgE-связывающая активность обнаружена в моче других животных, в том числе кошек и собак (14), но никакие аллергены из мочи этих животных выделены и охарактеризованы на молекулярном уровне не были.
Краткое описание изобретения
Как указано выше, с помощью лабораторного иммунологического анализа на специфические IgE с использованием природного экстракта собачьей перхоти можно обнаружить большинство случаев сенсибилизации на собак благодаря благоприятным условиям анализа и большой площади поверхности твердой фазы, доступной для прикрепления аллергена. Однако было обнаружено, что в уменьшенном или нелабораторном иммунологическом анализе, таком как микропанель аллергенов или тест, проводимый в кабинете врача, сочетание менее благоприятных условий, низкой пропускной способности для связывающего антитела аллергенного реагента и природного экстракта аллергена с ограниченной активностью вызывает недостаточную чувствительность для диагностики. Аналогичная ситуация также может возникать в случае иммунологических анализов на специфические IgE на эпителий других животных. Поэтому, в некоторых случаях, для того чтобы получить достаточную чувствительность в диагностических тестах на специфические IgE необходимо использовать чистые аллергенные белки.
Кроме того, у значительной части индивидуумов с аллергией на собак также отсутствует реакция на известные идентифицированные аллергены собак, что недавно было показано у финской популяции (7).
Все вышеперечисленное направило авторов настоящего изобретения к поиску не идентифицированных, дополнительных аллергенов собак. Такие новые аллергены могут использоваться не только в качестве реагентов для повышения чувствительности в повседневных диагностических тестах, но также дополнить известные аллергены собак в различных типах компонент-разделенных диагностических приложений (15, 16). Чистые аллергенные белки или их фрагменты и варианты со сниженной способностью вызвать анафилактическую реакцию также можно использовать в компонент-разделенной иммунотерапии (16-20).
Таким образом, из мочи собаки был очищен новый основной аллерген, и его идентифицировали как простатический калликреин. Этот аллерген во всех отношениях отличается от ранее известных аллергенов собак. Кроме того, было обнаружено, что в экстракте перхоти собак существует аналогичный или идентичный и иммунологически эквивалентный аллерген. Калликреин является важным дополнением к панели известных аллергенов собак, и может использоваться для диагностики аллергии на собак. Также было сделано предположение от том, что гомологичные белки других млекопитающих, таких как кошки, лошади и грызуны, включая крыс и мышей, имеют аналогичные аллергенные свойства и диагностическую применимость.
Было обнаружено, что простатический калликреин присутствует не только в моче, но также в шерсти и перхоти собак. Однако то, что белок специфически экспрессируется в ткани предстательной железы ограничивает его наличие только мужскими особями, и предполагает его отсутствие, что у женских особей собак аллерген будет отсутствовать. Предварительные результаты, полученные в лаборатории авторов изобретения, без сомнений поддерживают это наблюдение, и если эти результаты будут подтверждены более глубокими исследованиями, то можно будет сделать вывод о том, что индивидуумы с аллергией на собак, сенсибилизированные только на простатический калликреин, могут переносить наличие женских особей собак.
В недавно опубликованных данных было показано, что вагинальная реакция гиперчувствительности на эякулят была связана с IgE-сенсибилизацией на простатический специфический антиген человека, PSA, присутствующий в семенной плазме (21). Поскольку простатический калликреин собак и человека и простатический специфический антиген человека обладают частичной гомологией по последовательности, возможно, что сенсибилизация на простатический специфический калликреин увеличивает риск развития таких аллергических реакций. Также возможно, что IgE-опосредованные иммунные реакции на простатический специфический калликреин могут играть роль в некоторых случаях бесплодия у людей.
В одном из аспектов изобретение относится к применению калликреина для диагностики аллергии I типа и к применению калликреина для получения композиции для диагностики аллергии I типа.
В другом аспекте изобретение относится к композиции аллергенов с «внесенным» калликреином. Такая композиция аллергенов может быть экстрактом аллергенов или смесью очищенных или рекомбинантных аллергенных компонентов с низким содержанием калликреина или без него, в которую добавляют калликреин для связывания с IgE пациентов, IgE которых не связывается или плохо связывается с другими аллергенными компонентами в композиции. В этом аспекте изобретения также относится к способу получения такой композиции, причем способ включает стадию добавления калликреина к композиции аллергенов, например к экстракту аллергенов (необязательно с внесенными другими компонентами) или смеси очищенных природных или рекомбинантных аллергенных компонентов.
В еще одном дополнительном аспекте изобретение относится к in vitro способу диагностики у пациента аллергии I типа, причем способ включает приведение в контакт образца жидкости организма пациента, например образца крови или сыворотки, и калликреина или композицией предшествующего аспекта, и обнаружение содержания в образце пациента IgE-антител, специфически связывающих калликреин. Такой способ диагностики можно проводить любым способом, известным в данной области. Например, калликреин можно иммобилизовать на твердой подложке, как в обычном лабораторном иммунологическом анализе, на микропанелях или в иммунохроматографическом анализе.
В другом аспекте изобретение относится к диагностическому набору для проведения способа предшествующего аспекта, причем набор включает калликреин.
В вышеупомянутых аспектах молекулу калликреина дикого типа можно заменить на фрагменты или варианты калликреина, природные или искусственные, которые имеют общие эпитопы, распознаваемые антителами на калликреин дикого типа, как определено ниже.
Изобретение, кроме того, дополнительно относится к способу лечения аллергии I типа, включающему введение больному калликреина или модифицированного калликреина, как указано ниже. Этот аспект изобретения также относится к применению калликреина в такой иммунотерапии, как, например компонент-разделенную иммунотерапию (16). В одном из вариантов осуществления этого аспекта калликреин можно использовать в природной или в рекомбинантной форме, проявляющей биохимические и иммунологические свойства, аналогичные свойствам природной молекулы. В другом варианте осуществления изобретения калликреин можно использовать в модифицированной форме, полученной химическим или генетическим способом, в которой отсутствует или ослаблена способность связывать IgE-антитела; одновременно, предпочтительно, чтобы эта форма могла вызвать IgG-ответ у индивидуума, получающего лечение. Примеры модификаций включают, но ими не ограничены: фрагментацию, укорачивание или тандемеризацию молекулы, удаление внутреннего сегмента(ов), замещение аминокислотного(ых) остатка(ов), перестановку доменов или разрушение, по меньшей мере частичное, четвертичной структуры за счет удаления дисульфидных мостиков или ее связей с другой макромолекулярной структурой, или путем устранения способности белка связывать ионы кальция или другие низкомолекулярные соединения. В еще одном варианте осуществления в качестве модифицированного калликреина используют отдельные субъединицы калликреина размером 10 кДа и/или 18 кДа, у которых понижена способность связывать IgE по сравнению с интактной молекулой.
Во всех вышеупомянутых аспектах изобретения калликреин может быть получен из любого млекопитающего, в организме которого синтезируется калликреин, способный вызывать аллергический ответ у пациента. Калликреин может быть очищен из природного источника, такого как моча, слюна или другие жидкости организма, или из ткани, такой как шерсть или перхоть указанного млекопитающего. Калликреин также можно получить с помощью технологии рекомбинантных ДНК или химическим синтезом способами, известными специалисту в данной области.
Изобретение также относится к простатическому калликреину собак, использующемуся в диагностике и терапии, например, диагностики и терапии аллергии I типа на собак.
Изобретение также относится к способам очистки калликреина из мочи млекопитающих, включающим стадии:
фильтрации мочи млекопитающего;
замены буферного раствора на буферный раствор, подходящий для гидрофобной хроматографии;
фильтрации образца мочи с замененным буфером;
нанесения образца мочи с замененным буфером на колонку для гидрофобной хроматографии; и
сбора фракций «проскока», содержащий калликреин.
Моча млекопитающего может представлять собой мочу собак.
Определения
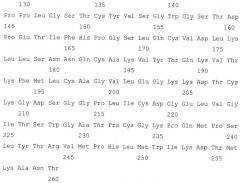
Калликреины представляют собой протеолитические ферменты семейства сериновых эндопептидаз, в норме присутствующие в крови и моче. В номенклатурной системе ферментов IUBMB плазматическому калликреину присвоен номер EC 3.4.21.34, а тканевому калликреину присвоен номер EC 3.4.21.35. Калликреин мочи собак представляет собой гетеродимерный белок, содержащий две субъединицы с приблизительным весом 10±2 и 18±2 кДа, соответственно, которые в настоящем изобретении обозначаются как субъединицы 10 и 18 кДа, соответственно. Калликреин имеет аминокислотную последовательность, соответствующую SEQ ID NO: 1, номер доступа в базе данных GenBank: P09582, а гомологичные белки были описаны для большого числа млекопитающих, в том числе лошадей, коров, свиней, мышей, крыс и приматов (например, номера доступа: AAQ23713-4 (лошадь), NP_001008416 (корова), P00752 (свинья), P00755-6 и P15947 (мышь), P36373 и P00758 (крыса), Q28773 (бабуин), XP_001174026 (шимпанзе), Q07276 (макака), P20151, Q07276 и AAM11874 (человек)).
Под вариантами и фрагментами калликреина следует понимать белки или пептиды с длиной, по меньшей мере 10 аминокислот, более предпочтительно, по меньшей мере 50, еще более предпочтительно, по меньшей мере 75 или 100 аминокислотных остатков, и последовательность которых идентична последовательности указанного калликреина, по меньшей мере на 50%, предпочтительно, более чем на 60%, 70%, 80%, 90% или 95%.
В контексте настоящего изобретения под модифицированным калликреином следует понимать калликреин, который был химически или генетически модифицирован и у которого таким образом изменены иммунологические свойства, например, как указано выше, в аспекте изобретения, относящегося к иммунотерапии.
Под вариантами и фрагментами калликреина с общими эпитопами, распознаваемые антителами на калликреин дикого типа, следует понимать фрагменты и варианты, связывание которых IgE-антителами из репрезентативного образца сыворотки пациента, сенсибилизированного на калликреин, можно в значительной степени ингибировать калликреином. Такой ингибиторный метод анализа можно, например, проводить в соответствии с протоколом, описанным в примере 8.
Под гипоаллергенно-модифицированным калликреином или вариантом или фрагментом калликреина следует понимать модифицированный калликреин или вариант или фрагмент калликреина, которые не способны связывать реагирующие с калликреином IgE-антитела из репрезентативного образца сыворотки пациента, сенсибилизированного на калликреин, определенные, например, в соответствии с протоколом примера 3, или которые не проявляют или проявляют значительно сниженную биологическую аллергенную активность, определенную анализом клеточной активации, таким как анализ высвобождения гистамина базофилами (22, 23).
Краткое описание чертежей
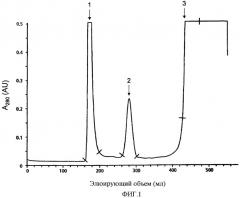
На фигуре 1 показано фракционирование белков мочи собаки с помощью гель-фильтрации. Каждую фракцию, содержащую три пика, указанных на фигуре (отмечены 1-3), собирали как указано в описании анализа IgE-связывающей активности.
На фигуре 2 показана очистка IgE-связывающего белка из пика 2 на фигуре 1 с помощью обращенно-фазовой хроматографии. Пик, содержащий белок, выбранный для дальнейшего исследования, указан стрелкой.
На фигуре 3 представлен анализ SDS-PAGE восстановленных (вост.) и невосстановленных (окисл.) образцов IgE-связывающего белка, очищенного из мочи собаки гель-фильтрацией и обращенно-фазовой хроматографией. Дорожка М содержит белки маркера молекулярного веса.
На фигуре 4 показан эффект калликреина как жидкофазного ингибитора специфического связывания IgE с иммобилизованным экстрактом перхоти собаки.
На фигурах 5a-b показана оценка иммуноблоттингом реактивности IgE-антител на экстракт перхоти собаки в сыворотке 37 индивидуумов с аллергией на собак. Перед инкубацией с полосками мембраны, образцы сыворотки разводили как указано. Дорожка М содержит белки маркера молекулярного веса.
На фигуре 6 показано сравнение интенсивности сигнала с иммуноблота полосы 28 кДа, скорректированное на разведение сыворотки, и уровень специфичных к калликреину IgE, определенный экспериментальным анализом ImmunoCAP. Использованные пределы чувствительности в анализе ImmunoCAP и иммуноблоттинге указаны прерывистыми линиями. Интенсивность сигнала с иммуноблота выражена в условных единицах (AU).
На фигуре 7 показано специфическое ингибирование на иммуноблоте белковой полосы 28 кДа очищенным калликреином мочи собаки. Дорожка М содержит белки маркера молекулярного веса.
На фигуре 8 показана первая стадия очистки калликреина из перхоти собаки гель-фильтрацией. Указанные на фигуре шесть фракций (отмечены 1-6) анализировали на IgE-связывающую активность.
На фигуре 9 показана вторая стадия очистки калликреина из перхоти собаки обращенно-фазовой хроматографией. Верхние фракции трех пиков, указанные на фигуре (отмечены 1-3), анализировали на IgE-связывающую активность.
На фигуре 10 показан сравнительный анализ иммуноблоттинга специфического связывания IgE-антителами экстракта перхоти собаки, очищенного калликреина мочи и частично очищенного калликреина из перхоти собаки. Использовали две реагирующие с калликреином сыворотки (№№ 6 и 8) и одну сыворотку, которая не реагирует с калликреином (№ 11). Анализировали как восстановленные, так и невосстановленнные формы препаратов аллергенов, как указано в подписи. Дорожка М содержит белки маркера молекулярного веса.
На фигуре 11 показан анализ SDS-PAGE очищенного рекомбинантного калликреина мочи собаки.
На фигуре 12 показан анализ аналитической гель-фильтрацией очищенного рекомбинантного калликреина мочи собаки.
На фигуре 13 показано сравнение специфической активности связывания IgE-антител природного и рекомбинантного калликреина мочи собаки.
Подробное описание изобретения
Настоящее изобретение проиллюстрировано в нижеследующих примерах на выделении и применении калликреина собак. Примеры являются только иллюстративными, и их не следует рассматривать как ограничивающие изобретение, которое определено объемом приложенной формулы изобретения.
ПРИМЕР 1: Обнаружение и выделение IgE-связывающего белка из мочи собаки
Для того чтобы установить, содержатся ли в моче собак аллергены, вызывающие аллергию на собак у людей, были проведены следующие эксперименты. У 7-летнего старого кобеля - помеси сибирских хаски и немецкого короткошерстного пойнтера собирали мочу. После фильтрации через 0,45 мкм-овый фильтр из смешанных эфиров целлюлозы 10 мл мочи наносили на колонку для гель фильтрации Superdex 75 (XK26/ 100, Vt=505 мл, GE Healthcare Biosciences, Uppsala, Sweden), уравновешенную 20 мМ MOPS, pH 7,6, 0,5 M NaCl (MBS-буфер), и проводили элюцию в том же буфере со скоростью потока 2 мл/мин. Собирали фракции из трех пиков, как указано на хроматограмме, показанной на фигуре 1, и проводили анализ на аллергенную активность. Белки каждой фракции иммобилизовали на твердой фазе ImmunoCAP (Phadia, Uppsala, Sweden), и их IgE-связывающую активность анализировали с использованием восьми сывороток, полученных у индивидуумов, сенсибилизированных на перхоть собак. Большинство из этих образцов сыворотки отбирали, как сыворотки с высоким IgE-связыванием экстракта перхоти собак, но низким связыванием rCan f 1, rCan f 2 и nCan f 3. Было обнаружено, что из трех протестированных пиков наибольшей IgE-связывающей активностью обладает пик 2 (таблица 1). С помощью электрофореза в полиакриламидном геле в присутствии додецил-сульфата натрия (SDS-PAGE) и используя буферную систему NuPAGE MES (10% гель NuPAGE, Invitrogen, Carlsbad, CA, USA) восстановленного образца пика 2 было выявлено 2 преобладающие белковые полосы с молекулярным весом приблизительно 10 и 18 кДа, соответственно (гель не показан).
Дальнейшую очистку белков из образца, соответствующего пику 2, проводили, используя колонку для обращенно-фазовой хроматографии Source 15 (ST4.6/100, Vt=1,66 мл, GE Healthcare Biosciences). После добавления трифторуксусной кислоты (TFA) до конечной концентрации 0,065% образец наносили на колонку, после чего колонку промывали 9 объемами колонки 0,065% раствора TFA в воде. Проводили элюцию в 0-45% линейном градиенте ацетонитрила в воде, содержащей 0,05% TFA, которая давала один характерный, но несколько асимметричный пик (фигура 2, указанный стрелкой пик). С помощью SDS-PAGE восстановленных образцов, содержащих этот пик, было выявлено наличие обеих полос 10 и 18 кДа, вероятно неразделимых (фигура 3). Поэтому, объединили покрывающие весь пик фракции, как указано горизонтальными полосами на фигуре 2. С помощью SDS-PAGE невосстановленного образца этой объединенной фракции была выявлена дополнительная полоса 28 кДа, и небольшое изменение в подвижности полос 10 кДа и 18 кДа (фигура 3). В невосстановленном образце также можно видеть слабую белковую полосу с весом приблизительно 55 кДа, которая может быть димером белка 28 кДа. Наличие полосы 28 кДа в невосстановленном образце позволяет предположить, что этот белок может состоять из полипептидов 10 и 18 кДа, соединенных вместе одним или несколькими дисульфидными мостиками. Позднее, с помощью линейного масс-спектрометрического анализа (данные не приведены) была показана диссоциация компонента 28 кДа при восстановлении и алкилировании, что также свидетельствует в пользу этой точки зрения.
ПРИМЕР 2: Идентификация IgE-связывающего белка из мочи собаки как простатического калликреина
Для идентификации IgE-связывающего белка, выделенного из мочи собаки, использовали масс-спектрометрию и N-концевое секвенирование.
Идентификация по масс-спектрометрическим пептидным картам, полученным с помощью MALDI-TOF (время пролетной масс-спектрометрии с матричной лазерной десорбцией/ионизацией)
Для расщепления в растворе очищенного обращенно-фазовой хроматографией белка мочи собаки проводили восстановление и алкилирование путем последовательного добавления к образцу DTT и иодацетамида в приблизительно 45- и 100-кратном молярном избытке, соответственно. Затем в течение ночи проводили гидролиз трипсином при 37°С, используя свиной трипсин (Trypsin Gold, чистота для использования для масс-спектрометрии, Promega, Madison, WI, USA). Образцы, содержащие расщепленные пептиды, наносили точками на пластину-мишень MALDI и добавляли α-циано-матрицу в 50% ацетонитриле, 10 мМ NH4[H2PO4], 0,1% TFA. После выпаривания растворителя, проводили масс-спектрометрическое определение пептидных карт (PMF-анализ) на приборе Bruker Daltonics Autoflex 2 (Bruker Daltonics, Bremen, Germany). Для идентификации белков, совпадающих с полученными результатами PMF-анализа, проводили поиск по базе данных MSDB с использованием сервера Mascot (Matrixscience, London, UK). Для отдельных пептидов проводили анализ распада ионов после источника (PSD-анализ). Внешнюю калибровку проводили с использованием пептидного калибровочного стандарта (Bruker Daltonics).
Анализ индивидуальных белковых полос расщеплением в геле после SDS-PAGE проводили в основном по Shevchenko (24). Кратко, полосы 10, 18 и 28 кДа, описанные в примере 1, вырезали из геля, окрашенного Кумасси бриллиантовым синим. Кусочки геля последовательно промывали 50 мМ бикарбонатом аммония, содержащим 50% ацетонитрил, с последующей их усадкой в чистом ацетонитриле. После насыщения кусочков геля водой в 50 мМ бикарбонате аммония, добавляли ацетонитрил до концентрации 50%, с последующей второй стадией промывки ацетонитрилом, кусочки геля сушили на вакуумной центрифуге, последовательно проводили восстановление и алкилирование, используя 45 мМ DTT и 100 мМ иодацетамид в 50 мМ бикарбонате аммония. После повторного промывания 50% ацетонитрилом в 50 мМ бикарбонате аммония и конечного промывания 100% ацетонитрилом, частицы геля снова сушили на вакуумной центрифуге. Расщепление трипсином проводили в течение ночи при 37°C с использованием свиного трипсина, как описано выше. Затем расщепленный образец обрабатывали ультразвуком, и пептиды экстрагировали из частиц геля 50% ацетонитрилом, содержащим 0,1% TFA. Приготовление образцов и определение пептидных карт проводили, как описано выше.
Результаты PMF-анализа белка мочи собаки, расщепленного в растворе, указывали на значительное совпадение (p<0,05) с простатическим калликреином собак (номер доступа P09582). PSD-анализ двух пептидов, m/z=1224,6 и m/z=1632,8, которые также присутствовали в результатах анализа полосы 18 кДа расщеплением в геле для, давали значительное совпадение по базе данных с аминокислотными последовательностями FMLCAGVLEGK и SHDLMLLHLEEPAK, соответствующими остаткам 194-204 и 117-130, соответственно, того же белка в базе данных.
Подтверждающие результаты были получены анализом пептидных полос, расщепленных в геле, поскольку PMF-анализ полосы 28 кДа также давал высокое совпадение по базе данных (p<0,05) с калликреином собак (P09582). Дополнительные данные идентичности выделенного белка мочи были получены путем анализа расщепленных в геле образцов полосы 10 кДа, PSD-анализ пептида m/z=1004,6 дал высокое совпадение по базе данных (p<0,05) с аминокислотной последовательностью SFIHPLYK, соответствующей остаткам 95-102 белка с номером доступа P09582.
N-концевое секвенирование аминокислот
Для N-концевого секвенирования восстановленные белковые полосы 10 кДа и 18 кДа вырезали по отдельности из геля и экстрагировали буфером (6 М гуанидин-HCl, 20 мМ Tris, pH 8,0, 0,5 M NaCl), используя для гомогенизации пластиковую палочку. В результате определения N-концевой последовательности экстрагированных полос 10 кДа и 18 кДа, проведенном на приборе Hewlett-Packard G1000A instrument (Hewlett-Packard, Palo Alto, CA), были получены аминокислотные последовательности IIGGREXLKN и AVIRPGEDRS, соответственно, которые, как было обнаружено, совпадают с остатками 25-34 и 108-117 последовательности предшественника простатического калликреина собак с номером доступа P09582.
Взятые вместе, результаты, описанные в примере, демонстрируют, что основная составляющая очищенного белка мочи собаки, соответствующая полосам 10 и 18 кДа при анализ SDS-PAGEe в восстанавливающих условиях, идентична простатическому калликреину собак. Кроме того, наблюдения позволяют предположить, что полипептиды 10 и 18 кДа образуются путем пост-трансляционного расщепления первичного продукта гена, и соединены вместе дисульфидными мостиками, образуя белок 28 кДа, видимый при невосстанавливающих условиях, аналогично тому, что ранее было описано для калликреина человека (25).
Простатический калликреин также известен как аргининовая эстераза и несет это название в записях базы данных, описывающих идентичные или практически идентичные аминокислотные последовательности, включая NP_001003284, CAA68720 и AAA30831. Кроме того, авторы изобретения отмечают, что у собак идентифицирован другой вариант калликреина, экспрессируемый в тканях почек, поджелудочной железы и слюнных желез (номер доступа CAA53210), имеющий 68% идентичности по аминокислотной последовательности с простатическим калликреином.
Пример 3: Оценка IgE-связывающей активности калликреина, rCan f 1, rCan f 2 и nCan f 3
IgE-связывающую активность очищенных рекомбинантных и природных аллергенов собаки оценивали in vitro с использованием ImmunoCAP® (Phadia, Uppsala, Sweden), иммуноаналитической системы, используемой для измерения связывания специфических IgE-антител в клинической диагностике атопической аллергии. Рекомбинантные Can f 1 и Can f 2 (5) клонировали и экспрессировали в E. coli в общем как описано в (26). Альбумин собаки очищали из сыворотки, используя анион-обменную хроматографию и аффинную хроматографию на Blue Sepharose в общем, как описано в (27). Экспериментальные тесты ImmunoCAP получали и использовали для анализа сыворотки, как описано в (26).
В исследовании использовали сыворотку 37 пациентов с аллергией на собак из Швеции (n=9), Испании (n=23) и Северной Америки (n=4). У всех пациентов были положительные кожные пробы на экстракт перхоти собак, и установленный врачом диагноз аллергии на собак с симптомами астмы, риноконъюнктивита и/или крапивницы. Все образцы сывороток давали положительный результат в тесте на специфические IgE (ImmunoCAP) на экстракт перхоти собаки.
Уровни специфических IgE на экстракт перхоти собаки, rCan f 1, rCan f 2, nCan f 3 и очищенный калликреин показаны в таблице 2, а итоговые результаты показаны в таблице 3. Из образцов протестированной сыворотки 29 обладали IgE-реактивностью на калликреин и 18 - на rCan f 1. И rCan f 2 и nCan f 3, являющиеся минорными аллергенами у исследуемых индивидуумов, связывали IgE только в 8 и 6 из 37 образцов, соответственно. Четырнадцать из 37 образцов сыворотки (38%) давали реакцию только на калликреин. В среднем, для сыворотки, дающей реакцию на калликреин, уровень IgE-связывания калликреина составлял 64% связывания IgE-антителами перхоти собаки. Соответствующие относительные уровни связывания IgE с rCan f 1, rCan f 2 и nCan f 3 были 45%, 25% и 47%, соответственно, среди образцов сыворотки, специфически реагирующих на эти аллергены. Только у двух из 37 протестированных образцов отсутствовала IgE-реактивность на все четыре аллергена собак. Для IgE-связывания калликреина не было показано никакой корреляции со связыванием с другими аллергенами собак, что демонстрирует, что иммунный ответ на калликреин является независимой величиной и не является результатом перекрестной реактивности на Can f 1, Can f 2 или Can f 3.
Полученные результаты ясно демонстрируют, что простатический калликреин собак является главным и уникальным аллергеном для индивидуумов с аллергией на собак, участвующих в данном исследовании. Было обнаружено, что вследствие превалирующего и сильного связывания с IgE калликреин является наиболее важным аллергеном собак из описанных на сегодняшний день, и среди исследуемых индивидумов более трети реагировало на калликреин, и больше ни на какие другие протестированные аллергены.
ПРИМЕР 4: Демонстрация способности экстракта перхоти собаки связывать антитела IgE, специфичные к калликреину
Для того чтобы определить, содержит ли экстракт перхоти собаки эпитопы, способные связывать IgE-антитела, реагирующие на калликреин, проводили эксперименты по ингибированию IgE. Сначала, образцы сыворотки трех индивидуумов с аллергией на собак (А-С), имеющих IgE-реакцию на калликреин, инкубировали в течение 2 часов при комнатной температуре с очищенным калликреином в конечной концентрации 100 мкг/мл, и параллельно с буфером для разбавления сыворотки или неаллергенным мальтозосвязывающим белком (МВР) E. coli в качестве отрицательного контроля. Затем проводили анализ всех образцов в дупликатах на связывание IgE в тестах ImmunoCAP, несущих иммобилизованный экстракт перхоти собаки для того, чтобы исследовать, могла ли предварительная инкубация с калликреином специфически предупреждать связывание IgE с белком перхоти, прикрепленным к твердой фазе. В качестве контроля специфичности калликреина как ингибитора в эксперимент вместе с другими образцами сыворотки включили сыворотку субъекта (D), сенсибилизированного на Can f 1 и Can f 2, а не на калликреин.
Результаты эксперимента по ингибированию показаны на фигуре 4. Было обнаружено, что калликреин, очищенный из мочи собаки, полностью ингибирует связывание IgE с перхотью собаки в двух (А и В) из трех реагирующих с калликреином образцов сыворотки, и частично, связывание третьего (С) образца сыворотки, про который было известно, что он также дает реакцию на другие аллергены собак. Белок отрицательного контроля, МВР, не показывал сколько-нибудь значимого ингибиторного эффекта по сравнению с буфером для разбавления сыворотки. В дополнение, не наблюдали никакого ингибирования калликреином связывания IgE с образцами сыворотки, дающими реакцию на Can f 1 и Can f 2 (D).
Эти результаты демонстрируют, что эпитопные структуры, способные связывать IgE-антитела, реагирующие на калликреин, присутствуют в перхоти собаки, и, поэтому, их наличие не ограничено только мочой.
ПРИМЕР 5: Оценка связывания IgE с калликреин-подобным белком 28 кДа из экстракта перхоти собаки иммуноблоттингом
Для идентификации белка, присутствующего в перхоти собаки, который может отвечать за наблюдаемую калликреин-подобную аллергенную активность, в иммуноблоттинге использовали 37 образцов сыворотки с известными уровнями IgE, дающими реакцию на калликреин. Иммуноблоттинг проводили с невосстановленным образцом экстракта перхоти собаки, разделенным SDS-PAGE (в 12,5% 2-D геле Excel, GE Healthcare Biosciences), и перенесенном электроблоттингом на нитроцеллюлозную мембрану (Hybond ECL, GE Healthcare Biosciences). Блокирование неспецифической сорбции белковых блотов проводили в течение 1 ч. при комнатной температуре с использованием блокирующего буфера (50 мМ фосфатный буфер, рН 7,4, 0,1% (v/v) Tween-20, 0,9% (w/v) NaCl, 0,3% (w/v) Декстран Tl0) и затем блоты инкубировали в течение ночи с каждым из образцов сыворотки пациентов, разведенных в 1,5-20 раз в блокирующем буфере. Фактор разведения для каждой сыворотки указан в квадратных скобках наверху соответствующей полоски мембраны на фигуре 5. После промывания блокирующим буфером с 0,5% (v/v) Tween-20 мембрану инкубировали 4 часа при комнатной температуре с меченными 125I антителами против IgE человека в блокирующем буфере, и затем связавшиеся IgE детектировали рентгенографически, используя фосфорный экран с длительным послесвечением и мультичастотный сканер, Typhoon 9410 (GE Healthcare Biosciences).
Результаты эксперимента показаны на фигуре 5a-b. Из 37 использованных образцов сыворотки, для 30 было показано связывание IgE с белком 28 кДа, в то время как для 21 было показано связывание IgE с полосой 23 кДа, соответствующей Can f 1 и/или, возможно, Can f 2. Интенсивность сигнала на иммуноблотах оценивали количественно, используя программное обеспечение Phoretix ID (Nonlinear Dynamics Ltd, Newcastle upon Tyne, UK). Уровень IgE-реактивности в каждой сыворотке на отдельные полосы вычисляли умножением интенсивности сигнала на фактор разведения сыворотки. На фигуре 6 показано сравнение уровня связывания IgE с полосой 28 кДа в анализе, полученном методом иммуноблоттинга, и с калликреином, полученном методом ImmunoCAP, описанным в примере 3 выше, которое показывает высокую корреляцию между результатами этих методов.
Для прямого изучения связи между калликреином мочи и полосой 28 кДа в перхоти собаки, проводили эксперимент по ингибированию связывания с мембраной в иммуноблоттинге. Сыворотку, монореактивную на полосу 28 кДа, предварительно инкубировали 2 часа при комнатной температуре с или очищенным калликреином мочи или rCan f 1, с конечной концентрацией 100 мкг/мл для обоих белков, или буфером для разбавления сыворотки. Затем, в предварительно инкубированные образцы сыворотки вносили полоски мембраны, несущие невосстановленный экстракт перхоти собаки, и проводили анализ связывания IgE, как описано выше. В результате эксперимента было выявлено, что связывание IgE с полосой 28 кДа в перхоти собаки полностью блокировалось предварительной инкубацией сыворотки с калликреином, тогда как на это связывание не влияла предварительная инкубация как с rCan f 1, так и с одним буфером (фигура 7).
Все вместе, результаты, описанные в этом примере, демонстрируют то, что в экстракте перхоти собаки присутствует белок, проявляющий близкое электрофоретическое и иммунологическое сходство с калликреином мочи.
Пример 6: Частичная очистка и идентификация калликреина в перхоти собаки
Для биохимической идентификации калликреин-подобный белок из перхоти собаки очищали гель-фильтрацией и обращенно-фазовой хроматографией. Экстрагировали три грамма перхоти собаки (Allergon, Valinge, Sweden) в 100 мл буфера MBS переворачиванием в течение 3 часов при комнатной температуре. После центрифугирования при 20000xg и концентрирования с использованием фильтра Amicon (PM-10, Millipore, Billerica, MA, USA) экстракт наносили на колонку XK50/100 Superdex 75 (GE Healthcare Biosciences) и элюировали буфером MBS (фигура 8). Собирали фракции из шести пиков (указаны как 1-6 на фигуре 8) и проводили анализ их аллергенной активности. Белки из каждой фракции иммобилизовали на твердой фазе ImmunoCAP (Phadia, Uppsala, Sweden) и тестировали их способность связывать антитела IgE, используя восемь образцов сыворотки индивидуумов с аллергией на перхоть собаки, как указано в таблице 4. Большинство из этих образцов сыворотки были выбраны как имеющие сильное IgE-связывание экстракта перхоти собаки, но относительно низкое связывание любого из rCan f 1, rCan f 2 и nCan f 3. Из таблицы 4 видно, что пик 3 после гель-хроматографического разделения содержал наиболее высокий уровень IgE-связывающей активности из всех протестированных 6 пиков. Эта фракция была выбрана для дальнейшей очистки.
После добавления TFA до конечной концентрации 0,065%, фракцию наносили на колонку для обращенно-фазовой хроматографии ST4.6/100 Source 15 (GE Healthcare Biosciences), и элюцию проводили в линейном, 0-54% градиенте ацетонитрила в воде, содержащей 0,05% TFA (фигура 8). Анализ аллергенной реактивности трех пиков, указанных на фигуре 9, проводили, используя 5 образцов сыворотки, выбранных по критериям, описанным выше. Результаты анализа (таблица 5) ясно показывают, что пик 1 наиболее сильно связывал IgE-антитела. Анализ этого пика с помощью SDS-PA