Фармацевтическая композиция с противовоспалительной, кардио- и хондропротекторной активностью, действием против гастропатий, вызываемых нпвп, и способ ее получения
Иллюстрации
Показать всеИзобретение относится к фармацевтической композиции с противовоспалительной, кардио- и хондропротекторной активностью, действием против гастропатий, вызываемых нестероидными противовоспалительными препаратами. Указанная композиция включает диклофенак натрия в количестве 5-25%, кверцетин в форме дигидрата или безводной субстанции в количестве 10-40%, поливинилпирролидон в количестве 10-50%, лаурилсульфат натрия в количестве 0,25-10%, микрокристаллическую целлюлозу в количестве 20-40%, кроскармелозы натриевую соль в количестве 1-15% и стеарат магния в количестве 0,25-5,0% в расчете на общую массу композиции. Также изобретение относится к способу получения указанной композиции. Заявленное изобретение обеспечивает получение фармацевтической композиции с высокими противовоспалительной, кардио- и хондропротекторной активностями. 2 н.п. ф-лы, 2 ил., 17 табл., 16 пр.
Реферат
Изобретение относится к фармации, а также к медицине и касается фармацевтической композиции с противовоспалительной, кардио- и хондропротекторной активностью, действием против гастропатий, вызываемых нестероидными противовоспалительными препаратами (НПВП), и способов ее получения, которая может быть использована для профилактики и лечения воспалительно-деструктивных заболеваний различных систем и органов.
Известно, что НПВП на фармацевтическом рынке Украины является наибольшей нишей фармакотерапевтической группы, охватывающей более 250 препаратов в различных лекарственных формах [1]. При признанной терапевтической эффективности НПВП, их применение имеет ряд ограничений, связанных с частыми проявлениями побочного действия. Например, даже непродолжительное лечение этими препаратами может привести к 25% случаев побочных эффектов и, в том числе, до 5% - серьезной угрозы для жизни [2].
Несмотря на значительный ассортимент НПВП фармакологическая и фармацевтическая наука продолжает интенсивный поиск по созданию новых более эффективных и значительно более безопасных лекарственных средств этой фармако-терапевтической группы. Целью в этих исследованиях часто бывают задачи по разработке оригинальных субстанций с принципиально новыми механизмами фармакологического действия. Возможны решения этих проблем поиском путей модификации структуры молекул субстанций НПВП или разработкой готовых лекарственных форм с новыми фармацевтическими свойствами. Весьма перспективным является создание комбинированных лекарственных форм НПВП с другими фармакологически активными веществами [1].
Открытие основных ферментативных факторов направленного фармакологического действия НПВП - двух изоформ циклооксигеназы (ЦОГ), а именно ЦОГ-1 и ЦОГ-2, в свое время, инициировало создание препаратов нового поколения - селективных и специфических ингибиторов ЦОГ-2 [2, 3]. Однако современная медицинская практика по разным причинам все же отдает предпочтение известным препаратам этой фармакотерапевтической группы. Поэтому наиболее признанными НПВП остаются лекарственные формы диклофенака, индометацина, ибупрофена и других, которые являются хорошо изученными по своей терапевтической эффективности и побочным действиям.
В целях расширения терапевтических возможностей известных НПВП и предотвращения побочных эффектов важен поиск путей модификации их лекарственных форм. Широкого терапевтического применения в медицинской практике при лечении многих болезней нашли препараты диклофенака натрия (ДН), которые при значительной лечебной эффективности, к сожалению, обладают рядом побочных проявлений, прежде всего, аллергических реакций а, так называемые, НПВП-гастропатии, суммарно могут составлять до 85% случаев. Даже непродолжительное применение небольших доз препаратов НПВП и, в том числе ДН, может привести к серьезным угрожающим нарушениям состояния здоровья. В таких случаях необходимо прекратить применение НПВП и проводить корректирующую терапию. Лекарственные формы ДН создавались с целью уменьшения проявлений НПВП-гастропатий, однако это не решило проблему их гастротоксичности. Противовоспалительное действие ДН связано с угнетением синтеза простагландинов (ПГ) путем блокады ключевого фермента метаболизма арахидоновой кислоты циклооксигеназы (ЦОГ). Известными являются изоформы ЦОГ: ЦОГ-1, ЦОГ-2 и ЦОГ-3, выполняющие различную регуляторную роль в синтезе ПГ. Так, ЦОГ-1 контролирует наработки ПГ, который обеспечивает нормальное функционирование активных молекул клетки, синтез тромбоцитами тромбоксана А2, эндотелиальными клетками и клетками слизистой оболочки желудка простациклинив, ПГ Е2 и др. ЦОГ-2 принимает участие в наработке ПГ, которые отвечают за процессы воспаления, клеточной пролиферации, деструкции клеток, митогенеза и др. В большинстве клеток базальный уровень ЦОГ-2 довольно низкий, однако экспрессия гена ЦОГ-2 способна резко увеличиваться (более чем в 50 раз) вследствие развития воспаления. Противовоспалительная активность НПВП имеет прямую связь с ингибированием ЦОГ-2, тогда как угнетение ЦОГ-1 обусловливает развитие побочных эффектов. Приведенный обобщенный механизм действия всех НПВП касается и в частности ДН, противовоспалительные эффекты и побочное действие, описываются теми же составляющими и принципиально похожими механизмами. Известными "классическими брендовыми" препаратами диклофенака являеюся лекарственные средства с торговым названием Вольтарен® концерна Novartis Pharma в разных дозах и в различных лекарственных формах. [4]. Препаратом быстрого действия являются Вольтарен® рапид, таблетки, покрытые сахарной оболочкой, 25 и 50 мг, №30, с активным веществом диклофенака калия. Быстрое достижение препаратом анальгезии, снижение воспаления и жара наступает благодаря достаточно высокой растворимости калиевой соли, так как обеспечивается быстрое создание достаточной терапевтической концентрации активного вещества в крови. При достаточно высоких терапевтических показателях эффективности средства Вольтарен® рапид в предостережении к применению всегда акцентируется внимание на возможных случаях гастропатий, то есть возникновения - кишечных кровотечений или развития язв в органах ЖКТ даже при отсутствии в анамнезе пептических язв.
Известна также фармацевтическая композиция, содержащая НПВП, соединение для усиления его фармакологического действия, снижения токсичности и побочных эффектов, и целевые добавки (Патент Украины №79072, МПК:: A61K 31/35, A61K 31/616, А61Р 29/00, 2007). Как агенты, усиливающие фармакологическое действие НПВП и снижающие их токсичность и побочные эффекты, использованы полифенольные соединения растительногопроисхождения, в частности кверцетин в чистом виде, или животного происхождения, вещества из группы двух основных карбоновых кислот или аминокислот или их солей. Все перечисленные вещества входят в состав фармацевтической композиции вместе с различными НПВП.
Однако известная композиция не обеспечивает высокой противовоспалительной, кардио-, и хондропротекторной активности в сочетании с минимальным влиянием на НПВП-гастропатии.
Известен способ получения фармацевтической композиции, содержащей диклофенак (патент РФ №2424793, МПК A61K 9/70, A61K 31/195, А61Р 29/00, 2011), состоящий во включении ДН в композиционную полимерную пленку. ДН предварительно равномерно диспергируют с набором вспомогательных веществ, включая гидроксипропилметилцеллюлозу, выполняющую функцию пищевой полимерной пленкой. Фармацевтическая композиция, полученная данным способом в виде жевательной пленки, способствует быстрому высвобождению ДН в диспергированном виде в полости рта пациента. Фармако-терапевтические возможности фармацевтической композиции ДН в виде пищевой пленки довольно ограничены, поскольку она предназначена исключительно для удобного перорального применения и никак не решает проблемы НПВП-гастропатий.
Известен также способ лечения остеатроза с целью предупреждения эрозивно-язвенных осложнений желудка и двенадцатиперстной кишки, вызываемых ДН, применяя в качестве протекторного средства препарат Гранулы кверцетина, производства НПЦ "Борщаговский химфармзавод" (Патент Украины №3903, МПК, 2009 г.). Препарат Гранулы кверцетина содержит 40 мг активного вещества - кверцетина, в 1 г гранул и его назначают в дозе 1-2 г трижды в день до еды тем же курсом, что и ДН дополнительно после его введения.
Известные фармацевтические композиции, способы их получения, к сожалению, не обеспечивают высокой противовоспалительного, кардио- и хондропротекторного действия, не всегда проявляют значимого влияния на НПВП-гастропатии.
В основу изобретения положена задача создания такой фармацевтической композиции с противовоспалительной, кардио- и хондропротекторной активностью, действием против НПВП-гастропатий и способа ее получения, в котором с введением в фармацевтическую композицию новых ингредиентов, их определенного количественного состава, с применением новых технологических операций получения, обеспечивалась бы ее высокая противовоспалительная, кардио-, и хондропротекторная активность и максимальное воздействие против НПВП-гастропатий.
Поставленная задача достигается тем, что фармацевтическая композиция с противовоспалительной, кардио- и хондропротекторной активностю, а также с воздействием против НПВП-гастропатий, содержит НПВП диклофенак натрия и биофлавоноид кверцетин, усиливающей его фармакологического действия, снижающий токсичность и побочные эффекты, а также целевые добавки, способствующие формированию лекарственных форм. Согласно изобретению, НПВП ДН, дополнительный противовоспалительный агент кверцетин и как солюбилизатор поливинилпирролидон поверхносто-активное вещество лаурисульфат натрия - основные компоненты фармацевтической композиции, при определенной технологической операции вследствие механо-химического взаимодействия образовывают комплекс с изученными фармацевтическими и фармакологическими свойствами.
При этом в фармацевтической композиции ДН содержится в количестве от 5 до 25%.
При этом кверцетин в виде дигидрата или безводной субстанции содержится в количестве от 10 до 40%.
Кроме того, как целевые добавки выбраны солюбилизатор поливинилпирролидон в количестве 10-50% и поверхностно-активный агент лаурилсульфат натрия в количестве 0,25-10%.
При этом наполнители содержат, как минимум, один связующий агент, один разрыхлитель и один смазывающий агент.
При этом как связующий агент выбрана микрокристаллическая целлюлоза в общем количестве 10-85%.
При этом в качестве разрыхлителя выбрана кроскармеллозы натриевая соль в общем количестве 1-15%.
При этом как смазывающий агент выбран стеарат магния в общем количестве 0,25-5%.
Кроме того, фармацевтическая композиция выполнена в лекарственных формах таблеток, покрытых полимерной пленкой или капсул.
Поставленная задача достигается также тем, что в способе получения фармацевтической композиции с противовоспалительной, кардио- и хондропротекторной активностью, а также с действием против НПВП-гастропатий, согласно изобретения, предварительно ДН, кверцетин и целевые добавки смешивают, компактируют, размалывают, полученную смесь смешивают с фармацевтически приемлемыми наполнителями, проводят сухую или влажную грануляцию смеси, после того гранулятом наполняют твердые желатиновые капсулы или прессуют и таблетки покрывают полимерной пленкой.
Согласно изобретению, разработанный способ получения фармацевтической композиции позволяет получать лекарственные формы с комплексной фармацевтической композицией в виде таблеток, покрытых оболочкой, или капсулы, содержащей в своем составе компоненты в таких количественных пределах, в %:
| Диклофенак натрия | 5-25% |
| Кверцетин | 10-40% |
| Наполнители | до 100% |
Оба активные вещества нового лекарственного средства сочетались в нем с учетом знаний об их фармакологические и лечебные свойства, полученных при применении монопрепаратов на основе их субстанций. Подобранные целевые добавки, в силу своих физико-химических свойств, способствуют солюбилизации активных субстанций и их достаточно высокому растворению в водной физиологической среде желудочно-кишечного тракта.
Противовоспалительное действие кверцетина имеет несколько нетрадиционный механизм, в основе которого лежит выраженная антилейкотриенова активность. Вместе с тем следует отметить, что фармакологическое действие кверцетина имеет много других позитивных свойств, что позволяет прогнозировать его незаменимость в коррекции воспалительного процесса и уместность в составе композиционного препарата с ДН. Целесообразность применения кверцетина, с учетом его фармакодинамики, в таком новом лекарственном средстве - очевидна. Механизм противовоспалительного действия кверцетина схематически сводится к ингибированию 5-липоксигеназы (ЛОГ-5) - ключевого фермента биотрансформации арахидоновой кислоты за липоксигеназним путем метаболизма. Биохимическая трансформация арахидоновой кислоты заканчивается образованием конечных продуктов - лейкотриенов, которые и обусловливают возникновение воспалительных процессов. Таким образом, блокирование кверцетином дальнейшей стадии синтеза лейкотриенов обеспечивает торможение этих негативных процессов. Вместе с тем, для лейкотриенов характерно снижение интенсивности кровоснабжения органов, активация процессов перекисного окисления липидов (ПОЛ) и др. [5, 6]. Кверцетину свойственно ангиопротекторное, сосудорасширяющее, противовоспалительное, гепатопротекторное, желчегонное действие. Он способен снижать интенсивность процессов свободнорадикального окисления липидов, протеинурии, гипергликемии и также проявлять гипоазотемичну и диуретическое действие [7-9].
Кверцетин, обладая антилейкотриеновым действием, предотвращает повреждения эндотелия сосудов ишемизированного участка и уменьшает постишемические нарушения микроциркуляции - патологические состояния, вызываемые лейкотриенами. Таким образом, кверцетин защищает эндотелий сосудов не только от таких факторов агрессии, индуцированных ишемией, как ПОЛ, так и от лейкотриенов [10-12]. Кверцетин, в отличие от традиционных НПВП, не только не проявляет ульцерогенное действие, но и наоборот, создает гастропротектний эффект благодаря способности подавлять функционирование Н+-К+-АТФ-азы (снижение синтеза соляной кислоты). Он также способен стимулировать наработку клетками слизистой оболочки желудка цитопротективного простагландина Е2 и уменьшать количество активных форм кислорода в ткани желудочной стенки [6].
Комбинированный препарат ДН с кверцетином - неизвестен. Сочетание в одной лекарственной форме двух активных веществ с различными физико-химическими свойствами является довольно сложной задачей для фармации.
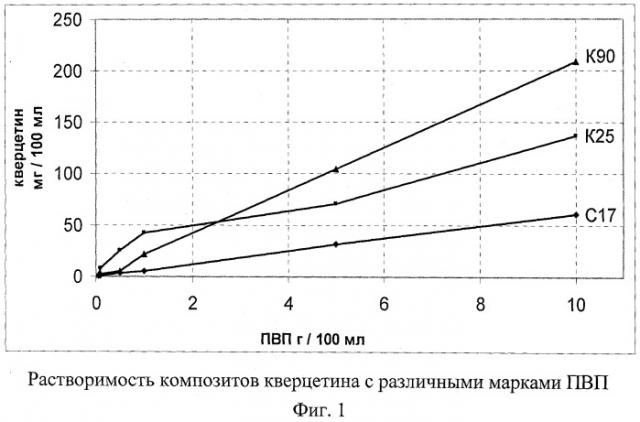
Решение поставленной задачи в техническом плане осуществлялось последовательной разработкой технологии изготовления фармацевтической композиции и в соответствии с фармакопейными методами ее исследования. Прежде всего, фармацевтическая разработка фармацевтической композиции начиналась с оценки физико-химических свойств ДН и кверцетина в первую очередь ориентируясь на их способность растворяться в водных средах с тем, чтобы эти активные вещества имели максимальную биодоступность при пероральном применении лекарственного средства в физиологических условиях желудка. Достичь высокой растворимости обеих субстанций возможно только с применением вспомогательных веществ со свойствами солюбилизаторов и поверхностно-активных веществ. Такими модуляторамы растворимости является поливинилпирролидон (повидон, ГТВП) и лаурилсульфат натрия (ЛСН), количественные величины их введения в фармацевтическую композицию было определено в ходе фармацевтической разработки состава, ориентируясь на профили растворимости образцов, выполняя тест "Растворимость". Исследуя кинетику растворения образцов фармацевтической композиции, как гранулята для капсул, так и для таблеток, при переменных массовых величинах ПВГТ и ЛСН было установлено оптимальное их соотношение с кверцетином. Известно, что в силу особенности кристаллической структуры кверцетина растворимость его субстанции очень низкая (1 мг в 100 мл воды). Комплексирования его с ПВП путем механо-химического взаимодействия, то есть прессованием (компактированием) исходного гранулята позволило повысить растворимость биофлаваноида до 200 мг в 100 мл воды. Таким образом, полученный комплекс кверцетина с ПВП практически одинаково растворяется в водных растворах с различными показателями рН, которые за фармацевтическими требованиями имитируют физиологическую среду организма. Результаты совместной растворимости кверцетина с различными марками ПВП представлено на графике 1 (фиг.1).
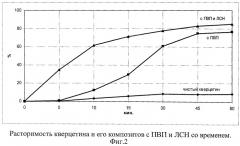
Для обеспечения физико-химической стабильности комплекса весовое соотношение между кверцетином и ПВП должно находиться в пределах 1:1-1:3. Следует отметить, что эти массовые величины ПВП также достаточны для повышения растворимости субстанции ДН вследствие образования соответствующей комплексного соединения. Применяемые повидоны по своим молекулярными массами отличаются следующим образом: К90 - 1000000; К25 - 30000; С17 - 10000. Учитывая характеристики кинетики растворения комплекса кверцетина с ПВП, было подобрано достаточное количество ЛСН - поверхностно-активного вещества, способствующее быстрому и равномерному смачиванию поверхности комплексного гранулята. Это также отражалось на ускорении растворения комплекса в начальные периоды времени и, таким образом, могло создавать оптимальные условия для всасывания стенками желудка растворимой формы кверцетина. При значительной гидрофобоности поверхности кристаллов ДН эти выбранные вспомогательные вещества - ПВП и ЛСН, также способствовали растворимости этой субстанции, а тем самым могли повышать биодоступность этого НПВП. Положительное влияние на растворимость кверцетина также оказывает подобранное количество ПВП и ЛСН, о чем свидетельствуют профили растворимости, приведенные на графике 2 (фиг.2).
Все образцы фармацевтической композиции, начиная с комплекса активных веществ - кверцетина и ДН с ПВП и ЛСН получали в условиях последовательных технологических операций путем сухой или влажной грануляции ингредиентов комплекса и вспомогательных веществ. Приготовленные гранулы применялись для наполнения капсул или их таблетировали и исследовали растворимость этих лекарственных форм в соответствии с фармакопейным тестом "Растворение". Характеристики растворимости ДН и кверцетина в фармацевтической композиции свидетельствовали о значительно более высокой растворимости этих активных ингредиентов по сравнению с растворимостью индивидуальных субстанций.
В ходе фармацевтической разработки был изготовлен образец фармацевтической композиции, определенного состава (см. Таблицу 1), названный авторами «Диклокор» и нашедший применение в исследованиях фармакологических свойств.
| Таблица 1 | |||
| Состав и соотношение ингредиентов в одной капсуле или ядре таблетки фармацевтической композиции Диклокор | |||
| № п/п | Наименование ингредиентю | в мг | в % |
| 1 | 2 | 4 | 5 |
| 1 | Кверцетин | 40,00 | 20,00 |
| 2 | Поливинилпирролидон К-25 | 40,00 | 20,00 |
| 3 | Диклофенак натрия | 25,00 | 12,50 |
| 4 | Целлюлоза микрокристаллическая | 80.00 | 40,00 |
| 5 | Кроскарсмелозы натриевая соль | 10,00 | 5,00 |
| 6 | Лаурилсульфат натрия | 3,00 | 1,50 |
| 6 | Магния стеарат | 2,00 | 1,00 |
| Содержание капсулы или ядра таблетки: | 200,00 | 100,00 |
Фармацевтическая композиция, приведенного состава, получаемая в соответствии с технологией сухого гранулирования включает: смешивание активных веществ с наполнителями, компактирование или брикетирование смеси, помол, смешивание помола с наполнителями и гранулирование, прессование гранулята в таблетки или наполнение им твердых желатиновых капсул. Технология влажной грануляции отличается стадией гранулирования смеси, где вместо компактера или пресса используется оборудование для влажной грануляции и сушилка, такое как смеситель-гранулятор с мешалками, типа Rota P или гранулятор-сушилка псевдокипящего слоя, типа Hurtling.
Приводим конкретные примеры осуществления изобретения. Нижеследующие примеры иллюстрируют основные аспекты данного изобретения, но не должны рассматриваться как имеющие ограничительное значение.
Получение всех образцов гранул комплекса активных веществ - кверцетина и ДН, с ПВП осуществлялось в условиях технологических операций грануляции сухим или мокрым способом, применяя сухое прессование (компактирования) смеси активных ингредиентов, с последующим размолом брикетированного материала. Влажную грануляцию выполняли в гранулятор-сушилках в вакууме или теплым проточным воздухом в устройствах с псевдокипящим слоем. Полученными гранулами наполняли капсулы или их таблетировали, исследуя растворимость этих лекарственных форм по тесту "Растворение".
Характеристики растворимости ДН и кверцетина в фармацевтической композиции свидетельствовали о значительно более высокой растворимости комплекса активных ингредиентов по сравнению с растворимостью индивидуальных субстанций.
Таким образом, в ходе фармацевтической разработки был изготовлен образец фармацевтической композиции, названный авторами изобретения «Диклокор», который нашел, как препарат определенного состава, применение в исследованиях токсико-фармакологических свойств:
| Таблица 2 | |||
| Состав и соотношение ингредиентов на одну капсулу или таблетку фармацевтической композиции Диклокор | |||
| № п/п | Наименование ингредиентов | мг | % |
| 1 | 2 | 3 | 4 |
| 1. | Кверцетин поливинилпирролидон | 40,00 | 20,00 |
| 2. | К-25 | 40,00 | 20,00 |
| 3 | Диклофенак натрия | 25,00 | 12,50 |
| 4. | Целлюлоза микрокристаллическая | 80.00 | 40,00 |
| 5. | Кроскарсмелоза натрия | 10,00 | 5,00 |
| 6. | Лаурилсульфат натрия | 3,00 | 1,50 |
| 7. | Магния стеарат | 2,00 | 1,00 |
| 8. | Содержимое капсулы или ядра таблетки | 200,00 | 100,00 |
Фармацевтическая композиция приведенного состава, полученная по технологии сухой грануляции, включающая смешивание активных веществ с наполнителями, компактирование или брикетированием смеси, помол и смешивание ее с наполнителями и в конце гранулят прессуют в таблетки или наполняют им твердые желатиновые капсулы. Технология влажной грануляции отличается стадией гранулирования смеси, где вместо компактера или пресса используется оборудование для влажной грануляции и сушки, такое как гранулятор-смеситель с мешалками, типа Rota Р или гранулятор-сушилка, типа Huttling с псевдокипящим слоем.
Нижеследующие примеры осуществления изобретения иллюстрируют аспекты данного изобретения, но они не должны рассматриваться как имеющие ограничительное значение.
Пример 1. Субстанции кверцетина, диклофенака натрия и поливинилпирролидона (полипласдон К-25) и лаурилсульфата натрия смешивают в грануляторе и прессуют с помощью компактеру. Затем полученную брикетированную массу размалывают в мельнице, просеивают и к полученному грануляту в смесителе добавляют, ранее приготовленную смесь из целлюлозы микрокристаллической и кроскармеллозы натриевой соли. После 2-3 часов смешивания к грануляту добавляют стеарат магния и затем продолжают перемешивать еще в течение 30 минут. Готовый гранулят передают на наполнение желатиновых капсул или на таблетирование. Образец фармацевтической композиции данного состава приведен в таблице 2. В случае таблеток ядра покрывали готовой смесью пленочного покрытия Colorcon Opadry II. Тесты "Распадение", "Растворение" и "Равномерность дозирования" выполнялись в соответствии с ГФУ.
| Таблица 3 | |||
| Состав и соотношение ингредиентов фармацевтической композициина одну капсулу или таблетку | |||
| № п/п | Наименование ингредиентов | мг | % |
| 1 | 2 | 3 | 4 |
| 1. | Кверцетин | 40,00 | 17,02 |
| 2. | Поливинилпирролидон К-25 | 80,00 | 34,04 |
| 3 | Диклофенак натрия | 25,00 | 10,63 |
| 4. | Целлюлоза микрокристаллическая | 71.00 | 30,57 |
| 5. | Кроскарсмелоза натрия | 13,00 | 5,53 |
| 6. | Лаурилсульфат натрия | 3,00 | 1,27 |
| 7. | Магния стеарат | 2,15 | 0,91 |
| 8. | Содержимое капсулы или ядра таблетки | 235,00 | 100,00 |
Пример 2. Субстанции кверцетина, диклофенака и поливинилпирролидона (полипласдон К-25), а затем лаурилсульфат натрия помещают в гранулятор-смеситель типа Rota P и перемешивают в течение 1,5-2 часов, добавляют целлюлозу микрокристаллическую и кроскармеллозы натриевую соль. Смесь перемешивают в течение 30 минут, к ней постепенно при перемешивании приливают достаточное количество воды очищенной, влажный гранулят перемешивают в течение 2 часов при комнатной температуре. Затем осуществляют сушку гранулята, подключив вакуум и обогрев, в течение 3-4 часа. Сухой гранулят опудривают стеаратом магния, перемешивая 40 минут и затем передают на изготовление готовых лекарственных форм. Таким образом, состав образца, полученной фармацевтической композиции, приведен в таблице 3.
| Таблица 4 | |||
| Состав и соотношение ингредиентов фармацевтической композициина одну капсулу или таблетку | |||
| № п/п | Наименование ингредиентов | мг | % |
| 1 | 2 | 3 | 4 |
| 1. | Кверцетин поливинилпирролидон | 40,00 | 13,33 |
| 2. | К-25 | 140,00 | 46,67 |
| 3 | Диклофенак натрия | 25,00 | 12,50 |
| 4. | Целлюлоза микрокристаллическая | 65.50 | 21,83 |
| 5. | Кроскарсмелоза натрия | 21,00 | 7,00 |
| 6. | Лаурилсульфат натрия | 5,00 | 1,67 |
| 7. | Магния стеарат | 3,50 | 1,17 |
| 8. | Содержимое капсулы или ядра таблетки | 300,00 | 100,00 |
Пример 3. Смесь субстанций кверцетина, диклофенака натрия, поливинилпирролидона (полипласдон К-25) и лаурилсульфата натрия переносят в гранулятор-сушилка с псевдокипящим слоем типа Hurtling, перемешивают в течение 30 минут, затем добавляют целлюлозу микрокристаллическую и кроскармеллозы натриевую соль, смесь с помощью сжатого очищенного воздуха перемешивают в течение 30 минут.Гранулят при интенсивном перемешивании постепенно увлажняют достаточным количеством воды очищенной, с помощью подогретого воздуха гранулят перемешивают в течение часа и затем опудривают стеаратом магния в течение 30 минут.Таким образом, получают образец фармацевтической композиции, приведенный в таблице 4. Гранулят далее применяют по назначению.
| Таблица 4 | |||
| Состав образца фармацевтической композиции, полученного по Примеру 3 | |||
| № п/п | Наименование ингредиентов | мг | % |
| 1 | 2 | 3 | 4 |
| 1. | Кверцетин поливинилпирролидон | 40,00 | 16,67 |
| 2. | К-25 | 40,00 | 16,67 |
| 3 | Диклофенак натрия | 50,00 | 20,83 |
| 1 | 2 | 3 | 4 |
| 4. | Целлюлоза микрокристаллическая | 92.00 | 38,33 |
| 5. | Кроскарсмелоза натрия | 15,00 | 6,25 |
| 6. | Лаурилсульфат натрия | 6,00 | 2,50 |
| 7. | Магния стеарат | 2,00 | 0,83 |
| 8. | Содержимое капсулы или ядра таблетки | 245,00 | 100,00 |
Пример 4. Компактированный гранулят субстанций кверцетина, диклофенака натрия, поливинилпирролидона и лаурилсульфата натрия, получаемый аналогично по примеру 1, помещают в гранулятор-сушилку псевдокиплячого слоя типа Huttling. К нему добавляют с интервалом 30-40 минут последовательно при интенсивном перемешивании кроскармеллозы натриевую соль и целлюлозу микрокристаллическую и в конце магния стеарат. Полученный гранулят передают на изготовление капсул или таблеток.
| Таблица 5 | |||
| Состав образца фармацевтической композиции, полученного по Примеру 4 | |||
| № п/п | Наименование ингредиентов | мг | % |
| 1. | Кверцетин поливинилпирролидон | :0,00 | 24,00 |
| 2. | К-25 | 50,00 | 20,00 |
| 3 | Диклофенак натрия | 25,00 | 10,00 |
| 4. | Целлюлоза микрокристаллическая | 92.00 | 36,80 |
| 5. | Кроскарсмелоза натрия | 16,00 | 6,40 |
| 6. | Лаурилсульфат натрия | 5,00 | 2,00 |
| 7. | Магния стеарат | 2,00 | 0,80 |
| 8. | Содержимое капсулы или ядра таблетки | 250,00 | 100,00 |
Доклиническое изучение фармацевтической композиции осуществлялось с применением образца Диклокора в тестах исследования с целью установления в полном объеме токсико-фармакологических свойств будущего препарата, который может стать перспективным лекарственным средством.
Пример 5. Исследования острой токсичности Диклокора при пероральном введении.
Экспериментальные исследования проводились по методу В.Б. Прозоровского [13] в диапазоне доз 500-1500 мг/кг по сумме действующих веществ, при внутрижелудочном введении Диклокора мышам и крысам. Наблюдения за животными проводились в течение двух недель после ввода препарата. Результаты исследования приведены в таблице 1.
| Таблица 5 | ||||
| Показатели летальности при изучении острой токсичности Диклокора (n=72) | ||||
| Доза, мг/кг | Летальный эффект, гибель животных/количество животных | Средняя летальность, % | ||
| мыши | крысы | мыши | крысы | |
| 500 | 0/6 | 0/6 | 0 | 0 |
| 700 | 1/6 | 1/6 | 16,7 | 716, |
| 900 | 2/6 | 3/6 | 33,3 | 50,0 |
| 1100 | 3/6 | 4/6 | 50,0 | 66,6 |
| 1300 | 4/6 | 5/6 | 66,7 | 83,3 |
| 1500 | 6/6 | 6/6 | 100 | 100 |
Среднелетальную дозу Диклокора рассчитывали на основании зависимости уровня летальности от использованной дозы методом пробит-анализа [13]. В результате расчетов было определено, что ЛД50 Диклокора для мышей составляет 1051,3±52,5 мг/кг (404,2 мг/кг по ДН), и для крыс - 952,5±45,2 мг/кг (366,5 мг/кг по ДН). Согласно данным литературы, показатель острой токсичности ДН для мышей при пероральном введении составляет 172-370 мг/кг [14-16], а для крыс - 53-95 мг/кг [17-19]. Следовательно, полученные данные свидетельствуют о выраженном снижение токсичности данного НПВП при его сочетании с кверцетином в одной лекарственной форме. Таким образом, результаты изучения токсикологических характеристик Диклокора у мышей и крыс позволяют отнести данное средство к классу малотоксичных веществ (501 мг/кг <ЛД50> 5000 мг/кг), согласно общепринятой классификации токсичности по К.К. Сидорову.
Пример 6. Исследование среднеэффективных доз Диклокора в условиях развития экспериментального воспаления.
Изучение среднеэффективных доз Диклокора проводили на модели карагенинового отека конечностей у крыс [14], с использованием препарата в дозах 5, 10 и 20 мг / кг по сумме действующих веществ, что соответствует примерно 1/200, 1/100 и 1/50 показателю ЛД50. Показатель ЕД50 определяли методом пробит-анализа зависимости "активность-доза" по состоянию через 3 часа после введения флогогену [13]. Результаты исследования приведены в таблице 2.
| Таблица 6 | |||
| Влияние Диклокора на течение карагенинового отека стопы у крыс через 3 часа после введения флогогену (n=40) | |||
| Опытная группа | Доза, мг/кг | Прирост объема стопы, у.е. | Антиэкссудативная активность, % |
| Контрольная патология | 36,8-±2,1 | - | |
| Диклокор | 5,0 | 33,4±1,6 | 9,2±0,4 |
| Диклокор | 10,0 | 23,5±0,9* | 36,1±1,3 |
| Диклокор | 20,0 | 17,6±0,7* | 52,2±2,2 |
| Примечание. * - Р<0,05 относительно группы контрольной патологии. |
В ходе проведенных расчетов были определены ЕД50 Диклокора по антиэксудативной активности, которая составила 18,24±2,06 мг/кг по сумме действующих веществ, что соответствует 7,02±0,79 мг/кг по ДН.
По результатам изучения острой токсичности и среднеэффективных доз Диклокора был рассчитан терапевтический индекс (ТИ), что характеризует широту терапевтического действия препарата (табл.3).
| Таблица 7 | ||||
| Характеристика широты терапевтического действия Диклокора | ||||
| Препарат | ЕД50, мг/кг | ЛД50, мг/кг | ТИ | Относительный ТИ по ДН |
| Диклокор | 18,2 (7,0 за ДН) | 952,5 (366,5 за ДН) | 523 | 4,4 |
| ДН | 8,0 [14, 16] | 95,0 [17] | 11,9 | 1 |
Результаты расчетов свидетельствуют о значительно большей широте терапевтического действия исследовуемого средства по сравнению с ДН, что обусловлено как снижением токсичности, так и повышением активности данного НПВП, которое, в свою очередь, обусловлено суммацией фармакологических эффектов обоих субстанций и подтверждает целесообразность создания комбинированной лекарственной формы на их основе.
Пример 7. Исследование ульцерогенных свойств Диклокора при пероральном введении.
Доклиническое изучение ульцерогенных свойств Диклокора, согласно рекомендациям ДЭЦ МЗ Украины [14],было проведено при пероральном введении препарата крысам в диапазоне доз 18,2-145,6 мг/кг (по сумме действующих веществ), что соответствует 1 ЕД50 - 8 ЕД5о препарата, по сравнению с ДН в дозе 48,0 мг/кг (средняя ульцерогенная доза (УД50) [16]. Уровень ульцерогенной активности Диклокора, в зависимости от дозы, рассчитывали на основании значений медиан в каждой группе и 50% уровня активности под влиянием Вольтарена в дозе УД50 (табл.4).
| Таблица 8 | |
| Ульцерогенная активность Диклокора у крыс (n=60) | |
| Исследовательская группа | Ульцерогенная активность, % |
| Диклокор 18,2 мг / кг | 1,7 |
| Диклокор 36,4 мг / кг | 3,3 |
| Диклокор 72,8 мг / кг | 16,7 |
| Диклокор 145,6 мг / кг | 41,7 |
| Вольтарен 48,0 мг / кг | 50,0 |
Затем рассчитывали показатель УД50 с помощью пробит-анализа [13] и индекс переносимости (ИП), как соотношение УД50/ЕД50, что свидетельствует о безопасности препарата со стороны органов ЖКТ [20] (табл.5).
| Таблица 9 | ||||
| Сравнительные показатели индекса переносимости Диклокора и ДН | ||||
| Препарат | УД50, МГ/КГ | ЕД50, мг/кг | ИП | Относительный ИП за ДН |
| Диклокор | 156,2 (60,1 за ДН) | 18,2 (7,0 за ДН) | 8,6 | 1,4 |
| ДН | 48,0 [16] | 8,0 [14, 16] | 6,0 | 1 |
Результаты проведенных исследований позволяют сделать вывод о выраженном снижении гастротоксичности ДН при совместном применении с кверцетином в одной лекарственной форме. Это подтверждает увеличение показателей УД50 Диклокора в 1,3 раза и ИП в 1,4 раза по сравнению с ДН.
Пример 8. Исследование антиальтеративной активности Диклокора на модели скарификованных ран у крыс.
Изучение антиальтеративных свойств Диклокора проводили на модели стандартных скарификованных ран у крыс [14] по сравнению с монокомпонентами композиции - кверцетина и ДН. Антиальтеративную активность препаратов оценивали по их влиянию на показатели уменьшения площадей ран. Результаты исследования приведены в таблице 6.
| Таблица 10 | ||||||
| Антиальтеративная активность Диклокора, % (п=40) | ||||||
| Исследуем, препарат | Доза, мг/кг | 7 сутки | 9 сутки | 11 сутки | 13 сутки | 15 сутки |
| Диклокор | 18,2 | 32,75±0,87* | 52,09±1,39* | 58,06±1,55* | 79,26±2,11* | 100,0 |
| Кверцетин | 11,2 | 16,52±0,44 | 17,87±0,48 | 27,96±0,75 | 31,85±0,85 | 48,86±1,3 |
| ДН | 7,0 | 10,72±0,29 | 12,17±0,32 | 15,05±0,40 | 14,81±0,4 | 4,55±0,12 |
| Примечание. * - Р<0,05 относительно животных, получавших референс-препараты. |
Полученные результаты свидетельствуют о значительно более высоком уровне активности Диклокора по сравнению с его монокомпонентами, поскольку полное ранозаживление и, соответственно, стопроцентный уровень антиальтеративного действия исследуемого средства было зарегистрировано на 15 сутки эксперимента. По уровню показателей альтернативной активности Диклокор достоверно превышал Кверцетин и ДН в 2,0-2,9 и 2,2-5,4 раза соответственно. Таким образом, Диклокор оказывает положительное влияние на альтеративное воспаление на модели скарификованих ран у крыс, способствуя ускорению скорости заживления ран, уменьшению площади ран и проявляя достоверно более высокие показатели альтернативной активности в сравнении с кверцетином и ДН.
Пример 9. Углубленное изучение антиальтеративных свойств Диклокора на модели фуразолидон-изадринового миокардита у крыс.
Анльтернативные свойства Диклокора изучали в дозе 18,2 мг / кг на модели фуразолидон-изадринового миокардита у крыс [14], вызывая эту патологию совместным введением 200 мг / кг фуразолидона и с интервалом в час - 40 мг/кг изадрина, по сравнению с действием ДН в эквивален