Cdca1 эпитоп-пептиды и содержащие их вакцины
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению вакцин против рака, и может быть использовано в медицине. Выделенный пептид, обладающий способностью индуцировать цитотоксический Т-лимфоцит (ЦТЛ) в присутствии антигенпрезентирующей клетки, несущей HLA-A*2402, используют для получения антигенпрезентирующих клеток и соответственно ЦТЛ. Полученные ЦТЛ используют для специфичного действия против раковых клеток, экспрессирующих CDCA1. Изобретение позволяет разработать эффективную вакцину для индукции противоопухолевого иммунитета у субъекта, у которого антиген HLA представляет собой HLA-A*2402. 13 н. и 3 з.п. ф-лы, 4 ил., 1 табл., 1 пр.
Реферат
Область техники, к которой относится изобретение
Настоящая заявка испрашивает приоритет предварительной заявки на патент США 61/074,062, поданной 19 июня 2008 года, и 61/197,599, поданной 28 октября 2008 года, все содержание которых включено в настоящую заявку путем отсылки.
Настоящее изобретение относится к области биологии, более конкретно, к области терапии рака. В частности, настоящее изобретение относится к новым пептидам, которые чрезвычайно эффективны в качестве противораковых вакцин, а также к лекарственным средствам для лечения и профилактики опухолей.
Уровень техники
Было продемонстрировано, что CD8-положительные цитотоксические T-лимфоциты (ЦТЛ) узнают эпитоп-пептиды, происходящие из опухолеспецифических антигенов (ОСА), обнаруженных на молекуле главного комплекса гистосовместимости (MHC) класса I, а затем убивают опухолевые клетки. После открытия семейства антигенов меланомы (MAGE), в качестве первого примера ОСА, были обнаружены многие другие ОСА, прежде всего с помощью иммунологических методов (Boon T, Int J Cancer 1993 May 8, 54(2): 177-80; Boon T&van der Bruggen P, J Exp Med 1996 Mar 1, 183(3): 725-9). Некоторые из указанных ОСА в настоящее время подвергаются клиническому испытанию как иммунотерапевтические мишени.
Идентификация новых ОСА, способных стимулировать мощные и специфичные противоопухолевые иммунные ответы, обеспечивает последующую разработку и клиническое применение стратегий пептидного вакцинирования для различных типов рака (Harris CC, J Natl Cancer Inst 1996 Oct 16, 88(20): 1442-55; Butterfield LH et al., Cancer Res 1999 Jul 1, 59(13): 3134-42; Vissers JL et al., Cancer Res 1999 Nov 1, 59(21): 5554-9; van der Burg SH et al., J Immunol 1996 May 1, 156(9): 3308-14; Tanaka F et al., Cancer Res 1997 Oct 15, 57(20): 4465-8; Fujie T et al., Int J Cancer 1999 Jan 18, 80(2): 169-72; Kikuchi M et al., Int J Cancer 1999 May 5, 81(3): 459-66; Oiso M et al., Int J Cancer 1999 May 5, 81(3): 387-94). На сегодняшний день имеется несколько сообщений о клинических испытаниях с использованием указанных пептидов, полученных из опухолеспецифических антигенов. К сожалению, в испытаниях указанных противораковых вакцин пока наблюдалась лишь низкая частота объективных ответов (Belli F et al., J Clin Oncol 2002 Oct 15, 20(20): 4169-80; Coulie PG et al., Immunol Rev 2002 Oct, 188: 33-42; Rosenberg SA et al., Nat Med 2004 Sep, 10(9): 909-15).
ОСА, необходимые для пролиферации и выживания раковых клеток, важны как мишени для иммунотерапии, поскольку использование таких ОСА может минимизировать хорошо описанный риск ускользания раковых клеток от иммунного ответа, который относится к делеции, мутации или отрицательной модуляции ОСА как следствию терапевтически управляемого иммунного отбора.
CDCA1 - ген, ассоциируемый с циклом деления клетки 1, был идентифицирован как представитель класса генов, которые коэкспрессируются с генами клеточного цикла, такими как CDC2, циклин, топоизомераза II и другие (Walker et al., Curr Cancer Drug Targets 2001 May;1(1):73-83). CDCA1, в частности, как обнаружили, был связан с центромерами митотических клеток HeLa и поэтому считался функциональным гомологом дрожжевого Nuf2 (J Cell Biol 2001 Jan 22; 152(2):349-60).
Кроме того, посредством анализа профиля экспрессии генов с использованием полногеномного набора кДНК микрочипов, содержащего 23040 генов (Cancer Res 2006 Nov 1; 66(21):10339-48), CDCA1 также был идентифицирован как новая молекула, позитивно регулируемая при раке молочной железы (WO2005/028676), раке мочевого пузыря (WO 2006/085684), раке пищевода (WO2007/013671), мелкоклеточном раке легкого (МРЛ) (WO2007/013665) и немелкоклеточном раке легкого (НМРЛ) (WO2005/089735), содержание указанных описаний включено путем отсылки в настоящую заявку. Экспрессия CDCA1 в особенности позитивно регулируется в линиях клеток опухолей МРЛ и НМРЛ, хотя в 23 нормальных тканях, за исключением яичка, экспрессия не была обнаружена. Кроме того, отрицательная регуляция экспрессии CDCA1 посредством миРНК вызвала подавление роста клеток в линиях клеток рака легкого, экспрессирующих CDCA1 (WO 2005/089735).
Взятые в совокупности, приведенные данные указывают на то, что CDCA1 является новым, потенциально универсальным онкоантигеном. Таким образом, эпитоп-пептиды, полученные из CDCA1, могут применяться в качестве противораковых иммунотерапевтических средств для лечения широкого ряда раковых опухолей.
Сущность изобретения
Настоящее изобретение частично базируется на открытии подходящих эпитоп-пептидов, которые могут служить мишенями для иммунотерапии. С учетом того, что CDCA1 позитивно регулируются во многих типах рака, включая рак молочной железы, рак мочевого пузыря, немелкоклеточный рак легкого, мелкоклеточный рак легкого и рак пищевода, настоящее изобретение направлено на указанный продукт гена, ассоциируемого с циклом деления клетки 1 (CDCA1) (SEQ ID NO: 35, кодируемый геном GenBank NM_145697 (SEQ ID NO: 34)) для дальнейшего анализа. В частности были отобраны продукты гена CDCA1, содержащие эпитоп-пептиды, которые индуцируют ЦТЛ, специфичные к соответствующим молекулам. Мононуклеарные клетки периферической крови (МКПК), полученные от здорового донора, стимулировали с использованием HLA-A*2402 связывающих кандидатных пептидов, полученных из CDCA1. Были получены линии ЦТЛ, которые специфично узнают HLA-A24 положительные клетки-мишени, сенсибилизированные соответствующими кандидатными пептидами, и были идентифицированы HLA-A24 рестриктированные эпитоп-пептиды, которые могут вызвать мощные и специфичные иммунные ответы против CDCA1. Представленные результаты демонстрируют, что CDCA1 является сильно иммуногенным, а его эпитопы представляют собой эффективные мишени для противоопухолевой иммунотерапии.
Таким образом, цель настоящего изобретения состоит в предоставлении пептидов, обладающих способностью индуцировать ЦТЛ, а также имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 3, 4, 11, 14, 22 и 23. Настоящее изобретение рассматривает модифицированные пептиды, имеющие аминокислотную последовательность SEQ ID NO: 3, 4, 11, 14, 22 или 23, в которой одна, две или более аминокислот заменены, введены, удалены или добавлены, при условии, что модифицированные пептиды сохраняют исходную способность индуцировать ЦТЛ.
При введении субъекту, настоящие пептиды презентируются на поверхности антигенпрезентирующих клеток или экзосомы и индуцируют ЦТЛ, направленные против соответствующих пептидов. Поэтому цель настоящего изобретения состоит в обеспечении антигенпрезентирующих клеток и экзосом, презентирующих любой из настоящих пептидов, а также способов индукции антигенпрезентирующих клеток.
Противоопухолевый иммунный ответ индуцируется путем введения настоящих CDCA1 полипептидов или полинуклеотида, кодирующего полипептиды, а также экзосом и антигенпрезентирующих клеток, которые презентируют CDCA1 полипептиды. Таким образом, цель настоящего изобретения состоит в предоставлении фармацевтических средств, содержащих полипептиды настоящего изобретения или кодирующих их полинуклеотиды, а также экзосомы и антигенпрезентирующие клетки, содержащие их в качестве активных компонентов. Фармацевтические средства настоящего изобретения находят конкретное применение в качестве вакцин.
Другая цель настоящего изобретения состоит в предоставлении способов лечения и/или профилактики (то есть, предотвращения возникновения) раковых новообразований (опухолей), и/или предотвращения их постоперативного рецидива, а также способов индукции ЦТЛ, способов индукции противоопухолевого иммунитета, где указанные способы включают стадию введения CDCA1 полипептидов, полинуклеотидов, кодирующих CDCA1 полипептиды, экзосом или антигенпрезентирующих клеток, презентирующих CDCA1 полипептиды, или фармацевтических средств согласно изобретению. Кроме того, ЦТЛ согласно изобретению также находят применение в качестве вакцин против рака. Примеры раковых опухолей, рассматриваемые в соответствии с настоящим изобретением, включают, помимо прочих, рак молочной железы, рак мочевого пузыря, рак пищевода, мелкоклеточный рак легкого (МРЛ) и немелкоклеточный рак легкого (НМРЛ).
В дополнение к вышесказанному, другие цели и признаки изобретения станут понятными в большей мере при прочтении последующего подробного описания в совокупности с сопровождающими фигурами и примерами. Впрочем, следует понимать, что и предыдущая сущность и последующее подробное описание изобретения относятся к примерам осуществления и не должны ограничивать изобретение или другие дополнительные варианты осуществления изобретения. В частности, хотя изобретение описано в настоящей заявке в отношении ряда конкретных вариантов осуществления, будет очевидно, что описание служит для пояснения изобретения и не должно рассматриваться как ограничение изобретения. У специалистов, квалифицированных в данной области техники, могут возникнуть идеи относительно различных модификаций и применений, не отступающих от сущности и объема изобретения, как описано в соответствии с прилагаемой формулой. Аналогичным образом, другие объекты, признаки, эффекты и преимущества настоящего изобретения будут очевидны из приведенной сущности и конкретных вариантов осуществления, описанных ниже, и будут с легкостью ясны специалистам, квалифицированным в данной области техники. Такие объекты, признаки, эффекты и преимущества будут очевидны из вышеизложенного в сочетании с сопровождающими примерами, данными, фигурами и всеми вытекающими из этого рациональными выводами, отдельно или с рассмотрением ссылок, включенных в настоящую заявку.
Краткое описание фигур
Различные аспекты и применения настоящего изобретения станут ясны квалифицированному специалисту после рассмотрения краткого описания фигур и подробного описания настоящего изобретения, а также его предпочтительных вариантов осуществления, следующих ниже.
[Фиг. 1] Фигура 1 составлена из серии фотографий (a)-(g), на которых изображены результаты IFN-гамма ELISPOT анализа ЦТЛ, индуцированных пептидами, полученными из CDCA1. ЦТЛ в лунках #8, стимулированные CDCA1-A24-10-119 (SEQ ID NO: 3) (a), #1, стимулированные CDCA1-A24-10-335 (SEQ ID NO: 4) (b), #1, стимулированные CDCA1-A24-10-48 (SEQ ID NO: 11) (c), #4, стимулированные CDCA1-A24-10-5 (SEQ ID NO: 14) (d), #2, стимулированные CDCA1-A24-9-8 (SEQ ID NO: 22) (e), и #2, стимулированные CDCA1-A24-9-56 (SEQ ID NO: 23) (f), показали мощную выработку IFN-гамма по сравнению с контролем, соответственно. Напротив, какой-либо определенной секреции IFN-гамма против сенсибилизированных пептидом клеток-мишеней в ЦТЛ, стимулированных CDCA1-A24-10-74 (SEQ ID NO: 2) (g), не обнаруживали. Клетки в лунках, обозначенных прямоугольной рамкой, использовали для получения линий ЦТЛ. На фигурах "+" указывает выработку IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, а "-" указывает выработку IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг. 2] Фигура 2 составлена из серии линейных графиков (a)-(g), на которых представлены результаты анализа IFN-гамма ELISA на линиях ЦТЛ, полученных с CDCA1-A24-10-119 (SEQ ID NO: 3) (a), CDCA1-A24-10-335 (SEQ ID NO: 4) (b), CDCA1-A24-10-48 (SEQ ID NO: 11) (c), CDCA1-A24-10-5 (SEQ ID NO: 14) (d), CDCA1-A24-9-8 (SEQ ID NO: 22) (e) и CDCA1-A24-9-56 (SEQ ID NO: 23) (f) в вышеуказанном анализе IFN-гамма ELISA. Результаты демонстрируют, что линии ЦТЛ, полученные при стимуляции каждым пептидом, показали мощную выработку IFN-гамма по сравнению с контролем. Напротив, в линии ЦТЛ, полученной с CDCA1-A24-10-74 (SEQ ID NO: 2) (g), какой-либо определенной секреции IFN-гамма против сенсибилизированных пептидом клеток-мишеней не наблюдали. На фигурах "+" указывает выработку IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, а "-" указывает выработку IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг. 3] Фигура 3 представляет собой линейный график, изображающий продукцию IFN-гамма ЦТЛ клона, полученного путем серийного разведения из линии ЦТЛ, стимулированной с использованием SEQ ID NO: 23. Результаты демонстрируют, что клон ЦТЛ, полученный путем стимуляции с использованием SEQ ID NO: 23, показал мощную выработку IFN-гамма по сравнению с контролем. На фигуре "+" указывает выработку IFN-гамма против клеток-мишеней, сенсибилизированных SEQ ID NO: 23, а "-" указывает выработку IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
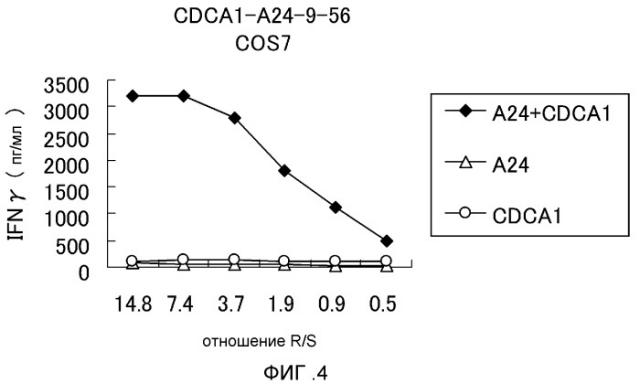
[Фиг. 4] Фигура 4 представляет собой линейный график, на котором показана специфическая активность ЦТЛ против клеток-мишеней, которые экзогенно экспрессируют CDCA1 и HLA-A*2402. Клон ЦТЛ, полученный с использованием CDCA1-A24-9-56 (SEQ ID NO: 23), показал высокую специфическую активность ЦТЛ против клеток COS7, трансфицированных и с CDCA1, и с HLA-A*2402 (ромб). Напротив, против клеток-мишеней, экспрессирующих HLA-A*2402 (треугольник) или CDCA1 (круг), какой-либо существенной специфической активности ЦТЛ не обнаружили.
Описание вариантов осуществления
Хотя любые методы и материалы, подобные или эквивалентные описанным в настоящей заявке, могут применяться при практическом осуществлении или испытании вариантов осуществления настоящего изобретения, ниже описаны предпочтительные способы, устройства и материалы. Впрочем, прежде чем будут описаны настоящие материалы и методы, следует понимать, что настоящее изобретение не ограничивается конкретными размерами, формами, измерениями, материалами, методологиями, методиками и т.д., описанными в настоящей заявке, поскольку они могут изменяться в соответствии со стандартным экспериментированием и оптимизацией. Необходимо также понимать, что терминология, используемая в описании, служит исключительно в целях описания конкретных версий или вариантов осуществления и не предназначена для ограничения объема настоящего изобретения, ограничиваемого только в соответствии с прилагаемой формулой.
Содержание каждой публикации, описание патента или заявки на патент, упомянутых в настоящем описании, прямо включено в настоящую заявку путем отсылки в полном объеме. Впрочем, в настоящей заявке ничто не следует рассматривать как допущение того, что изобретение не имеет правомочия предшествовать подобному описанию в силу предшествующего изобретения.
I. Определения
Если не указано иное, все технические и научные термины, используемые в настоящей заявке, имеют такое же значение, под которым они обычно понимаются средним специалистом в области техники, к которой относится настоящее изобретение. Впрочем, в случае коллизии, настоящее описание, включая определения, будет иметь преимущественную силу.
Артикли единственного числа, используемые в оригинальном тексте настоящей заявки, означают "по меньшей мере, один", если прямо не указано иное.
Термины "полипептид", "пептид" и "белок" в настоящей заявке используются попеременно, и относятся к полимеру из аминокислотных остатков. Термины относятся к полимерам аминокислот, в которых один или более аминокислотных остатков являются модифицированными остатками, или неприродными остатками, такими как искусственный химический миметик соответствующей природной аминокислоты, а также к природным полимерам аминокислот.
Термин "аминокислота", используемый в настоящей заявке, относится к природным и синтетическим аминокислотам, а также аналогам аминокислот и миметикам аминокислот, которые функционируют аналогично природным аминокислотам. Природные аминокислоты представляют собой аминокислоты, кодируемые генетическим кодом, а также аминокислоты, модифицированные после трансляции в клетках (например, гидроксипролин, гамма-карбоксиглутамат и O-фосфосерин). Фраза "аналог аминокислоты" относится к соединениям, которые имеют такую же основную химическую структуру (альфа-атом углерода связан с водородом, карбокси-группой, аминогруппой и R группой), как и природная аминокислота, но содержат модифицированную группу R или модифицированные скелеты (например, гомосерин, норлейцин, метионинсульфоксид, метионинметилсульфоний). Фраза "миметик аминокислоты" относится к химическим соединениям, которые имеют различные структуры, но имеют функции, подобные функциям обычных аминокислот.
Аминокислоты могут быть обозначены в настоящей заявке своими общеизвестными трехбуквенными символами или однобуквенными символами, рекомендованными Комиссией по биохимической номенклатуре IUPAC-IUB.
Термины "ген", "полинуклеотид", "нуклеотид" и "нуклеиновая кислота" в настоящей заявке используются попеременно и, если прямо не указано иное, обозначаются своими общепринятыми однобуквенными кодами.
Если не указано иное, термин "рак" относится к раковым опухолям, сверхэкспрессирующим ген CDCA1, включая, например, рак молочной железы, рак мочевого пузыря, рак пищевода, мелкоклеточный рак легкого (МРЛ) и немелкоклеточный рак легкого (НМРЛ).
Если не указано иное, термины "цитотоксический T-лимфоцит", "цитотоксическая T-клетка" и "ЦТЛ" в настоящей заявке используются попеременно и, если прямо не указано иное, относятся к подгруппе T-лимфоцитов, которые способны узнавать "чужие" клетки (например, опухолевые клетки, клетки, инфицированные вирусом) и вызывать гибель таких клеток.
II. Пептиды
Чтобы продемонстрировать, что пептиды, полученные из CDCA1, функционируют как антиген, узнаваемый цитотоксическими T-лимфоцитами (ЦТЛ), пептиды, полученные из CDCA1 (SEQ ID NO: 35), анализировали, чтобы определить, являлись ли они эпитопами антигена, рестриктированными HLA-A24, которые являются часто встречаемыми HLA аллелями (Date Y et al., Tissue Antigens 47: 93-101, 1996; Kondo A et al., J Immunol 155: 4307-12, 1995; Kubo RT et al., J Immunol 152: 3913-24, 1994). Кандидатные HLA-A24-связывающие пептиды, полученные из CDCA1, идентифицировали на основании их аффинностей связывания с HLA-A24. После in vitro стимуляции T-клеток дендритными клетками (ДК), нагруженными указанными пептидами, успешно получали линии ЦТЛ, используя каждый из следующих пептидов:
CDCA1-A24-10-119 (SEQ ID NO: 3),
CDCA1-A24-10-335 (SEQ ID NO: 4),
CDCA1-A24-10-48 (SEQ ID NO: 11),
CDCA1-A24-10-5 (SEQ ID NO: 14),
CDCA1-A24-9-8 (SEQ ID NO: 22) и
CDCA1-A24-9-56 (SEQ ID NO: 23).
Полученные линии ЦТЛ демонстрировали мощную специфичную активность ЦТЛ против клеток-мишеней, сенсибилизированных соответствующими пептидами. Данные результаты показывают, что CDCA1 является антигеном, узнаваемым ЦТЛ, и что пептиды являются эпитоп-пептидами CDCA1, рестриктированными HLA-A24.
Поскольку ген CDCA1 сверхэкспрессируется в большинстве раковых тканей, включая, например, рак молочной железы, рак мочевого пузыря, рак пищевода, мелкоклеточный рак легкого (МРЛ) и немелкоклеточный рак легкого (НМРЛ), он представляет собой хорошую мишень для иммунотерапии. Таким образом, в настоящем изобретении предложены нонапептиды (пептиды, состоящие из девяти аминокислотных остатков) и декапептиды (пептиды, состоящие из десяти аминокислотных остатков), соответствующие ЦТЛ-узнаваемым эпитопам CDCA1. Наиболее предпочтительные примеры нонапептидов и декапептидов настоящего изобретения включают пептиды, состоящие из аминокислотной последовательности, выбранной из SEQ ID NO: 3, 4, 11, 14, 22 и 23.
В большинстве случаев, программы, доступные на данный момент в Интернете, такие как программы, описанные в Parker KC et al., J Immunol 1994 Jan 1, 152(1): 163-75, могут использоваться для вычисления аффинностей связывания между различными пептидами и антигенами HLA in silico. Аффинность связывания с антигенами HLA может быть измерена, как описано, например, в Parker KC et al., J Immunol 1994 Jan 1, 152(1): 163-75; и Kuzushima K et al., Blood 2001, 98(6): 1872-81. Способы определения аффинности связывания описаны, например, в Journal of Immunological Methods, 1995, 185: 181-190 и Protein Science, 2000, 9: 1838-1846. Таким образом, настоящее изобретение охватывает определенные пептиды CDCA1, которые связываются с антигенами HLA, идентифицированными с применением таких известных программ.
Нонапептиды и декапептиды настоящего изобретения необязательно могут быть фланкированы дополнительными аминокислотными остатками, с условием, что пептид сохраняет свою способность индуцировать ЦТЛ. Такие пептиды, обладающие способностью индуцировать ЦТЛ, в большинстве случаев имеют длину менее чем приблизительно 40 аминокислот, часто менее чем приблизительно 20 аминокислот, обычно меньше чем приблизительно 15 аминокислот. Конкретная аминокислотная последовательность (последовательности), фланкирующая пептиды, состоящие из аминокислотной последовательности, выбранной из SEQ ID NO: 3, 4, 11, 14, 22 и 23, не ограничена и может состоять из аминокислот любого типа, при условии, что это не нарушает способность исходного пептида индуцировать ЦТЛ. Таким образом, настоящее изобретение также обеспечивает пептиды, обладающие способностью индуцировать ЦТЛ и имеющие аминокислотную последовательность, выбранную из SEQ ID NO: 3, 4, 11, 14, 22 и 23.
В большинстве случаев модификация одной, двух или более аминокислот в белке не будет влиять на функцию белка, а в некоторых случаях даже будет усиливать требуемую функцию исходного белка. Фактически, модифицированные пептиды (то есть, пептиды, состоящие из аминокислотной последовательности, в которой были модифицированы два или несколько аминокислотных остатков (то есть, заменены, добавлены, удалены или вставлены) по сравнению с исходной референсной последовательностью), как известно, сохраняли биологическую активность исходного пептида (Mark et al., Proc Natl Acad Sci USA 1984, 81: 5662-6; Zoller and Smith, Nucleic Acids Res 1982, 10: 6487-500; Dalbadie-McFarland et al., Proc Natl Acad Sci USA 1982, 79: 6409-13). Таким образом, в одном варианте осуществления пептиды настоящего изобретения могут обладать способностью индуцировать ЦТЛ и иметь аминокислотную последовательность, выбранную из SEQ ID NO: 3, 4, 11, 14, 22 и 23, в которой одна, две или даже больше аминокислот добавлено, вставлено, удалено и/или заменено.
Специалистам, квалифицированным в данной области, известно, что обычно при индивидуальных дополнениях или заменах в аминокислотной последовательности, при которых изменяется одна аминокислота или малый процент аминокислот, свойства исходной боковой цепи аминокислоты сохраняются. При этом они часто упоминаются как "консервативные замены" или "консервативные модификации", при которых изменение белка приводит к получению модифицированного белка, имеющего аналогичную исходному белку функцию. Таблицы консервативных замен, в которых приводятся функционально подобные аминокислоты, известны в уровне техники. Примерами свойств боковых цепей аминокислот являются гидрофобные аминокислоты (A, I, L, M, F, P, W, Y, V), гидрофильньные аминокислоты (R, D, N, C, E, Q, G, H, K, S, T), а также боковые цепи, имеющие следующие функциональные группы или характеристики одновременно: алифатическую боковую цепь (G, A, V, L, I, P); боковую цепь, содержащую гидроксильную группу (S, T, Y); боковую цепь, содержащую атом серы (C, M); боковую цепь, содержащую карбоксильную и амидную группу (D, N, E, Q); боковую цепь, содержащую основание (R, K, H); и боковую цепь, содержащую ароматическую группу (H, F, Y, W). Кроме того, каждая из следующих восьми групп содержит аминокислоты, которые являются консервативными заменами друг для друга:
1) Аланин (A), глицин (G);
2) Аспарагиновая кислота (D), глутаминовая кислота (E);
3) Аспарагин (N), глутамин (Q);
4) Аргинин (R), лизин (K);
5) Изолейцин (I), лейцин (L), метионин (M), валин (V);
6) Фенилаланин (F), тирозин (Y), триптофан (W);
7) Серин (S), треонин (T); и
8) Цистеин (C), метионин (M) (см., например, Creighton, Proteins 1984).
Такие консервативно модифицированные пептиды также рассматриваются как пептиды настоящего изобретения. Впрочем, пептиды настоящего изобретения не ограничиваются этим и могут включать неконсервативные модификации, при условии, что модифицированный пептид сохраняет способность исходного пептида индуцировать ЦТЛ. Кроме того, модифицированные пептиды не должны исключать ЦТЛ-индуцирующие пептиды полиморфных вариантов, межвидовых гомологов и аллелей CDCA1.
В целях сохранения необходимой способности индуцировать ЦТЛ, можно модифицировать (вставить, добавить, удалить и/или заменить) небольшое количество (например, 1, 2 или несколько) или небольшой процент аминокислот. В данном случае термин "несколько" означает 5 или меньше аминокислот, например, 3 или меньше. Процент модифицируемых аминокислот составляет предпочтительно 20% или меньше, более предпочтительно 15% или меньше, еще более предпочтительно 10% или меньше или 1-5%.
Анализ гомологии предпочтительных пептидов настоящего изобретения CDCA1-A24-10-119 (SEQ ID NO: 3), CDCA1-A24-10-335 (SEQ ID NO: 4), CDCA1-A24-10-48 (SEQ ID NO: 11), CDCA1-A24-10-5 (SEQ ID NO: 14), CDCA1-A24-9-8 (SEQ ID NO: 22) и CDCA1-A24-9-56 (SEQ ID NO: 23) подтвердил, что указанные пептиды не имеют существенной гомологии с пептидами, полученным из каких-либо других известных продуктов генов человека. Таким образом, возможность указанных пептидов вызывать неизвестные или нежелательные иммунные ответы при применении для иммунотерапии значительно снижена. Соответственно, указанные пептиды, как ожидают, будут крайне полезны для стимулирования иммунитета против CDCA1 у больных раком.
В случае применения в контексте иммунотерапии, пептиды настоящего изобретения должны быть презентированы на поверхности клетки или экзосомы, предпочтительно в виде комплекса с HLA антигеном. Таким образом, предпочтительно выбрать пептиды, которые не только индуцируют ЦТЛ, но также обладают высокой аффинностью связывания к HLA антигену. С этой целью, пептиды могут быть модифицированы заменой, вставкой, делецией и/или дополнением аминокислотных остатков, с получением модифицированного пептида, обладающего повышенной аффинностью связывания. В дополнение к пептидам, которые естественно презентируются, поскольку регулярность последовательностей пептидов, презентируемых при связывании с HLA антигенами, уже известна (J Immunol 1994, 152: 3913; Immunogenetics 1995, 41: 178; J Immunol 1994, 155: 4307), модификации, основанные на такой регулярности, могут быть введены в иммуногенные пептиды изобретения. Например, может потребоваться заменить вторую аминокислоту с N-конца фенилаланином, тирозином, метионином или триптофаном, и/или аминокислоту на C-конце фенилаланином, лейцином, изолейцином, триптофаном или метионином, чтобы повысить афинность связывания HLA-A24. Таким образом, пептиды, которые имеют аминокислотную последовательность, выбранную из SEQ ID NO: 3, 4, 11, 14, 22 и 23, в которой вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO заменена фенилаланином, тирозином, метионином или триптофаном, и/или в которой аминокислота на C-конце последовательности SEQ ID NO заменена фенилаланином, лейцином, изолейцином, триптофаном или метионином, включены в настоящее изобретение. Замены могут быть введены не только в концевые аминокислоты, но и в положение потенциального ТКР-узнавания пептидов. В нескольких исследованиях было продемонстрировано, что аминокислотные замены в пептиде могут соответствовать или превосходить исходные, например, CAP1, p53(264-272), Her-2/neu(369-377) или gp100(209-217) (Zaremba et al. Cancer Res. 57, 4570-4577, 1997, T. K. Hoffmann et al. J Immunol. (2002) Feb 1;168(3):1338-47., S. O. Dionne et al. Cancer Immunol immunother. (2003) 52: 199-206, а также S. O. Dionne et al. Cancer Immunology, Immunotherapy (2004) 53, 307-314).
Настоящее изобретение также рассматривает присоединение одной-двух аминокислот к N- и/или C-концу описанных пептидов. Подобные модифицированные пептиды, обладающие высокой аффинностью связывания к HLA-антигену и сохраняющие способность индуцировать ЦТЛ, также включены в настоящее изобретение.
Впрочем, когда последовательность пептида идентична части аминокислотной последовательности эндогенного или экзогенного белка, имеющего другую функцию, могут развиваться побочные эффекты, такие как аутоиммунные нарушения и/или аллергические симптомы против определенных веществ. Таким образом, сначала предпочтительно выполнить поиск гомологии, используя доступные базы данных, чтобы избежать ситуаций, в которых последовательность пептида соответствует аминокислотной последовательности другого белка. Когда из поиска гомологии становится ясно, что не существует пептид даже с 1 или 2 аминокислотными различиями по сравнению с целевым пептидом, целевой пептид может быть модифицирован с целью повышения его аффинности связывания с HLA антигенами, и/или повышения его способности индуцировать ЦТЛ без какой-либо опасности таких побочных эффектов.
Хотя пептиды, обладающие вышеописанной высокой аффинностью связывания к HLA антигенам, как ожидают, будут очень эффективны, кандидатные пептиды, которые выбраны согласно наличию высокой аффинности связывания в качестве индикатора, далее исследуют на предмет присутствия способности индуцировать ЦТЛ. В данном случае, фраза "способность индуцировать ЦТЛ" указывает на способность пептида индуцировать цитотоксические T-лимфоциты (ЦТЛ) при презентировании на антигенпрезентирующих клетках. Кроме того, "способность индуцировать ЦТЛ " включает способность пептида индуцировать активацию ЦТЛ, пролиферацию ЦТЛ, активировать ЦТЛ лизис клеток-мишеней и увеличивать выработку IFN-гамма в ЦТЛ.
Подтверждение способности индуцировать ЦТЛ осуществляют путем индуцирования антигенпрезентирующих клеток, несущих MHC-антигены человека (например, B-лимфоциты, макрофаги и дендритные клетки (ДК)), или более конкретно, ДК, полученные из мононуклеарных лейкоцитов периферической крови человека, и, после стимуляции пептидами, смешивания с CD8-положительными клетками, с последующим измерением уровня продукции IFN-гамма, который секретируют ЦТЛ против клеток-мишеней. В качестве реакционной системы могут использоваться трансгенные животные, экспрессирующие человеческий HLA-антиген (например, описанные в BenMohamed L, Krishnan R, Longmate J, Auge C, Low L, Primus J, Diamond DJ, Hum Immunol 2000 Aug, 61(8): 764-79, связанные статьи, книги, Linkout Induction of CTL response by a minimal epitope vaccine in HLA A*0201/DR1 transgenic mice: dependence on HLA class II restricted T(H) response). Например, целевые клетки могут быть помечены радиоактивным изотопом 51Cr и т.п., при этом цитотоксическая активность может быть вычислена из радиоактивности, испускаемой клетками-мишенями. В альтернативе, способность индуцировать ЦТЛ может быть оценена путем измерения уровня IFN-гамма, вырабатываемого и секретируемого ЦТЛ в присутствии антигенпрезентирующих клеток (АПК), которые несут иммобилизованные пептиды, и визуализации зоны ингибирования на среде с использованием моноклональных антител против IFN-гамма.
В результате исследования способности пептидов индуцировать ЦТЛ, как описано выше, было обнаружено, что пептиды, которые имеют высокую аффинность связывания к HLA-антигену, не обязательно обладают высокой способностью индуцировать ЦТЛ. Однако из всех идентифицированных и проанализированных пептидов, нонапептиды или декапептиды, которые имеют аминокислотную последовательность, выбранную из SEQ ID NO: 3, 4, 11, 14, 22 и 23, как обнаружили, демонстрировали наиболее высокую способность индуцировать ЦТЛ, а также высокую аффинность связывания к HLA-антигену. Таким образом, указанные пептиды представляются как предпочтительные варианты осуществления настоящего изобретения.
В дополнение к вышеописанным модификациям, пептиды настоящего изобретения также могут быть связаны с другими веществами, при условии, что получаемый в результате связанный пептид сохраняет способность исходного пептида индуцировать ЦТЛ. Примеры подходящих веществ включают, например, пептиды, липиды, сахара и сахаридные цепи, ацетильные группы, природные и синтетические полимеры и т.д. Пептиды могут содержать модификации, такие как гликозилирование, окисление боковой цепи или фосфорилирование, и т.д., если модификации не приводят к исчезновению биологической активности исходного пептида. Данные виды модификаций могут быть выполнены с целью придания дополнительных функций (например, функции направленного действия и функции доставки) или стабилизирования полипептида.
Например, для повышения in vivo стабильности полипептида, как известно из уровня техники, вводят D-аминокислоты, миметики аминокислот или неприродные аминокислоты; данная концепция может быть также приспособлена к настоящим полипептидам. Стабильность полипептида может быть оценена множеством способов. Например, пептидазы и различные биологические среды, такие как человеческая плазма и сыворотка, могут использоваться для анализа стабильности (см., например, Verhoef et al., Eur J Drug Metab Pharmacokin 1986, 11: 291-302).
Пептиды настоящего изобретения презентируются на поверхности клетки (например, антигенпрезентирующей клетки) или экзосомы в виде комплексов в комбинации с HLA-антигенами, а затем индуцируют ЦТЛ. Поэтому пептиды, формирующие комплексы с HLA-антигенами на поверхности клетки, или экзосомы также включены в настоящее изобретение. Такие экзосомы могут быть получены, например, с использованием способов, подробно описанных в опубликованных заявках на патент Японии Kohyo. Hei 11-510507 и WO99/03499, и могут быть получены с использованием АПК, полученных от пациентов, подвергнутых лечению и/или профилактике. Экзосомы или клетки, презентирующие пептиды настоящего изобретения, могут быть введены в виде вакцин.
Тип HLA-антигенов, содержащихся в вышеуказанных комплексах, должен соответствовать типу HLA-антигенов субъекта, нуждающегося в лечении и/или профилактике. Например, у населения Японии, HLA-A24, в особенности HLA-A2402, является наиболее распространенным, и поэтому подходит для лечения пациента в Японии. Использование типа A24, который экспрессируется на высоком уровне у японцев и европейцев, благоприятно для получения эффективных результатов, при этом такие подтипы, как A2402, также находят применение. Как правило, в клинике тип HLA-антигена пациента, нуждающегося в лечении, исследуют заранее, что позволяет провести надлежащий выбор пептидов, имеющих высокие уровни аффинности связывания к специфическому антигену, или обладающих способностью индуцировать ЦТЛ посредством презентирования антигена.
При использовании типа A24 HLA-антигена для экзосомы или клетки, предпочтительно применяются пептиды, которые имеют аминокислотную последовательность, выбиранную из SEQ ID NO: 3, 4, 11, 14, 22 и 23.
В данном случае, пептиды настоящего изобретения могут быть также описаны как "CDCA1 пептид(ы)" или "CDCA1 полипептид(ы)".
III. Получение CDCA1 пептидов
Пептиды изобретения могут быть получены с использованием известных методов. Например, пептиды могут быть получены искусственно, с применением методов генной инженерии или химического синтеза. Пептид изобретения может быть синтезирован индивидуально или в виде более длинных полипептидов, состоящих из двух или более пептидов. Затем пептиды могут быть выделены, то есть, очищены так, чтобы они практически не содержали других природных белков клетки-хозяина и их фрагментов, или любых других химических веществ.
Пептид настоящего изобретения может быть получен с помощью химического синтеза, основанного на выбранной аминокислотной последовательности. Примеры стандартных методов синтеза пептидов, которые могут быть применены в синтезе, включают:
(i) Peptide Synthesis, Interscience, New York, 1966;
(ii) The Proteins, Vol. 2, Academic Press, New York, 1976;
(iii) Peptide Synthesis (на японском языке), Maruzen Co., 1975;
(iv) Basics and Experiment of Peptide Synthesis (на японском языке), Maruzen Co., 1985;
(v) Development of Pharmaceuticals (второй том) (на японском языке), Vol. 14 (peptide synthesis), Hirokawa, 1991;
(vi) WO99/67288; и
(vii) Barany G. & Merrifield R.B., Peptides Vol. 2, "Solid Phase Peptide Synthesis", Academic Press, New York, 1980, 100-118.
В альтернативе, настоящие пептиды могут быть получены с применением любого известного метода генной инженерии для получения пептидов (например, Morrison J, J Bacteriology 1977, 132: 349-51; Clark-Curtiss & Curtiss, Methods in Enzymology (eds. Wu et al.) 1983, 101: 347-62). Например, сначала получают подходящий вектор, несущий полинуклеотид, кодирующий целевой пептид в экспрессируемой форме (например, расположенный после регулиряторной последовательности, соответствующей последовательности промотора), которым затем трансформируют подходящую клетку-хозяина. Затем клетку-хозяина культивируют, получая требуемый пептид. Пептид может также быть получен in vitro с применением системы трансляции in vitro.
IV. Полинуклеотиды
Настоящее изобретение также обеспечивает полинуклеотид, который кодирует любой из вышеупомянутых пептидов настоящего изобретения. Они включают полинуклеотиды, полученные из природного гена CDCA1 (GenBank NM_145697 (SEQ ID NO: 34)), а также полинуклеотиды, которые имеют консервативно модифицированную нуклеотидную последовательность. В данном случае, фраза "консервативно модифицированная нуклеотидная последовательность" относится к последовательностям, которые кодируют идентичные или по существу идентичные аминокислотные последовательности. Вследствие вырожденности генетического кода, большое количество функционально идентичных нуклеиновых кислот кодирует тот или иной белок. Например, кодоны GCA, GCC, GCG и GCU кодируют аминокислоту аланин. Таким образом, в каждом положении, в котором аланин определен кодоном, кодон может быть изменен на любой из соответствующих описанных кодонов, без изменения кодируемого полипептида. Подобные изменения нуклеиновой кислоты являются "молчащими вариациями" и являются одним из вариантов консервативно модифицированных вариаций. Каждая последовательность нукле