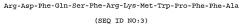Пептиды со способностью связываться со скурфином и их применение
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к пептиду со способностью связываться со скурфином и ингибировать биологическую активность скурфина, который выбран из пептида, состоящего из аминокислотной последовательности Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X, где Х отсутствует или Х присутствует и представляет собой X14 или X14-X15, где X14 и X15 независимо друг от друга обозначают аминокислоту, варианта указанного пептида и его фармацевтически приемлемой соли. Также раскрыты слитый белок и фармацевтическая композиция, предусматривающая использование указанного пептида и слитого белка, а также их применение для ее получения и лечения патологии, требующей транзиентной регуляции или ингибирования иммуносупрессорной активности регуляторных Т-лимфоцитов, такой как неопластическое заболевание или инфекционное заболевание. Кроме того, изобретение относится к способу получения указанного пептида и слитого белка, в том числе к нуклеиновой кислоте, кодирующей белок или пептид, ДНК-конструкции, экспрессирующему вектору и клетке хозяина. Изобретение позволяет эффективно лечить инфекционные и неопластические заболевания, требующие транзиентной регуляции или ингибирования иммуносупрессорной активности регуляторных Т-лимфоцитов. 11 н. и 15 з.п. ф-лы, 10 ил., 5 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В целом изобретение относится к пептидам, которые обладают способностью связываться со скурфином и к их применению. В частности, изобретение относится к пептидам, которые ингибируют биологическую активность скурфина посредством их прямого связывания с указанным белком и которые, таким образом, позволяют регулировать или блокировать активность регуляторных T (Treg) лимфоцитов. Указанные пептиды можно использовать для лечения патологий, таких как инфекционные и неопластические заболевания, при которых уместно или необходимо регулирование или блокирование активности регуляторных T-лимфоцитов управляемым способом.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
В начале 1970-х годов впервые было описано существование T-лимфоцитов, которые способны подавлять иммунный ответ. В это время полагали, что указанное супрессорное влияние опосредовано определенной клеточной субпопуляцией, но в распоряжении не было какого-либо специфического маркера указанной субпопуляции, который удалось бы клонировать или охарактеризовать, и интерес к клеткам этого субтипа был частично утрачен. Однако в 1995 Sakaguchi et. al. (Sakaguchi et al. 1995. J Immunol 155:1151-64) обнаружили, что минорная популяция клеток CD4+ (10%), которые совместно экспрессировали α-цепь рецептора интерлейкина-2 (CD25), играла ключевую роль в контроле аутореактивных клеток и аутоиммунных реакций in vivo. После этого различные группы исследователей показали, что эта субпопуляция клеток CD4+CD25+, также известная как регуляторные T-лимфоциты или регуляторные T-клетки, обладает иммуносупрессорными свойствами (Takahashi et al. 1998. Int Immunol 10:1969-80; Thornton & Shevach. 1998. J Exp Med 188:287-96). Сначала эти клетки были идентифицированы у мышей, но позже они были тщательно описаны у людей (Dieckmann et al. 2001. J Exp Med 193:1303-10; Jonuleit et al. 2001. J Exp Med 193:1285-94; Levings et al. 2001. J Exp Med 193:1295-302). В настоящее время существование специфической иммуносупрессорной субпопуляции получило широкое признание в научном сообществе и ведется поиск способа управления ее активностью в целях клинического использования. Главным вопросом является способ управления активностью этой субпопуляции.
Регуляторные T-лимфоциты играют важную роль в защите от аутоиммунных заболеваний и в предупреждении отторжения трансплантатов; следовательно, возможность увеличения их активности обладает большим потенциалом для лечения аутоиммунных заболеваний и для трансплантации органов. Однако вследствие того, что опухоли экспрессируют аутоантигены, регуляторные T-лимфоциты могут быть способны к ингибированию активации иммунного ответа против новообразования.
Несколько групп исследователей, включая группу авторов настоящего изобретения, продемонстрировали, что простая элиминация клеток CD4+CD25+ (регуляторных T-лимфоцитов) путем введения истощающих антител in vivo способствует индуцированию противоопухолевого иммунитета и защите от развития новообразований (Casares et al. 2003. J Immunol 171:5931-9; Onizuka et al. 1999. Cancer Res 59:3128-33; Shimizu et al. 1999. J Immunol 163:5211-8; Steitz et al. 2001. Cancer Res 61:8643-6; Sutmuller et al. 2001. J Exp Med 194:823-32). Таким образом, полагают, что (регуляторные T) клетки CD4+CD25+ постоянно замедляют активацию эффекторных T-лимфоцитов для того, чтобы предотвращать аутоиммунные процессы, но, в то же время, затрудняют надлежащую активацию противоопухолевого ответа, если это необходимо.
Иммунотерапия обладает большими перспективами в лечении пациентов с новообразованиями. Осуществление многих клинических протоколов, в которых используются способы лечения, основанные на цитокинах, инфузиях эффекторных T-клеток, или схем вакцинации продемонстрировало, что иммунотерапия новообразований, как правило, безопасна. Однако, несмотря на то, что в этих клинических протоколах после лечения данными способами наблюдалось индуцирование иммунного ответа, большинство пациентов не способны развить эффективный противоопухолевый ответ. Метаанализ 37 независимых клинических схем вакцинации, в который вошло более 700 пациентов, показал, что процентная доля частичных или полных ответов против опухоли очень мала (3,8%) (Rosenberg et al. 2004. Nat Med 10:909-15). Недавние сообщения о том, что присутствие регуляторных T-лимфоцитов в ткани опухоли или в лимфатических узлах пациентов с меланомой (Wang, H. Y., J Immunol, 2005. 174:2661-2670; Viguier, M., F. J Immunol, 2004. 173:1444-1453.), раком легких (Woo, E. Y., Cancer Res 61:4766-4772), раком яичников (Woo, E. Y., Cancer Res, 2001. 61:4766-4772, Curiel, T. J., Nat Med, 2004. 10:942-949), раком поджелудочной железы и раком молочной железы (Liyanage, U. K., J Immunol, 2002. 169:2756-2761), а также в гепатокарциномах (Ormandy, L. A. Cancer Res, 2005. 65:2457-2464; Kobayashi, N., Clin Cancer Res, 2007. 13:902-911), и сообщение о том, что ткань опухоли секретирует хемокины, которые привлекают, в частности, эту субпопуляцию в ткань опухоли, указывает на то, что поступление регуляторных T-лимфоцитов в опухоль является динамическим процессом и что оказывает влияние на иммуносупрессорный эффект, облегчая развитие заболевания. Присутствие регуляторных T-клеток в опухоли, а также в периферических узлах, может объяснить низкую эффективность протоколов иммунотерапии. Таким же образом, при инфекционных заболеваниях, контроль, осуществляемый регуляторными T-лимфоцитами, может ограничивать величину ответов эффекторных T-клеток и приводить к неспособности контролировать инфекцию. Таким образом, сообщалось о том, что некоторые вирусы, такие как вирус гепатита В (Xu, D. J Immunol, 2006. 177:739-747), вирус гепатита С (Boettler, Т., J Virol, 2005. 79:7860-7867; Cabrera, R. Hepatology, 2004. 40:1062-1071; Rushbrook, J Virol, 2005. 79:7852-7859; Sugimoto, K. Hepatology, 2003. 38:1437-1448) и HIV, (Aandahl, E. M. J Virol, 2004. 78:2454-2459; Kinter, A. L. J Exp Med, 2004. 200:331-343; Oswald-Richter, K. PLoS Biol2004. 2:E198; Weiss, L. Blood, 2004. 104:3249-3256) могут использовать регуляторные T-лимфоциты для того, чтобы блокировать противовирусный иммунный ответ и, таким образом, делать возможным установление персистирующей хронической инфекции. В силу всех этих причин полагают, что модулирование деятельности регуляторных T-лимфоцитов может играть важную роль в разработке способов иммунотерапии новообразований или инфекционных заболеваний.
Существует некоторое разногласие в отношении механизма действия регуляторных T-лимфоцитов, но понимание роли цитокина TGF-β (трансформирующий фактор роста-β) в процессе ингибирования эффекторных T-клеток, по всей видимости, увеличивается (Powrie et al. 1996. J Exp Med 183:2669-74; Somasundaram et al. 2002. Cancer Res 62:5267-72).
Кроме того, недавно сообщалось о том, что фактор транскрипции скурфина (FOXP3, продукт экспрессии гена foxp3) (Yagi et al. 2004. Int Immunol 16:1643-56. 2004 Oct 04) важен для активности регуляторных T-лимфоцитов, так что его присутствие определяет супрессорную активность этих клеток. Последовательности кДНК, которые кодируют скурфин человека или мыши, являются объектом патента США 6414129, в котором, кроме того, описан способ модулирования экспрессии скурфина, который обладает терапевтическими эффектами при различных заболеваниях; в указанном патенте также упоминается об использовании синтетических пептидов, среди прочих молекул, для регулирования экспрессии гена foxp3, но ничего не говорится о возможности ингибирования активности уже экспрессированного скурфина.
Подобным образом, применение способа усиления иммунного ответа у млекопитающих основано на элиминировании регуляторных T-лимфоцитов посредством применения нейтрализующих моноклональных антител (WO 2006/044864); однако в указанной патентной заявке ничего не говорится о транзиентном регулировании активности регуляторных Т-лимфоцитов путем ингибирования активности скурфина (который важен для иммуносупрессорного действия указанных клеток). Кроме того, истощение пула регуляторных Т-лимфоцитов увеличивает риск индукции аутоиммунных реакций, а тот факт, что такие моноклональные антитела не различают регуляторные Т-лимфоциты и эффекторные Т-лимфоциты, ограничивает их применение.
В настоящее время существуют сообщения лишь о тех экспериментально подтвержденных способах ингибирования активности регуляторных Т-лимфоцитов, которые включают элиминирование этих клеток путем применения истощающих антител или путем блокирования цитокинов, которые они продуцируют и которые могут отвечать за активность этих клеток (TGF-B, IL-10), однако не существует специфического ингибитора этой клеточной субпопуляции. Способы, основанные на истощении пула регуляторных Т-клеток, имеют недостаток в виде риска развития аутоиммунных заболеваний, который обусловлен элиминированием этих клеток. Кроме того, не существует специфических антител против регуляторных Т-клеток, а те антитела, которые существуют, также элиминируют эффекторные Т-клетки.
Поэтому сохраняется необходимость в выявлении новых соединений, которые способны регулировать или блокировать активность регуляторных Т-лимфоцитов, которые потенциально можно использовать для лечения людей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
С удивлением было обнаружено, что иммуносупрессорную активность регуляторных Т-лимфоцитов можно транзиентно или временно регулировать или блокировать путем ингибирования активности скурфина, фактора транскрипции, который важен для указанных регуляторных Т-лимфоцитов, чтобы оказывать влияние на их иммуносупрессорное действие путем применения пептидов, которые не только способны связываться со скурфином, но которые также способны ингибировать его биологическую активность. Указанные пептиды со способностью связываться со скурфином, в частности, такие пептиды со способностью ингибировать его биологическую активность, потенциально можно применять для лечения патологий, при которых необходимо временное или транзиентное регулирование или ингибирование иммуносупрессорной активности регуляторных Т-лимфоцитов, например, для лечения инфекционных заболеваний и неопластических заболеваний. Подобным образом, указанные пептиды представляют собой инструмент для изучения биологической роли скурфина и регуляторных Т-лимфоцитов.
Следовательно, один аспект данного изобретения относится к пептидам, которые обладают способностью связываться со скурфином. В конкретном и предпочтительном варианте осуществления, указанные пептиды дополнительно обладают способностью ингибировать биологическую активность скурфина.
В другом аспекте изобретение относится к слитому белку, содержащему пептид, предоставленный в этом изобретении, и пептид-носитель со способностью к интернализации пептида в клетку.
В другом аспекте изобретение относится к фармацевтической композиции, которая содержит по меньшей мере один пептид или один слитый белок, предоставленный в настоящем изобретении.
В другом аспекте изобретение относится к использованию указанных пептидов и слитых белков для получения лекарственного препарата для лечения патологии, при которой необходимо транзиентное регулирование или ингибирование иммуносупрессорной активности регуляторных Т-лимфоцитов, например, для лечения неопластического заболевания или инфекционного заболевания.
В другом аспекте изобретение относится к использованию указанных пептидов и слитых белков для лечения патологии, при которой необходимо транзиентное регулирование или ингибирование иммуносупрессорной активности регуляторных Т-лимфоцитов, например, для лечения неопластического заболевания или инфекционного заболевания.
В другом аспекте изобретение относится к нуклеиновым кислотам, которые кодируют указанные пептиды или указанные слитые белки.
В другом аспекте изобретение относится к генной конструкции, которая содержит нуклеиновую кислоту, которая кодирует пептид или слитый белок, предоставленный в настоящем изобретении.
В другом аспекте изобретение относится к вектору, который содержит указанную нуклеиновую кислоту или указанную генную конструкцию.
В другом аспекте изобретение относится к клетке-хозяину, например, к трансформированной клетке-хозяину, которая содержит указанную нуклеиновую кислоту, указанную генную конструкцию или указанный вектор.
В другом аспекте изобретение относится к способу получения пептида или слитого белка, предоставленного в настоящем изобретении, который включает культивирование указанных клеток-хозяев в условиях, которые допускают экспрессию указанного пептида и, при желании, сбор полученного пептида или слитого белка.
В другом аспекте изобретение относится к использованию указанных нуклеиновых кислот и генных конструкций для получения векторов и клеток для лечения патологии, при которой необходимо транзиентное регулирование или ингибирование иммуносупрессорной активности регуляторных Т-лимфоцитов, например, для лечения неопластического заболевания или инфекционного заболевания.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1 представляет собой график, на котором приведены результаты анализа взаимодействия биологических молекул, которое происходит между пептидом Р60 (SEQ ID NO:1) и скурфином, способом поверхностного плазменного резонанса (SPR), как это описано в примере 1 (раздел 1.3). Как можно видеть, пептид Р60 (SEQ ID NO:1) дает положительный сигнал, что подтверждает его способность избирательно связываться со скурфином. Приведенный результат является репрезентативным для трех независимых экспериментов. О.Е.: относительные единицы.
Фиг. 2 представляет собой диаграмму, на которой приведены результаты анализа взаимодействия биологических молекул, которое происходит между пептидом Р60 (SEQ ID NO:1) или его усеченными формами T(1-13) SEQ ID NO:2, T(1-14) (SEQ ID NO:3) и Т(2-15) (SEQ ID NO:4) и скурфином, способом поверхностного плазменного резонанса (SPR) (пример 1, раздел 1.4). Как можно видеть, удаление аминокислоты в N-концевом положении подавляет способность пептида связываться со скурфином; однако, удаление остатков 14 или 15 с C-конца не подавляет способность пептида связываться со скурфином.
Фиг.3 представляет собой столбцовую диаграмму, на которой показана супрессорная активность клеточной линии человека Karpas 299 (ACC-31, DSMZ, Germany). С использованием этих клеток осуществляли реакцию смешанной культуры лимфоцитов (РСКЛ), в которой измеряли уровни IFN-γ, продуцируемого после культивирования мононуклеарных клеток периферической крови (МКПК) от 2 доноров в присутствии или в отсутствие клеточной линии Karpas 299. При культивировании МКПК от 2 различных доноров развивался иммунный ответ, известный как ответ на смешанную культуру лимфоцитов, который включает в себя активацию клеточной пролиферации и образование таких цитокинов, как IFN-γ, путем аллогенного распознавания в реакции между главным комплексом гистосовместимости (MHC) и T-клеточным рецептором (TCR). Этот ответ ингибировался при добавлении клеток Karpas 299 (с фенотипом и активностью регуляторных T-лимфоцитов). Обозначения: МКПК1 (1 × 105 клеток/лунка), лимфоциты периферической крови от здорового донора (1); МКПК2 (1 × 105 клеток/лунка), лимфоциты периферической крови от другого здорового донора (2), отличающегося от донора (1); Karpas - клеточная линия Karpas 299 (1 × 104 клеток/лунка). На тех же фигурах показано, что пептид P60 (SEQ ID NO:1) (100 мкМ) способен восстанавливать образование IFN-γ в T-лимфоцитах (его измеряли в культуральных супернатантах с помощью теста ELISA, BD Biosciences), что ингибирует супрессорное действие клеток Karpas 299.
Фиг.4 представляет собой столбцовую диаграмму, на которой показано влияние пептида P60 (SEQ ID NO:1) на действие регуляторных T-лимфоцитов человека (выделены из периферической крови здорового донора с использованием Miltenyi Biotech kit, Ref 130-091-301) в реакции смешанной культуры лимфоцитов (РСКЛ). МКПК, полученные от двух доноров крови (1 × 105 клеток/лунка от каждого донора), смешивали и инкубировали в присутствии или в отсутствие регуляторных T-лимфоцитов (2 × 104 клеток/лунка; получены от одного из них) и пептида P60 (SEQ ID NO:1) (100 мкМ). После 3 дней культивирования измеряли клеточную пролиферацию с помощью стандартного теста на поглощение тритированного тимидина. Как можно видеть, регуляторные T-лимфоциты способны ингибировать РСКЛ, а пептид P60 (SEQ ID NO:1) способен снижать иммуносупрессорное влияние регуляторных T-лимфоцитов в РСКЛ.
Фиг.5 представляет собой столбцовую диаграмму, на которой показано влияние пептида P60 (SEQ ID NO:1) на влияние природных регуляторных T-лимфоцитов человека (выделены из периферической крови здорового донора) на ответную реакцию эффекторных клеток, вызванную стимуляцией антителами против CD3/CD28, связанными с бусами (Dynabeads® CD3/CD28, Ref 111-31, Dynal). Эффекторные T-лимфоциты, полученные от здорового донора (1 × 105 клеток/лунка), культивировали в присутствии или в отсутствие стимула в виде антител против CD3/CD28, регуляторных T-лимфоцитов (2 × 104 клеток/лунка) и пептида P60 (SEQ ID NO:1) (100 мкМ). После 48 часов культивирования присутствие IFN-γ в культуральных супернатантах измеряли с помощью коммерческого ELISA. Как можно видеть, пептид P60 (SEQ ID NO:1) способен ингибировать иммуносупрессорное влияние регуляторных T-лимфоцитов человека на активацию антигеном CD3/CD28.
Фиг.6 представляет собой столбцовую диаграмму, на которой показано влияние пептида P60 (SEQ ID NO:1) на влияние природных регуляторных T-лимфоцитов мыши (выделены из спленоцитов мыши при помощи Miltenyi Biotech kit, Ref: 130-091-041) на образование IFN-γ эффекторными T-клетками в зависимости от стимуляции антителами против CD3 (BD-Biosciences). Спленоциты мышей BALB/c (1 × 105 клеток/лунка) культивировали в присутствии или в отсутствие антител против CD3 (0,5 мкг/мл), регуляторных T-лимфоцитов (2 × 104 клеток/лунка) и пептида P60 (SEQ ID NO:1) (100 мкМ). Как можно видеть, пептид P60 (SEQ ID NO: 1) способен ингибировать иммуносупрессорное влияние регуляторных T-лимфоцитов на образование IFN-γ (его измеряли с помощью коммерческого ELISA) эффекторными клетками в ответ на стимулирование антителами против CD3.
Фиг.7 представляет собой столбцовую диаграмму, на которой показано влияние пептида P60 (SEQ ID NO:1) на влияние регуляторных T-лимфоцитов мыши (выделенных из спленоцитов мыши) на ответную реакцию эффекторных клеток при стимулировании в реакции смешанной культуры лимфоцитов (РСКЛ) (измерение клеточной пролиферации осуществляли с помощью стандартного теста на поглощение тритированного тимидина). Эффекторные лимфоциты выделяли из мышей BALB/c (1 × 105 клеток/лунка) и культивировали совместно с дендритными клетками, выделенными из мышей C57BL/6, в присутствии или в отсутствие регуляторных T-лимфоцитов BALB/c (2 × 104 клеток/лунка) и в присутствии или в отсутствие пептида P60 (SEQ ID NO:1) (100 мкМ). Как можно видеть, пептид P60 (SEQ ID NO:1) способен ингибировать иммуносупрессорное влияние регуляторных T-лимфоцитов на пролиферацию эффекторных клеток.
Фиг.8 представляет собой столбцовую диаграмму, на которой показано влияние пептида P60 (SEQ ID NO:1) на влияние природных регуляторных T-лимфоцитов мыши (выделены из спленоцитов мыши) на ответную реакцию эффекторных клеток, вызванную стимуляцией антигеном (измеряли по IFN-γ в культуральном супернатанте). Эффекторные лимфоциты, выделенные из трансгенных мышей OT-1 (1 × 105 клеток/лунка) (пример 3 (раздел 3.2.3)), культивировали вместе с дендритными клетками DC из мышей C57BL/6 и пептидом SIINFEKL (SEQ ID NO:7) (10 мкг/мл), в присутствии или в отсутствие регуляторных T-лимфоцитов BALB/c (2 × 104 клеток/лунка) и в присутствии или в отсутствие пептида P60 (SEQ ID NO:1) (100 мкМ). Как можно видеть, пептид P60 (SEQ ID NO:1) способен ингибировать иммуносупрессорное влияние регуляторных T-лимфоцитов sobre на образование IFN-γ эффекторными клетками, специфичными к этому пептидному антигену.
Фиг.9 представляет собой столбцовую диаграмму, на которой показано влияние пептида P60 (SEQ ID NO:1) на ингибирование активации фактора транскрипции NF-κВ скурфином. Клетки 293 трансфицировали плазмидой pNF-κВ-Luc (Clontech, Ref 631904), экспрессирующей люциферазу под управлением промоторами, которые индуцируются фактором транскрипции NF-кВ, в присутствии или в отсутствие плазмиды pcDNA, pcDNA-Foxp3 и пептида P60 (SEQ ID NO:1) (100 мкМ). Как можно видеть, присутствие скурфина в клетках ингибирует экспрессию люциферазы, а присутствие пептида P60 (SEQ ID NO:1) восстанавливает ее экспрессию. О.Е.: относительные единицы.
На фиг.10 показано влияние введенного пептида P60 (SEQ ID NO:1) на улучшение противоопухолевой ответной реакции при вакцинации пептидом AH1 (SEQ ID NO:8). Группы мышей BALB/c иммунизировали физиологическим раствором (контрольная группа n=11) или пептидом AH1 (SEQ ID NO:8), эмульгированным в неполном адъюванте Фрейнда (НАФ) (n=22) (как описано Casares et al, 2003. J Immunol 171:5931-9). Одиннадцати мышам, иммунизированным пептидом AH1 (SEQ ID NO:8), вводили физиологический раствор через 0, 2, 4, 6, 8 и 10 дней после иммунизации, тогда как оставшимся 11 мышам в дозировке 50 нм/мышь интраперитонеально (i.p.) вводили пептид P60 (SEQ ID NO:1), растворенный в физиологическом растворе. Ввели другую контрольную группу (n=11) неиммунизрованных мышей, которым вводили только пептид P60 (SEQ ID NO:1) в фосфатно-солевом буфере (PBS), придерживаясь такой же схемы введения, как у предыдущей группы. На фиг.10A приведены средние показатели роста опухоли в различных группах мышей BALB/c, которым подкожно инокулировали 5 × 105 опухолевых клеток (CT26). Различные группы представляют средние показатели развития опухоли при отсутствии лечения (контрольная группа, белые треугольники), при лечении только вакциной с антигеном AH1 (черные треугольники), при лечении только пептидом P60 (SEQ ID NO:1) (белые круги) или при лечении вакциной с антигеном в сочетании с пептидом P60 (SEQ ID NO:1) (черные круги). На фиг.10B приведены кривые выживаемости для различных экспериментальных групп (кривые Каплана-Мейера). p<0,001 указывает на то, что результат статистического анализа получен с использованием логарифмического рангового критерия.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Пептид по изобретению
В одном из аспектов изобретение относится к пептиду, в дальнейшем в настоящем документе обозначаемому как «пептид по изобретению», со способностью связываться со скурфином, который выбран из:
a) пептида общей формулы (I), которая содержит аминокислотную последовательность:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X
(I)
где X отсутствует или X присутствует и представляет собой X14 или X14-X15, где X14 и X15 независимо друг от друга обозначают аминокислоты;
b) варианта пептида, который определен в a); и
c) фрагмента пептида, который определен в a), или варианта, который определен в b); и
его фармацевтически приемлемые соли.
Термин «пептид», как применяют в настоящем документе, относится к полимеру, образованному α-аминокислотами, связанными в определенном порядке посредством пептидной связи, и включает его модификации или производные, например, гликозилированные, фосфорилированные, ацетилированные, амидированные и т.д.
Аминокислоты в пептиде по изобретению, в зависимости от положения аминогруппы при α-атоме углерода, могут принадлежать к L-ряду или к D-ряду, предпочтительно, к L-ряду.
Аминокислоты, представленные в положениях X14 и X15, могут представлять собой природные аминокислоты или модифицированные или редкие аминокислоты. Природные аминокислоты включают алифатические аминокислоты (глицин, аланин, валин, лейцин и изолейцин), гидроксилированные аминокислоты (серин и треонин), сульфитированные аминокислоты (цистеин и метионин), дикарбоксильные аминокислоты и их амиды (аспарагиновая кислота, аспарагин, глутаминовая кислота и глутамин), аминокислоты, содержащие две основных группы (лизин, аргинин и гистидин), ароматические аминокислоты (фенилаланин, тирозин и триптофан) и циклические аминокислоты (пролин). Иллюстративные неограничивающие примеры модифицированных или редких аминокислот включают 2-аминоадипиновую кислоту, 3-аминоадипиновую кислоту, β-аланин, 2-аминомасляную кислоту, 4-аминомасляную кислоту, 6-аминокапроновую кислоту, 2-аминогептановую кислоту, 2-аминоизомасляную кислоту, 3-аминоизомасляную кислоту, 2-аминопимелиновую кислоту, 2,4-диаминомасляную кислоту, десмозин, 2,2'-диаминопимелиновую кислоту, 2,3-диаминопропионовую кислоту, N-этилглицин, N-этиласпарагин, гидроксилизин, аллогидроксилизин, 3-гидроксипролин, 4-гидроксипролин, изодесмозин, аллоизолейцин, N-метилглицин, N-метилизолейцин, 6-N-метил-лизин, N-метилвалин, норвалин, норлейцин, орнитин и т.д.
Пептид по изобретению отличается способностью связываться со скурфином, и, предпочтительно, способностью ингибировать биологическую активность скурфина. Способность пептида связываться со скурфином можно определить любым подходящим способом, который позволяет определить связывание между двумя молекулами (например, с помощью теста на аффинность), указанный способ включает приведение скурфина в контакт с пептидом, подлежащим тестированию, в условиях, которые допускают связывание указанного пептида со скурфином, и оценку связывания пептида со скурфином. В конкретном варианте осуществления указанный тест на аффинность можно выполнять с использованием способа поверхностного плазмонного резонанса (SPR) (пример 1.3) или подобных способов, с использованием радиоактивно меченного скурфина, или, альтернативно, радиоактивно меченного пептида, подлежащего тестированию. Этот тип теста на аффинность, как правило, содержит приведение скурфина, например, иммобилизованного в лунках планшета, в контакт с пептидом с известной способностью связываться со скурфином, и затем инкубирование в течение соответствующего периода времени, анализ связывания пептида со скурфином. Пептиды с низкой аффинностью к скурфину удаляют промыванием, тогда как пептиды с более высокой аффинностью остаются связанными со скурфином и могут быть высвобождены путем разрушения молекулярных взаимодействий между обеими молекулами, что можно осуществить, например, путем снижения pH.
Пептид по изобретению предпочтительно отличается не только способностью связываться со скурфином, но также способностью ингибировать биологическую активность скурфина и, как следствие, опосредованно временно или транзиентно регулировать или блокировать иммуносупрессорную активность регуляторных Т-лимфоцитов. Несмотря на отсутствие намерения ограничиваться какой-либо теорией, полагают, что способность пептида ингибировать биологическую активность скурфина обусловлена прямым связыванием указанного пептида со скурфином. Способность пептида ингибировать биологическую активность скурфина можно исследовать in vitro с помощью любого подходящего способа, демонстрирующего такой эффект, например:
a) с помощью теста, основанного на измерении клеточной пролиферации в культуре эффекторных Т-лимфоцитов в присутствии антитела против CD3, регуляторных Т-лимфоцитов и тритированного тимидина и в присутствии или в отсутствие пептида, подлежащего тестированию; или
b) с помощью теста, основанного на совместном культивировании спленоцитов трансгенных мышей ОТ-1 (Т-лимфоциты этих мышей содержат Т-клеточный рецептор со специфичностью к пептиду SIINFEKL (SEQ ID NO:7) овальбумина) с регуляторными Т-лимфоцитами в присутствии антигена [пептида SIINFEKL (SEQ ID NO:7)], в присутствии или в отсутствие регуляторных Т-лимфоцитов и в присутствии или в отсутствие пептида, подлежащего тестированию; или, альтернативно
c) с помощью теста, основанного на реакции смешанной культуры лимфоцитов (РСКЛ), в которой эффекторные клетки мыши (например, мыши BALB/c) смешивают с дендритными клетками, полученными от другой линии мышей (например, C57BL/6) в присутствии или в отсутствие регуляторных Т-лимфоцитов, полученных от мыши, принадлежащей к одной из линий (например, BALB/c), и в присутствии или в отсутствие пептида, подлежащего тестированию.
Аналогично, подобные эксперименты можно осуществлять с использованием регуляторных T-лимфоцитов человека. В примере 3 подробно описаны различные тесты, предназначенные для оценки способности пептида, подлежащего тестированию (например, пептида по изобретению), ингибировать биологическую активность скурфина in vitro.
В конкретном варианте осуществления пептид по изобретению представляет собой пептид с общей формулой (I), которая содержит аминокислотную последовательность:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X
где X обладает значением, указанным ранее в отношении формулы (I).
В другом конкретном варианте осуществления пептид по изобретению представляет собой пептид с общей формулой (Ia) [пептид с формулой (I), где X представляет собой X14-X15] и содержит аминокислотную последовательность или состоит из аминокислотной последовательности:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X14-X15
(Ia)
где X14 и X15, независимо друг от друга, обозначают природную аминокислоту (например, Gly, Ala, Val, Leu, Ile, Ser, Thr, Cys, Met, Asp, Asn, Glu, Gln, Lys, Arg, His, Phe, Tyr, Trp или Pro) или модифицированную или редкую аминокислоту (например, Aad, bAad, bAla, Abu, 4Abu, Acp, Ahe, Aib, bAib, Apm, Dbu, Des, Dpm, Dpr, EtGly, EtAsn, Hyl, aHyl, 3Нур, 4Нур, Ide, aIle, MeGly, MeIle, MeLys, MeVal, Nva, Nle или Orn). Хотя X14 и Х15 могут быть одинаковыми или различающимися, в конкретном варианте осуществления X14 и X15 различны, например, X14 представляет собой Ala и X15 представляет собой Met.
В другом конкретном и предпочтительном варианте осуществления пептид по изобретению представляет собой пептид, который содержит аминокислотную последовательность или состоит из аминокислотной последовательности:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-Ala-Met
(SEQ ID NO:1)
Пептид, состоящий из SEQ ID NO:1, иногда обозначается в настоящем описании как пептид P60.
В другом конкретном варианте осуществления пептид по изобретению представляет собой пептид с общей формулой (Ib) [пептид с формулой (I), где X представляет собой X14] и содержит аминокислотную последовательность или состоит из аминокислотной последовательности:
Arg-Asp-Phe-Gln-Ser-Phe-Arg-Lys-Met-Trp-Pro-Phe-Phe-X
(Ib)
где X представляет собой X14, где X14 обозначает природную аминокислоту, такую как Gly, Ala, Val, Leu, Ile, Ser, Thr, Cys, Met, Asp, Asn, Glu, Gln, Lys, Arg, His, Phe, Tyr, Trp или Pro или модифицированную или редкую аминокислоту (например, Aad, bAad, bAla, Abu, 4Abu, Acp, Ahe, Aib, bAib, Apm, Dbu, Des, Dpm, Dpr, EtGly, EtAsn, Hyl, aHyl, 3Нур, 4Hyp, Ide, aIle, MeGly, MeIle, MeLys, MeVal, Nva, Nle или Orn), предпочтительно Ala.
В другом конкретном варианте осуществления пептид по изобретению представляет собой пептид, который содержит аминокислотную последовательность или состоит из аминокислотной последовательности:
В другом конкретном варианте осуществления пептид по изобретению представляет собой пептид с общей формулой (Ic) [пептид с формулой (I), где X отсутствует] и содержит аминокислотную последовательность или состоит из аминокислотной последовательности:
В другом конкретном варианте осуществления пептид по изобретению представляет собой пептид, который состоит из аминокислотной последовательности:
Авторы настоящего изобретения проводили тесты, которые выявили важную роль, которую играет N-конец пептида с общей формулой (I), в способности пептида связываться со скурфином, поскольку удаление аминокислоты с N-конца (Arg) резко снижает способность пептида связываться со скурфином, тогда как удаление остатков 14 или 15 с С-конца, т.е., фрагмента «X», не оказывает влияния на способность пептида связываться со скурфином (пример 1.4, фиг. 2).
В другом конкретном варианте осуществления пептид по изобретению представляет собой вариант пептида с общей формулой (I), который определен в разделе a). Термин «вариант», как применяют в настоящем документе, относится к пептиду, который по существу гомологичен и функционально эквивалентен пептиду с общей формулой (I), который определен в разделе a). Как применяют в настоящем документе, пептид «по существу гомологичен» другому пептиду, когда его аминокислотная последовательность обладает степенью идентичности по меньшей мере 50%, предпочтительно, по меньшей мере 60%, предпочтительно, по меньшей мере 70, более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90% и, даже более предпочтительно, по меньшей мере 95%. Подобным образом, выражение «функционально эквивалентен», как применяют в настоящем документе, обозначает, что рассматриваемый пептид (вариант) сохраняет способность связываться со скурфином и, предпочтительно, ингибировать биологическую активность скурфина in vitro и/или in vivo. Способность пептида связываться со скурфином можно определить любым подходящим стандартным способом, как отмечалось ранее, например, с помощью теста на аффинность, такого как тест на аффинность, основанный на способе поверхностного плазмонного резонанса (SPR) (пример 1.3). Подобным образом, способность пептида ингибировать биологическую активность скурфина можно определить любым подходящим стандартным способом, как отмечалось ранее, например, с помощью любого теста, описанного в примере 3. В конкретном варианте осуществления пептид по изобретению представляет собой вариант, который содержит одну или несколько инсерций, делеций и/или модификаций одной или нескольких аминокислот в аминокислотной последовательности, приведенной в разделе a), и сохраняет способность связываться со скурфином. В конкретном варианте осуществления указанный вариант содержит одну или несколько консервативных замен аминокислот по отношению к вышеприведенной аминокислотной последовательности.
В другом конкретном варианте осуществления пептид по изобретению представляет собой фрагмент пептида с общей формулой (I), который определен в разделе a), или варианта, который определен в разделе b). Термин «фрагмент», как он используется в настоящем описании, относится к пептиду, содержащему участок по меньшей мере из 5 последовательных аминокислот из пептида с общей формулой (I), который определен в разделе a), или к варианту, который определен в разделе b), т.е. к последовательности по меньшей мере из 5 смежных аминокислот, содержащейся в аминокислотной последовательности с общей формулой (I), которая приведена в указанном разделе a), или к варианту, который определен в разделе b) и который сохраняет способность связываться со скурфином. В конкретном варианте осуществления пептид по изобретению представляет собой фрагмент пептида с общей формулой (I), который определен в a), или варианта, который определен в b), содержит 5 или более (т.е. 6, 7, 8, 9, 10, 11, 12, 13 14 или 15) смежных аминокислот из аминокислотной последовательности с общей формулой (I), приведенной в разделе a), или из варианта, который определен в разделе b), в котором одна или несколько аминокислот удалены с N-конца или с C-конца или с обоих концов, и который сохраняет способность связываться со скурфином, и, предпочтительно, способность ингибировать биологическую активность скурфина. Способность фрагмента пептида связываться со скурфином можно определить любым подходящим стандартным способом, как отмечалось ранее, например, с помощью теста на аффинность, например, теста на аффинность, который основан на способе SPR (пример 1.3). Аналогично, способность фрагмента пептида ингибировать биологическую активность скурфина можно определить любым подходящим стандартным способом, как отмечалось ранее, например, посредством любого теста, описанного в примере 3.
Подобным образом, фармацевтически приемлемые соли пептида по изобретению включены в объем настоящего изобретения. Термин «фармацевтически приемлемые соли», как применяют в настоящем документе, включает соли, которые обычно используются для получения солей металлов, или кислотно-аддитивные соли. Свойства соли не являются решающими, при условии, что она является фармацевтически приемлемой. Фармацевтически приемлемые соли пептида по изобретению можно получить из органических или неорганических кислот или оснований. Указанные соли можно получить стандартными способами, которые хорошо известны профессионалам в данной области.
В конкретном и предпочтительном варианте осуществления пептид по изобретению представляет собой пептид со способностью связываться со скурфином и ингибировать его биологическую активность, аминокислотная последовательность которого содержит или состоит из SEQ ID NO:1, ее варианта или фрагмента, и его фармацевтически приемлемые соли. В примерах, сопровождающих данное описание, показано, что указанный пептид способен связываться со скурфином и ингибировать его биологическую активность и опосредованно транзиентно регулировать или блокировать иммуносупрессорную активность регуляторных Т-лимфоцитов.
Слитый белок по изобретению
Пептид по изобретению можно слить с другим пептидом и, таким образом, получить слитый белок. Поскольку взаимодействие между пептидом по изобретению и скурфином должно происходить внут