Наноантитело "anti-flu", рекомбинантные вирусные векторы и фармацевтические композиции для профилактики и терапии гриппа типа а
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложено наноантитело (однодоменное антитело), специфически связывающееся с гемагглютинином вируса гриппа типа А H5N2 и подавляющее инфекцию этого вируса, охарактеризованное аминокислотной последовательностью. Также рассмотрены вирусный, в том числе аденовирусный, адено-ассоциированный и лентивирусный, вектор для экспрессии наноантитела по изобретению и композиция для подавления развития инфекции вируса гриппа типа А H5N2, содержащая наноантитело и вирусный вектор по изобретению. Данное изобретение может найти дальнейшее применение в терапии инфекции вируса гриппа типа А H5N2. 3 н. и 3 з.п. ф-лы, 12 ил., 18 пр., 1 табл.
Реферат
Область техники настоящего изобретения
Настоящее изобретение относится к вирусологии и предполагает использование антител, представляющих собой наноантитела, для профилактики и терапии гриппа, а также к использованию генов этих антител в комбинации с вирусными векторами (векторы на основе рекомбинантных аденовирусов, адено-ассоциированных вирусов, лентивирусов) и их экспрессии в организме млекопитающих для профилактики и терапии гриппа.
Предшествующий уровень техники настоящего изобретения
Вирусы гриппа способны вызывать чрезвычайные эпидемические ситуации. Эти вирусы широко распространены в природе и могут поражать людей, многие виды млекопитающих (лошадей, свиней, тюленей и т.д.), а также все виды птиц. Респираторные заболевания, вызываемые вирусами гриппа, в некоторых случаях могут протекать с осложнениями и заканчиваться смертью.
Вирусы гриппа характеризуются большой антигенной вариабельностью. Наиболее подвержены изменениям поверхностные гликопротеины вириона - гемагглютинин и нейраминидаза. Известны два пути их изменения. Первый - антигенный дрейф. Под давлением популяционного иммунитета мутации, позволяющие уйти из-под контроля иммунной системы, дают вирусу серьезное преимущество и закрепляются. В итоге новые антигенные варианты гемагглютинина и нейраминидазы постоянно сменяют друг друга. В результате возникают эпидемии, т.к. защита от предыдущих штаммов вирусов, в том числе того же самого субтипа, недостаточна для нейтрализации нового штамма. К сожалению, применение современных субъединичных и инактивированных вакцин не решает эту проблему, т.к. обеспечивает хорошую защиту только от штамма, из которого они были получены. Поэтому в настоящее время для защиты населения от новых эпидемических штаммов требуется постоянно создавать новые вакцины.
Второй путь изменения вирусов гриппа - антигенный шифт, т.е. изменение антигенной формулы вируса в результате замены гена (генов) и соответствующего белка (белков). В основе механизма антигенного шифта лежит реассортация или рекомбинация генов, которая может происходить при совместной инфекции двумя и более вирусами [Кочергин-Никитский К.С. // Анализ взаимодействия генов при скрещивании низкопатогенного вируса гриппа птиц подтипа Н5 и высокопродуктивного штамма вируса гриппа человека. М., ГУ НИИ вирусологии им. Д.И.Ивановского РАМН, 2007]. Шифтовые изменения, как правило, затрагивают антигенную структуру гемагглютинина, реже - нейраминидазы. Таким образом, через нерегулярные интервалы времени появляются пандемические варианты вирусов гриппа с новыми антигенными и биологическими свойствами, которые вызывают тяжелые заболевания и гибель людей [Lvov D.K. // Sov. Med. Rev. E. Virol. Rev. 1987. V. 2. P.15-37; Webster R.G., Bean W.J., German O.T., et al. // Microbiol. Rev. 1992. V. 56. P.152-179]. Например, пандемия «испанки» - вируса гриппа H1N1 в 1918-1920 гг. привела к смерти около 50 млн человек по всему миру. В июне 2009 г. Всемирная Организация Здравоохранения (ВОЗ) присвоила новому вирусу H1N1, случаи заболевания которым начали детектировать в начале апреля 2009 г., шестую степень угрозы пандемии. Этот вирус представляет собой реассортант, содержащий гены птичьего, человеческого и свиного вирусов [Shinde V., Bridges C.B., Uyeki T.M. // The new England journal of medicine. 2009. V. 360; 25. P.2616-2625]. При возникновении нового пандемического штамма создание вакцины занимает слишком много времени, что не позволяет быстро остановить распространение опасного вируса. Таким образом, несмотря на проводимые широкомасштабные профилактические меры, включающие вакцинацию, во многих странах мира, в том числе в России, ежегодно регистрируются сезонные вспышки гриппа, охватывающие все слои населения от детей до лиц преклонного и старческого возраста. Для решения этой проблемы необходимы новые подходы к профилактике и лечению гриппа.
Помимо вакцин для борьбы с гриппом на сегодняшний день существует широкий выбор лекарственных средств. Однако следует отметить, что профилактика подобными средствами не обладает достаточной эффективностью, к тому же многие лекарственные средства имеют широкий перечень противопоказаний и могут вызвать побочные реакции.
В настоящее время для лечения и профилактики гриппа используются препараты нескольких групп, среди которых особое место занимают препараты ингибиторы М2-каналов и ингибиторы нейраминидазы. Из препаратов первой группы в нашей стране в течение многих лет применялся Ремантадин, оказывавший выраженный терапевтический и профилактический эффект при гриппе, вызванном вирусом типа А. Однако широкое использование ингибиторов М2-каналов привело к появлению устойчивых штаммов вирусов гриппа, резистентных к Ремантадину. Из препаратов второй группы в России зарегистрированы препараты занамивир и осельтамивир. Занамивир не пригоден для широкого использования в клинической практике, т.к. может применяться только в виде ингаляций, что неприемлемо для детей дошкольного возраста и пожилых пациентов. Кроме того, возможен целый ряд нежелательных реакций, включая бронхоспазм и отек гортани. Другой препарат - осельтамивир (Тамифлю) зарекомендовал себя как высокоэффективный и безопасный препарат, но одним из самых принципиальных недостатков этого препарата является необходимость его раннего применения (наиболее эффективен при приеме в первые 36 часов заболевания).
Проблема своевременного обращения за медицинской помощью и раннего лечения респираторных вирусных инфекций относится к наиболее острым проблемам практического здравоохранения. По данным НИИ гриппа РАМН, основная часть пациентов обращаются за медицинской помощью только на 2-3-и сутки, когда становится очевидным, что пациент болен не простой простудой и нельзя ограничиться лечением только жаропонижающими препаратами, однако уже с тяжелыми формами гриппа и вирусными пневмониями пациенты поступают в клиники Института гриппа РАМН только на 5-е сутки. В связи с этим ингибиторы нейраминидазы не могут быть широко использованы в реальных условиях начинающейся эпидемии.
Таким образом, можно заключить, что на сегодняшний день нет эффективных и безопасных препаратов для терапии или профилактики гриппа.
Решением данной проблемы может стать создание препаратов на основе антител, полученных против вируса гриппа типа А. Действие этих препаратов основано на введении в организм антител, полученных к протективному антигену патогена, которые способны защищать организм хозяина от развития инфекции. Такой подход применяется начиная с первой половины 20-го века. До конца 1960-х гг. в СССР сравнительно широко применялась гипериммунная лошадиная сыворотка для профилактики и лечения гриппа. Однако зачастую в качестве побочной реакции данный препарат вызывал аллергию, и в этой связи от него пришлось отказаться. Но сама идея использования содержащихся в крови людей противовирусных антител в настоящее время все еще реализуется в виде препаратов крови. Эти препараты называют иммуноглобулинами. Наиболее эффективен и распространен в России препарат «специфический противогриппозный иммуноглобулин» из крови доноров, специально и многократно вакцинированных против гриппа. Помимо противогриппозных антител, специально стимулируемых вакцинацией, в донорском иммуноглобулине содержатся антитела ко многим широко распространенным инфекционным агентам, в том числе и к респираторным вирусам. В последние годы появились сообщения о формировании антител к введенному человеческому белку. Препарат не лишен и других побочных эффектов: повышения температуры тела, аллергизации организма: от появления сыпи до развития тяжелого состояния и анафилактического шока.
Препараты иммуноглобулинов, полученные генно-инженерными методами, лишены некоторых этих недостатков. Так, на животных показана эффективность моноклональных одноцепочечных антител (scFv), полученных против белка-токсина сибирской язвы [Mabry R., Infect Immun. 2005:73:8362-8368.]. Однако при этом используются экстремально высокие дозы белка, что является существенным ограничением. Гуманизированные одноцепочечные наноантитела не отторгаются организмом человека и не вызывают аллергической реакции. Однако данный тип антител имеет ряд недостатков: высокие затраты на их производство и ограниченность генно-инженерных манипуляций.
В настоящее время разработана технология получения с помощью методов генной инженерии еще одного типа антител - рекомбинантных наноантител заданной специфичности. В ее основе - получение нуклеотидных последовательностей генов неканонических антител животных семейства Верблюдовых. Эти антитела представляют собой димер только одной укороченной (первый константный район СН1 отсутствует) тяжелой цепи иммуноглобулина. Для собственно специфического узнавания и связывания антигена при этом необходим и достаточен лишь один вариабельный домен этого антитела.
Полным эквивалентом термина "наноантитела" для целей настоящего изобретения является вошедшее в широкое употребление обозначение «нанотело», введенное фирмой ABLYNX (NANOBODYTM), а также «однодоменное мини-антитело» и «однодоменное наноантитело».
Полученные по этой технологии наноантитела обладают следующими свойствами [Тиллиб С.В. «Верблюжьи мини-антитела» - эффективный инструмент для исследований, диагностики и терапии. Молекулярная биология, 2011; 45(1):77-85]:
1) Высокая растворимость и стабильность (в широком диапазоне температур и кислотности среды).
2) Улучшенная проницаемость в клетки за счет малого размера (~2×4 нм, 13-15 кДа).
3) Способность образовывать необычные для классических антител паратипы, позволяющие связываться с углублениями и активными центрами белков.
4) Наличие отработанного способа получения и селекции наноантител.
5) Возможность экономичной наработки в больших количествах. Наноантитела можно нарабатывать в периплазме бактерий E.coli.
6) Возможность генно-инженерных модификаций для поливалентных наноантител.
7) Низкая иммуногенность.
Еще одним положительным свойством этих антител является возможность их «гуманизации» без заметной потери их специфической активности, проведя небольшое число точечных замен аминокислот [Vincke С., Loris R., Saerens D., et al. // J. Biol. Chem. 2009.V. 284. №5. P.3273-3284]. Это открывает потенциальную возможность широкого использования наноантител в качестве средств пассивной иммунизации для предотвращения развития различных опасных инфекционных заболеваний [Wesolowski J., Alzogaray V., Reyelt J. et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med. Microbiol. Immunol. 2009; 198, 157-174.].
Так, было показано (WO 2007/052242; Prendergast Patrick; Composition and method for the treatment of viral infection using camelid heavy chain antibodies), что антитела, полученные против вируса гриппа и отобранные по специфичности к нейраминидазе, способны защищать птиц от развития заболеваний, вызываемых вирусами гриппа различных штаммов. Данное техническое решение как наиболее близкое к заявляемому по составу действующего вещества фармацевтической композиции и способу введения его в организм выбрано авторами настоящего за прототип.
Недостатками прототипа являются:
1) Антитела к нейраминидазе вируса гриппа обладают слабой вируснейтрализующей активностью. Эффективная вируснейтрализация таким препаратом может обеспечиваться лишь в случае его длительной циркуляции в организме. Это приводит к необходимости введения в организм больших доз препаратов для достижения положительного эффекта, а также к необходимости повторного введения препарата.
2) Для предотвращения возникновения различных иммунных реакций на чужеродный белок (антитело), вводимый в большом количестве вследствие его слабой вируснейтрализующей активности, используется схема введения, согласно которой препарат вводится дважды, причем второй раз совместно с препаратом, ингибирующим ФНО-α. При этом зачастую повторное введение является затруднительным для пациентов.
Таким образом, в уровне техники существует острая потребность в разработке фармацевтической композиции, служащей для профилактики и терапии гриппа.
Задачей настоящего изобретения явилось создание:
1) наноантитела, которое может эффективно связывать определенный эпитоп гемагглютинина вируса гриппа и, тем самым, блокировать развитие гриппозной инфекции,
2) вектора, экспрессирующего наноантитело, которое может эффективно связывать определенный эпитоп гемагглютинина вируса гриппа и, тем самым, блокировать развитие гриппозной инфекции,
3) композиции, состоящей из наноантитела и аденовирусного вектора, экспрессирующего наноантитело, которое может эффективно связывать определенный эпитоп гемагглютинина вируса гриппа и, тем самым, блокировать развитие гриппозной инфекции.
Поставленная задача решается заявляемым изобретением за счет того, что создают наноантитело «anti-flu», специфически связывающееся с определенным эпитопом гемагглютинина вируса гриппа типа А, подавляющее инфекцию вируса гриппа типа А. Создают вирусный вектор, экспрессирующий наноантитело «anti-flu», которое может эффективно связывать определенный эпитоп гемагглютинина вируса гриппа и, тем самым, блокировать развитие гриппозной инфекции. При этом вирусный вектор может быть аденовирусным вектором, экспрессирующим наноантитело «anti-flu», которое способно эффективно связывать определенный эпитоп гемагглютинина вируса гриппа и, тем самым, блокировать развитие гриппозной инфекции. Вирусный вектор может быть также адено-ассоциированным вектором, экспрессирующим наноантитело «anti-flu», которое способно эффективно связывать определенный эпитоп гемагглютинина вируса гриппа и, тем самым, блокировать развитие гриппозной инфекции. Вирусный вектор может быть лентивирусным вектором, экспрессирующим наноантитело «anti-flu», которое способно эффективно связывать определенный эпитоп гемагглютинина вируса гриппа и, тем самым, блокировать развитие гриппозной инфекции. Предлагается композиция, состоящая из эффективного количества наноантитела anti-flu и вирусного вектора, экспрессирующего наноантитело «anti-flu», способного эффективно связывать гемагглютинин вируса гриппа и, тем самым, блокировать развитие гриппозной инфекции.
Раскрытие настоящего изобретения
Указанная выше задача настоящего изобретения решается тем, что разработку препарата проводят с использованием специально получаемых наноантител, связывающих определенный эпитоп поверхностного белка гемагглютинина вируса гриппа таким образом, что при этом нарушается (блокируется и нейтрализуется) инфекционная активность вируса гриппа А.
В качестве способов применения для действующего вещества (антитела) были выбраны следующие: использование наноантител в виде суспензии в фармацевтически-приемлемом растворителе; использование в качестве носителя для действующего вещества рекомбинантных вирусных векторов: на основе аденовирусов, адено-ассоциированных вирусов и лентивирусов, экспрессирующих гены наноантител, способных связывать и/или нейтрализовывать вирус гриппа; использование композиций, содержащих как вирусный вектор с геном наноантитела, так и наноантитело (в виде белка).
Выбор путей реализации с целью получения фармацевтической композиции с заявляемыми свойствами обусловлен следующими факторами.
Предлагаемое техническое решение предусматривает использование в качестве действующего вещества фармацевтической композиции особого наноантитела, способногоэффективно связываться с определенным эпитопом гемагглютинина вируса гриппа таким образом, что при этом нарушается(блокируется, нейтрализуется) инфекционная активность вируса. Большинство используемых в настоящее время вируснейтрализующих антител (классических антител, состоящих из 4-х иммуноглобулиновых цепей) имеют сродство именно к этому белку гемагглютинина вируса гриппа. Антитела против гемагглютинина способны предотвращать проникновение вируса в клетку и, таким образом, предотвращать развитие инфекции. В отличие от них действие антител против нейраминидазы осуществляется на уровне выхода зрелых частиц вируса из клетки и поэтому только лишь способны уменьшить период заболевания и его интенсивность. Ввиду того, что именно антитела к гемагглютинину могут обладать выраженной вируснейтрализующей активностью и оказывают свое действие против вируса гриппа сразу после попадания его в организм, то есть способны предотвратить развитие инфекции, наноантитела, полученные к гемагглютинину вируса гриппа и обладающие при этом вирусонейтрализующей активностью, были использованы в качестве действующего вещества для создания фармацевтической композиции, служащей для профилактики и терапии гриппа.
Предлагаемое техническое решение предусматривает способ использования наноантитела, включающий в себя применение вирусных векторов в качестве носителя для действующего вещества. Вирусные векторы представляют собой рекомбинантные вирусы, в геном которых включен целевой ген (ген наноантитела) с набором регуляторных элементов. В качестве вирусных векторов наиболее часто применяют следующие рекомбинантные вирусы: аденовирусы [Шмаров М.М., Тутыхина И.Л., Логунов Д.Ю. и др. Индукция протективного иммунного ответа у мышей, вакцинированных рекомбинантным аденовирусом птиц CELO, экспрессирующим гликопротеин G вируса бешенства. Журнал микробиологии, эпидемиологии и иммунологии, 2006; 4:69-71; Тутыхина И.Л., Шульпин М.И., Чвала И.А. и др. Конструирование рекомбинантных аденовирусов CELO, экспрессирующих ген гемагглютинина вируса гриппа А птиц, и изучение возможности их использования в качестве вакцин для защиты от вируса гриппа А птиц H5N1 и H7N1. Молекулярная генетика, микробиология и вирусология 2011.; Тутыхина И.Л., Шмаров М.М., Логунов Д.Ю. и др. Конструирование и перспективы использования в медицине рекомбинантных аденовирусных наноструктур. Российские нанотехнологии. 2009; 4(11-12):82-92; Liu M.A. Immunologic basis of vaccine vectors. Immunity. 2010; 33(4):504-15; Lasaro M.O., ErtI H.C.New insights on adenovirus as vaccine vectors. Mol Ther. 2009:17(8):1333-9], ретровирусы [Liu M.A. Immunologic basis of vaccine vectors. Immunity. 2010; 33(4):504-15; Pincha M., Sundarasetty B.S., Stripecke R.. Lentiviral vectors for immunization: an inflammatory field. Expert Rev Vaccines. 2010; 9(3):309-321; Negri D.R., Michelini Z., Cara A. Toward integrase defective lentiviral vectors for genetic immunization. Curr HIV Res. 2010; 8(4):274-2810]. Адено-ассоциированные вирусы [Sun J.Y., Anand-Jawa V., Chatterjee S., Wong K.K. Immune responses to adeno-associated virus and its recombinant vectors. Gene Ther. 2003:10(11):964-76]. Среди существующих систем доставки антигенов вирусные векторы занимают особое место, поскольку обладают следующими свойствами:
- имеют естественный механизм взаимодействия с клеткой и проникновения в клетку;
- транспортируют чужеродный генетический материал в ядро клетки;
- способны обеспечивать длительную экспрессию антигена;
- вирусная оболочка выполняет защитную функцию для генетического материала, кодирующего антиген.
При введении в организм вирусные векторы проникают в различные типы клеток, где осуществляют экспрессию встроенных в ДНК генов. В этой связи вирусные векторы являются широко используемым инструментом для доставки генов в клетки человека и животных [R.Harrop, et al., Advanced Drug Delivery Reviews, V.58, 1. 8, 2006, P.931-947].
Наряду с вышеперечисленным вирусные векторы отличаются высокой эффективностью экспрессии целевого гена в различных типах клеток, безопасностью для человека и животных.
Таким образом, использование вирусных векторов в качестве носителя для действующего вещества заявляемой композиции позволяет доставлять в организм гены целевых белков, что, в свою очередь, обеспечивает продление периода циркуляции продукта целевого гена в организме.
В качестве носителя используют вирусные векторы, полученные на основе рекомбинантного аденовируса человека 5-го серотипа. Известно, что аденовирусные векторы используются на практике наиболее часто. В настоящее время на основе аденовирусных векторов разрабатываются вакцины против различных бактериальных (туляремия, туберкулез, бруцеллез и др.) и вирусных (вирус иммунодефицита человека, папилломавирус человека, вирус бешенства, вирус Эбола и др.) патогенов человека [Wang J, Thorson L, Stokes RW, Santosuosso M, Huygen К, Zganiacz A, Hitt M, Xing Z. Single mucosal, but not parenteral, immunization with recombinant adenoviral-based vaccine provides potent protection from pulmonary tuberculosis. J Immunol. 2004 Nov 15; 173(10):6357-65.; Richardson JS, Yao MK, Tran KN, Croyle MA, Strong JE, Feldmann H, Kobinger GP. Enhanced protection against Ebola virus mediated by an improved adenovirus-based vaccine. PLoS One. 2009; 4(4):e5308. Epub 2009 Apr 23.; Li WH, Zhang Y, Wang SH, Liu L, Yang F. Recombinant replication-defective adenovirus based rabies vaccine. Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2003 Dec; 25(6):650-4.; Lees CY, Briggs DJ, Wu X, Davis RD, Moore SM, Gordon C, Xiang Z, ErtI HC, Tang DC, Fu ZF. Induction of protective immunity by topic application of a recombinant adenovirus expressing rabies virus glycoprotein. Vet Microbiol. 2002 Apr 2;85(4):295-303]. Так, были получены аденовирусные векторы, содержащие нуклеотидную последовательность гемагглютинина вируса гриппа человека, для дальнейшего использования в качестве вакцины для человека и животных против патогенного штамма вируса гриппа (Vaccine. 2005, V 23, р.1029-1036). Ген гемагглютинина вируса гриппа птиц H5N1 включали в ДНК РПАН на основе аденовируса человека 5-го серотипа также с целью использования полученного продукта как вакцины для человека, млекопитающих животных и птиц (Vaccine 2007, J. of Virology, 2006, V. 80, №4, p.1959-1964). Также аденовирусные векторы использовали для генной терапии опухолей в случае, когда в их ДНК был клонирован ген опухолевого супрессора р53 (US 7033750). Кроме того, два препарата, представляющих собой аденовирусные векторы на основе аденовируса человека 5-го серотипа, разрешены к применению в онкологии.
Также применение вирусных векторов в качестве носителей наделяет фармацевтическую композицию следующими преимуществами:
- С помощью вирусных векторов может быть решена проблема нестабильности препаратов антител (вводимых в организм в виде белков).
Вирусные векторы стабильны, могут быть лиофилизованы, могут храниться при 4°С длительное время без потери активности.
Технологии получения вирусных векторов в промышленных масштабах являются экономически оправданными и позволяют получать препараты с высоким титром. Процесс получения нового вида вирусного вектора занимает несколько недель, что может позволить быстро реагировать на меняющуюся эпидемиологическую обстановку в максимально сжатые сроки [R.Harrop, et al., Advanced Drug Delivery Reviews, V.58, 1. 8, 2006, P.931-947].
- Использование вирусных векторов позволяет обеспечивать наработку протективного уровня антител уже через 96 часов после введения. Более того, протективный уровень антител поддерживается в организме не менее 2-х недель [Kasuya К., Mol Ther.2005 Feb;11(2):237-44; Sofer-Podesta С., Infect Immun. 2009 Apr; 77(4): 1561-8; Chiuchiolo M.J., J Infect Dis. 2006 Nov 1; 194(9):1249-57.] в случае аденовирусных векторов и несколько месяцев в случае адено-ассоциированных и лентивирусных векторов [Viral vectors for gene transfer: a review of their use in the treatment of human diseases. WaltherW, Stein U. Drugs. 2000 Aug; 60(2):249-71].
В качестве носителя используют вирусные векторы, полученные на основе рекомбинантного адено-ассоциированного вируса 2-го серотипа (AAV-2). Известно, что это непатогенный вирус человека, который на практике часто используют для создания генно-терапевтических препаратов [AAV-mediated gene therapy for liver diseases: the prime candidate for clinical application? van der Laan LJ, Wang Y, Tilanus HW, Janssen HL, Pan Q. Expert Opin Biol Ther. 2011 Mar; 11(3):315-27; Adeno-associated virus (AAV) based gene therapy for eye diseases. Wang S, Liu P, Song L, Lu L, Zhang W, Wu Y. Cell Tissue Bank. 2011 May; 12(2):105-10; Gene therapy for ischemic heart disease. Hinkel R, Trenkwalder T, Kupatt C. Expert Opin Biol Ther. 2011 Jun; 11(6):723-37].
В настоящее время на основе адено-ассоциированных вирусных векторов разрабатываются вакцины против различных патогенов человека. Так, были получены адено-ассоциированные вирусные векторы, содержащие нуклеотидную последовательность гемагглютинина вируса гриппа типа А штамма H1N1, для дальнейшего использования в качестве вакцины для человека и животных против патогенного штамма вируса гриппа [Vaccine protection against lethal homologous and heterologous challenge using recombinant AAV vectors expressing codon-optimized genes from pandemic swine origin influenza virus (SOIV). Sipo I, Knauf M, Fechner H, Poller W, Planz O, Kurth R, Norley S. Vaccine. 2011 Feb 11; 29(8):1690-9]. Также адено-ассоциированные вирусные векторы использовали для генной терапии гемофилии (экспрессировали фактор IX), опухолей (экспрессировали дифтерийный токсин и про-апоптотический фактор PUMA) и других заболеваний [Novel cytotoxic vectors based on adeno-associated virus. Kohlschutter J, Michelfelder S, Trepel M. Toxins (Basel). 2010 Dec; 2(12):2754-68; AAV provides an alternative for gene therapy of the peripheral sensory nervous system. BeutIerAS. Mol Ther. 2010 Apr; 18(4):670-3; Muscle-directed gene therapy for hemophilia В with more efficient and less immunogenic AAV vectors. Wang L, Louboutin JP, Bell P, Greig JA, Li Y, Wu D, Wilson JM. J Thromb Haemost. 2011 Oct; 9(10):2009-19]. Более того, было показано, что адено-ассоциированные вирусные векторы, несущие гены наноантител к ВИЧ-1, способны предотвратить инфицирование животных вирусом ВИЧ-1 [Anti-gp120 minibody gene transfer to female genital epithelial cells protects against HIV-1 virus challenge in vitro. Abdel-Motal UM, Sarkis PT, Man T, Pudney J, Anderson DJ, Zhu Q, Marasco WA.PLoS One. 2011; 6(10):e26473].
В качестве носителя используют вирусные векторы, полученные на основе рекомбинантного вируса иммунодефицита человека (HIV-1). Известно, что этот вектор на практике часто используют для создания генно-терапевтических препаратов [Lentiviral vectors: their molecular design, safety, and use in laboratory and preclinical research. Dropulic B. Hum Gene Ther. 2011 Jun; 22(6):649-57]. Так, лентивирусные векторы использовали для генной терапии болезней нервной системы (экспрессировали различные гены), опухолей (экспрессировали shRNA STAT-3) и других заболеваний [STAT3 knockdown reduces pancreatic cancer cell invasiveness and matrix metalloproteinase-7 expression in nude mice. Li H, Huang C, Huang K, Wu W, Jiang T, Cao J, Feng Z, Qiu Z. PLoS One. 2011; 6(10):e25941; Manipulation of gene expression in the central nervous system with lentiviral vectors. Sun B, Gan L. Methods Mol Biol. 2011:670:155-68; Gene therapy for ocular diseases. Liu MM, Tuo J, Chan CC. Br J Ophthalmol. 2011 May; 95(5):604-12].
Более того, было показано, что лентивирусные векторы, несущие гены химерных антител к рецептору TRAIL, способны вызвать уменьшение размеров опухолей [2А Peptide-based, Lentivirus-mediated Anti-death Receptor 5 Chimeric Antibody Expression Prevents Tumor Growth in Nude Mice. Li M, Wu Y, Qiu Y, Yao Z, Liu S, Liu Y, Shi J, Zheng D. Mol Ther. 2011 Sep 20].
Использование препаратов, представляющих собой вирусный вектор, несущий в составе ДНК гена наноантитела, способного нейтрализовать вируса гриппа типа актуального штамма, позволяет обеспечить уже через 48-96 часов защиту организма от циркулирующего на данный момент штамма вируса гриппа. Более того, использование фармацевтической композиции, состоящей из вирусного вектора одного типа, несущего ген наноантитела, и белковых препаратов соответствующего однодоменного наноантитела, позволяет обеспечить защиту организма в период непосредственно после введения препарата, длящуюся, как минимум, 3-4 недели.
Таким образом, является целесообразным использование комплексного препарата, имеющего две составляющие: наноантител против вируса гриппа типа А и рекомбинантного вирусного вектора, экспрессирующего ген наноантител против вируса гриппа типа А.
Такой препарат будет обладать следующими преимущественными характеристиками:
1) Основой препарата являются антитела - наиболее эффективные природные противовирусные субстанции.
2) Кратковременный курс приема (1 раз), что снижает риск развития побочных эффектов и непереносимости.
3) Эффективность действия на различных стадиях развития инфекционного процесса.
4) Возможность использования в качестве дополнения к поздней вакцинации лиц из групп риска в первые 2 недели после вакцинации (на период выработки антител).
5) Возможность использования для лиц с иммунодефицитом, которые на вакцинацию могут дать недостаточный иммунный ответ.
6) Возможность использования для пожилых лиц, для которых эффективность вакцинации снижается и достигает 50-70%, как дополнение к вакцинации.
7) Возможность использования для не вакцинированных лиц, находящихся в контакте с заболевшими родственниками и соседями.
8) Возможность использования для тех, кто по каким-либо причинам не был вакцинирован вовремя.
9) Стоимость курса применения подобного препарата сравнима со стоимостью одной дозы вакцины.
Настоящее изобретение объединяет преимущества различных упомянутых подходов и относится к однодоменным наноантителам, связывающимся/нейтрализующим вирус гриппа, а также к способу применения таких антител как путем использования в качестве носителя действующего вещества (антитела) рекомбинантнымх вирусных векторов, несущих экспрессирующую кассету, содержащую нуклеотидную последовательность, которая кодирует наноантитело, связывающееся с вирусом гриппа, так и путем создания фармацевтической композиции, состоящей из наноантитела против вируса гриппа и рекмбинантного вирусного вектора, экспрессирующего данное наноантитело.
В соответствии с одним из предпочтительных вариантов осуществления настоящего изобретения вирус гриппа представляет собой вирус гриппа типа А, характеризующийся антигенной формулой H1N (1-9).
В соответствии с другим предпочтительным вариантом осуществления настоящего изобретения вирус гриппа представляет собой вирус гриппа типа А, характеризующийся антигенной формулой H3N (1-9) или H5N (1-9).
Кроме того, настоящее изобретение относится к фармацевтической композиции для профилактики или терапии гриппа, представляющей собой суспензию раскрытых выше рекомбинантных вирусных векторов в фармацевтически приемлемом растворителе или наполнителе. Такие фармацевтически приемлемые растворители и наполнители хорошо известны из предшествующего уровня техники (Remington's Pharmaceutical Sciences, 18th edition, A.R.Gennaro, Ed., MackPubIishing Company [1990]; Pharmaceutical Formulation Development of Peptides and Proteins, S. Frokjaer and L. Hovgaard, Eds., Taylor & Francis [2000]; и Handbook of Pharmaceutical Excipients, 3rd edition, A. Kibbe, Ed., Pharmaceutical Press [2000]).
Применение такой фармацевтической композиции позволяет добиться транзиторной экспрессии у пациента наноантител, которые за счет своих уникальных свойств, подробно описанных выше, способны обеспечивать достаточно надежную иммунную защиту против вируса гриппа. Среднему специалисту в данной области техники будет понятно, что применение такой фармацевтической композиции эффективно в основном для профилактики инфекции.
Кроме того, настоящее изобретение относится к фармацевтической композиции для профилактики или терапии гриппа, представляющей собой суспензию раскрытых выше рекомбинантных вирусных векторов и наноантител, связывающихся с вирусом гриппа того же типа и антигенной формулы, что и наноантитела, кодируемые экспрессирующими кассетами, содержащимися в указанных рекомбинантных вирусных векторах, в фармацевтически приемлемом растворителе или наполнителе.
Применение такой фармацевтической композиции позволяет обеспечить достаточно надежную иммунную защиту против вируса гриппа не только в порядке профилактики, но и после инфицирования пациента вирусом гриппа. Разумеется, чем на более ранней стадии инфекции будет применена заявленная фармацевтическая композиция, тем более эффективным окажется такое лечение.
Кроме того, настоящее изобретение относится к способу профилактики или терапии гриппа, предусматривающему введение нуждающемуся в этом пациенту профилактически или терапевтически эффективного количества одной из раскрытых выше фармацевтических композиций.
В соответствии с одним из предпочтительных вариантов осуществления настоящего изобретения указанную фармацевтическую композицию вводят интраназально.
В соответствии с более конкретными вариантами осуществления настоящего изобретения интраназальное введение осуществляют в форме капель или в форме спрея (аэрозоля).
Авторы настоящего изобретения исходят из того, что, как известно среднему специалисту в данной области техники, первичные, исходно получаемые последовательности наноантител могут служить исходными модулями более сложных многомодульных препаратов. Возможно объединение в одном мультивалентном производном двух, трех и более моновалентных первичных наноантител. Эти объединяемые в одну конструкцию наноантитела могут связываться как с одним и тем же эпитопом антигена-мишени, так и с его разными эпитопами или даже с различными антигенами-мишенями. Возможно также комбинированное объединение в одну конструкцию наноантител и других молекул или лекарств с получением многофункциональных препаратов [Conrath КЕ, Lauwereys M, Wyns L, Muyldermans S. Camel single-domain antibodies as modular building units in bispecific and bivalent antibody constructs. J Biol Chem. 2001 Mar 9; 276 (10):7346-50; Zhang J, Tanha J, Hirama T, Khieu NH. To R, Tong-Sevinc H, Stone E, Brisson JR, MacKenzie CR. Pentamerization of single-domain antibodies from phage libraries: a novel strategy for the rapid generation of high-avidity antibody reagents. J Mol Biol. 2004 Jan 2; 335 (1):49-56; Cortez-Retamozo V, Backmann N, Senter PD, Wernery U, De Baetselier P, Muyldermans S, Revets H. Efficient cancer therapy with a nanobody-based conjugate. Cancer Res. 2004 Apr 15; 64 (8):2853-7; Baral TN, Magez S, Stijlemans B, Conrath K, Vanhollebeke B, Pays E, Muyldermans S, De Baetselier P. Experimental therapy of African trypanosomiasis with a nanobody-conjugated human trypanolytic factor. Nat Med. 2006 May; 12 (5):580-4; Coppieters K, Dreier T, Silence К, Haard HD, Lauwereys M, Casteels P, Beirnaert E, Jonckheere H, Wiele CV, Staelens L, Hostens J, Revets H, Remaut E, Elewaut D, Rottiers P. Formatted anti-tumor necrosis factor alpha VHH proteins derived from camelids show superior potency and targeting to inflamed joints in a murine model of collagen-induced arthritis. Arthritis Rheum. 2006 Jun; 54 (6):1856-66]; мультимеризация с помощью введения дополнительных аминокислотных последовательностей, взаимодействующих белковых доменов, таких как лейциновые зипперы [Harbury P.B., Zhang Т.,Kirn P.S., et al. A switch between two-, three- and four-stranded coiled coils in GCN4 leucine zipper mutants. Science, 1993, 262:1401-1407; Shirashi Т., Suzuyama k., Okamoto H. et al. Increased cytotoxicity of soluble Fas ligand by fusing isoleucine zipper motif. Biochem. Biophys. Res. Communic. 2004, 322:197-202; Chenchik A., Gudkov A., Komarov A., Natarajan V. Reagents and methods for producing bioactive secreted peptides. 2010. US Patent Application 20100305002], последовательностей небольших белков, образующих стабильные комплексы [Deyev SM, Waibel R, Lebedenko EN, Schubiger AP, Pluckthun A. Design of multivalent complexes using the barnase*barstar module. Nat Biotechnol. 2003, 21(12):1486-92].
Для модулирования свойств препарата однодоменного наноантитела, например, увеличения времени жизни in vivo (в крови пациента), в состав конечного соединения могут быть введены дополнительные аминокислотные последовательности, последовательности белков (таких, например, как сывороточный альбумин) или другое наноантитело, специфически связывающееся с мажорным и долгоживущим белком в крови человека (например, альбумином или иммуноглобулином) [Gibbs WW. Nanobodies. Sci Am. 2005 Aug; 293 (2):78-83; Harmsen MM, Van Solt CB, Fijten HP, Van Setten MC. Prolonged in vivo residence times of llama single-domain antibody fragments in pigs by binding to porcine immunoglobulins. Vaccine. 2005 Sep 30; 23 (41):4926-34; Coppieters К, Dreier Т, Silence К, Haard HD, Lauwereys M, Casteels P, Beirnaert E, Jonckheere H, Wiele CV, Staelens L, Hostens J, Revets H, Remaut E, Elewaut D, Rottiers P. Formatted anti-tumor necrosis factor alpha VHH proteins derived from camelids show superior potency and targeting to inflamed joints in a murine model of collagen-induced arthritis. Arthritis Rheum. 2006 Jun; 54 (6):1856-66.].
Среднему специалисту в данной области техники будет очевидно, что такие модификации и прочие варианты антител, лежащих в основе настоящего изобретения, подпадают под объем настоящего изобретения, поскольку являются структурными и функциональными вариантами наноантител. Таким образом, авторы настоящего изобретения понимают под термином "однодоменные наноантитела" как первичные, исходно получаемые, "минимальные" аминокислотные последовательности наноантител, так и их модификации, полученные в результате упомянутых адаптации или «форматирования», и их варианты.
Краткое описание фигур
На фиг.1 представлены нуклеотидная и аминокислотная последовательность отобранного однодоменного наноантитела «anti-flu», способного специфически связывать и блокировать вирус гриппа A. SEQ ID NO: 1 - нуклеотидная последовательность, кодирующая наноантитело «anti-flu». Из нее была выведена соответствующая аминокислотная последовательность наноантитела «anti-flu» (SEQ ID NO: 2). В указанной аминокислотной последовательности подчеркнуты соответственно (слева направо, от N- к С-концу) гипервариабельные участки CDR1, CDR2 и CDR3, которые собственно являются основными определяющими специфичность связывания районами подобных антиген-узнающих молекул.
На фиг.2 проиллюстрированы результаты иммуноферментного анализа узнавания отобранным однодоменным наноантителом («anti-flu») иммобилизованного в лунках иммунологической плашки препарата вируса гриппа. В качестве контрольных использовали ячейки с иммобилизованным белком овальбумином кур.
На фиг.3 представлен график зависимости выживаемости мышей после интраназального введения однодоменного наноантитела anti-flu и последующего заражения их вирусом гриппа птиц A/Mallard duck/PA/10218/84(H5N2) от времени после заражения.
Сплошная линия с маркером в виде квадрата черного цвета - 20 мкл интраназально раствора однодоменного наноантитела anti-flu в фосфатном буфере в дозе 2,5 мкг/мышь, сплошная линия с маркером в виде квадрата белого цвета - 20 мкл интраназально раствора фосфатного буфера.
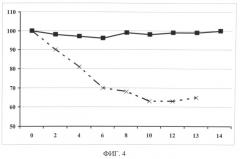
На фиг.4 представлен график зависимости изменения массы тела мышей после интраназального введения однодоменного наноантитела anti-flu и последующего заражения их вирусом гриппа птиц A/Mallard duck/PA/10218/84(H5N2) от времени после заражения.
Сплошная линия с маркером в виде квадрата черного цвета - 20 мкл интраназально раствора однодоменного наноантитела anti-flu в фосфатном буфере в